È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Riprogrammare cellule somatiche umane in cellule staminali pluripotenti indotte (iPSCs) Utilizzo vettore retrovirale con GFP
In questo articolo
Riepilogo
Un metodo per generare umani cellule staminali pluripotenti indotte (iPSCs) tramite retrovirus-mediata espressione ectopica di Oct4, Sox2, Klf4 e MYC è descritto. Un modo pratico per identificare umani IPSC colonie sulla base di GFP è anche discusso.
Abstract
Cellule staminali embrionali umane (hESC) sono pluripotenti e una fonte inestimabile per cellulari in vitro modelli di malattia e della medicina rigenerativa 1. E 'stato precedentemente dimostrato che cellule somatiche umane può essere riprogrammato per pluripotenza dall'espressione ectopica di quattro fattori di trascrizione (Oct4, Sox2, Klf4 e Myc) e diventare cellule staminali pluripotenti indotte (iPSCs) 2-4. Come hESC, iPSCs umani sono pluripotenti e una fonte potenziale di cellule autologhe. Qui descriviamo il protocollo per riprogrammare cellule di fibroblasti umani con i quattro fattori di riprogrammazione clonati in GFP-retrovirale contenente backbone 4. Utilizzando il seguente protocollo, generiamo iPSCs umani in 3-4 settimane sotto condizione umana della cultura ESC. Umani colonie IPSC assomigliano hESC nella morfologia e visualizzare la perdita di fluorescenza GFP come risultato di silenziamento del transgene retrovirale. colonie IPSC isolato meccanicamente con un microsco fluorescenzape si comportano in modo simile a come hESC. In queste cellule, si rileva l'espressione di geni multipli pluripotenziali e marcatori di superficie.
Protocollo
1. Riprogrammazione da Retrovirus Esprimere Fattori Riprogrammazione
- Fibroblasti umani vengono coltivate in mezzo di fibroblasti (10% FBS in DMEM con Pen / Strep).
- Un giorno prima dell'infezione, piastra 1x10 5 fibroblasti umani in un pozzetto di una piastra da 6 pozzetti.
- Aspirare il terreno per eliminare le cellule morte e aggiungere 2 ml di terreno di fibroblasti fresco. Aggiungere protammina solfato ad una concentrazione finale di 5 pg / ml.
- Cautela aggiungere la quantità appropriata di ciascun GFP-esprime virus corrispondente ad una molteplicità di infezione (MOI) 5 5.
- Un giorno dopo l'infezione, rimuovere il supernatante virale, lavare tre volte con 2 ml di PBS, quindi aggiungere due medie fibroblasti ml.
- Tre giorni dopo l'infezione, controllare la fluorescenza GFP e riempire il pozzo con 2 ml di terreno di fibroblasti.
- Quattro giorni dopo l'infezione, la piastra 1x10 4 / cm 2 di fibroblasti embrionali di topo irradiati (MEF) in cellule di alimentazione di fibroblasti su un mezzo10-cm Petri rivestito con 0,1% di gelatina. Incubare a 37 ° C per una notte.
- Cinque giorni dopo l'infezione, staccare infettati fibroblasti umani con 1 ml di 0,05% typsin / EDTA per 5 minuti a 37 ° C, e centrifugare per 5 minuti a 200 g. Aspirare il mezzo e risospendere le cellule con 10 ml di mezzo fibroblasti. Trasferire le cellule in un pre-rivestito 10-centimetri piastra.
- Dopo 24 ore, sostituire il mezzo con il mezzo hESC cultura (20% Knock-Out sostituzione siero, DMEM/F12, 0,1 ml di aminoacidi non essenziali, 4 ng / ml bFGF, Pen / Strep / glutammato, beta-merceptoethanol). Cambia il mezzo di tutti i giorni. ESC-colonie, come inizierà ad apparire di giorno 20-27 dopo l'infezione.
2. Isolamento ed espansione di iPSCs
- Sotto un microscopio a fluorescenza, verificare l'assenza di fluorescenza GFP in una colonia che mostra una morfologia simile a hESC.
- Usando una pipetta 10 pl, raccogliere le singole colonie IPSC e inserirli in un pozzetto di una gelatina e MEF-CoATed 12-pozzetti e integrato con media hESC. Cambiare media giornaliera.
- Per passaging, lavare la piastra con 1 ml di DMEM/F12, quindi aggiungere 0,5 ml di collagenasi, e incubare per 10 minuti a 37 ° C.
- Lavare le cellule due volte con DMEM/F12.
- Aggiungere 2 ml di terreno fresco hESC. Utilizzando un sollevatore cella, rompere le colonie in piccoli pezzi e staccare le cellule rimanenti dalla piastra.
- Trasferire i pezzi di colonie risospeso in un pozzetto di una gelatina e MEF rivestita piastra da 6 pozzetti.
3. Analisi Immunofluorescenza di marcatori pluripotenti
- Lavare le cellule tre volte con PBS e fissare con 4% paraformaldeide per 20 minuti a temperatura ambiente.
- Lavare delicatamente le cellule tre volte con PBS e permeabile con 0,2% Triton X-100 in PBS per 30 min.
- Blocco legame non specifico incubando le cellule con 3% BSA in PBS per due ore.
- Incubare le cellule con anticorpo primario per una notte a 4 ° C.
- Lavare le cellule tre volte con PBS e incubare le cellule con anticorpo secondario specifico per un'ora a temperatura ambiente, schermatura dalla luce.
- Lavare le cellule tre volte con PBS e add DAPI durante l'ultimo lavaggio seguito da incubazione a temperatura ambiente per 5 minuti.
- Rilevare la colorazione con un microscopio a fluorescenza.
4. Quantitativa Real-time PCR per i marker pluripotenti
- Isolare RNA totale dalle iPSCs umane derivate da fibroblasti umani usando il kit RNeasy Qiagen.
- Sintetizzare il primo filamento cDNA utilizzando trascrittasi inversa SuperScript II.
- Eseguire qPCR per individuare i geni pluripotenziali usando i primer riportati in precedenza. 6
5. Risultati rappresentativi
- Cambiamento morfologico durante la riprogrammazione
Noi fibroblasti umani infettati BJ1 e Detroit 551 con un cocktail di retrovirus che trasportano Oct4, Sox2, Klf4 e MYC,e sono stati in grado di rilevare i cambiamenti morfologici durante riprogrammazione (Figura 1). Ventun giorni dopo l'infezione, riconosciamo piccole colonie IPSC dalla loro hESC-come morfologia. Inoltre, riconosciamo iPSCs dalla fluorescenza GFP. Le cellule staminali pluripotenti, come CES e iPSCs, esprimono il macchinario molecolare di reprimere l'espressione genica provirale 7-9. Il nostro unico vettore retrovirale esprime GFP insieme riprogrammazione geni LTR retrovirale. Così, le cellule esprimenti GFP continuo sono considerati per esprimere transgeni senza silenziamento genico provirale. Fedelmente riprogrammati colonie IPSC che acquisiscono la rete pluripotenza molecolare dimostrare l'assenza di espressione di GFP (Figura 2) 10. - Caratterizzazione della pluripotenza delle iPSCs umani
Abbiamo analizzato le colonie derivate da Detroit-551 fibroblasti via immunoistochimica con Tra-1-81, Tra-1-60, SSEA-4, SSE-3, e gli anticorpi OCT4 Nanog ( Tabella 2). IPSCs successo riprogrammati esprimere tutti questi marcatori (Figura 3A). Abbiamo anche analizzato espressione genica tramite RT-PCR quantitativa analisi. Abbiamo osservato che l'espressione di Oct4, Sox2, Klf4, MYC e Nanog era significativamente maggiore rispetto alle cellule di fibroblasti dei genitori, ma commisurata a quella di hESC H9 (Figura 3B).
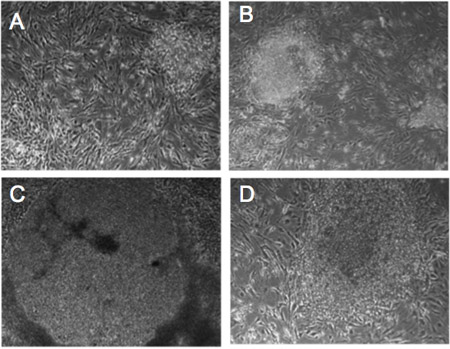
Figura 1. Cambiamenti morfologici di fibroblasti umani infettati da retrovirus. (AD) progressivo cambiamento morfologico nelle colonie da Detroit-551 fibroblasti infettati con i fattori di riprogrammazione. Giorno 5 (A), Giorno 10 (B), Giorno 14 (C), giorno 21 (D). Le cellule mostrano la hESC-come morfologia dopo 21 giorni.
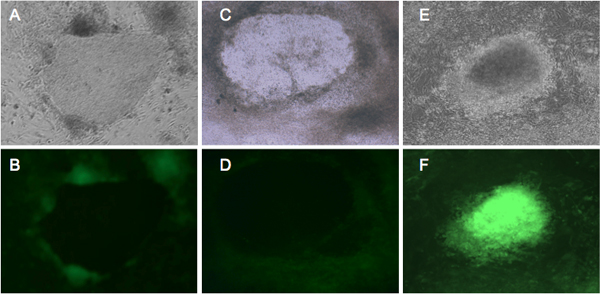
Figura 2. Rappresentante espressione fluorescente GFP in cellule in fase di riprogrammazione. BJ e Detroit 551 fibroblasti sono state infettate con retrovirus che esprime quattro fattori di riprogrammazione 4, e incubate in un mezzo hESC per quattro settimane. Fibroblasti BJ (A, B) e Detroit 551 (C, D) mostrano simili morfologica. Dal giorno 21, colonie GFP negativi cominciano a formarsi, che rappresentano le iPSCs buona fede 10. (E, F) mostrano trasformato Detroit 551 cellule che non hanno subito corretta riprogrammazione. (A, C, E) colonie sotto vista a contrasto di fase. (B, D) correttamente riprogrammato cellule che mostrano il silenziamento GFP. (F) espressione GFP luminoso da colonia trasformata.
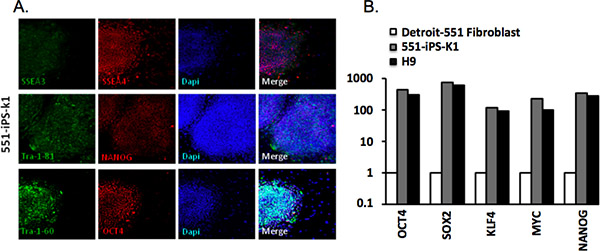
Figura 3. Caratterizzazione delle cellule staminali pluripotenti indotte umane. (A) 551-umane iPS-K1 colonie di cellule esprimono marcatori comuni alle cellule pluripotenti. Colorazione DAPI indica il contenuto totale delle cellule per campo. (B) quantitativa real time-PCR (RT-qPCR) per l'espressione di Oct4, Sox2, Klf4, MYC in f genitoriibroblast e 551-IPS-K1 iPSCs e H9 cellule staminali embrionali umane (hESC). I dati sono stati normalizzati contro la β-actina gene housekeeping e tracciati rispetto al livello di espressione nelle cellule di fibroblasti parentali 4.
Access restricted. Please log in or start a trial to view this content.
Discussione
Espressione di quattro fattori di trascrizione riprogramma i fibroblasti umani a iPSCs. Molti tentativi sono stati fatti per generare iPSCs umani utilizzando non-integrazione o non-genetica approcci per generare iPSCs clinicamente sicuro. Finora, questi metodi presentano efficienza estremamente bassa e richiedono ulteriore ottimizzazione per migliorare la riproducibilità 11-14. Metodi Retro-o lentivirali sono facilmente utilizzati per ricavare e applicare iPSCs per l'uomo in modelli di malattia ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dalla Yale School of Medicine e Salute Child Research Award da Charles Hood Foundation.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 11330057 | 80% |
| Knockout Serum Replacer | Invitrogen | 10828-028 | 20% |
| L-Glutamine (200 mM) | Invitrogen | 25030081 | 2 mM |
| Nonessential Amino Acids (10 mM) | Invitrogen | 11140050 | 0.1 mM |
| β-Mercapt–thanol (14.3 M) or MTG | Invitrogen | M-6250 | 0.1 mM |
| bFGF-2 10 μg/ml | GIBCO, by Life Technologies | GF003AF | 4 ng/ml |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| DMEM | Invitrogen | 11965118 | 90% |
| FBS | Invitrogen | 10407028 | 10% |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| Table 1. Culture Medium | |||
| OCT4 | Abcam | Ab19857 | 1:500 |
| SSEA3 | EMD Millipore | MAB4303 | 1:100 |
| SSEA4 | BD Biosciences | BD560218 | 1:100 |
| Tra-1-81 | BD Biosciences | BD560173 | 1:100 |
| Tra-1-60 | BD Biosciences | BD560174 | 1:100 |
| NANOG | Abcam | Ab21624 | 1:500 |
| Alexa-Flur 488 | Invitrogen | A11008 | 1:1000 |
| Alexa-Flur 555 | Invitrogen | A21422 | 1:1000 |
| DAPI | Invitrogen | D1306 | 1:5000 |
| pMIG-OCT4 | Addgene | 17225 | |
| pMIG-SOX2 | Addgene | 17226 | |
| pMIG-KLF4 | Addgene | 17227 | |
| pMIG-MYC | Addgene | 18119 | |
| Collagenase type IV | Invitrogen | 17104019 | 1mg/ml |
| Gelatin, Porcine | Sigma-Aldrich | G 1890 | 0.1% |
| Triton | Sigma-Aldrich | X100-500ML | 0.2% |
| Paraformaldehyde | Sigma-Aldrich | 47608 | 4% |
| BSA | American Bioanalytical | AB01800 | 3% |
| MEF feeder cells | EMD Millipore | PMEF-N | |
| Cell Lifter | Corning | 3008 | |
| Fluorescent microscopy: inverted microscope with GFP filter | |||
| Table 2. Reagents and equipment | |||
Riferimenti
- Murry, C. E., Keller, G. Differentiation of embryonic stem cells to clinically relevant populations: lessons from embryonic development. Cell. 132, 661-680 (2008).
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Yu, J., Vodyanik, M. A., Smuga-Otto, K., Antosiewicz-Bourget, J., Frane, J. L., Tian, S., Nie, J., Jonsdottir, G. A., Ruotti, V., Stewart, R. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Park, I. H., Lerou, P. H., Zhao, R., Huo, H., Daley, G. Q. Generation of human-induced pluripotent stem cells. Nature Protocols. 3, 1180-1186 (2008).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Hotta, A., Ellis, J. Retroviral vector silencing during iPS cell induction: an epigenetic beacon that signals distinct pluripotent states. Journal of Cellular Biochemistry. 105, 940-948 (2008).
- Matsui, T., Leung, D., Miyashita, H., Maksakova, I. A., Miyachi, H., Kimura, H., Tachibana, M., Lorincz, M. C., Shinkai, Y. Proviral silencing in embryonic stem cells requires the histone methyltransferase ESET. Nature. 464, 927-931 (2010).
- Wolf, D., Goff, S. P. Embryonic stem cells use ZFP809 to silence retroviral DNAs. Nature. 458, 1201-1204 (2009).
- Chan, E. M., Ratanasirintrawoot, S., Park, I. H., Manos, P. D., Loh, Y. H., Huo, H., Miller, J. D., Hartung, O., Rho, J., Ince, T. A. Live cell imaging distinguishes bona fide human iPS cells from partially reprogrammed cells. Nat. Biotechnol. 27, 1033-1037 (2009).
- Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin,, Thomson, J. A. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Kim, D., Kim, C. H., Moon, J. I., Chung, Y. G., Chang, M. Y., Han, B. S., Ko, S., Yang, E., Cha, K. Y., Lanza, R. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Warren, L., Manos, P. D., Ahfeldt, T., Loh, Y. H., Li, H., Lau, F., Ebina, W., Mandal, P. K., Smith, Z. D., Meissner, A. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Ban, H., Nishishita, N., Fusaki, N., Tabata, T., Saeki, K., Shikamura, M., Takada, N., Inoue, M., Hasegawa, M., Kawamata, S. Efficient generation of transgene-free human induced pluripotent stem cells (iPSCs) by temperature-sensitive Sendai virus vectors. Proceedings of the National Academy of Sciences of the United States of America. 108, 14234-14239 (2011).
- Wolf, D., Goff, S. P. TRIM28 mediates primer binding site-targeted silencing of murine leukemia virus in embryonic cells. Cell. 131, 46-57 (2007).
- Park, I. H., Arora, N., Huo, H., Maherali, N., Ahfeldt, T., Shimamura, A., Lensch, M. W., Cowan, C., Hochedlinger, K., Daley, G. Q. Disease-specific induced pluripotent stem cells. Cell. 134, 877-886 (2008).
- Kim, K. Y., Hysolli, E., Park, I. H. Neuronal maturation defect in induced pluripotent stem cells from patients with Rett syndrome. Proceedings of the National Academy of Sciences of the United States of America. 108, 14169-14174 (2011).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon