Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Reprogrammierung menschlichen Körperzellen in induzierte pluripotente Stammzellen (IPSCs) mit retroviralen Vektoren mit GFP
In diesem Artikel
Zusammenfassung
Ein Verfahren für die menschliche induzierte pluripotente Stammzellen (IPSCs) über Retrovirus-vermittelte ektopische Expression von Oct4 generieren, wird Sox2, Klf4 und MYC beschrieben. Ein praktischer Weg, um menschliche iPSC Kolonien auf GFP-Expression zu identifizieren Basis wird ebenfalls diskutiert.
Zusammenfassung
Menschliche embryonale Stammzellen (HES) sind pluripotent und einen unschätzbaren zellulären Quellen für In-vitro-Krankheit Modellierung und der regenerativen Medizin ein. Es wurde zuvor gezeigt, dass die somatischen Zellen Pluripotenz kann im Vergleich zur Expression von vier Transkriptionsfaktoren (Oct4, Sox2, Klf4 und Myc) umprogrammiert werden und werden induzierte pluripotente Stammzellen (IPSCs) 2-4. Wie hESCs, sind menschliche pluripotente IPSCs und eine potentielle Quelle für autologe Zellen. Hier beschreiben wir das Protokoll für die menschliche Fibroblasten-Zellen mit den vier Umprogrammierung Faktoren in GFP-haltigen retroviralen Backbone 4 geklont umzuprogrammieren. Mit dem folgenden Protokoll, erzeugen wir Menschen IPSCs in 3-4 Wochen unter die menschliche Kultur ESC Zustand. Menschliche iPSC Kolonien ähneln HES in der Morphologie und zeigt den Verlust der GFP-Fluoreszenz als Ergebnis von retroviralen Transgen-. iPSC Kolonien mechanisch unter einem Fluoreszenz-Mikroskopie isoliertEW verhalten sich ähnlich wie HES. In diesen Zellen erkennen wir die Expression mehrerer Gene und Pluripotenz Oberflächenmarker.
Protokoll
1. Reprogrammierung von Retrovirus Reprogrammierungsfaktoren
- Humane Fibroblasten in Fibroblasten-Medium (10% FBS in DMEM mit Pen / Strep) kultiviert.
- Einen Tag vor der Infektion, Platte 1x10 5 humane Fibroblasten in eine Vertiefung einer 6-Well-Platte.
- Saugen Sie Medium, um tote Zellen zu entfernen und 2 ml frisches Medium Fibroblasten. In Protaminsulfat in einer Endkonzentration von 5 pg / ml.
- Vorsichtig die geeignete Menge jedes GFP-exprimierenden Virus entsprechend einer Multiplizität der Infektion (MOI) 5 5.
- Einen Tag nach der Infektion, entfernen Sie den Virus-Überstand, waschen, dreimal mit 2 ml PBS, dann 2 ml Fibroblasten-Medium.
- Drei Tage nach der Infektion, überprüfen Sie die GFP-Fluoreszenz und füllt die gut mit 2 ml Fibroblasten-Medium.
- Vier Tage nach der Infektion Platte 1x10 4 / cm 2 bestrahlt embryonalen Maus-Fibroblasten (MEFs) Fibroblasten-Feeder-Zellen in Medium auf eine10-cm-Petrischale mit 0,1% Gelatine beschichtet. Bei 37 ° C über Nacht.
- Fünf Tage nach der Infektion lösen infizierten menschlichen Fibroblasten mit 1 ml 0,05% Trypsin / EDTA für 5 Minuten bei 37 ° C, und für 5 Minuten bei 200 g. Saugen Sie das Medium, und Zellen mit 10 ml Fibroblasten-Medium. Übertragen der Zellen in eine Pre-beschichteten 10-cm-Platte.
- Nach 24 Stunden, ersetzen Sie das Medium mit hES-Kulturmedium (20% Knock-Out Serumersatz, DMEM/F12, 0,1 ml nicht-essentielle Aminosäuren, 4 ng / ml bFGF, Pen / Strep / Glutamat, beta-merceptoethanol). Ändern Sie das Medium täglich. ESC-ähnliche Kolonien beginnt, am Tag 20-27 nach der Infektion auftreten.
2. Isolierung und Expansion von IPSCs
- Unter einem Fluoreszenzmikroskop, das Fehlen der GFP-Fluoreszenz in einer Kolonie, die eine ähnliche Morphologie zeigt, HES zu überprüfen.
- Mit einem 10 ul Pipette, Pick einzelnen iPSC Kolonien und legen Sie sie in eine Vertiefung einer Gelatine-und MEF-CoATed 12-Well-Platte und ergänzt mit hES-Medium. Ändern Medium täglich.
- Für die Passage, waschen Sie die Platte mit 1 ml DMEM/F12, dann fügen Sie 0,5 ml Kollagenase, und inkubieren Sie für 10 Minuten bei 37 ° C
- Waschen Sie die Zellen zweimal mit DMEM/F12.
- 2 ml frisches Medium hESC. Die Verwendung eines Handys Heber, brechen die Kolonien in kleine Stücke und lösen verbleibenden Zellen von der Platte.
- Übertragen Sie die resuspendierten Stücke von Kolonien in eine Vertiefung einer Gelatine-und MEF-beschichteten 6-Well-Platte.
3. Immunfluoreszenz-Analyse von pluripotenten Marker
- Die Zellen werden dreimal mit PBS und mit 4% Paraformaldehyd für 20 min bei Raumtemperatur.
- Danach weitere Reinigung die Zellen dreimal mit PBS gewaschen und mit 0,2% Triton X-100 in PBS für 30 min. Permeabilisieren
- Sperren nicht-spezifische Bindung durch Inkubation von Zellen mit 3% BSA in PBS für zwei Stunden.
- Inkubieren der Zellen mit dem primären Antikörper über Nacht bei 4 ° C
- Waschen Sie die Zellen dreimal mit PBS und Inkubation der Zellen mit spezifischen sekundären Antikörper für eine Stunde bei Raumtemperatur, Fernhalten von Licht.
- Die Zellen werden dreimal mit PBS und merken DAPI beim letzten Spülgang durch Inkubation bei Raumtemperatur für 5 Minuten.
- Ermitteln Sie die Färbung mit einem Fluoreszenz-Mikroskop.
4. Quantitative Real-time PCR Assay für den pluripotenten Marker
- Isolieren der Gesamt-RNA aus den menschlichen IPSCs aus humanen Fibroblasten mit Qiagen RNeasy-Kit abgeleitet.
- Synthetisieren der Erststrang-cDNA unter Verwendung von SuperScript II Reverse Transkriptase.
- Führen qPCR zu Pluripotenz-Gene unter Verwendung der Primer bereits berichtet erkennen. 6
5. Repräsentative Ergebnisse
- Morphologische Veränderung während der Umprogrammierung
Wir infizierten menschlichen Fibroblasten BJ1 und Detroit 551 mit einem Cocktail von Retroviren tragen Oct4, Sox2, Klf4 und MYC,und konnten morphologische Veränderungen während des Programmierens (1) zu erfassen. Einundzwanzig Tage nach der Infektion, erkennen wir kleine iPSC Kolonien durch ihre hES-ähnliche Morphologie. Darüber hinaus erkennen wir IPSCs durch die GFP-Fluoreszenz. Pluripotenten Stammzellen, wie WSR und IPSCs, drücken die molekulare Maschinerie zur Unterdrückung der proviralen Genexpression 09.07. Unsere einzigartige retroviralen Vektors exprimiert GFP zusammen mit Umprogrammierung Gene durch retrovirale LTR. Somit werden Zellen, die GFP exprimieren kontinuierlich als Transgene ohne provirale Gen-Silencing auszudrücken. Getreu umprogrammiert iPSC Kolonien, die die Pluripotenz molekularen Netzwerk zu erwerben zeigen die Abwesenheit von GFP-Expression (Abbildung 2) 10. - Charakterisierung von Pluripotenz menschlicher IPSCs
Wir analysierten Kolonien von Detroit-551 Fibroblasten via Immunhistochemie abgeleitet mit TRA-1-81, Tra-1-60, SSEA-4, SSEA-3, Oct4 und NANOG Antikörper ( Tabelle 2). Erfolgreich umprogrammiert IPSCs exprimieren alle dieser Marker (3A). Wir haben auch analysiert Genexpression über quantitative RT-PCR-Analyse. Wir haben beobachtet, dass die Expression von Oct4, Sox2, Klf4, MYC und NANOG signifikant war im Vergleich zu den parentalen Fibroblasten-Zellen erhöht, aber angemessen mit der H9 hESCs (3B).
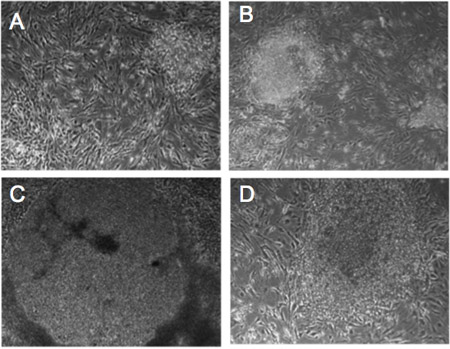
Abbildung 1. Morphologischen Veränderungen der Retrovirus-infizierten menschlichen Fibroblasten. (AD) Progressive morphologische Veränderung in Kolonien von Detroit-551 Fibroblasten mit Umprogrammierung Faktoren infiziert. Tag 5 (A), Tag 10 (B), Tag 14 (C), Tag 21 (D). Die Zellen zeigen den hES-ähnliche Morphologie nach 21 Tagen.
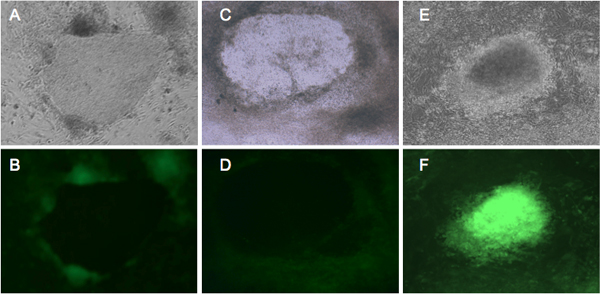
Abbildung 2. Vertreter fluoreszierende GFP-Expression in Zellen, die eine Neuprogrammierung. BJ und Detroit 551 Fibroblasten wurden mit Retrovirus vier Umprogrammierung Faktoren 4 infiziert und inkubiert in hES-Medium für vier Wochen. BJ-Fibroblasten (A, B) und Detroit 551 (C, D) zeigen ähnliche morphologische. Vom ersten Tag 21, beginnen GFP-negative Kolonien zu bilden, aus denen die bona fide IPSCs 10. (E, F) zeigen, verwandelt Detroit 551 Zellen, die nicht ordnungsgemäße Umprogrammierung unterzogen wurden. (A, C, E) Kolonien unter Phasenkontrast-Ansicht. (B, D) richtig Zellen, die das GFP-Silencing zeigen umprogrammiert. (F) helle GFP-Expression von transformierten Kolonie.
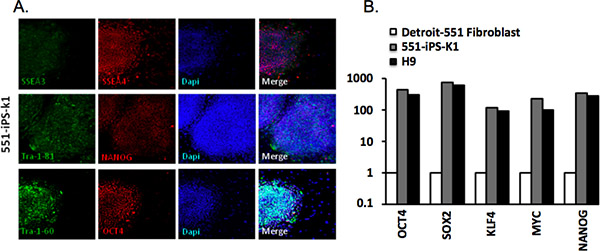
Abbildung 3. Die Charakterisierung der menschlichen induzierten pluripotenten Stammzellen. (A) Menschliche iPS-551-K1 Zellkolonien auszudrücken Marker gemeinsam pluripotenten Zellen. DAPI-Färbung zeigt die gesamte Zellgehalt pro Feld. (B) Quantitative Echtzeit-PCR (RT-qPCR) für die Expression von Oct4, Sox2, Klf4, MYC im elterlichen fibroblast, 551-iPS-K1 IPSCs, H9 und humanen embryonalen Stammzellen (hES). Die Daten wurden gegen β-Actin Housekeeping-Gen normalisiert und aufgetragen relativ zu der Expression in den parentalen Zellen 4 Fibroblasten.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Expression von vier Transkriptionsfaktoren umprogrammiert menschlichen Fibroblasten zu IPSCs. Viele Versuche wurden unternommen, um Menschen mit IPSCs nicht integrierenden oder nicht-genetische Ansätze zu einer klinisch sicheren IPSCs generieren generieren. Bisher zeigen diese Methoden extrem niedrigen Wirkungsgrad und erfordern eine weitere Optimierung, um die Reproduzierbarkeit zu verbessern 14.11. Retro-oder lentiviralen Methoden werden verwendet, um ohne weiteres abzuleiten und anzuwenden IPSCs für ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von der Yale School of Medicine and Child Health Research Award von Charles Hood Foundation finanziert.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 11330057 | 80% |
| Knockout Serum Replacer | Invitrogen | 10828-028 | 20% |
| L-Glutamine (200 mM) | Invitrogen | 25030081 | 2 mM |
| Nonessential Amino Acids (10 mM) | Invitrogen | 11140050 | 0.1 mM |
| β-Mercapt–thanol (14.3 M) or MTG | Invitrogen | M-6250 | 0.1 mM |
| bFGF-2 10 μg/ml | GIBCO, by Life Technologies | GF003AF | 4 ng/ml |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| DMEM | Invitrogen | 11965118 | 90% |
| FBS | Invitrogen | 10407028 | 10% |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| Table 1. Culture Medium | |||
| OCT4 | Abcam | Ab19857 | 1:500 |
| SSEA3 | EMD Millipore | MAB4303 | 1:100 |
| SSEA4 | BD Biosciences | BD560218 | 1:100 |
| Tra-1-81 | BD Biosciences | BD560173 | 1:100 |
| Tra-1-60 | BD Biosciences | BD560174 | 1:100 |
| NANOG | Abcam | Ab21624 | 1:500 |
| Alexa-Flur 488 | Invitrogen | A11008 | 1:1000 |
| Alexa-Flur 555 | Invitrogen | A21422 | 1:1000 |
| DAPI | Invitrogen | D1306 | 1:5000 |
| pMIG-OCT4 | Addgene | 17225 | |
| pMIG-SOX2 | Addgene | 17226 | |
| pMIG-KLF4 | Addgene | 17227 | |
| pMIG-MYC | Addgene | 18119 | |
| Collagenase type IV | Invitrogen | 17104019 | 1mg/ml |
| Gelatin, Porcine | Sigma-Aldrich | G 1890 | 0.1% |
| Triton | Sigma-Aldrich | X100-500ML | 0.2% |
| Paraformaldehyde | Sigma-Aldrich | 47608 | 4% |
| BSA | American Bioanalytical | AB01800 | 3% |
| MEF feeder cells | EMD Millipore | PMEF-N | |
| Cell Lifter | Corning | 3008 | |
| Fluorescent microscopy: inverted microscope with GFP filter | |||
| Table 2. Reagents and equipment | |||
Referenzen
- Murry, C. E., Keller, G. Differentiation of embryonic stem cells to clinically relevant populations: lessons from embryonic development. Cell. 132, 661-680 (2008).
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Yu, J., Vodyanik, M. A., Smuga-Otto, K., Antosiewicz-Bourget, J., Frane, J. L., Tian, S., Nie, J., Jonsdottir, G. A., Ruotti, V., Stewart, R. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Park, I. H., Lerou, P. H., Zhao, R., Huo, H., Daley, G. Q. Generation of human-induced pluripotent stem cells. Nature Protocols. 3, 1180-1186 (2008).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Hotta, A., Ellis, J. Retroviral vector silencing during iPS cell induction: an epigenetic beacon that signals distinct pluripotent states. Journal of Cellular Biochemistry. 105, 940-948 (2008).
- Matsui, T., Leung, D., Miyashita, H., Maksakova, I. A., Miyachi, H., Kimura, H., Tachibana, M., Lorincz, M. C., Shinkai, Y. Proviral silencing in embryonic stem cells requires the histone methyltransferase ESET. Nature. 464, 927-931 (2010).
- Wolf, D., Goff, S. P. Embryonic stem cells use ZFP809 to silence retroviral DNAs. Nature. 458, 1201-1204 (2009).
- Chan, E. M., Ratanasirintrawoot, S., Park, I. H., Manos, P. D., Loh, Y. H., Huo, H., Miller, J. D., Hartung, O., Rho, J., Ince, T. A. Live cell imaging distinguishes bona fide human iPS cells from partially reprogrammed cells. Nat. Biotechnol. 27, 1033-1037 (2009).
- Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin,, Thomson, J. A. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Kim, D., Kim, C. H., Moon, J. I., Chung, Y. G., Chang, M. Y., Han, B. S., Ko, S., Yang, E., Cha, K. Y., Lanza, R. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Warren, L., Manos, P. D., Ahfeldt, T., Loh, Y. H., Li, H., Lau, F., Ebina, W., Mandal, P. K., Smith, Z. D., Meissner, A. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Ban, H., Nishishita, N., Fusaki, N., Tabata, T., Saeki, K., Shikamura, M., Takada, N., Inoue, M., Hasegawa, M., Kawamata, S. Efficient generation of transgene-free human induced pluripotent stem cells (iPSCs) by temperature-sensitive Sendai virus vectors. Proceedings of the National Academy of Sciences of the United States of America. 108, 14234-14239 (2011).
- Wolf, D., Goff, S. P. TRIM28 mediates primer binding site-targeted silencing of murine leukemia virus in embryonic cells. Cell. 131, 46-57 (2007).
- Park, I. H., Arora, N., Huo, H., Maherali, N., Ahfeldt, T., Shimamura, A., Lensch, M. W., Cowan, C., Hochedlinger, K., Daley, G. Q. Disease-specific induced pluripotent stem cells. Cell. 134, 877-886 (2008).
- Kim, K. Y., Hysolli, E., Park, I. H. Neuronal maturation defect in induced pluripotent stem cells from patients with Rett syndrome. Proceedings of the National Academy of Sciences of the United States of America. 108, 14169-14174 (2011).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten