需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
人类体细胞重编程为诱导多能干细胞(iPS细胞)用绿色荧光蛋白逆转录病毒载体
摘要
的方法来产生人类诱导多能干细胞(iPS细胞)通过逆转录病毒介导的异位表达Oct4的,SOX2的,KLF4和MYC的描述。基于GFP的表达,以确定人类IPSC的殖民地一个切实可行的办法进行了讨论。
摘要
人类胚胎干细胞(胚胎干细胞),多能干细胞在体外疾病建模和再生医学的宝贵来源。它已被先前的研究显示,人体细胞可以被重新编程为多能性异位表达四个转录因子(OCT4,SOX2,KLF4和 Myc),成为诱导多能干细胞(iPS细胞)2-4。胚胎干细胞一样,人类iPS细胞是多能干细胞和自体细胞的潜在来源。在这里,我们描述的协议进行重新编程人类成纤维细胞克隆到含有GFP的逆转录病毒的骨干4四个重编程因素 。使用下面的协议,我们生成人类胚胎培养条件下的人类iPS细胞在3-4周。人类IPSC的殖民地酷似胚胎干细胞形态和逆转录病毒转基因沉默的结果显示,GFP荧光的损失。 IPSC的殖民地下的荧光microsco机械分离体育作为人类胚胎干细胞类似的方式表现。在这些细胞中,我们检测的多的多能性基因的表达和表面标志。
研究方案
1。逆转录病毒重新编程,重编程因子的表达
- 人成纤维细胞培养成纤维细胞培养基(10%与PEN /链球菌培养液胎牛血清)。
- 感染前的一天,1×10板5到6孔板人成纤维细胞。
- 抽吸介质,去除死皮细胞和新鲜的成纤维细胞培养基中添加2毫升。在终浓度为5微克/毫升,加入硫酸鱼精蛋白。
- 仔细地添加适量的每个表达GFP病毒的感染复数(MOI)5。
- 感染后的一天,清除病毒上清,2毫升PBS洗三次,然后加入2毫升的成纤维细胞培养基。
- 感染后3天,检查GFP荧光,以及补充成纤维细胞培养基2毫升。
- 感染四天后,板1×10 4 /厘米2辐照小鼠胚胎成纤维细胞(MEFs)在成纤维细胞培养基中饲养细胞到一个涂有0.1%明胶的10厘米的培养皿。孵育37℃过夜。
- 五天后感染,感染人成纤维细胞分离与1毫升0.05%胰蛋白酶/ EDTA 5分钟,在37°C间,在200克离心5分钟。抽吸的介质,悬浮细胞,成纤维细胞培养基10毫升。细胞转移到10厘米预涂板。
- 24小时后,取代胚胎干细胞培养基血清替代20%击倒,DMEM/F12培养液,0.1毫升的非必需氨基酸,4 ng / ml的碱性成纤维细胞生长因子,PEN /链球菌/谷氨酸,β-merceptoethanol的介质。改变中等每日。 ESC - 殖民地将开始出现在感染后20-27天。
2。 iPS细胞的分离和扩展的
- 荧光显微镜下,检查GFP荧光在殖民地的情况下,显示了一个类似的形态胚胎干细胞。
- 使用10μL移液器,挑选个别IPSC的殖民地,并放入明胶和MEF-COA特德与胚胎干细胞培养基的12孔板和补充。每天改变介质。
- 对于传代,用1毫升的DMEM/F12板,再加入0.5毫升胶原酶,孵育10分钟,在37°C
- 与DMEM/F12培养液洗细胞两次。
- 加入2毫升的新鲜胚胎干细胞培养基。使用细胞升降机,打破成小块殖民地和分离板的剩余细胞。
- 转入的明胶涂层和MEF 6孔板殖民地的再悬浮件。
3。多能干标记免疫分析
- 洗细胞三次,用PBS,并固定为4%多聚甲醛在室温下20分钟。
- 用PBS轻轻洗细胞三次,通透与0.2%的Triton的PBS X-100的30分钟。
- 阻止了两个小时,在PBS 3%的BSA孵育细胞非特异性结合。
- 孵育与小学抗体细胞一夜之间在4°C。 <李>洗细胞三次,用PBS孵育一小时在室温下与特定的二级抗体的细胞,从遮光。
- 洗细胞与PBS及附加的DAPI随后在室温下孵育5分钟的最后一次洗涤三次。
- 用荧光显微镜检测染色。
4。为多能干标记实时定量PCR检测
- 隔离使用Qiagen公司的RNeasy试剂盒的人成纤维细胞的人类iPS细胞的总RNA。
- 合成cDNA第一链的使用上标II逆转录酶。
- 执行定量PCR检测使用以前报道的引物的全能性基因。
5。代表结果
- 编程期间的形态学变化
感染人成纤维细胞与账面OCT4,SOX2,KLF4和MYC基因的逆转录病毒的鸡尾酒BJ1和底特律551,能够探测到的形态学变化,在重新规划( 图1)。感染后二十一日内,我们承认他们的人类胚胎干细胞一样的形态小IPSC的殖民地。此外,我们认识到iPSCs的GFP荧光。如胚胎干细胞和iPS细胞,多能干细胞表达的分子机制,压制7-9前病毒基因的表达。我们独特的逆转录病毒载体表达绿色荧光蛋白基因与逆转录病毒LTR的重新编程。因此,持续表达GFP的细胞被认为是没有前病毒基因沉默表达外源基因。忠实地重新编程的IPSC的殖民地获得全能性的分子网络显示的情况下GFP的表达( 图2)10。 - 人类iPS细胞的全能性的表征
我们分析了从底特律-551成纤维细胞与TRA-1-81,TRA-1-60,SSEA-4,SSEA-3,OCT4和NANOG的抗体通过免疫组化派生的殖民地( 表2)。成功地重新编程的iPS细胞表达所有这些标记( 图3A)。我们还通过定量RT-PCR分析基因表达分析。我们观察到,表达Oct4的,SOX2的,KLF4基因,MYC和NANOG显着增加父母的成纤维细胞相比,但与H9的胚胎干细胞( 图3B)。
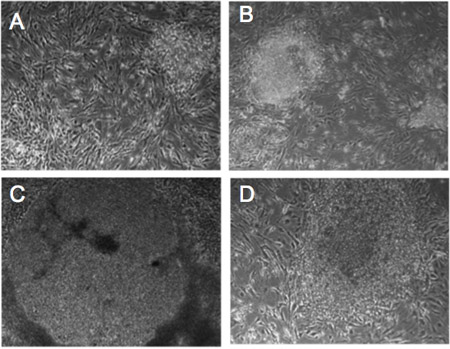
图1。逆转录病毒感染人成纤维细胞的形态变化。(AD)的进步从底特律-551感染的成纤维细胞重编程因子的菌落的形态变化。第5天(一),第10天(二),第14天(三),(四)21天。细胞显示经过21天的人类胚胎干细胞样形态。
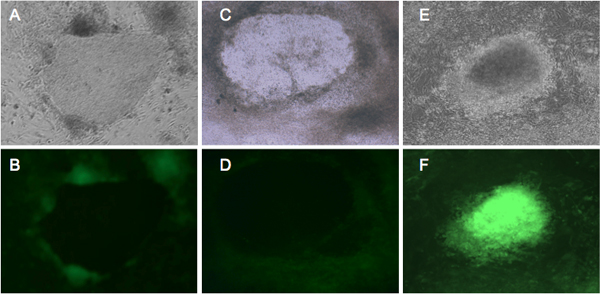
图2。代表GFP荧光表达细胞进行重新编程。 北京和底特律551成纤维细胞感染逆转录病毒表达4个重编程因子4,四个星期在人类胚胎干细胞培养基中培养。北京成纤维细胞(甲,乙)和底特律551(C和D)显示出类似的形态。从第21天,GFP阴性殖民地开始形成,它代表了真正的10善意iPSCs的。 (,E,F)显示底特律551没有进行适当的重新编程的细胞转化。在相衬视图(一个C,E)的殖民地。 (B,D)正确地重新编程细胞显示了GFP沉默。 (六)从转化菌落明亮的绿色荧光蛋白表达。
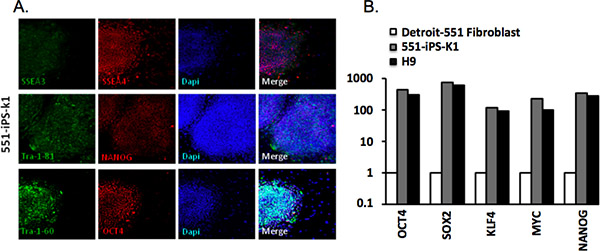
图3。人类诱导多能干细胞的特征。(一)人力551-IPS-K1细胞克隆表达常见的多能干细胞的标记。 DAPI染色显示每场总的单元格的内容。 (二)实时定量聚合酶链反应(RT-QPCR)时间为表达Oct4的,SOX2的,KLF4的,myc在父母f551-IPS-K1 ibroblast,iPS细胞,人类胚胎干细胞和H9(胚胎干细胞)。数据正常化对β-actin的看家基因,并绘制相对表达水平在父母的成纤维细胞4。
Access restricted. Please log in or start a trial to view this content.
讨论
四个转录因子重编程iPSCs的人类成纤维细胞中的表达。作了许多尝试使用非集成或者非遗传方法来生成临床安全iPSCs的人类iPS细胞生成。到目前为止,这些方法效率极低,需要进一步优化,提高了重复性11-14。复古或慢病毒的方法,很容易获得和运用人类iPS细胞, 在体外的疾病模型,这是减少病毒整合所造成的安全问题上的依赖。重新编程的方法,这里描述的是人类iPS细胞的效率推?...
Access restricted. Please log in or start a trial to view this content.
披露声明
致谢
这项工作是由耶鲁大学的查尔斯·胡德基金会的医学和儿童健康研究奖的学校。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 11330057 | 80% |
| Knockout Serum Replacer | Invitrogen | 10828-028 | 20% |
| L-Glutamine (200 mM) | Invitrogen | 25030081 | 2 mM |
| Nonessential Amino Acids (10 mM) | Invitrogen | 11140050 | 0.1 mM |
| β-Mercapt–thanol (14.3 M) or MTG | Invitrogen | M-6250 | 0.1 mM |
| bFGF-2 10 μg/ml | GIBCO, by Life Technologies | GF003AF | 4 ng/ml |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| DMEM | Invitrogen | 11965118 | 90% |
| FBS | Invitrogen | 10407028 | 10% |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| Table 1. Culture Medium | |||
| OCT4 | Abcam | Ab19857 | 1:500 |
| SSEA3 | EMD Millipore | MAB4303 | 1:100 |
| SSEA4 | BD Biosciences | BD560218 | 1:100 |
| Tra-1-81 | BD Biosciences | BD560173 | 1:100 |
| Tra-1-60 | BD Biosciences | BD560174 | 1:100 |
| NANOG | Abcam | Ab21624 | 1:500 |
| Alexa-Flur 488 | Invitrogen | A11008 | 1:1000 |
| Alexa-Flur 555 | Invitrogen | A21422 | 1:1000 |
| DAPI | Invitrogen | D1306 | 1:5000 |
| pMIG-OCT4 | Addgene | 17225 | |
| pMIG-SOX2 | Addgene | 17226 | |
| pMIG-KLF4 | Addgene | 17227 | |
| pMIG-MYC | Addgene | 18119 | |
| Collagenase type IV | Invitrogen | 17104019 | 1mg/ml |
| Gelatin, Porcine | Sigma-Aldrich | G 1890 | 0.1% |
| Triton | Sigma-Aldrich | X100-500ML | 0.2% |
| Paraformaldehyde | Sigma-Aldrich | 47608 | 4% |
| BSA | American Bioanalytical | AB01800 | 3% |
| MEF feeder cells | EMD Millipore | PMEF-N | |
| Cell Lifter | Corning | 3008 | |
| Fluorescent microscopy: inverted microscope with GFP filter | |||
| Table 2. Reagents and equipment | |||
参考文献
- Murry, C. E., Keller, G. Differentiation of embryonic stem cells to clinically relevant populations: lessons from embryonic development. Cell. 132, 661-680 (2008).
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Yu, J., Vodyanik, M. A., Smuga-Otto, K., Antosiewicz-Bourget, J., Frane, J. L., Tian, S., Nie, J., Jonsdottir, G. A., Ruotti, V., Stewart, R. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Park, I. H., Lerou, P. H., Zhao, R., Huo, H., Daley, G. Q. Generation of human-induced pluripotent stem cells. Nature Protocols. 3, 1180-1186 (2008).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Hotta, A., Ellis, J. Retroviral vector silencing during iPS cell induction: an epigenetic beacon that signals distinct pluripotent states. Journal of Cellular Biochemistry. 105, 940-948 (2008).
- Matsui, T., Leung, D., Miyashita, H., Maksakova, I. A., Miyachi, H., Kimura, H., Tachibana, M., Lorincz, M. C., Shinkai, Y. Proviral silencing in embryonic stem cells requires the histone methyltransferase ESET. Nature. 464, 927-931 (2010).
- Wolf, D., Goff, S. P. Embryonic stem cells use ZFP809 to silence retroviral DNAs. Nature. 458, 1201-1204 (2009).
- Chan, E. M., Ratanasirintrawoot, S., Park, I. H., Manos, P. D., Loh, Y. H., Huo, H., Miller, J. D., Hartung, O., Rho, J., Ince, T. A. Live cell imaging distinguishes bona fide human iPS cells from partially reprogrammed cells. Nat. Biotechnol. 27, 1033-1037 (2009).
- Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin,, Thomson, J. A. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Kim, D., Kim, C. H., Moon, J. I., Chung, Y. G., Chang, M. Y., Han, B. S., Ko, S., Yang, E., Cha, K. Y., Lanza, R. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Warren, L., Manos, P. D., Ahfeldt, T., Loh, Y. H., Li, H., Lau, F., Ebina, W., Mandal, P. K., Smith, Z. D., Meissner, A. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Ban, H., Nishishita, N., Fusaki, N., Tabata, T., Saeki, K., Shikamura, M., Takada, N., Inoue, M., Hasegawa, M., Kawamata, S. Efficient generation of transgene-free human induced pluripotent stem cells (iPSCs) by temperature-sensitive Sendai virus vectors. Proceedings of the National Academy of Sciences of the United States of America. 108, 14234-14239 (2011).
- Wolf, D., Goff, S. P. TRIM28 mediates primer binding site-targeted silencing of murine leukemia virus in embryonic cells. Cell. 131, 46-57 (2007).
- Park, I. H., Arora, N., Huo, H., Maherali, N., Ahfeldt, T., Shimamura, A., Lensch, M. W., Cowan, C., Hochedlinger, K., Daley, G. Q. Disease-specific induced pluripotent stem cells. Cell. 134, 877-886 (2008).
- Kim, K. Y., Hysolli, E., Park, I. H. Neuronal maturation defect in induced pluripotent stem cells from patients with Rett syndrome. Proceedings of the National Academy of Sciences of the United States of America. 108, 14169-14174 (2011).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。