Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Reprogrammation des cellules somatiques humaines dans cellules souches pluripotentes induites (CISP) Utilisation vecteur rétroviral avec la GFP
Dans cet article
Résumé
Une méthode pour générer de l'homme cellules souches pluripotentes induites (CISP) via un rétrovirus médiation expression ectopique de OCT4, SOX2, KLF4 et MYC est décrite. Un moyen pratique pour identifier l'homme colonies iPSC fondées sur l'expression de GFP est également discuté.
Résumé
Cellules souches embryonnaires humaines (CSEh) sont pluripotentes et une source précieuse pour cellulaires dans la modélisation des maladies in vitro et la médecine régénérative 1. Il a été montré précédemment que des cellules somatiques humaines peuvent être reprogrammées pour la pluripotence par l'expression ectopique de quatre facteurs de transcription (Oct4, Sox2, Klf4 et Myc) et devenir cellules souches pluripotentes induites (CISP) 2-4. Comme les CSEh, CSPi humaines sont pluripotentes et une source potentielle de cellules autologues. Nous décrivons ici le protocole de reprogrammer des cellules de fibroblastes humains avec les quatre facteurs de reprogrammation clonés dans GFP-rétroviral contenant un squelette 4. En utilisant le protocole suivant, nous générons CSPi de l'homme dans les 3-4 semaines dans des conditions de culture des CSE humaines. Homme colonies iPSC ressemblent CSEh dans la morphologie et afficher la perte de la GFP de fluorescence en résultat de l'inactivation transgène rétroviral. colonies isolées iPSC mécaniquement sous un microsco fluorescencepe se comporter de la même façon que les CSEh. Dans ces cellules, nous avons détecter l'expression de multiples gènes de pluripotence et des marqueurs de surface.
Protocole
1. Reprogrammation par rétrovirus exprimant les facteurs de reprogrammation
- Des fibroblastes humains sont cultivées dans un milieu des fibroblastes (10% de FBS dans DMEM avec Pen / Strep).
- Un jour avant l'infection, la plaque de 1x10 5 fibroblastes humains dans un puits d'une plaque à 6 puits.
- Aspirer à moyen et à éliminer les cellules mortes et ajoutez 2 ml de milieu de fibroblastes frais. Ajouter du sulfate de protamine à une concentration finale de 5 ng / ml.
- Soigneusement ajouter la quantité appropriée de chacun des virus GFP-exprimer correspondant à une multiplicité d'infection (MOI) 5 5.
- Un jour après l'infection, retirer le surnageant viral, laver trois fois avec 2 ml de PBS, puis ajoutez les 2 moyennes des fibroblastes ml.
- Trois jours après l'infection, vérifier la fluorescence de la GFP et de reconstituer le puits avec 2 moyennes des fibroblastes ml.
- Quatre jours après l'infection, la plaque de 1x10 cellules nourricières 4 / cm 2 de fibroblastes embryonnaires irradiés (MEF) dans le milieu des fibroblastes SUR UNE10-cm boîte de Pétri revêtues de 0,1% de gélatine. Incuber à 37 ° C pendant la nuit.
- Cinq jours après l'infection, se détacher des fibroblastes humains infectés avec 1 ml 0,05% typsin / EDTA pendant 5 minutes à 37 ° C, et centrifuger pendant 5 minutes à 200 g. Aspirer le milieu et remettre en suspension les cellules avec 10 ml de milieu de fibroblastes. Transférer les cellules dans un pré-enduit la plaque de 10 cm.
- Après 24 heures, remplacer le milieu de milieu de culture des CSEh (20% Knock-Out de remplacement du sérum, DMEM/F12, 0,1 ml non-acides aminés essentiels, 4 ng / ml de bFGF, Pen / Strep / glutamate, le bêta-merceptoethanol). Changer le support quotidien. ESC-like colonies commencent à apparaître 20 à 27 par jour après l'infection.
2. L'isolement et l'expansion des CSPi
- Sous un microscope à fluorescence, vérifier l'absence de fluorescence de la GFP dans une colonie qui montre une morphologie similaire à CSEh.
- En utilisant une pipette de 10 ul, choisissez individuels colonies IPSC et les placer dans un puits d'une gélatine et MEF-coaTed de 12 puits de plaque et complétée avec le milieu de CSEh. Changer le milieu tous les jours.
- Pour repiquage, laver la plaque avec 1 ml de DMEM/F12, puis ajoutez 0,5 ml de collagénase, et incuber pendant 10 minutes à 37 ° C.
- Laver les cellules deux fois avec DMEM/F12.
- Ajouter 2 ml de milieu CSEh frais. L'utilisation d'un lève-cellule, de briser les colonies en petits morceaux et détacher les cellules restantes de la plaque.
- Transférer les morceaux de remises en suspension des colonies dans un puits d'une gélatine et MEF-enduit des plaques 6 puits.
3. Analyse par immunofluorescence de marqueurs pluripotentes
- Laver les cellules trois fois avec du PBS et le fixer avec du paraformaldéhyde à 4% pendant 20 min à température ambiante.
- Lavez délicatement les cellules trois fois avec du PBS et perméabiliser avec 0,2% de Triton X-100 dans du PBS pendant 30 min.
- Bloquer non-spécifiques de liaison par incubation des cellules avec de la BSA 3% dans du PBS pendant deux heures.
- Incuber les cellules avec l'anticorps primaire nuit à 4 ° C.
- Laver les cellules trois fois avec du PBS et laisser incuber les cellules avec l'anticorps secondaire spécifique pendant une heure à température ambiante, le blindage de la lumière.
- Laver les cellules trois fois avec du PBS et ajouter DAPI lors du dernier rinçage suivie d'une incubation à température ambiante pendant 5 minutes.
- Détecter la coloration avec un microscope à fluorescence.
4. Quantitative en temps réel PCR pour les marqueurs pluripotentes
- Isoler l'ARN total à partir des CSPi humaines dérivées de fibroblastes humains en utilisant le kit RNeasy de Qiagen.
- Synthétiser l'ADNc de premier brin en utilisant la transcriptase inverse SuperScript II.
- Effectuer qPCR pour détecter les gènes de pluripotence en utilisant des amorces précédemment rapportés. 6
5. Les résultats représentatifs
- Changement morphologique lors de la reprogrammation
Nous fibroblastes humains infectés BJ1 et Detroit 551 avec un cocktail de rétrovirus transportant OCT4, SOX2, KLF4 et MYC,et étaient capables de détecter des changements morphologiques lors de la reprogrammation (Figure 1). Vingt-et-un jours après l'infection, nous reconnaissons de petites colonies iPSC par leur morphologie CSEh. En outre, nous reconnaissons CSPi par la fluorescence de la GFP. Les cellules souches pluripotentes, comme les CES et iPSCs, expriment la machinerie moléculaire de réprimer l'expression du gène proviral 7-9. Notre unique vecteur rétroviral exprime la GFP en collaboration avec la reprogrammation des gènes par LTR rétroviral. Ainsi, les cellules exprimant la GFP en continu sont considérés à exprimer des transgènes sans gene silencing proviral. Fidèlement reprogrammées colonies iPSC qui acquièrent le réseau pluripotence moléculaire montrent l'absence d'expression de GFP (Figure 2) 10. - Caractérisation de la pluripotence des CSPi humaines
Nous avons analysé colonies issues de Detroit-551 fibroblastes par l'intermédiaire d'immunohistochimie avec Tra-1-81, Tra-1-60, AESS-4, SSEA-3, et des anticorps OCT4 NANOG ( Tableau 2). CSPi succès reprogrammées exprimer l'ensemble de ces marqueurs (figure 3A). Nous avons également analysé l'expression génique par l'intermédiaire RT-PCR quantitative d'analyse. Nous avons observé que l'expression de OCT4, SOX2, KLF4, MYC et NANOG a été significativement augmenté par rapport à des cellules de fibroblastes parentaux, mais en rapport avec celle de CSEh H9 (figure 3B).
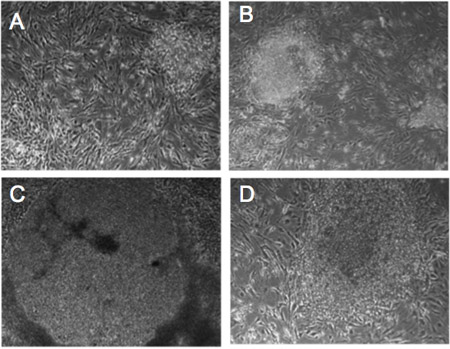
Figure 1. Les modifications morphologiques des rétrovirus-infectés fibroblastes humains. (AD) Progressive changement morphologique dans les colonies de Detroit-551 fibroblastes infectés avec des facteurs de reprogrammation. Jour 5 (A), Jour 10 (B), Jour 14 (C), jour 21 (D). Les cellules montrent la morphologie de CSEh comme après 21 jours.
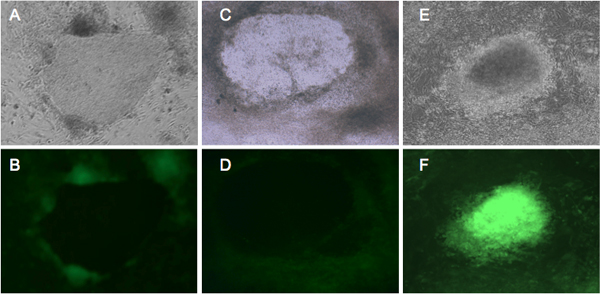
Figure 2. Représentant GFP fluorescente expression dans les cellules subissant une reprogrammation. BJ et Detroit 551 fibroblastes ont été infectées par le rétrovirus exprimant quatre facteurs de reprogrammation 4, et incubées dans un milieu CSEh pendant quatre semaines. Fibroblastes BJ (A, B) et Detroit 551 (C, D) montrent similaires morphologique. De jour 21, les colonies GFP négatifs commencent à se former, qui représentent les CSPi de bonne foi 10. (E, F) montrent transformé Detroit 551 cellules qui n'ont pas subi une reprogrammation appropriée. (A, C, E) des colonies sous vue contraste de phase. (B, D) correctement reprogrammé les cellules qui montrent le silence GFP. (F) expression de la GFP lumineux de la colonie transformée.
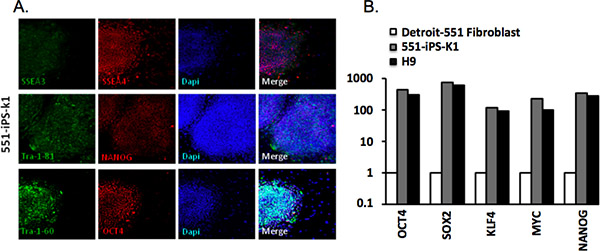
Figure 3. Caractérisation des humains cellules souches pluripotentes induites. (A) de l'homme des colonies de cellules iPS-551-K1 expriment des marqueurs communs aux cellules pluripotentes. Coloration DAPI indique le contenu de la cellule total par domaine. (B) quantitative en temps réel-PCR (RT-qPCR) pour l'expression de OCT4, SOX2, KLF4, MYC dans f parentaleibroblast, 551-iPS-K1 CSPi et H9 cellules souches embryonnaires humaines (CSEh). Les données ont été normalisées par rapport gène de ménage β-actine et tracées par rapport au niveau d'expression dans les cellules de fibroblastes parentaux 4.
Access restricted. Please log in or start a trial to view this content.
Discussion
L'expression de facteurs de transcription quatre fibroblastes humains à la reprogrammation des CSPi. De nombreuses tentatives ont été faites pour produire des CSPi humaines en utilisant des approches non-intégration ou non-génétiques pour générer CSPi cliniquement sûres. Jusqu'à présent, ces méthodes montrent l'efficacité très faible et nécessitent une optimisation plus poussée pour améliorer la reproductibilité 11-14. Rétro-méthodes ou lentiviral sont facilement utilisée pour...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Ce travail a été financé par l'École de médecine de Yale et de bourses de recherche santé de l'enfant à partir de Charles Hood Foundation.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 11330057 | 80% |
| Knockout Serum Replacer | Invitrogen | 10828-028 | 20% |
| L-Glutamine (200 mM) | Invitrogen | 25030081 | 2 mM |
| Nonessential Amino Acids (10 mM) | Invitrogen | 11140050 | 0.1 mM |
| β-Mercapt–thanol (14.3 M) or MTG | Invitrogen | M-6250 | 0.1 mM |
| bFGF-2 10 μg/ml | GIBCO, by Life Technologies | GF003AF | 4 ng/ml |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| DMEM | Invitrogen | 11965118 | 90% |
| FBS | Invitrogen | 10407028 | 10% |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| Table 1. Culture Medium | |||
| OCT4 | Abcam | Ab19857 | 1:500 |
| SSEA3 | EMD Millipore | MAB4303 | 1:100 |
| SSEA4 | BD Biosciences | BD560218 | 1:100 |
| Tra-1-81 | BD Biosciences | BD560173 | 1:100 |
| Tra-1-60 | BD Biosciences | BD560174 | 1:100 |
| NANOG | Abcam | Ab21624 | 1:500 |
| Alexa-Flur 488 | Invitrogen | A11008 | 1:1000 |
| Alexa-Flur 555 | Invitrogen | A21422 | 1:1000 |
| DAPI | Invitrogen | D1306 | 1:5000 |
| pMIG-OCT4 | Addgene | 17225 | |
| pMIG-SOX2 | Addgene | 17226 | |
| pMIG-KLF4 | Addgene | 17227 | |
| pMIG-MYC | Addgene | 18119 | |
| Collagenase type IV | Invitrogen | 17104019 | 1mg/ml |
| Gelatin, Porcine | Sigma-Aldrich | G 1890 | 0.1% |
| Triton | Sigma-Aldrich | X100-500ML | 0.2% |
| Paraformaldehyde | Sigma-Aldrich | 47608 | 4% |
| BSA | American Bioanalytical | AB01800 | 3% |
| MEF feeder cells | EMD Millipore | PMEF-N | |
| Cell Lifter | Corning | 3008 | |
| Fluorescent microscopy: inverted microscope with GFP filter | |||
| Table 2. Reagents and equipment | |||
Références
- Murry, C. E., Keller, G. Differentiation of embryonic stem cells to clinically relevant populations: lessons from embryonic development. Cell. 132, 661-680 (2008).
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Yu, J., Vodyanik, M. A., Smuga-Otto, K., Antosiewicz-Bourget, J., Frane, J. L., Tian, S., Nie, J., Jonsdottir, G. A., Ruotti, V., Stewart, R. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Park, I. H., Lerou, P. H., Zhao, R., Huo, H., Daley, G. Q. Generation of human-induced pluripotent stem cells. Nature Protocols. 3, 1180-1186 (2008).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Hotta, A., Ellis, J. Retroviral vector silencing during iPS cell induction: an epigenetic beacon that signals distinct pluripotent states. Journal of Cellular Biochemistry. 105, 940-948 (2008).
- Matsui, T., Leung, D., Miyashita, H., Maksakova, I. A., Miyachi, H., Kimura, H., Tachibana, M., Lorincz, M. C., Shinkai, Y. Proviral silencing in embryonic stem cells requires the histone methyltransferase ESET. Nature. 464, 927-931 (2010).
- Wolf, D., Goff, S. P. Embryonic stem cells use ZFP809 to silence retroviral DNAs. Nature. 458, 1201-1204 (2009).
- Chan, E. M., Ratanasirintrawoot, S., Park, I. H., Manos, P. D., Loh, Y. H., Huo, H., Miller, J. D., Hartung, O., Rho, J., Ince, T. A. Live cell imaging distinguishes bona fide human iPS cells from partially reprogrammed cells. Nat. Biotechnol. 27, 1033-1037 (2009).
- Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin,, Thomson, J. A. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Kim, D., Kim, C. H., Moon, J. I., Chung, Y. G., Chang, M. Y., Han, B. S., Ko, S., Yang, E., Cha, K. Y., Lanza, R. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Warren, L., Manos, P. D., Ahfeldt, T., Loh, Y. H., Li, H., Lau, F., Ebina, W., Mandal, P. K., Smith, Z. D., Meissner, A. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Ban, H., Nishishita, N., Fusaki, N., Tabata, T., Saeki, K., Shikamura, M., Takada, N., Inoue, M., Hasegawa, M., Kawamata, S. Efficient generation of transgene-free human induced pluripotent stem cells (iPSCs) by temperature-sensitive Sendai virus vectors. Proceedings of the National Academy of Sciences of the United States of America. 108, 14234-14239 (2011).
- Wolf, D., Goff, S. P. TRIM28 mediates primer binding site-targeted silencing of murine leukemia virus in embryonic cells. Cell. 131, 46-57 (2007).
- Park, I. H., Arora, N., Huo, H., Maherali, N., Ahfeldt, T., Shimamura, A., Lensch, M. W., Cowan, C., Hochedlinger, K., Daley, G. Q. Disease-specific induced pluripotent stem cells. Cell. 134, 877-886 (2008).
- Kim, K. Y., Hysolli, E., Park, I. H. Neuronal maturation defect in induced pluripotent stem cells from patients with Rett syndrome. Proceedings of the National Academy of Sciences of the United States of America. 108, 14169-14174 (2011).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon