このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
GFPをレトロウイルスベクターを用いた誘導多能性幹細胞(性IPSC)にヒト体細胞を再プログラミングする
要約
OCT4、SOX2、KLF4とMYCのレトロウイルス媒介性異所性発現を介してヒトの人工多能性幹細胞(性IPSC)を生成する方法が記載されている。 GFP発現に基づいて人間のIPSCコロニーを識別するための実用的な方法についても説明されています。
要約
ヒト胚性幹細胞(ヒトES細胞) のin vitro疾患モデルと再生医療1 のための多能性と非常に貴重な細胞の源である。それは以前にヒト体細胞は、4つの転写因子の異所性発現(Oct4の、レトロウイルスベクター、KLF4及び Myc)によって多能性を再プログラムすることができることを示して誘導多能性幹細胞(性IPSC)2-4になっています。ヒトES細胞と同様に、人間性IPSCは、多能性と自己細胞の潜在的な源である。ここでは、GFPを含有するレトロウイルスバックボーン4にクローン化された4初期化因子によるヒト線維芽細胞を再プログラムするためのプロトコルについて説明します。以下のプロトコルを使用して、我々は、ヒトESCを培養条件下で3〜4週間で人間性IPSCを生成します。人間のIPSCのコロニーが密接に形態の似ているヒトES細胞とレトロウイルスのジーンサイレンシングの結果、GFP蛍光の損失を表示します。蛍光microscoの下に機械的に隔離されたIPSCのコロニーPEは、ヒトES細胞と同様の方法で動作します。これらの細胞では、我々は、複数の多能性遺伝子と表面マーカーの発現を検出することができます。
プロトコル
1。初期化因子を発現するレトロウイルスによるプログラミング
- ヒト線維芽細胞は線維芽細胞の培地(10%ペン/連鎖球菌を含むDMEM中でFBS)で培養されています。
- 6ウェルプレートの1ウェルに感染する前に、一日は、プレート1×10 5、ヒト線維芽細胞。
- 死んだ細胞を除去し、新鮮な線維芽細胞の培地2mlを追加するには、培地を吸引除去する。 5μg/ mlの最終濃度で硫酸プロタミンを追加します。
- 慎重に感染多重度(MOI)5に対応する各GFP発現ウイルスの適切な量を追加します。
- 感染後一日、ウイルス上清を除去し、2 mlの線維芽細胞の培地を追加し、2 mlのPBSで3回洗浄する。
- 感染3日後、GFPの蛍光を確認し、2 mlの線維芽細胞培地でウェルを補充する。
- 四日間の上に線維芽細胞培地中で照射したマウス胚性線維芽細胞(MEF)フィーダー細胞の感染は、プレート1×10 4 / cm 2とした後0.1%ゼラチンでコーティングされた10cmのペトリ皿。 37℃で一晩インキュベートします。
- 五日、感染後、1ミリリットル0.05パーセントtypsin / EDTA、5分間37℃、および200 gで5分間遠心分離に感染したヒト線維芽細胞を切り離します。培地を吸引除去し、線維芽細胞の培地10mlので細胞を再懸濁します。プレコート10cmのプレートに細胞を移す。
- 24時間後、hESCの培地(20%ノックアウト血清代替物、DMEM/F12、0.1ミリリットル非必須アミノ酸、4 ng / mlのbFGFを、ペン/球菌/グルタミン酸、β-merceptoethanol)で培地を交換してください。毎日の培地を変更します。 ESCのようなコロニーは感染後20から27日で表示を開始します。
2。 iPSCsの分離と拡張
- 蛍光顕微鏡下で、ヒトES細胞に似た形態を示しています。植民地におけるGFP蛍光の有無を確認してください。
- 10μlのピペットを用いて、個々のIPSCのコロニーをピックアップし、ゼラチンおよびMEF-CoAの1つのウェルに配置しますテッド12ウェルプレートとhESCの培地を添加した。毎日の培地を変更します。
- 継代については、DMEM/F12 1mlでプレートを洗浄し、コラゲナーゼの0.5ミリリットルを追加し、37℃で10分間インキュベート℃、
- DMEM/F12で細胞を2回洗浄します。
- 新鮮なhESCの培地2mlを追加します。セルリフターを使用して、小さな部分にコロニーを破壊し、プレートから残りの細胞を切り離します。
- ゼラチンとMEF-コーティングされた6ウェルプレートの1ウェルにコロニーの再懸濁の部分を転送します。
3。多能性マーカーの免疫蛍光分析
- PBSで細胞を3回洗浄し、室温で20分間、4%パラホルムアルデヒドで固定します。
- 静かにPBSで細胞を3回洗浄し、30分間PBSでトリトンX-100 0.2%透過性。
- 2時間のPBSで3%BSAで細胞をインキュベートすることにより、非特異的結合をブロックします。
- 4℃で一晩一次抗体で細胞をインキュベートします。
- PBSで細胞を3回洗浄し、光から遮蔽し、室温で1時間の特定の二次抗体で細胞をインキュベートします。
- 室温で5分間インキュベートし、続いて最後の洗浄時にPBSおよびアドオンDAPIで細胞を3回洗浄します。
- 蛍光顕微鏡による染色を検出します。
4。多能性マーカーの定量的リアルタイムPCRアッセイ
- キアゲン社のRNeasyキットを用いて、ヒト線維芽細胞由来のヒト性IPSCからトータルRNAを分離します。
- Superscript II逆転写酵素を用いた第一鎖cDNAを合成する。
- 以前に報告されたプライマーを用いて、多能性の遺伝子を検出するために定量PCRを実行します。6
5。代表的な結果
- プログラミング時の形態変化
我々は、OCT4、SOX2、KLF4およびMYCを運ぶレトロウイルスのカクテルで、ヒト線維芽細胞BJ1とデトロイト551感染と( 図1)プログラミング時の形態学的変化を検出することができました。二十一日、感染後、我々は彼らのhESCのような形態で小さなIPSCコロニーを認識しています。さらに、我々はGFPの蛍光により性IPSCを認識しています。そのようなESCと性IPSCとして多能性幹細胞、プロウイルス遺伝子発現7-9を抑制する分子機構を表現しています。当社独自のレトロウイルスベクターは、レトロウイルスLTRで遺伝子を再プログラミングと一緒にGFPを表現しています。したがって、継続的にGFPを発現する細胞は、プロウイルス遺伝子サイレンシングすることなく導入遺伝子を発現するように考えられている。多能性分子ネットワークを取得忠実に再プログラムIPSCコロニーはGFP発現( 図2)10の不在を示しています。 - 人間のiPSCsの多能性のキャラクタリゼーション
我々は、TRA-1-81、TRA-1-60、SSEA-4、SSEA-3、OCT4とNANOG抗体を用いた免疫組織化学を経由してデトロイト-551線維芽細胞由来コロニーを分析した( 表2)。首尾よく再プログラム性IPSCは、これらのマーカー( 図3A)のすべてを表現しています。また、定量的RT-PCR分析を介して遺伝子発現を解析した。我々は、OCT4、SOX2、KLF4、MYCとNANOGの発現が有意に親の線維芽細胞と比較しますが、H9ヒトES細胞( 図3B)のそれに見合った増加したことを観察した。
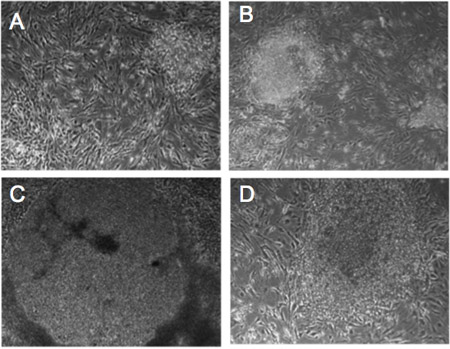
図1。レトロウイルスに感染したヒト線維芽細胞の形態変化(AD)初期化因子に感染したデトロイト-551線維芽細胞からのコロニーでプログレッシブ形態変化。 5日目()、10日目(B)、14日目(C)、21日(D)。細胞は21日後hESCのような形態を示しています。
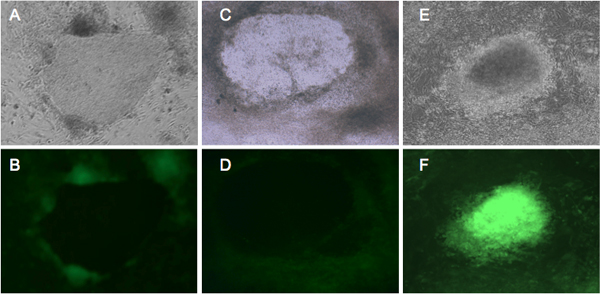
図2。リプログラミングを受けている細胞の代表的GFP蛍光発現。 BJとデトロイト551線維芽細胞は、4つの初期化因子4を発現するレトロウイルスに感染し、4週間hESCの培地中でインキュベートした。 BJ繊維芽細胞(A、B)とデトロイト551(C、D)は、形態学的類似の表示されます。 21日から、GFP陰性のコロニーは10善意性IPSCを表現する、形成するために開始します。 (E、F)適切なリプログラミングを受けていないデトロイト551細胞の形質転換を示しています。位相コントラストビューの下に(A、C、E)のコロニー。 (B、D)が正しくGFPサイレンシングを示す細胞を再プログラム。形質転換コロニーから(F)明るいGFP発現。
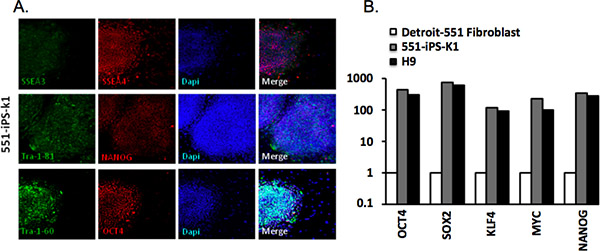
図3。人間の人工多能性幹細胞のキャラクタリゼーション。(a)ヒト551-IPS-K1細胞のコロニーは、多能性細胞に共通のマーカーを発現する。 DAPI染色は、フィールドごとの合計のセルの内容を示しています。 OCT4、SOX2の発現のために(B)定量リアルタイムPCR(RT-QPCR)、KLF4、MYC親のfのibroblast、551-IPS-K1の性IPSC、およびH9ヒト胚性幹細胞(ヒトES細胞)。データは、β-アクチンのハウスキーピング遺伝子に対して正規化し、4親の線維芽細胞での発現レベルを基準にプロットした。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
性IPSCの4つの転写因子の発現は、ヒト線維芽細胞を再プログラムします。多くの試みが臨床的に安全性IPSCを生成するために、非積分または非遺伝的アプローチを用いてヒトの性IPSCを生成するために行われました。これまでのところ、これらのメソッドは非常に低い効率を示し、再現性11月14日を向上させるためにさらに最適化する必要があります。レトロまたはレンチウイルスの方法...
Access restricted. Please log in or start a trial to view this content.
開示事項
私たちは、開示することは何もありません。
謝辞
この作品は、チャールズ·フッド財団からの医学、母子保健研究賞のイェール大学によって資金を供給された。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 11330057 | 80% |
| Knockout Serum Replacer | Invitrogen | 10828-028 | 20% |
| L-Glutamine (200 mM) | Invitrogen | 25030081 | 2 mM |
| Nonessential Amino Acids (10 mM) | Invitrogen | 11140050 | 0.1 mM |
| β-Mercapt–thanol (14.3 M) or MTG | Invitrogen | M-6250 | 0.1 mM |
| bFGF-2 10 μg/ml | GIBCO, by Life Technologies | GF003AF | 4 ng/ml |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| DMEM | Invitrogen | 11965118 | 90% |
| FBS | Invitrogen | 10407028 | 10% |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| Table 1. Culture Medium | |||
| OCT4 | Abcam | Ab19857 | 1:500 |
| SSEA3 | EMD Millipore | MAB4303 | 1:100 |
| SSEA4 | BD Biosciences | BD560218 | 1:100 |
| Tra-1-81 | BD Biosciences | BD560173 | 1:100 |
| Tra-1-60 | BD Biosciences | BD560174 | 1:100 |
| NANOG | Abcam | Ab21624 | 1:500 |
| Alexa-Flur 488 | Invitrogen | A11008 | 1:1000 |
| Alexa-Flur 555 | Invitrogen | A21422 | 1:1000 |
| DAPI | Invitrogen | D1306 | 1:5000 |
| pMIG-OCT4 | Addgene | 17225 | |
| pMIG-SOX2 | Addgene | 17226 | |
| pMIG-KLF4 | Addgene | 17227 | |
| pMIG-MYC | Addgene | 18119 | |
| Collagenase type IV | Invitrogen | 17104019 | 1mg/ml |
| Gelatin, Porcine | Sigma-Aldrich | G 1890 | 0.1% |
| Triton | Sigma-Aldrich | X100-500ML | 0.2% |
| Paraformaldehyde | Sigma-Aldrich | 47608 | 4% |
| BSA | American Bioanalytical | AB01800 | 3% |
| MEF feeder cells | EMD Millipore | PMEF-N | |
| Cell Lifter | Corning | 3008 | |
| Fluorescent microscopy: inverted microscope with GFP filter | |||
| Table 2. Reagents and equipment | |||
参考文献
- Murry, C. E., Keller, G. Differentiation of embryonic stem cells to clinically relevant populations: lessons from embryonic development. Cell. 132, 661-680 (2008).
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Yu, J., Vodyanik, M. A., Smuga-Otto, K., Antosiewicz-Bourget, J., Frane, J. L., Tian, S., Nie, J., Jonsdottir, G. A., Ruotti, V., Stewart, R. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Park, I. H., Lerou, P. H., Zhao, R., Huo, H., Daley, G. Q. Generation of human-induced pluripotent stem cells. Nature Protocols. 3, 1180-1186 (2008).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Hotta, A., Ellis, J. Retroviral vector silencing during iPS cell induction: an epigenetic beacon that signals distinct pluripotent states. Journal of Cellular Biochemistry. 105, 940-948 (2008).
- Matsui, T., Leung, D., Miyashita, H., Maksakova, I. A., Miyachi, H., Kimura, H., Tachibana, M., Lorincz, M. C., Shinkai, Y. Proviral silencing in embryonic stem cells requires the histone methyltransferase ESET. Nature. 464, 927-931 (2010).
- Wolf, D., Goff, S. P. Embryonic stem cells use ZFP809 to silence retroviral DNAs. Nature. 458, 1201-1204 (2009).
- Chan, E. M., Ratanasirintrawoot, S., Park, I. H., Manos, P. D., Loh, Y. H., Huo, H., Miller, J. D., Hartung, O., Rho, J., Ince, T. A. Live cell imaging distinguishes bona fide human iPS cells from partially reprogrammed cells. Nat. Biotechnol. 27, 1033-1037 (2009).
- Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin,, Thomson, J. A. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Kim, D., Kim, C. H., Moon, J. I., Chung, Y. G., Chang, M. Y., Han, B. S., Ko, S., Yang, E., Cha, K. Y., Lanza, R. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Warren, L., Manos, P. D., Ahfeldt, T., Loh, Y. H., Li, H., Lau, F., Ebina, W., Mandal, P. K., Smith, Z. D., Meissner, A. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Ban, H., Nishishita, N., Fusaki, N., Tabata, T., Saeki, K., Shikamura, M., Takada, N., Inoue, M., Hasegawa, M., Kawamata, S. Efficient generation of transgene-free human induced pluripotent stem cells (iPSCs) by temperature-sensitive Sendai virus vectors. Proceedings of the National Academy of Sciences of the United States of America. 108, 14234-14239 (2011).
- Wolf, D., Goff, S. P. TRIM28 mediates primer binding site-targeted silencing of murine leukemia virus in embryonic cells. Cell. 131, 46-57 (2007).
- Park, I. H., Arora, N., Huo, H., Maherali, N., Ahfeldt, T., Shimamura, A., Lensch, M. W., Cowan, C., Hochedlinger, K., Daley, G. Q. Disease-specific induced pluripotent stem cells. Cell. 134, 877-886 (2008).
- Kim, K. Y., Hysolli, E., Park, I. H. Neuronal maturation defect in induced pluripotent stem cells from patients with Rett syndrome. Proceedings of the National Academy of Sciences of the United States of America. 108, 14169-14174 (2011).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved