É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Reprogramação de células somáticas humanas em células tronco pluripotentes induzidas (iPSCs) usando vetor retroviral com GFP
Neste Artigo
Resumo
Um método para gerar células tronco pluripotentes induzidas (iPSCs) através de expressão retrovírus mediada ectópica de Oct4, SOX2, KLF4 e MYC é descrito. Uma maneira prática de identificar humanos colônias de IPSC com base na expressão de GFP também é discutida.
Resumo
Células estaminais embrionárias humanas (hESCs) são pluripotentes e uma fonte de valor inestimável para celulares in vitro de modelagem de doenças e medicina regenerativa 1. Já foi demonstrado que as células somáticas humanas pode ser reprogramado para pluripotência pela expressão ectópica dos quatro fatores de transcrição (Oct4, Sox2, KLF4 e Myc) e tornar-se células-tronco pluripotentes induzidas (iPSCs) 2-4. Como hESCs, iPSCs humanas são pluripotentes e uma fonte potencial de células autólogas. Aqui nós descrevemos o protocolo de reprogramar células de fibroblastos humanos, com os quatro fatores de reprogramação clonados em GFP contendo backbone retroviral 4. Usando o protocolo seguinte, geramos iPSCs humanos em 3-4 semanas sob condições de cultura humana ESC. Colónias humanos IPSC se assemelham hESCs na morfologia e exibir a perda de fluorescência da GFP como um resultado de silenciamento do transgene retroviral. IPSC colônias isoladas mecanicamente sob microscopia de fluorescênciaep comportar-se de uma maneira semelhante à hESCs. Nestas células, nós detectar a expressão de vários genes pluripotência e marcadores de superfície.
Protocolo
1. Reprogramação por retrovírus Expressando Fatores Reprogramação
- Fibroblastos humanos são cultivados em meio de fibroblastos (10% de FBS em meio DMEM com Pen / Strep).
- Um dia antes da infecção, placa de 1x10 5 fibroblastos humanos em um poço de uma placa de 6 poços.
- Aspirar meio para remover células mortas e adicionar 2 ml de meio de fibroblastos fresco. Adicionar sulfato de protamina, na concentração final de 5 ug / ml.
- Adicionar cuidadosamente a quantidade apropriada de cada vírus GFP-expressando o que corresponde a uma multiplicidade de infecção (MOI) 5 5.
- Um dia após a infecção, remover o sobrenadante viral, lavar três vezes com 2 ml de PBS, em seguida, adicionar 2 ml médio de fibroblastos.
- Três dias após a infecção, verifique a fluorescência da GFP e repor o bem com 2 ml meio de fibroblastos.
- Quatro dias após a infecção, placa de 1x10 cm 4/2, de fibroblasto do rato irradiado embrionário (MEFs) células de alimentação, em meio de fibroblastos para um10-cm placa de Petri revestidas com 0,1% de gelatina. Incubar a 37 ° C durante a noite.
- Cinco dias após a infecção, separar fibroblastos humanos infectados com 1 ml de 0,05% typsin / EDTA durante 5 minutos a 37 ° C, e centrifuga-se durante 5 minutos a 200 g. Aspirar o meio e ressuspender as células com 10 ml de meio de fibroblastos. Transferir as células em uma placa pré-revestida 10-cm.
- Após 24 horas, substituir o meio com meio de cultura hESC (20% de substituição knock-out soro, DMEM/F12, 0,1 ml Non-aminoácidos essenciais, 4 ng / ml de bFGF, Pen / Strep / glutamato, beta merceptoethanol-). Alterar a média diária. ESC-colônias, como vão começar a aparecer durante o dia 20-27 após a infecção.
2. Isolamento e Expansão das iPSCs
- Sob um microscópio de fluorescência, para verificar a ausência de GFP fluorescência em uma colónia que mostra uma morfologia semelhante à hESCs.
- Usando uma pipeta de 10 ul, escolha colônias individuais da IPSC e colocá-los em um poço de uma gelatina e MEF-coated placa 12 poços e suplementado com meio de hESC. Alterar média diária.
- Para passaging, lavar a placa com 1 ml de DMEM/F12, em seguida, adicionar 0,5 ml de colagenase, e incubar durante 10 minutos a 37 ° C.
- Lave as células duas vezes com DMEM/F12.
- Adicionar 2 ml de meio fresco hESC. Usando um levantador célula, romper as colónias em pedaços pequenos e separar células restantes a partir da placa.
- Transfira os pedaços de colónias ressuspensos em um poço de uma gelatina, e MEF-revestido placa de 6 poços.
3. Análise de marcadores de imunofluorescência pluripotentes
- Lave as células três vezes com PBS e fixar com paraformaldeído a 4% durante 20 min à temperatura ambiente.
- Suavemente lavar as células três vezes com PBS e permeabilizar com 0,2% de Triton X-100 em PBS durante 30 min.
- Bloquear a ligação não específica através da incubação de células com BSA a 3% em PBS durante duas horas.
- Incubar as células com anticorpo primário durante a noite a 4 ° C.
- Lave as células três vezes com PBS e incubar as células com anticorpo secundário específico para uma hora à temperatura ambiente, protegendo da luz.
- Lave as células três vezes com PBS e DAPI extra durante a última lavagem, seguido por incubação à temperatura ambiente durante 5 minutos.
- Detectar a coloração com um microscópio de fluorescência.
4. Quantitativo em tempo real PCR para os marcadores pluripotentes
- Isolar o RNA total a partir dos derivados de humanos iPSCs fibroblastos humanos usando o kit Qiagen RNeasy do.
- Sintetizar o cDNA fita-primeiro usando SuperScript Transcriptase Reversa II.
- Execute qPCR para detectar genes de pluripotência usando primers previamente relatados. 6
5. Os resultados representativos
- Mudança morfológica durante a reprogramação
Nós fibroblastos humanos infectados BJ1 e Detroit 551 com um coquetel de retrovírus que transportam Oct4, Sox2, KLF4 e MYC,e foram capazes de detectar alterações morfológicas durante reprogramação (Figura 1). Vinte e um dias após a infecção, reconhecemos pequenas colónias IPSC pela sua morfologia hESC-like. Além disso, reconhecemos iPSCs pela fluorescência da GFP. As células estaminais pluripotentes, tais como CES e iPSCs, expressam a maquinaria molecular para reprimir a expressão do gene proviral 7-9. O nosso vector retroviral única expressa GFP em conjunto com genes de reprogramação por LTR retroviral. Assim, as células que expressam GFP continuamente são considerados expressar transgenes sem silenciamento do gene proviral. Fielmente reprogramadas colónias IPSC que adquirem a rede pluripotência molecular mostram a ausência de expressão da GFP (Figura 2) 10. - Caracterização da pluripotência das iPSCs humanos
Analisou-se as colónias derivadas de Detroit-551 fibroblastos através imuno-histoquímica com Tra-1-81, Tra-1-60, SSEA-4, SSEA-3, Oct4 e anticorpos NANOG ( Tabela 2). IPSCs com sucesso reprogramadas expressar todos estes marcadores (Figura 3A). Foram também analisadas a expressão do gene através de análise quantitativa de RT-PCR. Observou-se que a expressão de Oct4, SOX2, KLF4, myc e NANOG foi significativamente aumentada em comparação com as células de fibroblasto parental mas em proporção com a de H9 hESCs (Figura 3B).
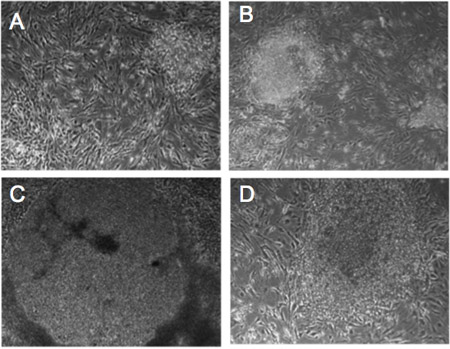
Figura 1. As alterações morfológicas de retrovírus infectados fibroblastos humanos. (AD) mudança morfológica Progressive em colônias de Detroit-551 fibroblastos infectados com fatores de reprogramação. Dia 5 (A), Dia 10 (B), Dia 14 (C), dia 21 (D). As células mostram a morfologia hESC-like após 21 dias.
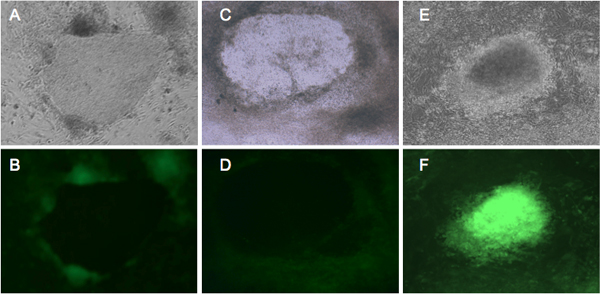
Figura 2. Representante expressão da GFP fluorescente em células submetidas a reprogramação. BJ e Detroit 551 fibroblastos foram infectadas com retrovírus expressando quatro factores de reprogramação 4, e incubadas em meio hESC durante quatro semanas. Fibroblastos BJ (A, B) e Detroit 551 (C, D) mostram semelhante morfológica. A partir do dia 21 de colônias GFP negativos começam a se formar, que representam as iPSCs de boa-fé 10. (E, F) mostram transformada Detroit 551 células que não tenham sido submetidos a reprogramação adequada. (A, C, E) colónias sob visão de contraste de fase. (B, D) adequadamente reprogramado células que mostram o silenciamento GFP. (F) expressão GFP brilhante de colônia transformada.
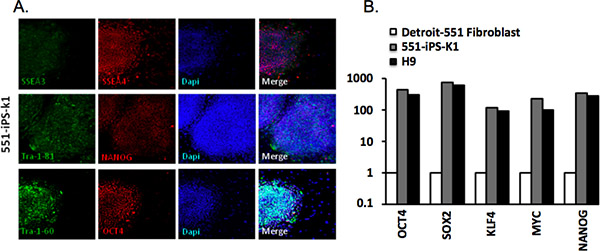
Figura 3. Caracterização das células estaminais pluripotentes induzidas. (A) colónias Humanos 551-IPS-K1 de células expressam marcadores comuns para as células pluripotentes. Coloração DAPI indica o teor total de células por campo. (B) quantitativa em tempo real-PCR (RT-qPCR) para a expressão de Oct4, SOX2, KLF4, myc em f parentalibroblast e 551-iPS-K1 iPSCs e H9 células estaminais embrionárias humanas (hESCs). Os dados foram normalizados contra β-actina gene de limpeza e traçada em relação ao nível de expressão nas células de fibroblasto parental 4.
Access restricted. Please log in or start a trial to view this content.
Discussão
Expressão de quatro fatores de transcrição reprograma fibroblastos humanos para iPSCs. Muitas tentativas foram feitas para gerar iPSCs humanos utilizando abordagens não integradoras ou não-genética para gerar iPSCs clinicamente seguros. Até agora, esses métodos mostram eficiência extremamente baixa e exigem otimização para melhorar a reprodutibilidade 11-14. Métodos de retro-ou lentiviral são prontamente utilizados para obter e aplicar iPSCs para o homem em modelos de doenças <...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Não temos nada a divulgar.
Agradecimentos
Este trabalho foi financiado pela Yale School of Medicine e Prêmio Criança Pesquisa em Saúde da Fundação Charles capa.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 11330057 | 80% |
| Knockout Serum Replacer | Invitrogen | 10828-028 | 20% |
| L-Glutamine (200 mM) | Invitrogen | 25030081 | 2 mM |
| Nonessential Amino Acids (10 mM) | Invitrogen | 11140050 | 0.1 mM |
| β-Mercapt–thanol (14.3 M) or MTG | Invitrogen | M-6250 | 0.1 mM |
| bFGF-2 10 μg/ml | GIBCO, by Life Technologies | GF003AF | 4 ng/ml |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| DMEM | Invitrogen | 11965118 | 90% |
| FBS | Invitrogen | 10407028 | 10% |
| Penicillin/Streptomycin | EMD Millipore | 15140-122 | 1% |
| Table 1. Culture Medium | |||
| OCT4 | Abcam | Ab19857 | 1:500 |
| SSEA3 | EMD Millipore | MAB4303 | 1:100 |
| SSEA4 | BD Biosciences | BD560218 | 1:100 |
| Tra-1-81 | BD Biosciences | BD560173 | 1:100 |
| Tra-1-60 | BD Biosciences | BD560174 | 1:100 |
| NANOG | Abcam | Ab21624 | 1:500 |
| Alexa-Flur 488 | Invitrogen | A11008 | 1:1000 |
| Alexa-Flur 555 | Invitrogen | A21422 | 1:1000 |
| DAPI | Invitrogen | D1306 | 1:5000 |
| pMIG-OCT4 | Addgene | 17225 | |
| pMIG-SOX2 | Addgene | 17226 | |
| pMIG-KLF4 | Addgene | 17227 | |
| pMIG-MYC | Addgene | 18119 | |
| Collagenase type IV | Invitrogen | 17104019 | 1mg/ml |
| Gelatin, Porcine | Sigma-Aldrich | G 1890 | 0.1% |
| Triton | Sigma-Aldrich | X100-500ML | 0.2% |
| Paraformaldehyde | Sigma-Aldrich | 47608 | 4% |
| BSA | American Bioanalytical | AB01800 | 3% |
| MEF feeder cells | EMD Millipore | PMEF-N | |
| Cell Lifter | Corning | 3008 | |
| Fluorescent microscopy: inverted microscope with GFP filter | |||
| Table 2. Reagents and equipment | |||
Referências
- Murry, C. E., Keller, G. Differentiation of embryonic stem cells to clinically relevant populations: lessons from embryonic development. Cell. 132, 661-680 (2008).
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Yu, J., Vodyanik, M. A., Smuga-Otto, K., Antosiewicz-Bourget, J., Frane, J. L., Tian, S., Nie, J., Jonsdottir, G. A., Ruotti, V., Stewart, R. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Park, I. H., Lerou, P. H., Zhao, R., Huo, H., Daley, G. Q. Generation of human-induced pluripotent stem cells. Nature Protocols. 3, 1180-1186 (2008).
- Park, I. H., Zhao, R., West, J. A., Yabuuchi, A., Huo, H., Ince, T. A., Lerou, P. H., Lensch, M. W., Daley, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Hotta, A., Ellis, J. Retroviral vector silencing during iPS cell induction: an epigenetic beacon that signals distinct pluripotent states. Journal of Cellular Biochemistry. 105, 940-948 (2008).
- Matsui, T., Leung, D., Miyashita, H., Maksakova, I. A., Miyachi, H., Kimura, H., Tachibana, M., Lorincz, M. C., Shinkai, Y. Proviral silencing in embryonic stem cells requires the histone methyltransferase ESET. Nature. 464, 927-931 (2010).
- Wolf, D., Goff, S. P. Embryonic stem cells use ZFP809 to silence retroviral DNAs. Nature. 458, 1201-1204 (2009).
- Chan, E. M., Ratanasirintrawoot, S., Park, I. H., Manos, P. D., Loh, Y. H., Huo, H., Miller, J. D., Hartung, O., Rho, J., Ince, T. A. Live cell imaging distinguishes bona fide human iPS cells from partially reprogrammed cells. Nat. Biotechnol. 27, 1033-1037 (2009).
- Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin,, Thomson, J. A. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Kim, D., Kim, C. H., Moon, J. I., Chung, Y. G., Chang, M. Y., Han, B. S., Ko, S., Yang, E., Cha, K. Y., Lanza, R. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Warren, L., Manos, P. D., Ahfeldt, T., Loh, Y. H., Li, H., Lau, F., Ebina, W., Mandal, P. K., Smith, Z. D., Meissner, A. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Ban, H., Nishishita, N., Fusaki, N., Tabata, T., Saeki, K., Shikamura, M., Takada, N., Inoue, M., Hasegawa, M., Kawamata, S. Efficient generation of transgene-free human induced pluripotent stem cells (iPSCs) by temperature-sensitive Sendai virus vectors. Proceedings of the National Academy of Sciences of the United States of America. 108, 14234-14239 (2011).
- Wolf, D., Goff, S. P. TRIM28 mediates primer binding site-targeted silencing of murine leukemia virus in embryonic cells. Cell. 131, 46-57 (2007).
- Park, I. H., Arora, N., Huo, H., Maherali, N., Ahfeldt, T., Shimamura, A., Lensch, M. W., Cowan, C., Hochedlinger, K., Daley, G. Q. Disease-specific induced pluripotent stem cells. Cell. 134, 877-886 (2008).
- Kim, K. Y., Hysolli, E., Park, I. H. Neuronal maturation defect in induced pluripotent stem cells from patients with Rett syndrome. Proceedings of the National Academy of Sciences of the United States of America. 108, 14169-14174 (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados