A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
في Electroporation المختبر من شفة السفلى المعينية من أجنة الفئران Midgestation
In This Article
Summary
هذه الدراسة توضح وضع في المختبر تقنية electroporation التي تسمح للتلاعب في التعبير الجيني في الشفة السفلى معيني الشكل من الأجنة midgestation.
Abstract
الشفة المعينية هو الظهارة العصبية الجنينية الموجودة في الدماغ المؤخر على مفترق الطرق بين الأنبوب العصبي وroofplate من البطين الرابع (استعرضت في 1). ويمكن تقسيم الشفة المعينية إلى الشفة العليا والمعينية (URL) الذي يضم قسيم معيني 1 (R1) وتولد الخلايا العصبية في المخيخ، والشفة السفلى المعينية (LRL) والذي يؤدي إلى تنوع السلالات الدماغ العصبية 2-4. وتشمل المشتقات LRL الخلايا العصبية السمعية من نوى القوقعة وتلك التابعة للنوى precerebellar التي تشارك في تنظيم التوازن والتحكم في المحركات 5-8. تكوين الخلايا العصبية من خلال LRL يحدث النافذة الزمنية الكبيرة التي تشمل أيام الجنينية (E) 9،5-16،5 5 و 9. الأنساب العصبية المختلفة على الخروج من LRL كخلايا تالية للتفتل (أو يولدون) خلال أيام تنموية متميزة خلال هذه النافذة العصبية.
ويمكن استخدام Electroporation من بنيات التعبير الجيني للالتلاعب في التعبير الجيني في LRL الأسلاف، ويمكن تغيير محتمل في مصير الخلايا العصبية التي تنتج من هذه المنطقة 10-12. وكان تغيير الجينات من الأسلاف LRL في الماوس عبر في الرحم electroporation ناجحة للغاية لمعالجة الأنساب ولدت في يوم الجنينية E12.5 أو 10 في وقت لاحق، 12-14. في electroporations الرحم قبل E12.5 لم تكلل بالنجاح في المقام الأول نظرا ل الفتك المرتبطة ثقب roofplate البطين الرابع، خطوة ضرورية في تقديم الحمض النووي الخارجية التي يتم electroporated في LRL. ومع ذلك، فإن العديد LRL الأنساب المستمدة تنشأ من LRL في وقت سابق من E12.5 9. هذه النسب في وقت سابق من مواليد تشمل الخلايا العصبية التي تشكل شبكي الوحشي، الإسفينية الخارجية، ونوى الزيتونية السفلية للنظام precerebellar التي تعمل على ربط مدخلات من النخاع الشوكي والقشرة في المخيخ 5. من أجل التعامل مع التعبير في LRLمن الأجنة الذين تقل أعمارهم عن E12.5، قمنا بتطوير نظام 1 في المختبر في الأجنة التي يتم وضعها في الثقافة بعد electroporation.
تقدم هذه الدراسة وسيلة فعالة وفعالة من أجل التلاعب في الجينات من الأسلاف LRL في E11.5. الأجنة electroporated مع بروتين الفلورية الخضراء (GFP) طردوا من المروج CAG نشط على نطاق واسع وأعرب بتكاثر GFP بعد 24 ساعة من ثقافة. وهناك جانب حاسم من هذا الفحص هو أن يتم تبديل فقط التعبير الجيني بسبب التعبير عن الجينات خارجية وليس بسبب الآثار الثانوية التي تنتج عن electroporation وتقنيات زراعة. وقد تقرر أن أنماط التعبير الجيني الذاتية لا تزال دون عائق في الأجنة electroporated والمثقفين. ويمكن استخدام هذا الاختبار لتغيير مصير الخلايا الناشئة من LRL الأجنة الذين تقل أعمارهم عن E12.5 من خلال إدخال البلازميدات لoverexpression أو هدم (من خلال رني) من مختلف الموالية للعوامل النسخ العصبية.
Protocol
1. وقبل Electroporation الاستعدادات
- تضخيم الحمض النووي لelectroporation من قبل الإعدادية ماكسي (رئيس الوزراء، وأو QIAGEN). وينبغي تركيز الحمض النووي أن يكون الحد الأدنى من 1 ملغ / مل لامتصاص كفاءة.
- إزالة 495 ميكرولتر من الحمض النووي والاختلاط مع 5 ميكرولتر من الأخضر بسرعة 0.01٪ في برنامج تلفزيوني X 1 (الفوسفات مخزنة المالحة) في أنبوب microcentrifuge.
2. الجنينية الحصاد
- إنشاء التزاوج توقيتها من الفئران CD-1 (هارلان). تحقق من وجود المقابس المهبلية واعتبار تاريخ ويلاحظ أحد المكونات المهبلية كما يوم الجنينية (E) 0.5. وسيتم حصاد الأجنة بعد 11 يوما من تصور قابس (E11.5).
- وضع أدوات معقمة في الايثانول 70٪. علاج غطاء تدفق رقائقي للأشعة فوق البنفسجية لمدة ساعة على الأقل قبل استخدامها. رذاذ غطاء محرك السيارة، وعلبة تشريح، وتشريح مجال الايثانول مع 70٪. قبل حرارة 1 X PBS إلى 37 درجة مئوية.
- في E11.5 الموت ببطء الأنثى وفقا لشروط التي وافق عليها معهدIONAL لجنة لرعاية واستخدام الحيوانات (ICCUA). وضع علبة تشريح في رقائقي تدفق غطاء محرك السيارة. رش أسفل البطن من الأنثى مع الايثانول 70٪.
- فتح التجويف البريتوني ويعلقون على الجدران لعلبة تشريح. سحب قرون الرحم بحيث تقع داخل التجويف البريتوني.
- قطع بعناية فتح جدار الرحم القرن. استخدام الملعقة 20 ملم (الأدوات العلمية الجميلة) لإزالة بلطف الجنين في الكيس المحي بعيدا عن المشيمة. الأجنة مكان في صحن 100 ملم زراعة الأنسجة مملوءة مسبقا مع 10 مل من معقم PBS X 1 التي تم مسخن في 2.2.
- كرر لجميع الأجنة الحالي.
3. Electroporation من الأجنة E11.5 (الشكل 1)
- باستخدام ملعقة 20 مم، ونقل الجنين أول من طبق جديد 100 ملم مملوءة مسبقا مع 10 مل من 1XPBS العقيمة التي تم مسخن الى 37 درجة مئوية.
- استخدام ملقط 11 سم مع طرف X 0.05 ملم 0.02 (الأدوات العلمية الجميلة) لإعادة بعنايةنقل والتخلص من الكيس المحي.
- جنين موقف بحيث جانبها ظهري يواجه ما يصل بحيث يشبه الرسوم المتحركة في الشكل 1A. استخدام 7 المجاذيف القطب ملم (هارفارد جهاز) لاجراء بلطف الجنين. وينبغي وضع الأقطاب الكهربائية في كل من جانبي الأنبوب العصبي على مستوى البطين الدماغ المؤخر الرابع. البطين مرئية للعين المجردة ولكن باستخدام مجهر تشريح دقيق يمكن أن تسهل وضع مجداف. المواقع من المجاذيف أمر بالغ الأهمية لتحديد المنطقة التي تتلقى الحمض النووي electroporated. إذا كانت هناك رغبة في الشفة السفلى المعينية (LRL) من الدماغ المؤخر والجنينية ظهري، ويجب أن يكون مكان هذه المجاذيف أنهم المحيطة مباشرة على أوسع نطاق جزء من افتتاح البطين الرابع.
- استخدم حقنة سم مكعب 1 لوضع البلازميد مختلطة مع الأخضر سريع 0.01٪. وينبغي أن 500 ميكرولتر من الخليط يكون كافيا لelectroporation ما لا يقل عن 8-10 الأجنة (انظر 3.5).
- ثقب بلطف OV roofplateerlying في البطين الرابع بإبرة السلين 25G 5/8 تعلق على حقنة سم مكعب (1) وحقن مزيج الحمض النووي صبغ إلى البطين. وتتميز حقن الناجحة التي قام بها هذا الخليط الحمض النووي صبغ ملء البطين نظام بأكمله (الشكل 1C). كمية الحمض النووي صبغ خليط حقن عادة أقل من 50 ميكرولتر. المبالغ الحقيقية هي متغيرة بين الأجنة وجزء من خليط يميل إلى يتسرب من البطين في برنامج تلفزيوني المحيطة الجنين. فإن وجود وسائل بديلة لتقديم مزيج الحمض النووي صبغ يكون من خلال الوصول إلى نظام البطين بواسطة ثقب الشراع التي تغمر المخ الأوسط. مرة أخرى، وتتميز حقن الناجحة التي قام بها هذا الخليط الحمض النووي صبغ ملء البطين نظام بأكمله.
- تسليم خمسة البقول مربع باستخدام مولد نبض كهربائي (BTX)، و 7 ملم المجاذيف الكهربائي. كل نبضة هو 50 V دائم 5 مللي في النبضة مع 500 مللي ثانية بين كل نبضة. سوف الأنسجة الأقرب إلى القطب موجبة ثم تاكه حتى البلازميد.
4. ثقافة الأجنة
- في غطاء محرك السيارة تدفق الصفحي، وملء الآبار الخارجي للصحن ثقافة 12-جيدا مع 2 مل من وسائل الاعلام DMEM/F12 تستكمل مع 10٪ مصل بقري جنيني، 5٪ فرسي المصل، الجلوتامين 1٪، 1٪ البنسلين / الستربتومايسين التي تم مسخن الى 37 درجة مئوية. تم تكييف الشروط ثقافة من دييغو دي والزملاء. 15
- في رقائقي الأجنة تدفق قرصة غطاء محرك السيارة في القسم الوسطي (أقل من القلب) مع ملقط وإزالة جزء الخلفي من الجنين. ضع الجزء الأمامي إلى واحدة من الآبار ملأت الطبق ثقافة 12-جيدا.
- كرر لجميع الأجنة. شغل فقط الآبار الخارجي للوحة 12-جيدا لتجنب التلوث من الثقافات.
- ثقافة الأجنة في الحاضنة 37 درجة مئوية مع 5٪ CO 2. وينبغي ملاحظتها تعبير عن البلازميد electroporated في غضون 24 ساعة.
- وينبغي أن يعد المطلوب مرات والثقافة، وملء الآبار للخروج من لوحة 12 جديدة جيدا مع 2 مل منوسائل الإعلام المستخدمة في 4.1. مع ملعقة تعقيم نقل الأجنة إلى بئر في لوحة جديدة. وضع مرة أخرى في الحاضنة 37 درجة مئوية. الثقافة لمدة تصل إلى 48 ساعة أمر ممكن.
- عند الوصول إلى الوقت المطلوب ثقافة، وتحديد الأجنة لأغراض التحليل (انظر أدناه).
5. إعداد الأجنة لتحليل
- شطف الأجنة في برنامج تلفزيوني X 1 في 4 درجة مئوية لمدة خمس دقائق. كرر.
- إصلاح الأجنة لأغراض التحليل في بارافورمالدهيد 2٪ (منهاج العمل) في 1XPBS لمدة 2 ساعة في درجة مئوية 4
- شطف الأجنة في برنامج تلفزيوني X 1 في 4 درجة مئوية لمدة خمس دقائق. كرر.
- تتوازن الأجنة في السكروز 30٪ في برنامج تلفزيوني X 1 بين عشية وضحاها في 4 درجات مئوية.
- تضمين الأجنة في مجمع الأمثل للقطع (أكتوبر) درجة الحرارة باستخدام الثلج الجاف / الإيثانول حمام. ويمكن تخزين الأجنة عند درجة حرارة -20 درجة مئوية.
- الأجنة قسم على ناظم البرد (لايكا) إلى 30 أقسام ميكرومتر وجبل على شرائح (VWR، Superfrost زائد). مخزن عند درجة حرارة -20 درجة مئوية.
6. Immunohistochemistry التحليل
- تم تنفيذ المناعية كما هو موضح في 16. التخفيفات الأجسام المضادة الأولية المستخدمة في هذه الدراسة تشمل أرنب α-GFP (إينفيتروجن) 1:2500؛ الماوس α-Mash1 دينار بحريني (العلوم البيولوجية) 1:100؛ أرنب α Ngn1-(جونسون جين) 1:5000؛ أرنب α Ptf1a-(جين جونسون ) 1:2500، أرنب، Math1 (جين جونسون) 1:100. احتضان شريحة شقة جانب عينة، ما على علبة التلوين عند 4 درجات مئوية خلال الليل.
- وقد تم تحليل الشرائح في المجهر المركب (أوليمبوس BX51).
7. ممثل النتائج
التخطيطي في الشكل 1A يصور تجربة electroporation. 1B ويبين الشكل وجهة نظر سهمي للجنين قبل E11.5 للتلاعب. ويظهر الجنين نفسه بعد حقن CAG والتي تحتوي على البلازميد :: GFP في الأخضر بسرعة 0.01٪ في الشكل 1C والجنين ممثل غير المثبتة واظهار GFP من جانب واحدويظهر التعبير في ثقافة الدماغ المؤخر ظهري مدار 24 ساعة التالية في 1D الشكل. مدى مساحة LRL التي يتم electroporated بنجاح هو متغير، ويبدو أن تعتمد بشكل كبير على المواقع من الأقطاب الكهربائية. في دراستنا تبين أن 52 من أصل 65 (80٪) من الأجنة electroporated أعرب بنجاح GFP. واعتبر أن الأنسجة electroporated بنجاح إذا كانت إيجابية للGFP في المناطق المحلية على عدة أقسام بعد تثبيت والتحليل المناعى (انظر أدناه). وسجل الأجنة التي فشلت في تحقيق هذه المعايير ومحاولات غير ناجحة في electroporation.
ويمكن مواصلة تقييم كفاءة electroporation التأكد قبل تنفيذ المناعية ضد GFP على المقاطع العرضية للأجنة electroporated على مستوى البطين الرابع. ويبين الشكل 2 أقسام المسلسل ممثل من جنين عرض من جانب واحدGFP التعبير. الشكل 2A يظهر التخطيطي، مثالي، ويوضح أن الجانب الأيسر من الجنين وكان نحو القطب الموجب. المقاطع العرضية (على مستويات ممثلة في الرسوم المتحركة منتصف الشكل 2A) تكشف المترجمة التعبير GFP حصرا على الجانب الأيسر من الدماغ المؤخر الأنسجة (أرقام 2C و 2D). لم المنطقة electroporated من LRL لا تمديد كامل الأمامي، الخلفي محور الأنبوب العصبي مثل فحص أجزاء 300 ميكرون منقاري أو أكبر إلى أن يظهر في 2C الشكل لا يعبر عن GFP (الشكل 2B).
فائدة هذا الفحص للتلاعب في التعبير الجيني يتوقف على الاستقرار في مجالات التعبير عن البروتينات الذاتية. اتسمت LRL كما تمتلك المجالات سلف فريدة من نوعها تتميز التعبير المتفاوت للعوامل النسخ proneural (مراجعة في 1).وقد تم اختيار مجموعة فرعية من هذه العوامل (Mash1، Math1، Ngn1، وPtf1a) للتحليل بسبب المقترحة و / أو أدوار تميزت في مواصفات فرعية العصبية precerebellar في LRL، موضوعا للدراسات المستقبلية 16-18. جميع البروتينات أربعة منها مجالات التعبير مميزة جدا في الدماغ المؤخر الذيلية في E11.5 16-18. لاحظنا أن الأجنة التي وضعت الثقافات فشلت في زيادة في حجم وأيضا فشلت في بدء الإنتاج من ظهارة الضفيرة المشيمية وانغلاف للأحداث، وLRL roofplate المورفولوجية التي تحدث بين E11.5 و 5 E12.5. بناء على هذه الملاحظات تقرر أن توقف التطور الطبيعي في هذه الأجنة أو تأخير على الإطلاق والتحكم مشابه للأجنة مثقف يجب أن تكون الأجنة غير مثقف في E11.5.
للتأكد من أن الثقافة وelectroporation لا تخل مستويات البروتينات الذاتية، قمنا بتحليل أربعة بروتينات مختلفة بواسطة immunohistochemistry (IHC) في 34 الأجنة المختلفة التي تم electroporated ومثقف ثم ما لا يقل عن 24 ساعة. ويبين الجدول الأول عدد الأجنة تحليلها من أجل كل علامة والنسبة المئوية للأجنة التي احتفظت تحليل مستويات بروتين طبيعي. ويبين الشكل 3 ممثل IHC البيانات من اثنين من البروتينات تحليلها، Mash1 (أرقام 3A و 3B) وMath1 (أرقام 3C و 3D). لاحظنا أن الغالبية العظمى من الأجنة الاحتفاظ المستويات العادية من electroporation التعبير التالي والثقافة (أرقام 3B و 3D) مقارنة الأجنة سيطرة على E11.5 (أرقام 3A و 3C). الأهم من ذلك، لم تكن المجالات التعبير سمة من هذه البروتينات قلق.
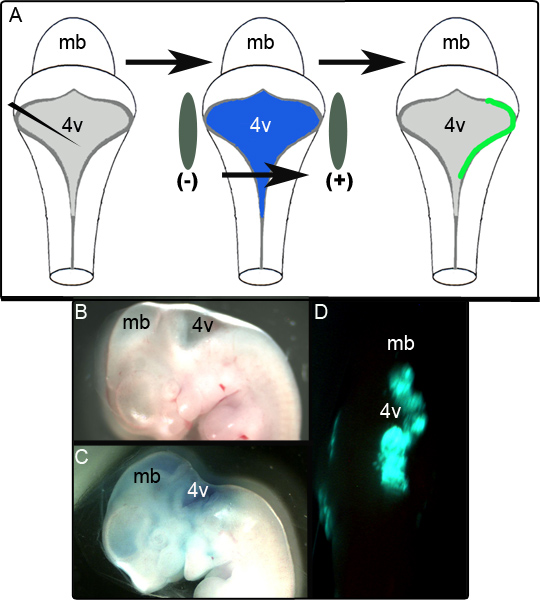
الشكل 1. Electroporation من أجنة في E11.5. (A) تخطيطي من اله electroporation التجربة. معزول الجنين E11.5 ويتم حقن التعبير البلازميد في الأخضر سريع 0.01٪ في البطين الرابع. ويحيط ثم الجنين بواسطة المجاذيف الكهربائي وتعرض لنبض V 50 قبل وضعه في الثقافة (ب) بالنظر سهمي للجنين E11.5 قبل الحقن. (ج) الجنين E11.5 نفسه بعد حقن من البلازميد في الأخضر سريع 0.01٪. (D): لاحظ التعبير من جانب واحد من الدماغ المؤخر GFP في جنين E11.5 بعد 24 ساعة من ثقافة. MB-الدماغ المتوسط؛ 4V الرابعة والبطين.
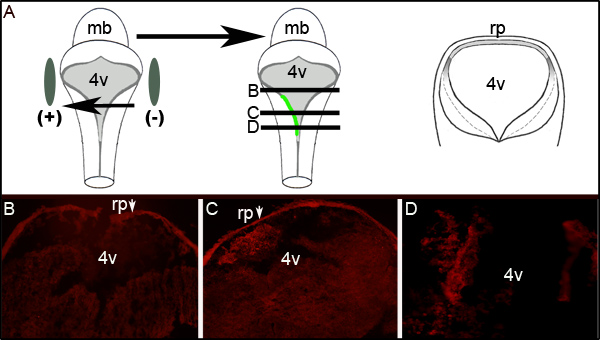
الشكل 2. التعبير عن GFP في الأنسجة Electroporated. (A) ورسوم متحركة على اليسار يصور وضع أقطاب كهربائية حول الجنين E11.5. رسوم متحركة وسط يصور امتصاص والتعبير عن GFP ترميز البلازميد على الجانب الأيسر من الجنين. رسوم متحركة على الحق هو تخطيطي من القسم 1 عرضية مثالية من خلال اتخاذ الجنين في لترتدل evels بواسطة خطوط سوداء في وسط الكرتون. (B-D) المناعية لGFP على المقاطع العرضية من خلال الجنين E11.5 electroporated بعد 24 ساعة من ثقافة. تبين الأسهم (حزب الرفاه) roofplate التي الفخاخ الجسم المضاد الثانوي. تؤخذ الصور في التكبير 10x. وصفت المستويات النسبية للقطاعات التي أبداها خطوط أفقية من خلال الرسوم المتحركة في منتصف (A). MB-الدماغ المتوسط؛ ل 4V الرابعة والبطين، RP-roofplate.
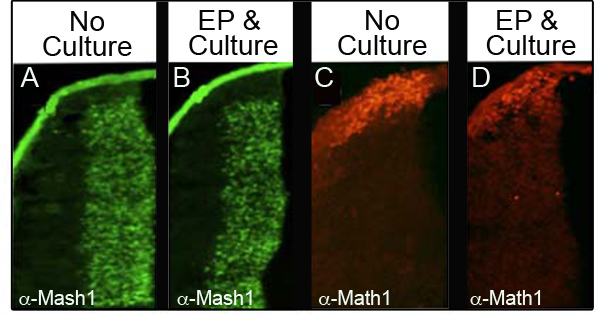
الشكل 3. التعبير عن البروتينات الذاتية في الشفة السفلى المعينية المناعية لMash1 (A و B) أو Math1 (C و D) مقارنة المقاطع العرضية للأجنة E11.5 التي لم تكن مثقف (A، C) مع الأجنة التي تم electroporated مع CAG.: : GFP ومثقف لمدة 24 ساعة (B و D). الصور التي التقطت في التكبير 10x.
| Proneural Transcriptiعلى عامل حلل | حلل عدد الأجنة | نسبة الاحتفاظ أنماط التعبير عادي |
| Math1 | 15 | 86.7٪ |
| Mash1 | 12 | 83.3٪ |
| Ngn1 | 7 | 71.4٪ |
| Ptf1a | 6 | 100٪ |
أولا جدول النسبة المئوية للأجنة Electroporated ومثقف الاحتفاظ عادي عامل النسخ Proneural المجالات في LRL.
Discussion
وفي تقنية electroporation المختبر التي قدمت في هذه الدراسة هو منهج الرواية التي يمكن استخدامها بكفاءة لمعالجة الجينات في الأجنة الذين تقل أعمارهم عن 12 يوما من الحمل. وضع الأجنة في الثقافة يسمح التعبير عن الجينات المدخلة وتلتف على الفتك لاحظ عندما يسمح لأجنة electropora...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
فإن الكتاب أود أن أشكر جين جونسون لNgn1، Math1، والأجسام المضادة Ptf1a وكوني Cepko لpCAG :: GFP البلازميد. وقد تم تمويل هذا العمل من قبل المعاهد الوطنية للصحة 1R15HD059922 R15-01.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليق (اختياري) |
| ناظم البرد | لايكا | CM-1850 | |
| تعامل البيولوجيا طرف Dumoxel دومون ملقط | العلمي أدوات غرامة | 11252-30 | |
| 20 ملعقة موريا ملم مثقوبة | العلمي أدوات غرامة | 10370-17 | |
| ECM موجة مربع 830 Electroporation مولد | BTX (VWR) | 47745-928 | |
| هارفارد جهاز Tweezertrodes 7 ملم * الأقطاب الكهربائية | BTX (فيشر) | BTX450165 | |
| فيشر Isotemp CO 2 حاضنة | الصياد | 1325525 | |
| نابكو ثاني منظم غاز 2 | الصياد | 15497020 | |
| 12 زراعة الأنسجة حسنا لوحات | دينار بحريني الصقر (فيشر) | 877229 | |
| HyClone سائل الإعلام DMEM/F-12 (1:1)، مع الجلوتامين-L وHEPES؛ 500mL | الحرارية العلمية (فيشر) | SH3002301 | |
| HyClone * المانحة فرسي المصل | الحرارية العلمية (فيشر) | SH3007402 | |
| الأبقار مصل الجنين، ومؤهل، الحرارة المعطل | إينفيتروجن | 16140-063 | |
| cellgro * 10،000 وحدة دولية البنسلين، 10000 ميكروغرام / مل الستربتوميسين | Mediatech (فيشر) | MT-30-002-CI | |
| HyClone * L-L-الجلوتامين الجلوتامين، و 200mM في كلوريد الصوديوم 0.85٪ | الحرارية العلمية (فيشر) | SH3003401 | |
| سريع والخضر | الصياد | AC41053-0250 | 0.01٪ |
References
- Ray, R. S., Dymecki, S. M. Rautenlippe Redux -- toward a unified view of the precerebellar rhombic lip. Current opinion in cell biology. 21, 741-747 (2009).
- Machold, R., Fishell, G. Math1 is expressed in temporally discrete pools of cerebellar rhombic-lip neural progenitors. Neuron. 48, 17-24 (2005).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Wingate, R. J., Hatten, M. E. The role of the rhombic lip in avian cerebellum development. Development (Cambridge, England). 126, 4395-4404 (1999).
- Altman, J., Bayer, S. A. . Development of Cerebellar System: In relation to its evolution, structure, and function. , (1997).
- Farago, A. F., Awatramani, R. B., Dymecki, S. M. Assembly of the brainstem cochlear nuclear complex is revealed by intersectional and subtractive genetic fate maps. Neuron. 50, 205-218 (2006).
- Wang, V. Y., Rose, M. F., Zoghbi, H. Y. Math1 expression redefines the rhombic lip derivatives and reveals novel lineages within the brainstem and cerebellum. Neuron. 48, 31-43 (2005).
- Rodriguez, C. I., Dymecki, S. M. Origin of the precerebellar system. Neuron. 27, 475-486 (2000).
- Taber-Pierce, E. Histogenesis of the nuclei griseum ponitis, corporis pontobulbaris and reticularis tegmenti pontis (bechterew) in mouse. J. Comp. Neurol. 126, 219-240 (1966).
- Dipietrantonio, H. J., Dymecki, S. M. Zic1 levels regulate mossy fiber neuron position and axon laterality choice in the ventral brain stem. Neuroscience. 162, 560-573 (2009).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155-162 (2002).
- Taniguchi, H., Kawauchi, D., Nishida, K., Murakami, F. Classic cadherins regulate tangential migration of precerebellar neurons in the caudal hindbrain. Development (Cambridge, England). 133, 1923-1931 (2006).
- Kawauchi, D., Taniguchi, H., Watanabe, H., Saito, T., Murakami, F. Direct visualization of nucleogenesis by precerebellar neurons: involvement of ventricle-directed, radial fibre-associated migration. Development (Cambridge, England). 133, 1113-1123 (2006).
- Okada, T., Keino-Masu, K., Masu, M. Migration and nucleogenesis of mouse precerebellar neurons visualized by in utero electroporation of a green fluorescent protein gene. Neuroscience research. 57, 40-49 (2007).
- de Diego, I., Kyriakopoulou, K., Karagogeos, D., Wassef, M. Multiple influences on the migration of precerebellar neurons in the caudal medulla. Development (Cambridge, England). 129, 297-306 (2002).
- Landsberg, R. L. Hindbrain rhombic lip is comprised of discrete progenitor cell populations allocated by Pax6. Neuron. 48, 933-947 (2005).
- Hoshino, M. Ptf1a, a bHLH transcriptional gene, defines GABAergic neuronal fates in cerebellum. Neuron. 47, 201-213 (2005).
- Yamada, M. Origin of climbing fiber neurons and their developmental dependence on. Ptf1a. J. Neurosci. 27, 10924-10934 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved