Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
En électroporation in vitro de la lèvre inférieure rhombique d'embryons de souris Midgestation
Dans cet article
Résumé
Cette étude décrit le développement d'un In vitro qui permet pour la manipulation de l'expression des gènes dans la lèvre inférieure en losange d'embryons midgestation.
Résumé
La lèvre rhombique est un neuroépithélium embryonnaire situé dans le cerveau postérieur à la jonction entre le tube neural et le roofplate du quatrième ventricule (commentaire dans 1). La lèvre rhombique peut être subdivisé en la lèvre supérieure rhombiques (URL), qui englobe une rhombomère (r1) et génère neurones du cervelet et la lèvre inférieure rhombiques (Fmin) qui donne lieu à diverses lignées tronc neuronales 2-4. Dérivés LRL comprennent des neurones auditifs du noyau cochléaire et ceux de l'noyaux précérébelleux qui sont impliqués dans la régulation de l'équilibre et de commande de moteur 5-8. Neurogenèse de la LRL se produit sur une grande fenêtre temporelle qui englobe jours embryonnaires (E) de 9,5 à 16,5 5, 9. Différentes lignées neuronales sortir de la LRL que les cellules post-mitotiques (ou qui sont nés) au cours distincts jours de développement au cours de cette fenêtre neurogène.
L'électroporation de constructions d'expression des gènes peut être utilisé pourmanipuler l'expression des gènes dans les progéniteurs LRL et peut potentiellement changer le destin des neurones produits à partir de cette région 10-12. L'expression des gènes Modification des progéniteurs LRL chez la souris via électroporation in utero a été couronnée de succès pour la manipulation de lignées nés le jour embryonnaire E12.5 ou plus tard, 10, 12-14. Dans électroporations in utero avant E12.5 ont échoué en raison principalement de la létalité associé à la perforation de la roofplate quatrième ventricule, une étape nécessaire dans la prestation de l'ADN exogène qui est électroporation dans le LRL. Cependant, de nombreuses lignées dérivées LRL découlent de la LRL plus tôt que E12.5 9. Ces lignées tôt nés comprennent les neurones qui composent le réticulaire latéral, cunéiforme externe, et inférieure noyaux olivaires du système précérébelleux qui fonctionnent pour connecter les entrées de la moelle épinière et du cortex du cervelet 5. Dans le but de manipuler l'expression dans le LRLd'embryons âgés de moins de E12.5, nous avons développé un système in vitro dans lequel les embryons sont placés dans la culture à la suite d'électroporation.
Cette étude présente une méthode efficace et utile pour manipuler l'expression des gènes des progéniteurs LRL à E11.5. Embryons électroporés avec la protéine fluorescente verte (GFP) entraînée par le promoteur CAG large actif reproductible exprimé la GFP après 24 heures de culture. Un aspect essentiel de cet essai est que l'expression des gènes ne sont modifiées en raison de l'expression du gène exogène et non à cause des effets secondaires qui résultent de l'électroporation et les techniques de culture. Il a été déterminé que les modèles endogènes d'expression des gènes ne sont pas perturbés dans des embryons de électroporées et cultivé. Ce test peut être utilisé pour modifier le destin des cellules issues de la LRL d'embryons âgés de moins de E12.5 grâce à l'introduction de plasmides pour la surexpression ou d'assommer (par ARNi) de différents pro-des facteurs de transcription neuronaux.
Protocole
1. La préparation avant l'électroporation
- Amplifier l'ADN pour l'électroporation par une préparation maxi (Prime-It ou Qiagen). La concentration de l'ADN doit être au minimum de 1 mg / mL pour une absorption efficace.
- Retirer 495 uL d'ADN et mélanger avec 5 pi de Green Fast 0,01% dans du 1 x PBS (tampon phosphate salin) dans un microtube.
2. Récolte embryonnaire
- Établir accouplements chronométrés de souris CD-1 (Harlan). Vérifier la présence de bouchons vaginaux et considérer la date un bouchon vaginal est observé comme le jour embryonnaire (E) 0,5. Les embryons seront récoltés 11 jours après la visualisation fiche (E11.5).
- Placez les outils stérilisés dans de l'éthanol 70%. Traiter une hotte à écoulement laminaire avec une lumière UV pendant au moins une heure avant l'utilisation. Capote de roof, bac de dissection, et la dissection étendue à l'éthanol 70%. Pré-chauffer 1 X PBS à 37 ° C.
- Sur E11.5 euthanasier la femelle à des conditions agréées par l'InstitutComité ional pour le soin et l'utilisation des animaux (ICCUA). Placer le plateau de dissection dans la hotte à flux laminaire. Vaporiser vers le bas de l'abdomen de la femelle avec de l'éthanol 70%.
- Ouvrez la cavité péritonéale et épinglez les murs sur le plateau de dissection. Tirez sur les cornes utérines afin qu'il repose dans la cavité péritonéale.
- Découper soigneusement la paroi de la corne utérine. Utilisez une cuillère 20 mm (Beaux-outils scientifiques) pour enlever délicatement l'embryon dans le sac vitellin loin de la barrière placentaire. Embryons déposer dans un plat de 100 mm de culture de tissus pré-remplie avec 10 ml de PBS stérile 1 X qui a été préchauffé à la section 2.2.
- Répétez l'opération pour tous les embryons présents.
3. Électroporation d'embryons E11.5 (Figure 1)
- Avec une cuillère 20 mm, transfert de l'embryon d'abord à un nouveau 100 mm plat pré-remplie avec 10 ml de 1XPBS stériles qui a été préchauffé à 37 ° C.
- Utilisez une pince 11 cm avec une pointe de 0,05 x mm 0,02 (Beaux-outils scientifiques) à réexaminer avec soindéplacer et jeter le sac vitellin.
- Embryon position de telle sorte que sa face dorsale est tournée vers le haut afin qu'il ressemble à la bande dessinée dans la figure 1A. Utilisez 7 palettes d'électrodes mm (Harvard Apparatus) pour tenir doucement l'embryon. Les électrodes doivent être positionnés de chaque côté du tube neural au niveau du ventricule rhombencéphale quatrième. Le ventricule est visible à l'œil nu mais en utilisant un microscope à dissection peut faciliter le placement pagaie précis. Positionnement des palettes est essentiel pour déterminer la région qui reçoit l'ADN électroporé. Si la lèvre inférieure rhombique (LRL) du cerveau postérieur dorsal embryonnaire est souhaitée, pagaies doivent être lieu de telle sorte qu'ils sont directement flanquant la partie la plus large de l'ouverture du quatrième ventricule.
- Utilisez une seringue de 1 cc de dresser l'ADN plasmidique mélangé avec Green Fast 0,01%. 500 ul du mélange doit être suffisante pour l'électroporation d'au moins 8-10 embryons (voir 3.5).
- Délicatement percer la ov roofplateerlying quatrième ventricule avec une aiguille tuberculine 25G 5/8 fixée à la seringue 1 cc et injecter le mélange d'ADN-colorant dans le ventricule. Injections retenus sont caractérisés par le mélange d'ADN-colorant de remplissage du système ventriculaire ensemble (figure 1C). La quantité d'ADN de colorant mélange généralement injecté est inférieure à 50 pL. Montants exactes sont variables entre les embryons en tant que partie du mélange a tendance à s'écouler du ventricule dans le PBS entourant l'embryon. Un autre moyen de fournir le mélange d'ADN de colorant serait en accédant au système ventriculaire par ponction du voile recouvrant le mésencéphale. À nouveau, les injections sont retenus caractérisé par le mélange d'ADN-colorant de remplissage du système ventriculaire ensemble.
- Donner cinq impulsions carrées en utilisant un générateur d'impulsions électriques (BTX) et 7 palettes d'électrodes mm. Chaque impulsion est de 50 V durable 5 ms par impulsion avec 500 ms entre chaque impulsion. Le tissu le plus proche de l'électrode chargée positivement sera alors take le plasmide.
4. Culture des embryons
- Dans une hotte à flux laminaire, remplir les puits extérieurs d'une boîte de culture de 12 puits avec 2 ml de DMEM/F12 des milieux supplémentés avec 10% de sérum de veau foetal, 5% de sérum équin, de la glutamine à 1%, 1% de pénicilline / streptomycine qui a été préchauffé à 37 ° C. Les conditions de culture ont été adaptés à partir de Diego et ses collègues 15.
- Dans les embryons de flux laminaire hotte à pincée section médiane (ci-dessous du cœur) avec une pince et retirer la partie postérieure de l'embryon. Placer la partie antérieure dans l'une des puits rempli de la boîte de culture à 12 puits.
- Répétez l'opération pour tous les embryons. Remplissez seulement les puits extérieurs de la plaque à 12 puits pour éviter la contamination des cultures.
- Culture d'embryons dans un incubateur à 37 ° C avec 5% de CO 2. Expression du plasmide électroporé devrait être observable dans les 24 heures.
- Si plus temps de culture désirer, remplir les puits sur un nouveau plateau 12 et avec 2 ml deles médias utilisés dans 4.1. Avec une cuillère stérilisée transférer les embryons à un puits dans la nouvelle plaque. Remettre dans l'incubateur à 37 ° C. Culture pour un maximum de 48 heures est possible.
- Lorsque le temps de culture désirée est atteinte, fixer des embryons pour l'analyse (voir ci-dessous).
5. Préparation d'embryons pour l'analyse
- Rincer embryons en 1 X PBS à 4 ° C pendant cinq minutes. Répéter.
- Fixer embryons pour l'analyse de paraformaldéhyde 2% (PFA) dans 1XPBS pendant 2 heures à 4 ° C.
- Rincer embryons en 1 X PBS à 4 ° C pendant cinq minutes. Répéter.
- Equilibrer embryons de saccharose à 30% en 1 X PBS pendant une nuit à 4 ° C.
- Intégrer les embryons in Température de coupe optimale (PTOM) composé en utilisant un sèche glace / éthanol bain. Les embryons peuvent être conservés à -20 ° C.
- Section embryons sur un cryostat (Leica) dans 30 sections um et monter sur des lames (VWR, Superfrost Plus). Conserver à -20 ° C.
6. ImmuAnalyse nohistochemistry
- L'immunohistochimie a été réalisée comme décrit dans 16. Dilutions d'anticorps primaires utilisés pour cette étude comprennent lapin α-GFP (Invitrogen) 1:2500; souris α-Mash1 (BD Biosciences) 1:100; lapin α-Ngn1 (Jane Johnson) 1:5000, lapin α-Ptf1a (Jane Johnson ) 1:2500; lapin Math1 (Jane Johnson) 1:100. Incuber diapositive côté plat spécimen, sur un plateau de coloration à 4 ° C pendant la nuit.
- Les lames ont été analysées sur un microscope composé (Olympus BX51).
7. Les résultats représentatifs
Un schéma de la figure 1A représente l'expérience d'électroporation. Figure 1B montre une vue sagittale d'un embryon E11.5 avant la manipulation. Le même embryon après injection de l'ACG plasmide contenant :: GFP dans Green Fast 0,01% est illustré à la figure 1C et un embryon présentant représentant non fixée GFP unilatéraleexpression dans le rhombencéphale culture de 24 h dorsale suivante est affichée dans la figure 1D. L'étendue de la zone de la LRL qui est avec succès par électroporation est variable et semble être très dépendante sur le positionnement des électrodes. Dans nos études, il a été constaté que 52 des 65 (80%) des embryons électroporées exprimé avec succès la GFP. Le tissu a été réputé être avec succès par électroporation si elle a été positive pour la GFP dans des régions localisées sur plusieurs sections après la fixation et l'analyse immunohistochimique (voir ci-dessous). Les embryons qui ne répondaient pas aux critères ont été marqués ce que les tentatives infructueuses de l'électroporation.
Une évaluation plus poussée de l'efficacité d'électroporation peut être déterminée en effectuant immunohistochimie contre la GFP sur des coupes transversales d'embryons électroporées au niveau du quatrième ventricule. La figure 2 montre représentatives des coupes sériées de l'embryon affichage unilatéraleExpression de la GFP. La figure 2A montre un schéma idéalisé qui illustre que le côté gauche de l'embryon était vers l'électrode positive. Les sections transversales (à des niveaux représentés par le dessin animé milieu de la figure 2A) révèlent expression de la GFP localisée exclusivement sur le côté gauche du tissu du cerveau postérieur (Figures 2C et 2D). La zone de l'électroporation LRL ne s'étend pas l'ensemble axe antéro-postérieur du tube neural que l'examen des articles 300 um rostrales ou supérieure à celle montrée à la figure 2C ne expriment la GFP (figure 2B).
L'utilité de cet essai pour la manipulation de l'expression génique est dépendante de la stabilité des domaines d'expression pour les protéines endogènes. Le LRL a été caractérisé comme possédant domaines progénitrices unique caractérisé par l'expression différentielle des facteurs de transcription proneural (revue dans 1).Un sous-ensemble de ces facteurs (Mash1, Math1, Ngn1, et Ptf1a) ont été choisis pour l'analyse en raison de leur projet et / ou des rôles caractérisés dans la spécification des sous-types de neurones précérébelleux dans le LRL, un objet d'études futures 16-18. Tous les quatre protéines ont des domaines d'expression très caractéristiques dans le cerveau postérieur caudale à E11.5 16-18. Nous avons observé que les embryons qui ont été placés cultures n'a pas augmenté en taille et en a également omis de lancer la production de l'épithélium du plexus choroïde et l'invagination des LRL et roofplate, des événements morphologiques qui se produisent entre E11.5 E12.5 et 5. Sur la base de ces observations, il a été déterminé que le développement normal de ces embryons a été interrompue ou retardée grossièrement et le contrôle comparable pour les embryons cultivés devrait être embryons incultes à E11.5.
Pour veiller à ce que la culture et l'électroporation ne pas déranger les niveaux de protéines endogènes, nous avons analysé quatre protéines différentes par immunohistochemistry (IHC) dans 34 embryons différents qui ont été électroporés puis cultivées pendant au moins 24 heures. Le tableau I montre le nombre d'embryons analysés pour chaque marqueur et le pourcentage des embryons analysés qui ont conservé des taux de protéines normales. La figure 3 montre les données représentant IHC de deux des protéines analysées, Mash1 (figures 3A et 3B) et Math1 (figures 3C et 3D). Nous avons observé que la majorité des embryons conservés des niveaux normaux d'expression à la suite d'électroporation et la culture (figures 3B et 3D) par rapport aux embryons de contrôle à E11.5 (figures 3A et 3C). Fait important, les domaines d'expression caractéristiques de ces protéines ne sont pas perturbés.
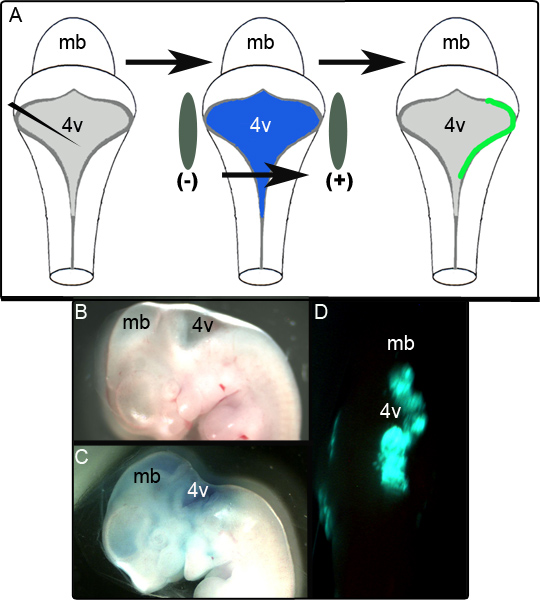
Figure 1. Électroporation d'embryons à E11.5. (A) Schéma d'eexpérience électroporation e. Un embryon E11.5 est isolé et le plasmide d'expression dans le vert rapide 0,01% est injecté dans le quatrième ventricule. L'embryon est ensuite flanqué par des palettes d'électrodes et soumis à une impulsion de 50 V avant d'être placé dans la culture (B) Coupe sagittale d'un embryon E11.5 avant l'injection. (C) Le même embryon E11.5 suite à l'injection de plasmide dans Green Fast 0,01%. (D) l'expression unilatérale de la GFP rhombencéphale observée dans l'embryon E11.5 après 24 h de la culture. mb-mésencéphale; 4v-quatrième ventricule.
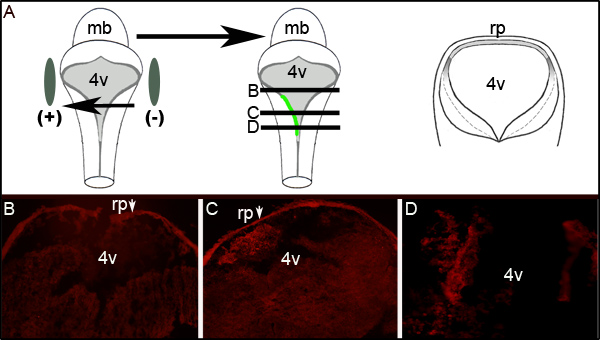
Figure 2. Expression de la GFP dans les tissus électroporé. (A) La bande dessinée sur la gauche représente le placement des électrodes autour d'un embryon E11.5. Moyen dessin représente l'absorption et l'expression de plasmide codant la GFP sur le côté gauche de l'embryon. Caricature sur le droit est schématique d'une section transversale prise à travers idéalisée de l'embryon à lES NIVEAUX notée par des lignes noires dans la bande dessinée du milieu. (B-D) immunohistochimie pour la GFP sur des coupes transversales à travers un embryon électroporé E11.5 après 24 h de la culture. Les flèches indiquent la roofplate (rp) qui piège l'anticorps secondaire. Les images sont prises à un grossissement de 10X. Les niveaux relatifs des sections indiquées sont représentés par les lignes horizontales par le biais du dessin animé du milieu dans (A). mb-mésencéphale; l 4v-quatrième ventricule; rp-roofplate.
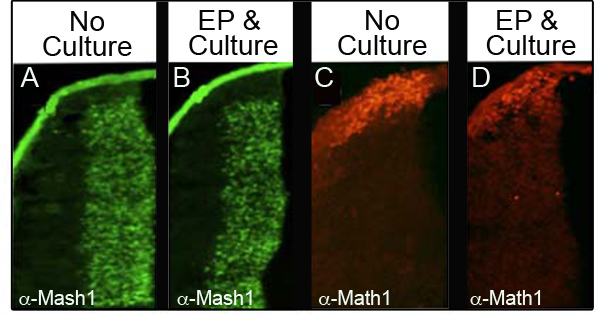
Figure 3. Expression de protéines endogènes dans la lèvre inférieure rhombique immunohistochimie pour Mash1 (A et B) ou Math1 (C et D) en comparant des coupes transversales d'embryons E11.5 qui n'étaient pas cultivées (A, C) avec des embryons qui ont été électroporés avec l'ACG.: : GFP et cultivé pendant 24 heures (B et D). Images prises à un grossissement de 10X.
| Proneural Transcriptisur une analyse factorielle | Nombre d'embryons analysés | Pourcentage de retenue profils d'expression normales |
| Math1 | 15 | 86,7% |
| Mash1 | 12 | 83,3% |
| Ngn1 | 7 | 71,4% |
| Ptf1a | 6 | 100% |
Tableau I. Pourcentage d'embryons et d'élevage de soutènement électroporées normales Proneural Domaines facteur de transcription dans le LRL.
Discussion
La technique d'électroporation in vitro dans présentés dans cette étude est une nouvelle méthodologie qui peut être efficacement utilisée pour manipuler l'expression des gènes dans les embryons de moins de 12 jours de gestation. Placement des embryons dans la culture permet l'expression du gène introduit et contourne la létalité observée lorsque les embryons électroporées sont autorisés à rester in vivo. Cette technique permet pour la manipulation de l'expression des gè...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs tiennent à remercier Jane Johnson pour la Math1, Ngn1, et des anticorps PTF1A et Connie Cepko pour la pCAG :: GFP plasmide. Ce travail a été financé par le NIH R15 1R15HD059922-01.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires (optionnel) |
| Cryostat | Leica | CM-1850 | |
| Biologie pointe Dumoxel traitée DUMONT pince | Beaux-outils scientifiques | 11252-30 | |
| 20 mm MORIA cuillère perforée | Beaux-outils scientifiques | 10370-17 | |
| ECM 830 générateur de signaux carrés électroporation Vague | BTX (VWR) | 47745-928 | |
| Harvard Apparatus 7 Tweezertrodes mm * Electrodes | BTX (Fisher) | BTX450165 | |
| Fisher Isotemp incubateur à CO 2 | Pêcheur | 1325525 | |
| NAPCO CO 2 Régulateur de gaz | Pêcheur | 15497020 | |
| 12 plaques à puits de culture de tissus | BD Falcon (Fisher) | 877229 | |
| HyClone liquide médias DMEM/F-12 (1:1); Avec L-glutamine et HEPES; 500 ml | Thermo Scientific (Fisher) | SH3002301 | |
| * HyClone donateurs sérum équin | Thermo Scientific (Fisher) | SH3007402 | |
| Sérum de veau foetal, qualifié, inactivé par la chaleur | Invitrogen | 16140-063 | |
| Cellgro * 10.000 UI de pénicilline, 10.000 pg / ml de streptomycine | Mediatech (Fisher) | MT-30-002-CI | |
| HyClone * L-Glutamine L-glutamine, 200mm en NaCl à 0,85% | Thermo Scientific (Fisher) | SH3003401 | |
| Fast-Vert | Pêcheur | AC41053-0250 | 0,01% |
Références
- Ray, R. S., Dymecki, S. M. Rautenlippe Redux -- toward a unified view of the precerebellar rhombic lip. Current opinion in cell biology. 21, 741-747 (2009).
- Machold, R., Fishell, G. Math1 is expressed in temporally discrete pools of cerebellar rhombic-lip neural progenitors. Neuron. 48, 17-24 (2005).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Wingate, R. J., Hatten, M. E. The role of the rhombic lip in avian cerebellum development. Development (Cambridge, England). 126, 4395-4404 (1999).
- Altman, J., Bayer, S. A. . Development of Cerebellar System: In relation to its evolution, structure, and function. , (1997).
- Farago, A. F., Awatramani, R. B., Dymecki, S. M. Assembly of the brainstem cochlear nuclear complex is revealed by intersectional and subtractive genetic fate maps. Neuron. 50, 205-218 (2006).
- Wang, V. Y., Rose, M. F., Zoghbi, H. Y. Math1 expression redefines the rhombic lip derivatives and reveals novel lineages within the brainstem and cerebellum. Neuron. 48, 31-43 (2005).
- Rodriguez, C. I., Dymecki, S. M. Origin of the precerebellar system. Neuron. 27, 475-486 (2000).
- Taber-Pierce, E. Histogenesis of the nuclei griseum ponitis, corporis pontobulbaris and reticularis tegmenti pontis (bechterew) in mouse. J. Comp. Neurol. 126, 219-240 (1966).
- Dipietrantonio, H. J., Dymecki, S. M. Zic1 levels regulate mossy fiber neuron position and axon laterality choice in the ventral brain stem. Neuroscience. 162, 560-573 (2009).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155-162 (2002).
- Taniguchi, H., Kawauchi, D., Nishida, K., Murakami, F. Classic cadherins regulate tangential migration of precerebellar neurons in the caudal hindbrain. Development (Cambridge, England). 133, 1923-1931 (2006).
- Kawauchi, D., Taniguchi, H., Watanabe, H., Saito, T., Murakami, F. Direct visualization of nucleogenesis by precerebellar neurons: involvement of ventricle-directed, radial fibre-associated migration. Development (Cambridge, England). 133, 1113-1123 (2006).
- Okada, T., Keino-Masu, K., Masu, M. Migration and nucleogenesis of mouse precerebellar neurons visualized by in utero electroporation of a green fluorescent protein gene. Neuroscience research. 57, 40-49 (2007).
- de Diego, I., Kyriakopoulou, K., Karagogeos, D., Wassef, M. Multiple influences on the migration of precerebellar neurons in the caudal medulla. Development (Cambridge, England). 129, 297-306 (2002).
- Landsberg, R. L. Hindbrain rhombic lip is comprised of discrete progenitor cell populations allocated by Pax6. Neuron. 48, 933-947 (2005).
- Hoshino, M. Ptf1a, a bHLH transcriptional gene, defines GABAergic neuronal fates in cerebellum. Neuron. 47, 201-213 (2005).
- Yamada, M. Origin of climbing fiber neurons and their developmental dependence on. Ptf1a. J. Neurosci. 27, 10924-10934 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon