Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Midgestation Fare Embryolarının Alt Rombik Dudak in vitro Elektroporasyon yılında
Bu Makalede
Özet
Bu çalışma, bir gelişmesi açıklar In vitro elektroporasyon tekniği.
Özet
Eşkenar dudak nöral tüp ve dördüncü ventrikül (1 Yorumlar) ile roofplate arasındaki kavşakta arka beyin bulunan bir embriyonik neuroepithelium olduğunu. Eşkenar dudak rhombomere 1 (R1) kapsar ve beyincik nöronlar ve çeşitli nöronal beyin soy 2-4 sebebiyet veren alt eşkenar dudak (LRL) oluşturduğu eşkenar üst dudak (URL) bölünmüştür edilebilir. LRL türevleri işitsel koklear çekirdeklerin nöronlar ve denge ve motor kontrol 5-8 düzenleyen katılan precerebellar çekirdeklerin olanları içerir. LRL gelen nörogenez embriyonik gün (E) 9,5-16,5 5, 9 kapsayan geniş bir zamansal pencere içinde oluşur. Farklı nöronal soy bu nörojenik penceresi sırasında farklı gelişimsel gün boyunca postmitotik hücreleri (veya doğar) gibi LRL çıkarlar.
Gen ifadesi yapıları elektroporasyon için kullanılabilirLRL ataları gen ekspresyonu işlemek ve potansiyel olarak bu bölgede 10-12 üretilen nöronların kaderini değiştirebilirsiniz. Utero elektroporasyon yılında aracılığıyla fare LRL progenitörlerin değiştirilmesi gen ekspresyonu embriyonik gün E12.5 veya daha sonra 10, 12-14 doğumlu soy işlenmesi için oldukça başarılı olmuştur. Utero electroporations yılında öncesinde E12.5 öncelikle nedeniyle başarısız olmuştur ölümcül dördüncü ventrikül roofplate, LRL içine electroporated olan eksojen DNA sağlanmasında gerekli bir adım delinme ile ilişkilidir. Ancak, birçok LRL edilen soyların önceki E12.5 9'dan LRL kaynaklanmaktadır. Bunlar daha önce doğan soy lateral retiküler oluşturan nöronlar, dış cuneate ve beyincik 5 omurilik ve korteks girişleri bağlamak için işlev precerebellar sisteminin alt olivary çekirdekleri içerir. LRL ifade işlemek amacıylaE12.5 daha genç embriyo, bu embriyosu elektroporasyon takiben kültürü içine yerleştirilmiş olduğu bir in vitro sistemi geliştirilmiştir.
Bu çalışma E11.5 az LRL progenitörlerin gen ifadesini değiştirmek için etkin ve verimli bir yöntem sunar. Genel olarak aktif CAG organizatörü sürüldü yeşil floresan protein (GFP) ile electroporated embriyolar tekrarlanabilir kültür 24 saat sonra GFP dile getirdi. Bu testin kritik bir yönü olduğunu gen ekspresyonu çünkü sadece eksojen geninin ifade değil, çünkü ikincil etkiler değiştirilmiş olmasıdır elektroporasyon ve kültür teknikleri sonucu bu. Bu endojen gen ekspresyonu electroporated ve kültürlü embriyolarda bozulmadan kalır olduğu tespit edilmiştir. Bu test için aşırı plazmidlerin tanıtım yoluyla E12.5 daha genç embriyoların LRL çıkan hücrelerin kaderini değiştirebilir veya (RNAi yoluyla) yıkmak için kullanılabilecek farklı pro-nöral transkripsiyon faktörleri.
Protokol
1. Elektroporasyon öncesinde hazırlıklar
- Bir maxi hazırlık (Prime-It or Qiagen) tarafından elektroporasyon için DNA Amplify. DNA konsantrasyonu etkin alımı için 1 mg / mL 'lik bir az olmalıdır.
- Bir mikrosantrifüj tüp içinde 1 X PBS (fosfat tamponlu tuz)% 0.01 'Fast Green 5 ul DNA ve karışımı 495 uL çıkarın.
2. Embriyonik Hasat
- CD-1 fareleri (Harlan) ile zamanlanmış çiftleşmelerin oluşturulması. Vajinal fişler varlığı için kontrol edin ve vajinal fiş embriyonik gün (E) 0.5 olarak tespit edildiği tarihten görüyoruz. Embriyolar 11 gün fişi (E11.5) görselleştirmek sonra hasat edilir.
- % 70 etanol içinde sterilize araçları yerleştirin. Kullanmadan önce en az bir saat için UV ışığı ile laminar akım kaput davranın. Sprayhood, diseksiyon tepsi, ve% 70 etanol ile kapsamı diseksiyon. 37 Öncesi ısı 1 X PBS ° C
- E11.5 On Enstitüsü tarafından onaylanmış koşullarına göre kadın euthanizeHayvan Bakımı ve Kullanımı (ICCUA) için ional Komitesi. Laminer akış kaputu diseksiyon tepsiye yerleştirin. % 70 etanol ile kadın karın aşağı püskürtün.
- Periton boşluğuna açın ve diseksiyon tepsiye duvarlara takılmalıdır. Bu periton boşluğu içinde duracak şekilde laparotomi çekin.
- Dikkatle uterin horn duvarı açın kesti. Hafifçe uzak plasenta yolk kesesi içinde embriyonun kaldırmak için bir 20 mm kaşık (Güzel Bilimsel Araçları) kullanın. 100 mm doku kültürü kabına Yeri embriyolar 2.2 ön ısıtmaya edildi steril 1 X PBS 10 mL doldurulmuş.
- Mevcut tüm embriyolar için tekrarlayın.
3. E11.5 Embryolarının Elektroporasyon (Şekil 1)
- Bir 20 mm kaşık kullanılarak, 37 ısıtılmış edildi steril 1XPBS 10 mL ile doldurulmuş yeni bir 100 mm çanağı ° C'ye kadar birinci embriyo transferi
- Dikkatli bir şekilde tekrar bir 0.05 x 0.02 mm uç (Güzel Bilimsel Araçları) ile 11 cm forseps kullanmataşımak ve yolk kesesi atın.
- Pozisyon embriyo yüzden onun sırt tarafında Şekil 1A karikatür benzer şekilde yukarı baktığından emin. Yavaşça embriyo için 7 mm elektrot kürekler (Harvard Apparatus) kullanın. Elektrotlar ardbeyin dördüncü ventrikül seviyesinde sinir tüpün her iki tarafında konumlandırılmış edilmelidir. Ventrikül çıplak gözle ancak bir diseksiyon mikroskobu kullanarak doğru kürek yerleştirme kolaylaştırabilir. Pedallarının Konumlandırma electroporated DNA aldığı bölgenin belirlenmesi için çok önemlidir. Dorsal embriyonik ardbeyin alt eşkenar dudak (LRL) isteniyorsa, kürek doğrudan dördüncü ventrikül açıklığı olan en geniş kısmını taarruzcu olduğu gibi yer olmalıdır.
- % 0.01 Fast Green ile karıştırılır plazmid DNA hazırlamak için 1 cc şırınga kullanın. Karışım 500 uL, en azından 8-10 embriyosu (3,5 bakınız) elektroporasyon için yeterli olmalıdır.
- Yavaşça ponksiyon roofplate ov1 cc enjektöre bağlanmış 25G 5/8 tüberkülin iğnesi ile dördüncü ventriküle erlying ve ventrikül içine DNA-boya karışımı enjekte edilir. Başarılı enjeksiyonlar tamamını ventriküler sistemi (Şekil 1C) dolum DNA-boya karışımı ile karakterize edilir. Tipik olarak enjekte DNA-boya karışımının miktarı en az 50 uL olup. Karışımın bir kısmı embriyonun çevresindeki PBS içine ventrikül taþmasýna eğilimi kesin miktarda embriyoları arasında değişkendir. DNA-boya karışımı teslim alternatif demektir Ortabeyin örten zar delinmesiyle ventriküler sisteme erişen yoluyla olacaktır. Yine, başarılı bir enjeksiyon tamamını ventriküler sistemi dolum DNA-boya karışımı ile karakterize edilir.
- Elektrikli bir darbe jeneratörü (BTX) ve 7 mm elektrot kürekler kullanarak beş kare bakliyat sunun. Her darbe, her darbe arasında 500 ms puls başına 50 V ömürlü 5 ms. Pozitif yüklü elektrot en yakın doku tak sonra olacakplazmid kadar e.
4. Embriyolar Kültür
- Bir laminar akış davlumbaz olarak,% 10 fetal bovin serumu,% 5 equine serumu,% 1 glutamin,% 1 penisilin / streptomisin ısıtılmış edildi ile desteklenmiş DMEM/F12 ortam 2 ml ile 12 bölümlü kültür çanağı dış kuyu dolgu 37 ° C Kültür koşullarında de Diego ve arkadaşları uyarlandı. 15
- Forseps ile midsection (kalp aşağıda) laminer akış kaput tutam embriyo ve embriyonun arka kısmını kaldırın. 12 oyuklu kültür kabının doldurulması kuyuları birine ön kısmına yerleştirin.
- Tüm embriyolar için tekrarlayın. Kültürlerin kirlenmesini önlemek için 12-iyi plaka sadece dış kuyuları doldurun.
- % 5 CO2 içeren bir inkübatör 37 ° C de kültüre embriyosu. Electroporated ekspresyon plazmidi 24 saat içinde gözlemlenebilir edilmelidir.
- Artık kültür kez istenen olmalı, 2 mL ile yeni bir 12 de plaka Kuyulardan doldurunOrtam 4,1 kullanılır. Steril bir kaşık ile yeni plaka bir kuyuya embryo transfer. 37 ° C inkübatör içine geri yerleştirin. 48 saat için Kültür mümkündür.
- İstenen kültür zamanı geldiğinde, (bkz. aşağıda) analizi için embriyo düzeltin.
5.. Analiz için Embriyolar hazırlanması
- Beş dakika süreyle 4 ° C 'de 1 X PBS içinde embriyo çalkalayın. Tekrarlayın.
- 4 ° C'de 2 saat süreyle 1XPBS içinde% 2 paraformaldehit analiz (PFA) sabitlemek için embriyosu
- Beş dakika süreyle 4 ° C 'de 1 X PBS içinde embriyo çalkalayın. Tekrarlayın.
- 4 gece 1 X PBS içinde% 30 sükroz embriyoların dengeye ° C
- Bir kuru buz / etanol banyosu kullanılarak Optimum Kesme Sıcaklığı (OCT) bileşik embriyoların Embed. Embriyolar -20 ° C'de saklanabilir
- 30 mikron bölüme kriyostat (Leica) ve (VWR, SuperFrost Plus) kızaklar üzerinde monte bölümü embriyoların. -20 ° C de saklayınız
6. İmmünoreaktifnohistochemistry Analizi
- 16 içinde açıklandığı gibi İmmünohistokimya yapıldı. Fare α-Mash1 (BD Biosciences) 1:100;; tavşan α-Ngn1 (Jane Johnson) 1:5000; tavşan α-Ptf1a (Jane Johnson bu çalışma için kullanılan primer antikor dilüsyonları tavşan α-GFP (Invitrogen) 1:2500 dahil ) 1:2500; tavşan Math1 (Jane Johnson) 1:100. 4 ° C'da bir boyama tepsi üzerinde slayt düz, örnek tarafı yukarı inkübe edin.
- Slaytlar bir bileşik mikroskobu (Olympus BX51) üzerinde analiz edildi.
7. Temsilcisi Sonuçlar
Şekil 1A şematik elektroporasyon deneyi anlatıyor. Şekil 1B manipülasyon önce bir E11.5 embriyonun sagittal bir görünümdür. % 0.01 Fast Green plazmid içeren CAG :: GFP enjeksiyonu takiben aynı embriyo Şekil 1C ve tek taraflı GFP sergileyen bir temsilci sabitlenmemiş embriyo gösterilirdorsal ardbeyin 24 saat kültüre aşağıdaki ifade Şekil 1B 'de gösterilmiştir. Başarıyla electroporated edilir LRL alanının ölçüde değişkenlik göstermektedir ve bu elektrot konumlandırma çok bağımlı olarak görünmektedir. Bizim çalışmalarda electroporated embriyoların 65 (% 80) 52 dışında başarıyla GFP ifade bulunmuştur. Doku bu tespit ve immünohistokimyasal analizi (bkz. aşağıda) sonra çeşitli bölümler üzerinde lokalize bölgelerde GFP pozitif ise başarıyla electroporated olarak kabul edildi. Bu kriterlere uymayan Embriyolar elektroporasyon de başarısız girişimler olarak skorlandı.
Elektroporasyon verimliliği daha fazla incelenmesine dördüncü ventrikül düzeyinde electroporated embriyoların enine kesitlerinde GFP karşı immünohistokimya yapılarak tespit edilebilir. Şekil 2 tek taraflı gösteren bir embriyodan temsilcisi seri bölümleri gösterirGFP. Şekil 2A embriyonun sol tarafına pozitif elektrot doğru olduğunu gösteren bir idealize şematik gösterir. Enine bölümleri (Şekil 2A, orta çizgi ile gösterilen seviyelerde) arka beyin doku (Şekil 2C ve 2B) sol tarafında münhasıran lokalize GFP tanımı ortaya koymaktadır. Şekil 2C gösterildiği üzere 300 mikron rostral veya daha büyük bölümlerde muayene express GFP (Şekil 2B) olmadığı için LRL ile electroporated alan nöral tüpün tüm ön-arka eksen vermemiştir.
Gen ekspresyonunun manipülasyonu için Bu testin yardımcı endojen proteinler için ifadesi etki stabilite bağlıdır. LRL proneural transkripsiyon faktörlerinin diferansiyel ifadesi (1 Yorumlar) ile karakterize benzersiz progenitör etki sahip olarak karakterize edilmiştir.Bu faktörlerin bir alt kümesi (Mash1, Math1, Ngn1 ve Ptf1a) LRL, gelecekteki çalışmalarda 16-18 bir konuda precerebellar nöral alt tiplerinin özellikleri kendi önerilen ve / veya karakterize rolleri nedeniyle analiz için seçilmiştir. Dört proteinler E11.5 16-18 az kaudal ardbeyin oldukça karakteristik ifadeler etki var. Biz kültürler yerleştirildi embriyo büyüklüğü artırmak için başarısız oldu ve aynı zamanda koroid pleksus epitel ve E11.5 ve E12.5 5 arasında meydana LRL ve roofplate, morfolojik olaylar invajinasyon üretimi başlatmak için başarısız olduğu görülmektedir. Bu gözlemlere dayanarak bu embriyoların normal gelişimini durdurdu veya fena halde geciktirdi ve kültürlü embriyolar için karşılaştırılabilir kontrol E11.5 az kültürsüz embriyo olmalıdır tespit edildi.
Kültür ve elektroporasyon endojen protein düzeyleri rahatsız etmemelerini sağlamak için, immunohistoch tarafından dört farklı proteinler analizelectroporated ve en az 24 saat sonra kültür alındı 34 farklı embriyolarda emistry (İHK). Tablo muhafaza Normal protein düzeyleri. Şekil 3 temsilcisi IHC veriler gösteriyor ki analiz her marker ve embriyoların yüzdesi için analiz embriyo sayısını gösterir proteinler iki analiz gelen, Mash1 (Şekil 3A ve 3B) ve Math1 (Şekil 3C ve 3B). Biz E11.5 (Şekil 3A ve 3C) de kontrol embriyo kıyasla embriyo çoğunluğu ifadesi takiben elektroporasyon ve kültür (Şekil 3B ve 3B) normal seviyede muhafaza gözlemlenmiştir. Önemli olarak, bu proteinlerin karakteristiği etki ifadesi pertürbe edilmemiştir.
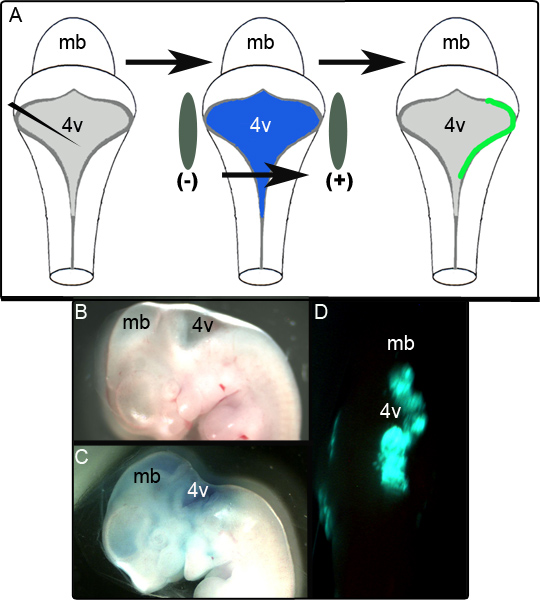
Şekil 1.. Th E11.5 az Embryolarının Elektroporasyon. (A) Şematike elektroporasyon deney. Bir E11.5 embriyo izole edilir ve% 0.01 Fast Green plazmid ifade dördüncü ventrikül içine enjekte edilir. Embriyo daha sonra elektrot kürekler tarafından yanlı ve önceden kültürü içine enjeksiyon önce bir E11.5 embriyo (B) Sagital görünümü konuyor için 50 V darbe tabi tutulur. (C) aynı E11.5 embriyo% 0.01 Fast Green plazmid enjeksiyonu takiben. (D) GFP tek taraflı arka beyin ifade kültür 24 saat takip E11.5 embriyo gözlenmiştir. mb-orta beyin; 4v-dördüncü ventrikül.
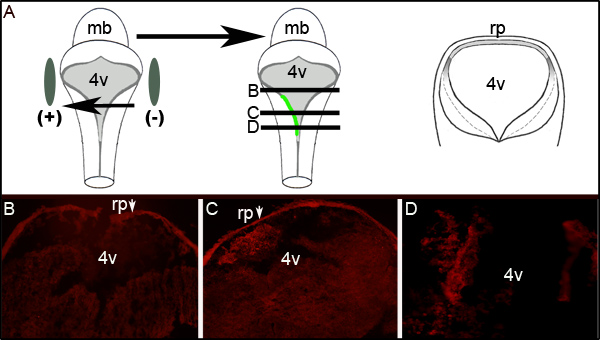
Şekil 2. Electroporated Doku GFP ekspresyonu. (A) sol karikatür bir E11.5 embriyonun çevresindeki elektrot yerleştirme gösteriyor. Orta karikatür embriyonun sol tarafında plazmid kodlama GFP alımı ve ifade resmediyor. Sağdaki Karikatür l embriyo üzerinden alınan idealize enine bölümün şemasıevels orta karikatür siyah çizgiler ile gösterilir. Kültür 24 saat sonra bir electroporated E11.5 embriyo ile enine kesitlerinde GFP (B-D) İmmünohistokimya. Oklar roofplate (rp) hapseden sekonder antikor göstermektedir. Görüntüler 10X büyütme alınır. Gösterilen kesitlerin nispi seviyeleri (A) 'in, orta çizgi boyunca yatay çizgiler ile tasvir edilmektedir. mb-orta beyin, l 4v-dördüncü ventrikül; rp-roofplate.
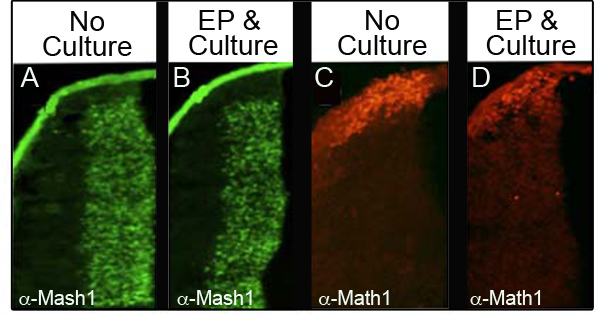
Şekil 3. Alt Rombik Dudak Endojen Proteinlerin ifadesi Mash1 (A ve B) veya CAG ile electroporated edildi embriyolu (A, C) kültür değillerdi E11.5 embriyo enine bölüm karşılaştırarak Math1 (C ve D) için İmmünohistokimya.: : GFP ve 24 saat (B ve D) için kültür. Görüntüler 10X büyütmede alınmıştır.
| Proneural TranscriptiFactor üzerinde Analyzed | Embriyolar sayısı İncelendi | Normal İfade Desenler İstinat Yüzde |
| Math1 | 15 | % 86.7 |
| Mash1 | 12 | % 83.3 |
| Ngn1 | 7 | % 71.4 |
| Ptf1a | 6 | % 100 |
LRL Normal Proneural Transkripsiyon Faktörü Alanlar İstinat Electroporated ve kültür Embriyoların Tablo I. yüzdesi.
Tartışmalar
Bu çalışmada sunulan vitro elektroporasyon tekniği verimli gebeliğin 12. günden küçük embriyolarda gen ekspresyonu işlemek için kullanılabilir yeni bir yöntemdir. Kültürüne embriyoların Yerleştirme tanıttı gen ekspresyonu izin verir ve electroporated embriyolar in vivo olarak kalmasına izin verildiğinde öldürücü gözlenen circumvents. Bu teknik elektroporasyon tabanlı çalışmalar için daha önce ulaşılamayan embriyonik ataları gen ifadeleri değişiklik yapıla...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar Math1, Ngn1 Jane Johnson teşekkür ve Ptf1a antikorlar ve pCAG için Connie Cepko :: GFP plazmid olacaktır. Bu çalışma NIH R15 1R15HD059922-01 tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
| Kriyostat | Leica | CM-1850 | |
| Biologie ucu Dumoxel DUMONT forseps tedavi | Güzel Bilimsel Araçları | 11252-30 | |
| 20 mm Moria delikli kaşık | Güzel Bilimsel Araçları | 10370-17 | |
| ECM 830 Kare Dalga Elektroporasyon Generator | BTX (VWR) | 47745-928 | |
| Harvard Apparatus 7 mm Tweezertrodes * Elektrotlar | BTX (Fisher) | BTX450165 | |
| Fisher Isotemp CO 2 İnkübatör | Balıkçı | 1325525 | |
| NAPCO CO 2 Gaz Regülatörü | Balıkçı | 15497020 | |
| 12 Peki Doku Kültürü Tabaklar | BD Falcon (Fisher) | 877229 | |
| HyClone Sıvı Ortamda DMEM/F-12 (1:01); L-glutamin ve HEPES grubu; 500ml | Thermo Scientific (Fisher) | SH3002301 | |
| HyClone * Donör Atçılık Serum | Thermo Scientific (Fisher) | SH3007402 | |
| İnaktive Fetal Bovine Serum, Nitelikli, Isı | Invitrogen | 16140-063 | |
| cellgro * 10.000 IU Penisilin, 10,000 mcg / mL Streptomisin | Mediatech (Fisher) | MT-30-002-CI | |
| HyClone * L-Glutamin L-Glutamin; 20% 0.85 NaCl 0mm | Thermo Scientific (Fisher) | SH3003401 | |
| Fast-Yeşil | Balıkçı | AC41053-0250 | % 0.01 |
Referanslar
- Ray, R. S., Dymecki, S. M. Rautenlippe Redux -- toward a unified view of the precerebellar rhombic lip. Current opinion in cell biology. 21, 741-747 (2009).
- Machold, R., Fishell, G. Math1 is expressed in temporally discrete pools of cerebellar rhombic-lip neural progenitors. Neuron. 48, 17-24 (2005).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Wingate, R. J., Hatten, M. E. The role of the rhombic lip in avian cerebellum development. Development (Cambridge, England). 126, 4395-4404 (1999).
- Altman, J., Bayer, S. A. . Development of Cerebellar System: In relation to its evolution, structure, and function. , (1997).
- Farago, A. F., Awatramani, R. B., Dymecki, S. M. Assembly of the brainstem cochlear nuclear complex is revealed by intersectional and subtractive genetic fate maps. Neuron. 50, 205-218 (2006).
- Wang, V. Y., Rose, M. F., Zoghbi, H. Y. Math1 expression redefines the rhombic lip derivatives and reveals novel lineages within the brainstem and cerebellum. Neuron. 48, 31-43 (2005).
- Rodriguez, C. I., Dymecki, S. M. Origin of the precerebellar system. Neuron. 27, 475-486 (2000).
- Taber-Pierce, E. Histogenesis of the nuclei griseum ponitis, corporis pontobulbaris and reticularis tegmenti pontis (bechterew) in mouse. J. Comp. Neurol. 126, 219-240 (1966).
- Dipietrantonio, H. J., Dymecki, S. M. Zic1 levels regulate mossy fiber neuron position and axon laterality choice in the ventral brain stem. Neuroscience. 162, 560-573 (2009).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155-162 (2002).
- Taniguchi, H., Kawauchi, D., Nishida, K., Murakami, F. Classic cadherins regulate tangential migration of precerebellar neurons in the caudal hindbrain. Development (Cambridge, England). 133, 1923-1931 (2006).
- Kawauchi, D., Taniguchi, H., Watanabe, H., Saito, T., Murakami, F. Direct visualization of nucleogenesis by precerebellar neurons: involvement of ventricle-directed, radial fibre-associated migration. Development (Cambridge, England). 133, 1113-1123 (2006).
- Okada, T., Keino-Masu, K., Masu, M. Migration and nucleogenesis of mouse precerebellar neurons visualized by in utero electroporation of a green fluorescent protein gene. Neuroscience research. 57, 40-49 (2007).
- de Diego, I., Kyriakopoulou, K., Karagogeos, D., Wassef, M. Multiple influences on the migration of precerebellar neurons in the caudal medulla. Development (Cambridge, England). 129, 297-306 (2002).
- Landsberg, R. L. Hindbrain rhombic lip is comprised of discrete progenitor cell populations allocated by Pax6. Neuron. 48, 933-947 (2005).
- Hoshino, M. Ptf1a, a bHLH transcriptional gene, defines GABAergic neuronal fates in cerebellum. Neuron. 47, 201-213 (2005).
- Yamada, M. Origin of climbing fiber neurons and their developmental dependence on. Ptf1a. J. Neurosci. 27, 10924-10934 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır