需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
菱形唇下的Midgestation小鼠胚胎在体外电穿孔
摘要
这项研究描述了一个发展在体外电穿孔技术,允许在较低的菱形唇midgestation胚胎的基因表达操纵。
摘要
菱形唇是位于后脑的胚胎神经上皮之间的神经管及第四脑室(1检讨)roofplate交界。可分为菱形嘴唇上的菱形唇(URL),其中包括1(R1)和菱产生小脑的神经元和低菱形唇(LRL的),而产生不同的神经脑干谱系2-4。 LRL的衍生工具包括耳蜗核的听觉神经细胞和那些的原子核参与调节平衡和电机控制5-8 precerebellar的。神经再生的LRL的发生在一个大的时间窗口,包括胚胎(五)9.5-16.5 5天,9。不同的神经细胞谱系出现分裂后的细胞在不同发育天,在此期间神经窗口(或出生)LRL的。
基因表达结构的电可以用来操纵LRL的祖细胞的基因表达,并可能改变命运10-12从本地区产生的神经元。通过在子宫内的电LRL的祖细胞在小鼠的基因表达改变已经非常成功地操纵胚胎一天E12.5或以后10 12-14出生的谱系。 在宫内 electroporations前到E12.5已经失败主要是由于穿刺第四脑室roofplate的必要步骤,在提供外源DNA进入LRL的电穿孔相关的杀伤力。然而,许多LRL的派生谱系来自LRL的早于E12.5 9。这些以前出生的谱系,包括外侧网状神经元组成,外部的楔形,下橄榄核的precerebellar系统的功能连接脊髓和大脑皮质的投入小脑5。为了操作的LRL的表达胚胎E12.5年轻,我们开发了在体外系统在胚胎放置到文化电。
这项研究提出了一个在E11.5 LRL的祖细胞的基因表达操纵的高效率和有效的方法。重复性表示培养24小时后的GFP绿色荧光蛋白(GFP)的广泛积极的CAG启动驱动与电穿孔的胚胎。此法的一个重要方面,是基因表达的改变只因为外源基因的表达,并没有因为二次效应,从电和栽培技术的结果。它被确定内源性基因表达模式保持原状电穿孔和培养胚胎。此法可以用来改变命运的细胞从胚胎E12.5年轻的过度表达质粒引进LRL的新兴或击倒(通过RNA干扰)不同亲神经转录因子。
研究方案
1。以电穿孔前的准备
- 由马克西准备(总理或Qiagen公司)的DNA扩增为电。 DNA的浓度应该是最低的1毫克/毫升的高效吸收。
- 5微升0.01%快速绿色1×PBS(磷酸盐缓冲液)在离心管取出495μLDNA和混合。
2。胚胎丰收
- CD-1小鼠(哈伦)建立定时交配。检查阴道塞的存在,并把阴道塞观察胚胎一天(五)0.5的日期。胚胎将可视化插件(E11.5)后11天收获。
- 将在70%乙醇消毒工具。层流罩与紫外线灯治疗至少一小时前使用。喷雾罩,托盘解剖,解剖用70%乙醇的范围。预热1×PBS至37°C。
- 在E11.5安乐死的女性,根据研究所批准的条件护理和使用动物(ICCUA)的成分委员会。放置在层流罩的解剖托盘。喷用70%乙醇对女性的腹部。
- 打开腹腔,针城墙解剖的托盘。拉出子宫角,以便它的腹腔内休息。
- 仔细剖开的子宫角的墙上。使用20毫米的勺子(精细的科学工具)轻轻取出胚胎卵黄囊远离胎盘。预填充10毫升无菌1×PBS 2.2预热到100毫米组织培养皿的地方胚胎。
- 出席会议的所有胚胎重复。
3。 E11.5胚胎的电( 图1)
- 使用20毫米的勺子,第一胚胎转移到与预先填写10 mL无菌1XPBS预热至37中一个新的100毫米菜°C。
- 使用1 0.05×0.02毫米的小费(精细的科学工具)11厘米镊子仔细重新移动和丢弃卵黄囊。
- 胚胎的位置,因此,其背侧朝上,以便它类似于图1A卡通。使用7毫米的电极桨(哈佛器械)轻轻按住胚胎。电极应定位在任的神经管在一侧的后脑第四脑室水平。脑室是肉眼可见的,但使用解剖显微镜可以方便准确桨安置。桨的定位是,以确定该地区接收的电穿孔DNA的关键。如果是理想的,较低的菱形唇(LRL)背胚胎后脑桨必须是这样,它们直接侧翼第四脑室开放的最广泛的部分。
- 用1毫升注射器制订混有0.01%的快速绿色的质粒DNA。 500μL混合物应为至少8-10胚胎(见3.5)的电足够。
- 轻轻穿刺roofplate OVerlying与25G 5/8结核菌素1毫升注射器针第四脑室及脑室注入DNA染料混合物。成功的注射填补了整个脑室系统( 图1C)由DNA染料混合物的特点。通常注射DNA的染料混合物的数量少于50μL。确切数额之间胚胎变量的混合物的一部分,往往泄漏到周围的胚胎PBS心室。将通过访问软腭上覆的脑穿刺脑室系统提供的DNA染料混合物的替代手段。再次,成功的注射DNA染料混合物填充整个脑室系统的特点。
- 交付使用电脉冲发生器(BTX)和7毫米的电极桨5平方脉冲。每个脉冲50 V的持久5毫秒500毫秒之间的每个脉冲,每脉冲。组织最接近的带正电荷的电极,然后德电子商务支撑的载体。
4。文化的胚胎
- 在层流罩,填写2毫升辅以10%小牛血清,5%马血清,1%谷氨酰胺,1%青霉素/链霉素预热的DMEM/F12媒体外井12井培养皿到37°C。培养条件进行了改编自15 de地亚哥和他的同事们。
- 在层流罩在中段(以下心)用钳子捏胚胎并取出胚胎的后部。放入前部的12孔培养皿中充满井之一。
- 重复所有的胚胎。只填写12孔板外井文化,以避免污染。
- 在37℃培养箱培养胚胎用5%的CO 2。电穿孔质粒表达应观察24小时内。
- 应该更长文化理想,填写一个新的12孔板出井,2毫升媒体4.1。用消毒勺转移胚胎以及在新板。放回37℃培养箱。 48小时的文化是可能的。
- 当达到所需的培养时间,解决胚胎进行分析(见下文)。
5。用于分析胚胎的制备
- 在4°C冲洗胚胎五分钟,1×PBS。重复。
- 修正了2%多聚甲醛分析2小时1XPBS(PFA)的胚胎在4°C
- 在4°C冲洗胚胎五分钟,1×PBS。重复。
- 在30%蔗糖1×PBS平衡胚胎一夜之间在4°C。
- 嵌入最佳切削温度(OCT)复合使用干冰/乙醇浴中的胚胎。胚胎可以保存在-20°C
- 低温恒温器(徕卡)到30微米的部分幻灯片上装载(厂商VWR,Superfrost加),第胚胎。贮存于-20°C
6。免疫nohistochemistry分析
- 16所述进行免疫组化。用于这项研究的主要抗体稀释包括兔的α-GFP(Invitrogen公司)1:2500;小鼠α-,MASH1(BD Biosciences公司)1:100;兔α-Ngn1,(简·约翰逊)1:5000;兔α-Ptf1a(简·约翰逊)1:2500;兔MATH1(简·约翰逊)1:100。孵育平面幻灯片,标本方在4°C过夜染色托盘。
- 幻灯片分析了复合显微镜(奥林巴斯BX51)。
7。代表结果
图1A中的示意图描绘了电实验。 图1B显示了一个E11.5胚胎矢状前操纵的。相同的胚胎,含造影:: GFP质粒注射0.01%快速绿色显示在图1C和有代表性的非固定胚胎参展单方面的GFP显示在图1D背后脑24小时以下文化的表达。 LRL的,是成功的电穿孔面积的范围是可变的,似乎是高度依赖的电极定位。在我们的研究结果发现,52 65(80%)的电穿孔胚胎成功表达GFP。组织被认为是成功的电穿孔,如果它是固定和免疫组化分析(见下文)后的几个部分,在局部地区的GFP阳性。胚胎未能满足此条件,取得了在电不成功的尝试。
电效率的进一步评估,确定对GFP电穿孔胚胎在第四脑室水平的横截面进行免疫组化。 图2显示了从代表显示单方面胚胎的连续切片GFP的表达。 图2A显示了一个理想化的原理,说明胚胎左侧是朝正电极。横截面( 图2A中的卡通所代表的水平),揭示了完全本地化的GFP表达左侧后脑组织( 图2C和2D)。电穿孔的LRL的面积没有扩大整个前后轴的神经管延髓300微米或更大,以图2C显示,部分考试不表达GFP( 图2B)。
此法对基因表达操纵的工具是依赖于内源性蛋白的表达域的稳定。 LRL的特点是原神经转录因子的表达差异(审查1)具有独特的祖域已被定性为。这些因素中的一个子集(MASH1,MATH1,Ngn1,Ptf1a),被选择的分析,由于他们的建议和/或规范的LRL的,今后的研究课题16-18 precerebellar神经亚型特点的角色。所有四个蛋白质有高度在在E11.5 16-18尾后脑特征表达域。我们观察到,置于文化的胚胎未能扩大规模,也未能启动生产的脉络丛上皮内陷LRL的和roofplate,E11.5和E12.5 5之间发生的形态学事件。根据这些意见,它被确定在这些胚胎的正常发育停止或严重延迟和培养的胚胎相媲美的控制应该是落后的胚胎在E11.5。
为了确保文化和电不打扰内源性蛋白的水平,我们分析了四个不同的蛋白质由immunohistoch我 emistry化(IHC),电穿孔,然后培养24小时,至少在34个不同的胚胎。 表显示每个标记和分析,保留了正常的蛋白质水平。 图3免疫组数据显示代表胚胎的百分比分析胚胎数从蛋白质分析,MASH1( 图3A和3B)和MATH1( 图3C和3D)。我们观察到,大部分胚胎电和文化表达( 图3B和3D)保留正常水平相比,控制胚胎E11.5( 图3A和3C)。重要的是,这些蛋白质的特征表达域,不慌乱。
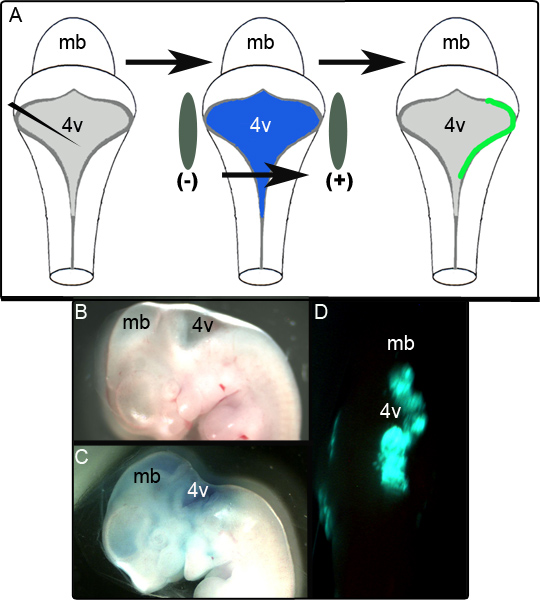
图1。在E11.5胚胎的电。日(一)示意图ê电实验。 E11.5胚胎分离和表达质粒在0.01%的快速绿色到第四脑室注射。胚胎,然后两侧电极桨和50 V脉冲之前被放置到文化(二)注射前的E11.5胚胎矢状。 (三)同一E11.5胚胎后,在0.01%的快速绿色注射质粒。 (四)单方面后脑表达GFP的观察E11.5胚胎后24小时的文化。 MB-脑; 4V第四脑室。
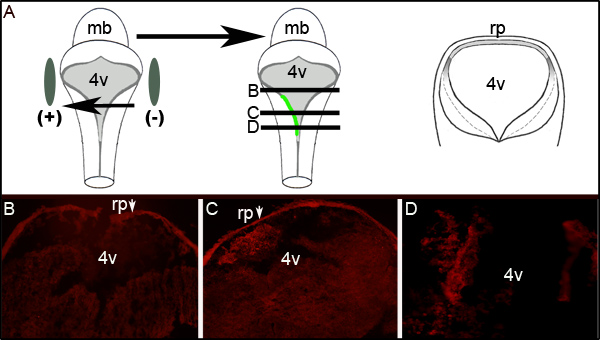
图2。电穿孔组织中的绿色荧光蛋白表达的影响。(一)在左边的卡通描绘电极周围的E11.5胚胎的位置。中东卡通描绘胚胎左侧质粒编码绿色荧光蛋白的摄取和表达。右边的卡通是一个理想化的横向部分通过胚胎在l原理evels由中间卡通黑线表示。通过电穿孔E11.5胚胎培养24小时后的横截面的绿色荧光蛋白的免疫组织化学(的B-D)。箭头指示的roofplate(RP)的陷阱二级抗体。图像是在10X的放大倍率。显示部分的相对水平描述(一)通过中间卡通水平线。 MB-脑,L 4V第四脑室; RP-roofplate。
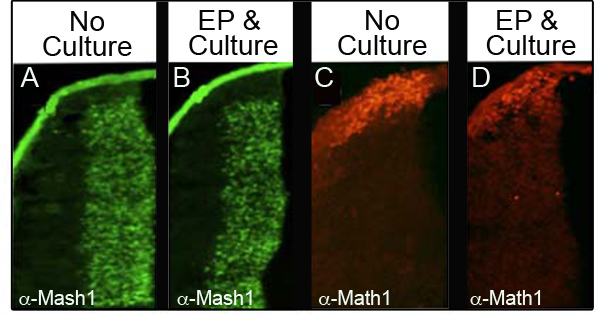
图3。菱形唇下的内源性蛋白的免疫组织化学,MASH1(A和B)或比较E11.5胚胎的横截面,培养与电穿孔与CAG的胚胎(C)MATH1(C和D)的表达。 GFP和培养24小时(B和D)。在10倍放大倍率拍摄的图像。
| 原神经Transcripti分析因子 | 胚胎数分析 | 挡土墙的正常表达模式的百分比 |
| MATH1 | 15 | 86.7% |
| MASH1 | 12 | 83.3% |
| ngn1 | 7 | 71.4% |
| ptf1a | 6 | 100% |
表一百分比电穿孔和培养胚胎,保留原神经正常的转录因子在LRL的域。
讨论
在这项研究中提出的技术在体外电击是一种新颖的方法,可以有效地利用胚胎年龄小于12天的妊娠期,操纵基因表达。胚胎放置到文化允许引入基因的表达和规避杀伤力观察电穿孔胚胎时,被允许留在体内 。这种技术允许基于电的研究,这在以前无法进入的胚胎祖细胞的基因表达操纵。
电技术,导致在引入80%的胚胎基因的高效表达分析。观察图2中...
披露声明
没有利益冲突的声明。
致谢
作者想感谢简·约翰逊的MATH1,Ngn1,的Ptf1a抗体和康妮Cepko为“pCAG :: GFP的质粒。这项工作是由NIH的R15的1R15HD059922-01。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论(可选) |
| 低温恒温器 | 徕卡 | CM-1850 | |
| biologie尖Dumoxel治疗杜蒙镊子 | 精细的科学工具。 | 11252-30 | |
| 20毫米莫里亚穿孔勺 | 精细的科学工具。 | 10370-17 | |
| 流脑830方波电脉冲发生器 | A型肉毒毒素(厂商VWR) | 47745-928 | |
| 哈佛仪器7 *电极毫米Tweezertrodes | A型肉毒毒素(雪) | BTX450165 | |
| 费舍尔Isotemp 二氧化碳培养箱 | 费舍尔 | 1325525 | |
| 新机场工程统筹署的CO 2气体调节器 | 费舍尔 | 15497020 | |
| 12孔培养板 | BD猎鹰(费舍尔) | 877229 | |
| 液体介质DMEM/F-12胎牛血清(1:1);与L-谷氨酰胺和肝素钠; 500毫升 | 赛默飞世尔科技(费舍尔) | SH3002301 | |
| 胎牛血清*捐助马血清 | 赛默飞世尔科技(费舍尔) | SH3007402 | |
| 胎牛血清,合格,热灭活 | Invitrogen公司 | 16140-063 | |
| cellgro * 10,000 IU青霉素,10,000μg/ mL链霉素 | 敏达(费舍尔) | MT-30-002-CI | |
| 胎牛血清·L-谷氨酰胺L-谷氨酰胺; 200MM在0.85%的NaCl | 赛默飞世尔科技(费舍尔) | SH3003401 | |
| 快绿 | 费舍尔 | AC41053-0250 | 0.01% |
参考文献
- Ray, R. S., Dymecki, S. M. Rautenlippe Redux -- toward a unified view of the precerebellar rhombic lip. Current opinion in cell biology. 21, 741-747 (2009).
- Machold, R., Fishell, G. Math1 is expressed in temporally discrete pools of cerebellar rhombic-lip neural progenitors. Neuron. 48, 17-24 (2005).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Wingate, R. J., Hatten, M. E. The role of the rhombic lip in avian cerebellum development. Development (Cambridge, England). 126, 4395-4404 (1999).
- Altman, J., Bayer, S. A. . Development of Cerebellar System: In relation to its evolution, structure, and function. , (1997).
- Farago, A. F., Awatramani, R. B., Dymecki, S. M. Assembly of the brainstem cochlear nuclear complex is revealed by intersectional and subtractive genetic fate maps. Neuron. 50, 205-218 (2006).
- Wang, V. Y., Rose, M. F., Zoghbi, H. Y. Math1 expression redefines the rhombic lip derivatives and reveals novel lineages within the brainstem and cerebellum. Neuron. 48, 31-43 (2005).
- Rodriguez, C. I., Dymecki, S. M. Origin of the precerebellar system. Neuron. 27, 475-486 (2000).
- Taber-Pierce, E. Histogenesis of the nuclei griseum ponitis, corporis pontobulbaris and reticularis tegmenti pontis (bechterew) in mouse. J. Comp. Neurol. 126, 219-240 (1966).
- Dipietrantonio, H. J., Dymecki, S. M. Zic1 levels regulate mossy fiber neuron position and axon laterality choice in the ventral brain stem. Neuroscience. 162, 560-573 (2009).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155-162 (2002).
- Taniguchi, H., Kawauchi, D., Nishida, K., Murakami, F. Classic cadherins regulate tangential migration of precerebellar neurons in the caudal hindbrain. Development (Cambridge, England). 133, 1923-1931 (2006).
- Kawauchi, D., Taniguchi, H., Watanabe, H., Saito, T., Murakami, F. Direct visualization of nucleogenesis by precerebellar neurons: involvement of ventricle-directed, radial fibre-associated migration. Development (Cambridge, England). 133, 1113-1123 (2006).
- Okada, T., Keino-Masu, K., Masu, M. Migration and nucleogenesis of mouse precerebellar neurons visualized by in utero electroporation of a green fluorescent protein gene. Neuroscience research. 57, 40-49 (2007).
- de Diego, I., Kyriakopoulou, K., Karagogeos, D., Wassef, M. Multiple influences on the migration of precerebellar neurons in the caudal medulla. Development (Cambridge, England). 129, 297-306 (2002).
- Landsberg, R. L. Hindbrain rhombic lip is comprised of discrete progenitor cell populations allocated by Pax6. Neuron. 48, 933-947 (2005).
- Hoshino, M. Ptf1a, a bHLH transcriptional gene, defines GABAergic neuronal fates in cerebellum. Neuron. 47, 201-213 (2005).
- Yamada, M. Origin of climbing fiber neurons and their developmental dependence on. Ptf1a. J. Neurosci. 27, 10924-10934 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。