Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In-vitro-Elektroporation von der Unteren Rhombischer Lip von der Schwangerschaft ab muriner Embryonen
In diesem Artikel
Zusammenfassung
Diese Studie beschreibt die Entwicklung eines In-vitro- Elektroporation Technik, die für die Manipulation der Genexpression in der unteren rhombischen Lippe Schwangerschaft ab Embryonen erlaubt.
Zusammenfassung
Das rautenförmige Lippe ist eine embryonale Neuroepithels im Rautenhirn an der Verbindungsstelle zwischen dem Rohr und dem neuronalen roofplate des vierten Ventrikels (Übersicht in 1) angeordnet ist. Die rhombischen Lippe in den oberen rhombischen Lippe (URL), die Rhombomer 1 (R1) umfasst und erzeugt Neuronen des Kleinhirns und des unteren rhombischen Lippe (LRL), die Anlass zu vielfältigen neuronalen Hirnstamm Linien 2-4 unterteilt werden. LRL Derivate umfassen die auditorischen Neuronen des Cochlea-Kerne und die der precerebellar Kerne, die bei der Regulierung der Balance und motorische Kontrolle 8.5 beteiligt sind. Neurogenese aus dem LRL tritt über eine große zeitliche Fenster, das embryonalen Tag (E) 9,5 bis 16,5 5, 9 umfasst. Unterschiedliche neuronale Linien ergeben sich aus der LRL als postmitotischen Zellen (oder geboren sind) während der verschiedenen Entwicklungs-Tag während dieser neurogenen Fenster.
Elektroporation von Genexpression Konstrukte können verwendet werdenManipulation der Genexpression in LRL Vorläuferzellen und kann potentiell verändern das Schicksal der Neuronen aus dieser Region von 10 bis 12 produziert. Veränderung der Genexpression von LRL Vorläuferzellen der Maus über die in utero Elektroporation ist sehr erfolgreich für die Manipulation von Linien an embryonalen Tag E12.5 oder später 10, 12-14 geboren. In utero Elektroporationen vor E12.5 erfolglos waren in erster Linie auf die Letalität mit Punktion des vierten Ventrikels roofplate, ein notwendiger Schritt bei der Bereitstellung von exogenen DNA, die in die LRL elektroporiert assoziiert ist. Allerdings ergeben sich viele LRL abgeleitet Abstammungslinien von der LRL früher als E12.5 9. Diese früher geboren Linien sind die Neuronen, die den lateralen retikulären umfassen, externe keilig, und olivaris inferior Kerne der precerebellar System, das auf Eingaben aus dem Rückenmark und Cortex zum Kleinhirn 5 verbinden funktionieren. Um zu manipulieren Expression in der LRLvon Embryonen jünger als E12.5, entwickelten wir ein in vitro System, in dem Embryonen in Kultur nach Elektroporation platziert werden.
Diese Studie stellt eine effiziente und effektive Methode zur Manipulation der Genexpression von LRL Vorläuferzellen bei E11.5. Embryonen mit dem grün fluoreszierenden Protein (GFP) aus der aktiven weitgehend CAG-Promotor gesteuert elektroporiert reproduzierbar GFP exprimierten nach 24 Stunden Kultur. Ein kritischer Aspekt dieses Assays ist, dass die Genexpression wird nur wegen der Expression des exogenen Gens und nicht wegen Nebenwirkungen verändert, die durch die Elektroporation und Kulturverfahren. Es wurde festgestellt, dass das endogene Gen-Expressionsmuster ungestört bleiben in elektroporierte und kultivierten Embryonen. Dieser Test kann verwendet werden, um das Schicksal von Zellen, die aus dem LRL von Embryonen jünger als E12.5 durch die Einführung von Plasmiden zur Überexpression zu verändern oder knock down (durch RNAi) werden von verschiedenen pro-neuronalen Transkriptionsfaktoren.
Protokoll
1. Zubereitungen vor der Elektroporation
- Amplify die DNA für die Elektroporation von einem Maxi Prep (Prime-It oder Qiagen). Die Konzentration der DNA sollte mindestens 1 mg / ml für eine effiziente Aufnahme sein.
- Nehmen Sie 495 ul von DNA und mischen mit 5 ul von 0,01% Fast Green in 1 X PBS (phosphate buffered saline) in einem Mikrozentrifugenröhrchen.
2. Embryonale Ernte
- Stellen Sie zeitlich Paarungen von CD-1 Mäuse (Harlan). Prüfen auf das Vorhandensein von vaginalen Stecker und betrachten Sie das Datum ein Vaginalpfropf wie embryonale Tag (E) 0,5 eingehalten wird. Die Embryonen werden 11 Tage nach Visualisierung Stecker (E11.5) geerntet werden.
- Platzieren Sie sterilisierten Instrumente in 70% Ethanol. Behandeln eines Laminarbox mit UV-Licht für mindestens eine Stunde vor der Verwendung. Sprayhood, Sezieren Fach, und Binokular mit 70% Ethanol. Vorheizen 1 X PBS auf 37 ° C
- Am E11.5 einschläfern das Weibchen entsprechend den Bedingungen der vom Institut genehmigtionalen Ausschuss für die Pflege und Nutzung von Tieren (ICCUA). Platzieren Sie sezieren Tablett in der Sterilbank. Sprühen Sie den Bauch des Weibchens mit 70% Ethanol.
- Öffnen Sie die Bauchhöhle und Pin die Wände zum Sezieren Fach. Ziehen Sie die Uterushörner so dass diese innerhalb der Bauchhöhle liegt.
- Schneiden Sie vorsichtig öffnen Sie die Wand der Gebärmutter-Horn. Verwenden Sie eine 20 mm Löffel (Fine Scientific Tools) zur schonenden Entfernung der Embryo im Dottersack weg von der Plazenta. Ort Embryonen in einen 100 mm Gewebe-Kulturschale mit 10 ml sterilem 1 x PBS, die in 2,2 vorgewärmt wurde vorgefüllt.
- Wiederholen Sie für alle Embryonen vorhanden.
3. Elektroporation von E11.5 Embryonen (1)
- Mit Hilfe eines 20 mm Löffel, übertragen Sie den ersten Embryo auf eine neue 100 mm-Schale mit 10 ml sterilem 1XPBS, die auf 37 vorgeheizt war vorgefüllt ° C.
- Verwenden einer Pinzette 11 cm mit einer 0,05 x 0,02 mm Spitze (Fine Scientific Tools), um ihn wieder vorsichtigbewegen und entsorgen Sie den Dottersack.
- Position Embryo, so dass seine dorsale Seite nach oben zeigt, so dass es die Karikatur in 1A ähnelt. Verwenden 7 mm Elektrode Paddel (Harvard Apparatus) vorsichtig halten den Embryo. Die Elektroden werden auf jeder Seite des Neuralrohrs auf der Ebene des Rautenhirns vierten Ventrikels positioniert werden. Die Kammer ist mit bloßem Auge, sondern unter Verwendung eines Dissektionsmikroskop kann eine genaue Paddel Anordnung zu erleichtern. Positionierung der Paddles ist entscheidend für die Bestimmung der Region, die die DNA elektroporierten empfängt. Wenn die untere Lippe rhombischen (LRL) des dorsalen embryonalen Hinterhirn gewünscht wird, muss Paddel Platz, so dass sie direkt flankieren den breitesten Teil des vierten Ventrikels Öffnung sein.
- Benutzen Sie einen 1-ml-Spritze für die Erarbeitung der Plasmid-DNA mit 0,01% Fast Green gemischt. 500 ul der Mischung sollte ausreichend sein für die Elektroporation von mindestens 8-10 Embryonen (siehe 3.5).
- Sanft Punktion der roofplate overlying den vierten Ventrikel mit einer 25G 08.05 Tuberkulin-Nadel an der 1 cc Spritze aufgezogen und das DNA-Farbstoff-Mischung in die Herzkammer. Erfolgreiche Injektionen werden durch die DNA-Farbstoffmischung Füllen des gesamten Ventrikelsystem (1C) aufweist. Die Menge an DNA-Farbstoffmischung üblicherweise injiziert weniger als 50 ul. Genaue Mengen sind variabel zwischen Embryonen als ein Teil der Mischung entweichen kann, der Herzkammer in die PBS den Embryo umgibt. Eine alternative Möglichkeit der Abgabe der DNA-Farbstoff-Gemisch würde durch den Zugriff auf das Ventrikelsystem durch Punktion des Velum über dem Mittelhirn sein. Wiederum sind erfolgreiche Injektionen durch die DNA-Farbstoffmischung Füllen des gesamten ventrikulären Systems gekennzeichnet sind.
- Deliver fünf Rechteckimpulse mit einem elektrischen Impulsgeber (BTX) und 7 mm Elektrode Paddel. Jeder Impuls ist 50 V dauerhaft 5 ms pro Puls mit 500 ms zwischen jedem Impuls. Das Gewebe am nächsten zu dem positiv geladenen Elektrode wird dann take bis das Plasmid.
4. Kultur von Embryonen
- In einer Laminarbox füllen die äußeren Vertiefungen einer 12-Well-Kulturschale mit 2 ml DMEM/F12-Medien mit 10% fötalem Rinderserum, 5% Pferdeserum, 1% Glutamin, 1% Penicillin / Streptomycin ergänzt wurde vorerhitzt, die auf 37 ° C Die Kulturbedingungen wurden von de Diego und Kollegen angepasst. 15
- In Laminarströmungshaube Prise Embryonen bei Mittelteil (unterhalb des Herzens) mit einer Pinzette entfernen und hinteren Teil des Embryos. Platzieren der vordere Teil in eine der gefüllten Vertiefungen der 12-Well-Kulturschale.
- Wiederholen Sie für alle Embryonen. Füllen nur die äußeren Vertiefungen der Platte mit 12 Vertiefungen, um eine Kontamination der Kulturen zu vermeiden.
- Kultur Embryonen in einem 37 ° C Inkubator mit 5% CO 2. Die Expression des elektroporierte Plasmid sollte innerhalb von 24 Stunden zu beobachten sein.
- Sollten mehr Kultur Zeiten gewünscht werden, füllen die aus Vertiefungen einer neuen 12-Well-Platte mit 2 mldie Medien in 4.1 verwendet. Mit einem sterilisierten Löffel übertragen die Embryonen zu einem Brunnen in der neuen Platte. Platzieren Sie zurück in die 37 ° C Inkubator. Kultur für bis zu 48 Stunden möglich ist.
- Wenn die gewünschte Kultur Zeitpunkt erreicht ist, fixieren Embryonen für die Analyse (siehe unten).
5. Vorbereitung von Embryonen für die Analyse
- Spülen Embryonen in 1 × PBS bei 4 ° C für fünf Minuten. Wiederholen.
- Befestigen Embryonen zur Analyse in 2% Paraformaldehyd (PFA) in 1XPBS für 2 Stunden bei 4 ° C
- Spülen Embryonen in 1 × PBS bei 4 ° C für fünf Minuten. Wiederholen.
- Äquilibrieren Embryonen in 30% Saccharose in 1 × PBS über Nacht bei 4 ° C
- Einbetten Embryonen in optimaler Temperatur Cutting (OCT) Verbindung mit einem Trockeneis / Ethanol-Bad. Embryonen können bei -20 ° C gelagert werden
- § Embryonen auf einem Kryostat (Leica) in 30 um Abschnitte und montieren auf Objektträgern (VWR, Superfrost Plus). Lagerung bei -20 ° C.
6. Immunohistochemistry Analyse
- Die Immunhistochemie wurde durchgeführt, wie in 16 beschrieben. Primäre Antikörper-Verdünnungen für diese Studie verwendet werden, gehören Kaninchen α-GFP (Invitrogen) 1:2500; Maus α-Mash1 (BD Biosciences) 1:100; Kaninchen α-Ngn1 (Jane Johnson) 1:5000; Kaninchen α-Ptf1a (Jane Johnson ) 1:2500; Kaninchen-Math1 (Jane Johnson) 1:100. Inkubieren Dia flach, Probe nach oben auf eine Färbegestell bei 4 ° C über Nacht.
- Die Objektträger wurden auf einem zusammengesetzten Mikroskop (Olympus BX51) analysiert.
7. Repräsentative Ergebnisse
Eine schematische in 1A zeigt die Elektroporation Experiment. 1B zeigt eine sagittale Ansicht eines E11.5 Embryos vor der Manipulation. Derselbe Embryo nach der Injektion des Plasmids, welches CAG :: GFP in 0,01% Fast Green ist in 1C und einem Vertreter unfixierten Embryo aufweist einseitige GFP gezeigtExpression in der dorsalen Rautenhirn 24 Stunden folgende Kultur wird in 1D gezeigt. Das Ausmaß der Fläche der LRL, die erfolgreich elektroporiert wird, ist variabel und wird eine starke Abhängigkeit von der Positionierung der Elektroden. In unseren Studien wurde festgestellt, dass 52 von 65 (80%) der elektroporierte Embryonen erfolgreich exprimierten GFP. Das Gewebe wurde als erfolgreich elektroporiert werden, wenn sie positiv für GFP in räumlich begrenzten Bereichen über mehrere Abschnitte war nach Fixierung und immunhistochemische Analyse (siehe unten). Embryonen, die diese Kriterien erfüllen konnten, wurden als erfolglose Elektroporation erzielt.
Eine weitere Beurteilung Elektroporationseffizienz ermittelt werden kann, indem Immunhistochemie gegen GFP auf Querschnitten der elektroporierten Embryonen auf der Ebene des vierten Ventrikels. 2 zeigt repräsentative serielle Schnitte von einem Embryo Anzeigen einseitigeGFP-Expression. 2A zeigt eine schematische Darstellung, die idealisierten, dass die linke Seite des Embryos in Richtung der positiven Elektrode betrug veranschaulicht. Querschnitte (in Konzentrationen von der Mitte cartoons von 2A dargestellt) zeigen lokalisierten GFP-Expression ausschließlich auf der linken Seite des Rautenhirns Gewebe (2C und 2D). Das elektroporierte Bereich der LRL nicht verlängern die gesamte anterior-posterioren Achse des Neuralrohrs als Untersuchung von Schnitten 300 um rostralen oder mehr zu, dass in 2C gezeigt nicht ausdrücklich GFP (Abbildung 2B).
Die Nützlichkeit dieser Methode für Manipulation der Genexpression ist abhängig von der Stabilität der Expression Domänen für die endogene Proteine. Die LRL als Vorläuferzellen, die einzigartige Domänen, die unterschiedliche Expression von proneurale Transkriptionsfaktoren (Übersicht in 1) dadurch gekennzeichnet.Ein Teil dieser Faktoren (Mash1, Math1, Ngn1 und Ptf1a) wurden für die Analyse aufgrund ihrer geplanten und / oder gekennzeichnet Rollen in der Spezifikation der neuronalen Subtypen precerebellar in der LRL, ein Thema weiterer Studien 16-18 gewählt. Alle vier Proteine haben sehr charakteristischen Ausdruck Domains im kaudalen Hirnstamm bei E11.5 16-18. Wir beobachteten, dass Embryonen, die Kulturen gelegt wurden, um an Größe zu und scheiterte ebenfalls keine Produktion von Epithel des Plexus choroideus und Invagination der LRL und roofplate, morphologischen Ereignisse, die zwischen E11.5 und E12.5 5 auftreten zu initiieren. Basierend auf diesen Beobachtungen wurde festgestellt, dass eine normale Entwicklung in diesen Embryonen gestoppt wurde oder grob verzögert und die vergleichbare Regelung für den kultivierten Embryonen sollten unkultivierten Embryonen bei E11.5 sein.
Um sicherzustellen, dass Kultur und Elektroporation nicht stören Konzentrationen endogener Proteine, analysierten wir vier verschiedene Proteine, die von immunohistochemistry (IHC) in 34 verschiedenen Embryonen, die Elektroporation und wurden dann kultiviert für mindestens 24 Stunden. Tabelle I zeigt die Anzahl der Embryonen für jeden Marker und der prozentuale Anteil der Embryonen analysiert, dass beibehalten normalen Protein-Spiegel. Abbildung 3 zeigt repräsentative Daten IHC analysiert von zwei der Proteine analysiert, Mash1 (3A und 3B) und Math1 (3C und 3D). Wir beobachteten, dass die Mehrheit der Embryonen ein normales Niveau der Expression nach der Elektroporation und die Kultur (3B und 3D) gehalten zu den Kontrolltieren Embryonen E11.5 (3A und 3C) verglichen. Wichtig ist, wurden die charakteristischen Ausdruck Domänen dieser Proteine nicht gestört.
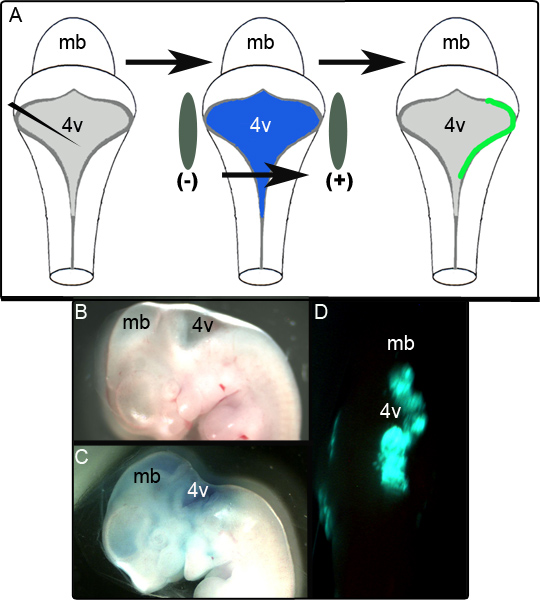
Abbildung 1. Elektroporation von Embryonen bei E11.5. (A) Schematische Darstellung the Elektroporation Experiment. Ein E11.5 Embryo isoliert und das Expressionsplasmid in 0,01% Fast Green in den vierten Ventrikel injiziert. Der Embryo wird dann durch die Elektrode Schaufeln flankiert und einer 50 V-Impuls, bevor sie in Kultur (B) Sagittal Ansicht eines E11.5 Embryos vor der Injektion angeordnet. (C) Das gleiche E11.5 Embryos nach der Injektion von Plasmid in 0,01% Fast Green. (D) Einseitige Hinterhirn Expression von GFP beobachtet in E11.5 Embryo nach 24 Stunden der Kultur. mb-Mittelhirn; 4V-vierten Ventrikels.
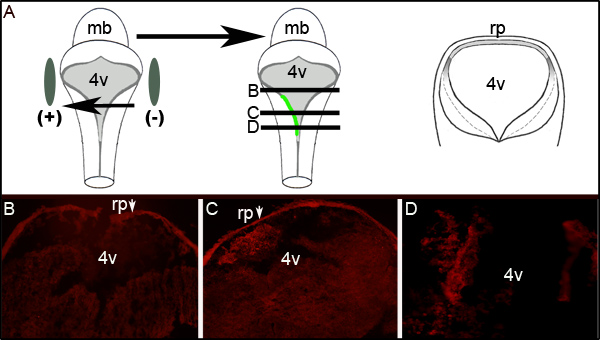
Abbildung 2. Die Expression von GFP in elektroporiertem Tissue. (A) Die Karikatur auf der linken Seite zeigt die Platzierung der Elektroden um einen E11.5 Embryos. Mittlerer cartoons zeigt Aufnahme und Expression von GFP-codierende Plasmid auf der linken Seite des Embryos. Cartoon auf der rechten Seite ist schematisch von einer idealisierten Querschnitt durch den Embryo in l genommenevels bezeichnet mit schwarzen Linien in der Mitte Karikatur. (B-D) Immunhistochemie für GFP auf Querschnitten durch eine elektroporierte E11.5 Embryo nach 24 Stunden Kultur. Die Pfeile zeigen die roofplate (RP), hält den sekundären Antikörper. Die Bilder werden mit 10facher Vergrößerung. Die relativen Werte der Abschnitte dargestellt sind durch die horizontalen Linien in der Mitte Karton in (A) dargestellt. mb-Mittelhirn; l 4V-vierten Ventrikels; rp-roofplate.
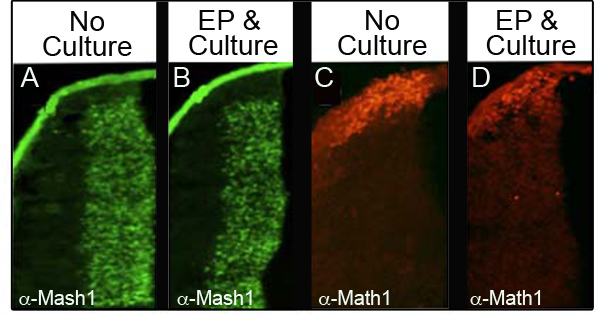
Abbildung 3. Die Expression von endogenen Proteinen in der unteren Lippe rhombische Immunhistochemie für Mash1 (A und B) oder Math1 (C und D) Vergleichen Querschnitte E11.5 Embryonen, die nicht kultiviert (A, C) mit Embryonen, die mit CAG elektroporiert wurden.: : GFP und für 24 h (B und D). Bilder mit 10facher Vergrößerung.
| Proneurale TranscriptiFactor auf Analysierte | Anzahl der Embryonen Analysierte | Prozentsatz Beibehaltung normaler Expression Patterns |
| Math1 | 15 | 86,7% |
| Mash1 | 12 | 83,3% |
| Ngn1 | 7 | 71,4% |
| Ptf1a | 6 | 100% |
Tabelle I. Anteil der elektroporiert und kultivierten Embryonen Zurückhalten der proneurale Transkriptionsfaktors Domains in der LRL.
Diskussion
Die In-vitro-Elektroporation Technik in dieser Studie vorgestellt ist eine neuartige Methodik, die effizient genutzt werden können, um die Genexpression in Embryonen zu manipulieren jünger als 12 Tagen der Trächtigkeit. Die Platzierung der Embryonen in Kultur erlaubt die Expression des eingeführten Gens und umgeht die Letalität beobachtet, wenn elektroporierten Embryonen erlaubt, in vivo bleibt. Diese Technik erlaubt die Manipulation der Genexpression in der embryonalen Vorläufer, die bisher nich...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren bedanken sich bei Jane Johnson für die Math1, Ngn1 danken und Ptf1a Antikörpern und Connie Cepko für die pCAG :: GFP-Plasmid. Diese Arbeit wurde vom NIH R15 1R15HD059922-01 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| Kryostat | Leica | CM-1850 | |
| Biologie Spitze Dumoxel behandelt DUMONT Pinzetten | Feine Wissenschaftliche Werkzeuge | 11252-30 | |
| 20 mm MORIA Schaumlöffel | Feine Wissenschaftliche Werkzeuge | 10370-17 | |
| ECM 830 Square Wave Generator Elektroporation | BTX (VWR) | 47745-928 | |
| Harvard Apparatus 7 mm * Elektroden Tweezertrodes | BTX (Fisher) | BTX450165 | |
| Fisher Isotemp CO 2-Inkubator | Fischer | 1325525 | |
| NAPCO CO 2-Gas Regulator | Fischer | 15497020 | |
| 12 well-Zellkulturplatten | BD Falcon (Fisher) | 877229 | |
| HyClone Liquid Media DMEM/F-12 (1:1); mit L-Glutamin und HEPES; 500mL | Thermo Scientific (Fisher) | SH3002301 | |
| HyClone * Donor Pferdeserum | Thermo Scientific (Fisher) | SH3007402 | |
| Rinderfötenserum, Qualifizierte, hitzeinaktiviertem | Invitrogen | 16140-063 | |
| CellGro * 10.000 IE Penicillin, 10.000 ug / ml Streptomycin | Mediatech (Fisher) | MT-30-002-CI | |
| HyClone * L-Glutamin L-Glutamin, 200 mM in 0,85% NaCl | Thermo Scientific (Fisher) | SH3003401 | |
| Fast-Grün | Fischer | AC41053-0250 | 0,01% |
Referenzen
- Ray, R. S., Dymecki, S. M. Rautenlippe Redux -- toward a unified view of the precerebellar rhombic lip. Current opinion in cell biology. 21, 741-747 (2009).
- Machold, R., Fishell, G. Math1 is expressed in temporally discrete pools of cerebellar rhombic-lip neural progenitors. Neuron. 48, 17-24 (2005).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Wingate, R. J., Hatten, M. E. The role of the rhombic lip in avian cerebellum development. Development (Cambridge, England). 126, 4395-4404 (1999).
- Altman, J., Bayer, S. A. . Development of Cerebellar System: In relation to its evolution, structure, and function. , (1997).
- Farago, A. F., Awatramani, R. B., Dymecki, S. M. Assembly of the brainstem cochlear nuclear complex is revealed by intersectional and subtractive genetic fate maps. Neuron. 50, 205-218 (2006).
- Wang, V. Y., Rose, M. F., Zoghbi, H. Y. Math1 expression redefines the rhombic lip derivatives and reveals novel lineages within the brainstem and cerebellum. Neuron. 48, 31-43 (2005).
- Rodriguez, C. I., Dymecki, S. M. Origin of the precerebellar system. Neuron. 27, 475-486 (2000).
- Taber-Pierce, E. Histogenesis of the nuclei griseum ponitis, corporis pontobulbaris and reticularis tegmenti pontis (bechterew) in mouse. J. Comp. Neurol. 126, 219-240 (1966).
- Dipietrantonio, H. J., Dymecki, S. M. Zic1 levels regulate mossy fiber neuron position and axon laterality choice in the ventral brain stem. Neuroscience. 162, 560-573 (2009).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155-162 (2002).
- Taniguchi, H., Kawauchi, D., Nishida, K., Murakami, F. Classic cadherins regulate tangential migration of precerebellar neurons in the caudal hindbrain. Development (Cambridge, England). 133, 1923-1931 (2006).
- Kawauchi, D., Taniguchi, H., Watanabe, H., Saito, T., Murakami, F. Direct visualization of nucleogenesis by precerebellar neurons: involvement of ventricle-directed, radial fibre-associated migration. Development (Cambridge, England). 133, 1113-1123 (2006).
- Okada, T., Keino-Masu, K., Masu, M. Migration and nucleogenesis of mouse precerebellar neurons visualized by in utero electroporation of a green fluorescent protein gene. Neuroscience research. 57, 40-49 (2007).
- de Diego, I., Kyriakopoulou, K., Karagogeos, D., Wassef, M. Multiple influences on the migration of precerebellar neurons in the caudal medulla. Development (Cambridge, England). 129, 297-306 (2002).
- Landsberg, R. L. Hindbrain rhombic lip is comprised of discrete progenitor cell populations allocated by Pax6. Neuron. 48, 933-947 (2005).
- Hoshino, M. Ptf1a, a bHLH transcriptional gene, defines GABAergic neuronal fates in cerebellum. Neuron. 47, 201-213 (2005).
- Yamada, M. Origin of climbing fiber neurons and their developmental dependence on. Ptf1a. J. Neurosci. 27, 10924-10934 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten