このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
妊娠中期のマウス胚の低菱形リップの in vitroエレクトロポレーションで
要約
本研究では開発について説明します。 in vitroでエレクトロポレーション技術。
要約
菱形の唇は神経管と第四脳室(1日)のroofplate間の接合部における後脳に位置して胚の神経上皮である。菱形リップはrhombomere 1(R1)を包含し、小脳の神経細胞と神経細胞の多様な脳幹系統2-4を生じさせる下菱形リップ(LRL)を生成し、上部菱形リップ(URL)に細分することができます。 LRL誘導体は、聴覚蝸牛神経核の神経細胞のバランスとモータ制御5-8制御に関与しているprecerebellar核のものが含まれています。 LRLから神経新生は、胚日(E)9.5から16.5 5、9を含む大規模な一時的なウィンドウの上に発生します。別の神経系統は、この神経ウィンドウの間に明確な発達日間分裂細胞(または生まれている)のようなLRLから出てくる。
遺伝子発現コンストラクトのエレクトロポレーションに使用することができLRL前駆細胞における遺伝子発現を操作し、潜在的にこの地域の10月12日から生産ニューロンの運命を変更することができます。胎生12.5日以降10日12月14日に生まれた系統を操作するための非常に成功しました。 子宮内エレクトロポで前のE12.5に子宮内エレクトロポレーションで経由してマウスのLRL前駆細胞の遺伝子発現を変更すると、ために主に成功していない致死率は、第四脳室のroofplate、LRLにエレクトロされている外因性DNAを提供する上で必要なステップを穿刺に関連付けられています。しかし、多くのLRL派生した系統は、以前のE12.5 9よりLRLから生じる。これらの以前の生まれの系統は横網を構成するニューロンは、外部楔状束、小脳5に脊髄および大脳皮質からの入力を接続する機能precerebellarシステムの下オリーブ核が含まれています。 LRLの式を操作するためにE12.5未満の胚から、我々は、胚をエレクトロポレーション後に文化に置かれているのin vitroシステムを開発しました。
本研究では、E11.5でLRL前駆細胞の遺伝子発現を操作するための効率的かつ効果的な手法を提案する。広くアクティブなCAGプロモーターから駆動される緑色蛍光タンパク質(GFP)でエレクトロ胚は、再現性の文化の24時間後にGFPを発現した。このアッセイの重要な側面だけのため外来遺伝子の発現しないため、エレクトロポレーションおよび培養技術から、その結果二次的効果の変更されている遺伝子発現されています。それは、内在性遺伝子の発現パターンがエレクトロポレーションおよび培養胚で邪魔されずに残っていることが判明した。このアッセイは、過剰発現用プラスミドの導入によりE12.5より若い胚のLRLから出てきた細胞の運命を変更したり、の(RNAiを介して)をノックダウンするために利用することができる別のプロ神経転写因子。
プロトコル
1。エレクトロポレーションに先立って準備
- マキシプレップ(内閣総理 - それまたはキアゲン)でエレクトロポレーションのためのDNAを増幅する。 DNAの濃度は、効率的な取り込みは1 mg / mLの最小値である必要があります。
- マイクロ遠心チューブに1×PBS(リン酸緩衝生理食塩水)で0.01%ファストグリーンの5μlでDNAとミックスの495μLを削除します。
2。胚の収穫
- CD-1マウス(Harlan)のタイムアウト交配を確立します。膣栓の有無をチェックして、膣栓が胚日(E)0.5として観察された日付を考えています。胚は11日プラグ(E11.5)を可視化した後に収穫されます。
- 70%エタノールで滅菌のツールを配置します。使用前に少なくとも1時間UV光で層流フードを扱う。スプレーフード、トレイを解剖し、70%エタノールで範囲を解剖。 37予熱1 X PBS℃で
- E11.5に研究所によって承認された条件に従ってメスを安楽死させる動物のケアと使用(ICCUA)のional委員会。層流フードの解剖トレイを置きます。 70%エタノールで女性の腹部を下にスプレーします。
- 腹腔を開き、解剖トレイに壁をピン。それが腹腔内にかかっているように子宮角を引き出します。
- 慎重に子宮角の壁を切り開く。静かに胎盤から卵黄嚢の胚を削除するには、20ミリメートルのスプーン(ファイン科学ツール)を使用します。 2.2で予熱された滅菌1×PBS 10 mLであらかじめ入力さ100mmの組織培養皿に場所が胚。
- 存在するすべての胚に対して、この手順を繰り返します。
3。 E11.5胚のエレクトロポレーション( 図1)
- 20 mmのスプーンを使用して、37に予熱された滅菌1XPBS 10mLの℃であらかじめ入力さ新しい100 mmディッシュに最初の胚を転送する
- 慎重に再0.05×0.02ミリメートルのチップ(ファイン科学ツール)で11 cmの鉗子を使用します。卵黄嚢に移動し、破棄します。
- 位置胚ので、その背側は図1Aの漫画に似ているので、上を向いていること。静かに胚を保持するために7 mmの電極パドル(ハーバード装置)を使用します。電極は、後脳第四脳室レベルでの神経管の両側に配置する必要があります。心室は肉眼では見えていますが、解剖顕微鏡を使用して正確なパドルの配置を容易にすることができます。パドルの位置決めは、エレクトロポレーション、DNAを受け取る領域を決定することが重要です。背側の胚後脳の下の菱形リップ(LRL)が必要な場合は、パドルは、彼らが直接に第四脳室の開口部の広い部分に隣接していることをそのような場所でなければなりません。
- 0.01パーセントの高速グリーンと混合したプラスミドDNAを描画する1ccのシリンジを使用しています。混合物の500μLには、少なくとも8月10日胚(3.5を参照)エレクトロポレーションのために十分でなければなりません。
- そっと穿刺roofplate OV1ccの注射器に接続されている25G 5月8日ツベルクリン針で第四脳室をerlyingと心室にDNA-染料混合物を注入します。成功した注射は、全体の心室システム( 図1C)を充填DNA-染料の混合物によって特徴付けられる。一般的に注入されたDNA-色素混合物の量は50μL未満です。混合物の一部が胚を囲むPBS中に心室から漏れる傾向にあるように正確な金額は、胚の間で可変です。 DNA-色素混合物を提供する代替手段は、脳を覆って軟口蓋を穿刺による脳室系へのアクセスであるでしょう。再び、成功した注射は、全体の脳室系を充填DNA-染料の混合物によって特徴付けられる。
- 電気パルスジェネレータ(BTX)および7 mmの電極パドルを使用して5つの方形波パルスを提供します。各パルスは、各パルスの間に500ミリ秒のパルス当たり50 V持続的な5 msです。正に帯電した電極に最も近い組織が鐸しますプラスミド上のe。
4。胚の培養
- 層流フードでは、10%ウシ胎児血清、5%ウマ血清、1%グルタミン、1%ペニシリン/予熱したストレプトマイシンを補充したDMEM/F12メディア2mLで12ウェル培養皿の外側の井戸を埋める37℃に培養条件は、デ·ディエゴや同僚から適応された15
- ピンセットで中央部(心臓の下)で層流フードのピンチ胚と胚の後方部分を削除します。 12ウェル培養皿の塗りつぶされた井戸の一つに前方部分に配置します。
- すべての胚に対して、この手順を繰り返します。文化の汚染を避けるために12ウェルプレートの外側の井戸を埋める。
- 5%CO 2、37℃インキュベーターで培養胚。エレクトロポレーションプラスミドの発現は24時間以内に観測する必要があります。
- より長い培養時間は、所望されるべき、2mLで新しい12ウェルプレートのうち、井戸を埋める4.1で使用されるメディア。滅菌スプーンで新しいプレートのウェルに胚を転送します。 37℃インキュベーターに戻してください。最大48時間の培養が可能です。
- 希望の培養時間に達したときに、(下記参照)を分析のために胚を固定します。
5。分析のための胚の準備
- 5分間、4℃で1×PBS中で胚を洗浄します。繰り返します。
- 4℃で2時間1XPBSで2%パラホルムアルデヒドの分析(PFA)のために胚を修正しました。
- 5分間、4℃で1×PBS中で胚を洗浄します。繰り返します。
- 4℃で一晩1 X PBS中30%スクロース中で胚を平衡℃に
- ドライアイス/エタノール浴を用いて最適な切削温度(OCT)化合物の胚を埋め込むことができます。胚は-20℃で保存することができます
- 30μm以下のセクションにクリオスタット(ライカ)と(VWR、Superfrostプラス)スライド上にマウントするのセクションの胚。 -20℃で保存
6。 IMMUnohistochemistry分析
- 16で説明したように免疫組織化学を行った。マウスα-MASH1(BD Biosciences)で1:100;ウサギα-Ngn1(ジェーン·ジョンソン)1:5000、ウサギα-Ptf1a(ジェーン·ジョンソンこの研究に用いた一次抗体希釈液は、ウサギα-GFP(Invitrogen社製)1:2500を含む)1:2500、ウサギ、Math1の(ジェーン·ジョンソン)1:100。 4℃で一晩染色トレイにスライドを平らな、試料面を上にしてインキュベートします。
- スライドは、複合顕微鏡(Olympus BX51)で分析した。
7。代表的な結果
図1Aに模式的エレクトロポレーション実験を示しています。 図1Bは、操作の前にE11.5胚の矢状図を示します。プラスミドを含むCAGの注入後、同じ胚:: GFP 0.01%ファストグリーンは、 図1Cと一方的なGFPを示す代表的な不定胚に示されている背後脳24時間以下の培養での発現は、 図1Dに示されています。成功したエレクトロポレーションされてLRLの領域の範囲は可変であり、電極の位置に大きく依存するように見える。我々の研究では、エレクトロポレーション胚の65(80%)の52アウトに成功し、GFPを発現していることが判明した。それが(下記参照)の固定および免疫組織化学的分析は、次のいくつかのセクションに比べて局所領域におけるGFP陽性であった場合は、組織が正常にエレクトロポレーションされたものとみなされました。この基準を満たしていなかった胚は、エレクトロポレーションに失敗した試行と評価した。
エレクトロポレーション効率のさらなる評価は、第四脳室レベルでのエレクトロポレーションの胚の横断切片にGFPに対する免疫組織化学を行うことによって確かめることができる。 図2は、一方的な表示胚から代表的な連続切片GFP発現。 図2Aは、胚の左側には正極に向かったことを示しています理想的な回路図を示します。横断切片( 図2Aの中央漫画で表さレベル)排他的に後脳組織( 図2Cおよび2D)の左側にローカライズされたGFPの発現を明らかにした。 図2Cに示すように300μmの吻側以上のセクションの試験はGFPを発現する( 図2B)をしないようLRLのエレクトロポレーション領域は、神経管の全体の前後軸を延長するものではありませんでした。
遺伝子発現の操作のためのこのアッセイの有用性は、内在性タンパク質の発現ドメインの安定性に依存しています。 LRLは、プロニューラル転写因子の差動式(1日)によって特徴づけられるユニークな前駆ドメインを有するとして特徴づけされています。これらの要因のサブセット(MASH1、Math1の、Ngn1と、Ptf1a)は、LRL、今後の研究16から18のテーマでprecerebellar神経サブタイプの仕様では彼らの提案、および/ または特徴の役割のために分析のために選ばれました。すべての4つのタンパク質は、E11.5で16から18尾後脳に非常に特徴的な発現ドメインを持っています。我々は文化を置かれた胚のサイズが増加するのに失敗し、また脈絡叢上皮とLRLとE11.5とE12.5 5の間に発生するroofplate、形態学的イベントの陥入の生産を開始するために失敗したことを観察した。これらの観察結果に基づいて、これらの胚の正常な発達が停止または著しく遅延し、培養胚に匹敵するコントロールが、E11.5で教養のない胚でなければなりませんされていることを決定した。
文化やエレクトロポレーションは、内因性タンパク質のレベルを乱さないことを確認するために、我々はimmunohistochによって4つの異なるタンパク質を分析した私は、各マーカーの分析を行った胚の数を示しており、胚の割合は、通常のタンパク質レベルを保持していることを分析したエレクトロポレーションし、少なくとも24時間。 表の培養した34種類の胚でemistry(IHC)。 図3代表的なIHCデータ分析したタンパク質の2つ、MASH1( 図3Aおよび3B)からとMath1の( 図3Cおよび3D)。我々は、胚の大半はE11.5( 図3Aと3C)での制御の胚に比べて( 図3Bおよび3D)エレクトロポレーションと文化の後の式の正常なレベルを保持していることを観察した。重要なのは、これらのタンパク質の特性発現ドメインは乱されていませんでした。
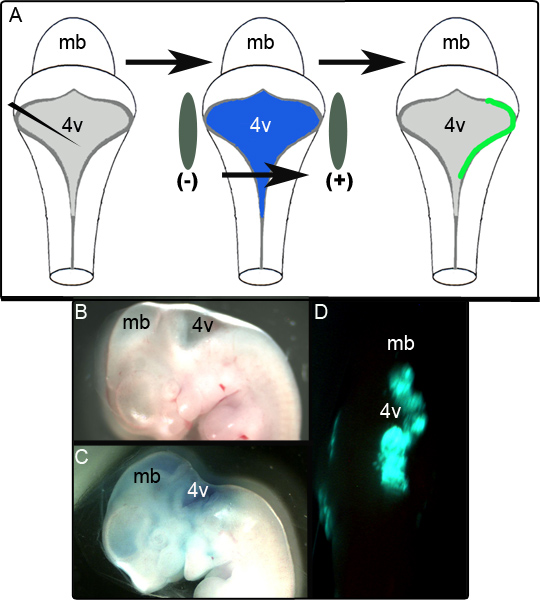
図1。番目のE11.5における胚のエレクトロポレーション(A)の回路図eのエレクトロポレーション実験を行った。 E11.5の胚は、隔離され、0.01%ファストグリーンの発現プラスミドは、第四脳室に注入される。胚は、その後、電極パドルに挟まれたと前の培養液への注入前にE11.5胚の(B)矢のビューを配置されてから50 Vのパルスに供される。 (C)同じE11.5の胚は、0.01%ファストグリーンでのプラスミドの注入を後に。 (D)GFPの片側後脳の発現は、培養24時間後にE11.5胚で観察された。 MB-脳、4V-第四脳室。
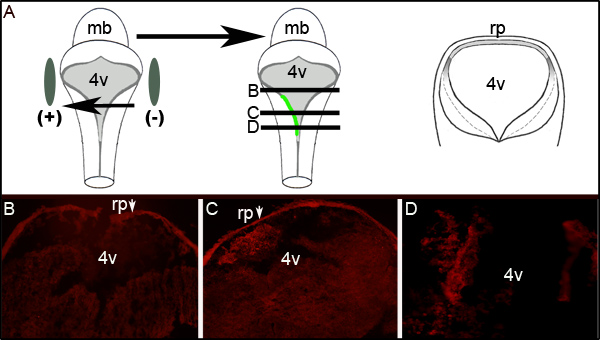
図2。エレクトロポ組織におけるGFPの発現は、(A)左の漫画は、E11.5胚の周りに電極の配置を示しています。中央の漫画は、胚の左側をコードするプラスミドのGFPの取り込みおよび発現を示しています。右側の漫画は、Lで胚を通じて取得された理想的な横断面の模式図です。evelsは、中間漫画で黒い線で表される。文化の24時間後、エレクトロポレーションE11.5の胚を介して横断切片上でGFPの(B-D)免疫組織化学。矢印はroofplate(RP)がトラップを二次抗体を示しています。画像は10倍の倍率で撮影されています。示す各セクションの相対的なレベルは、(A)の真ん中の漫画を通る水平線で描かれています。 MB-脳、L 4V-第四脳室、RP-roofplate。
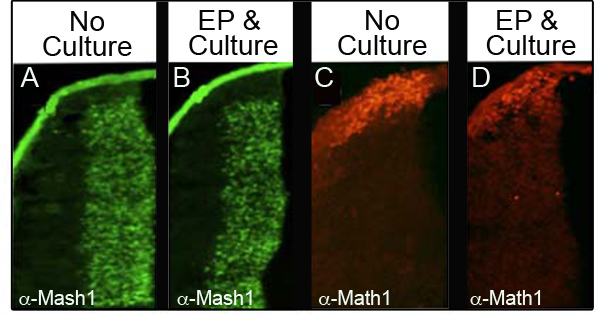
図3。低菱形リップの内 因性タンパク質の発現は CAGとエレクトロポレーションした胚を培養ませんでしたE11.5胚(A、C)の横断面を比較しMASH1(AおよびB)またはMath1の(CおよびD)の免疫組織化学。 :24時間(BとD)のGFPと培養した。画像は10倍の倍率で撮影した。
| プロニューラルTranscriptiファクターで分析 | 胚の数は、分析 | 通常の発現パターンを保持割合 |
| MATH1 | 15 | 86.7パーセント |
| MASH1 | 12 | 83.3パーセント |
| Ngn1 | 7 | 71.4パーセント |
| Ptf1a | 6 | 100パーセント |
LRLでノーマルプロニューラル転写因子ドメインを保持エレクトロポと培養胚の表Iの割合。
ディスカッション
本研究で提示したin vitroエレクトロポレーション技術は、効率的に妊娠12日未満の胚における遺伝子発現を操作するために利用することができる新たな方法論です。文化への胚の配置は、導入遺伝子の発現を可能にし、エレクトロポレーション胚をin vivoで維持する許可されているときに観察致死性を回避します。この手法は、エレクトロポレーションベースの研究のために以前?...
開示事項
利害の衝突が宣言されません。
謝辞
著者らは、Math1の、Ngn1ためにジェーン·ジョンソンに感謝したい、とPtf1a抗体およびpCAGためのコニーCepko :: GFPプラスミドと思います。この作品は、NIH R15 1R15HD059922-01によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(オプション) |
| クライオスタット | ライカ | CM-1850 | |
| Biologie先端Dumoxelはデュモン鉗子を治療 | ファイン科学ツール | 11252から30 | |
| 20ミリメートルMORIA穴あきスプーン | ファイン科学ツール | 10370から17 | |
| ECM 830方形波エレクトロ·ジェネレータ | BTX(VWR) | 47745-928 | |
| ハーバード装置7ミリメートルTweezertrodes *電極 | BTX(フィッシャー) | BTX450165 | |
| フィッシャーIsotemp CO 2インキュベータ | フィッシャー | 1325525 | |
| NAPCO CO 2ガスレギュレータ | フィッシャー | 15497020 | |
| 12ウェル組織培養プレート | BDファルコン(フィッシャー) | 877229 | |
| ハイクローン液体培地DMEM/F-12(1:1)、L-グルタミンおよびHEPESを使って; 500mLに | サーモフィッシャーサイエンティフィック(フィッシャー) | SH3002301 | |
| ハイクローン*ドナーウマ血清 | サーモフィッシャーサイエンティフィック(フィッシャー) | SH3007402 | |
| 不活化ウシ胎児血清、修飾され、熱 | インビトロジェン | 16140-063 | |
| cellgro * 10,000 IUペニシリン、10,000μg/ mLのストレプトマイシン | メディアテック(フィッシャー) | MT-30-002-CI | |
| ハイクローン* L-グルタミンL-グルタミン、200.85%NaClでの0mmの | サーモフィッシャーサイエンティフィック(フィッシャー) | SH3003401 | |
| 高速グリーン | フィッシャー | AC41053-0250 | 0.01パーセント |
参考文献
- Ray, R. S., Dymecki, S. M. Rautenlippe Redux -- toward a unified view of the precerebellar rhombic lip. Current opinion in cell biology. 21, 741-747 (2009).
- Machold, R., Fishell, G. Math1 is expressed in temporally discrete pools of cerebellar rhombic-lip neural progenitors. Neuron. 48, 17-24 (2005).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Wingate, R. J., Hatten, M. E. The role of the rhombic lip in avian cerebellum development. Development (Cambridge, England). 126, 4395-4404 (1999).
- Altman, J., Bayer, S. A. . Development of Cerebellar System: In relation to its evolution, structure, and function. , (1997).
- Farago, A. F., Awatramani, R. B., Dymecki, S. M. Assembly of the brainstem cochlear nuclear complex is revealed by intersectional and subtractive genetic fate maps. Neuron. 50, 205-218 (2006).
- Wang, V. Y., Rose, M. F., Zoghbi, H. Y. Math1 expression redefines the rhombic lip derivatives and reveals novel lineages within the brainstem and cerebellum. Neuron. 48, 31-43 (2005).
- Rodriguez, C. I., Dymecki, S. M. Origin of the precerebellar system. Neuron. 27, 475-486 (2000).
- Taber-Pierce, E. Histogenesis of the nuclei griseum ponitis, corporis pontobulbaris and reticularis tegmenti pontis (bechterew) in mouse. J. Comp. Neurol. 126, 219-240 (1966).
- Dipietrantonio, H. J., Dymecki, S. M. Zic1 levels regulate mossy fiber neuron position and axon laterality choice in the ventral brain stem. Neuroscience. 162, 560-573 (2009).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155-162 (2002).
- Taniguchi, H., Kawauchi, D., Nishida, K., Murakami, F. Classic cadherins regulate tangential migration of precerebellar neurons in the caudal hindbrain. Development (Cambridge, England). 133, 1923-1931 (2006).
- Kawauchi, D., Taniguchi, H., Watanabe, H., Saito, T., Murakami, F. Direct visualization of nucleogenesis by precerebellar neurons: involvement of ventricle-directed, radial fibre-associated migration. Development (Cambridge, England). 133, 1113-1123 (2006).
- Okada, T., Keino-Masu, K., Masu, M. Migration and nucleogenesis of mouse precerebellar neurons visualized by in utero electroporation of a green fluorescent protein gene. Neuroscience research. 57, 40-49 (2007).
- de Diego, I., Kyriakopoulou, K., Karagogeos, D., Wassef, M. Multiple influences on the migration of precerebellar neurons in the caudal medulla. Development (Cambridge, England). 129, 297-306 (2002).
- Landsberg, R. L. Hindbrain rhombic lip is comprised of discrete progenitor cell populations allocated by Pax6. Neuron. 48, 933-947 (2005).
- Hoshino, M. Ptf1a, a bHLH transcriptional gene, defines GABAergic neuronal fates in cerebellum. Neuron. 47, 201-213 (2005).
- Yamada, M. Origin of climbing fiber neurons and their developmental dependence on. Ptf1a. J. Neurosci. 27, 10924-10934 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved