Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
En electroporación in vitro del labio inferior rómbico mitad de la gestación de embriones de ratón
En este artículo
Resumen
Este estudio describe el desarrollo de un In vitro electroporación, que permite la manipulación de la expresión génica en el labio inferior rómbica mitad de la gestación de los embriones.
Resumen
El labio rómbico es un neuroepitelio embrionario localizado en el cerebro posterior en la unión entre el tubo neural y la roofplate del cuarto ventrículo (revisado en 1). El labio rómbico puede subdividirse en el labio superior romboidal (URL), que abarca rhombomere 1 (R1) y genera las neuronas del cerebelo y el labio inferior rómbica (LIF), que da lugar a diversos linajes neuronales del tronco cerebral 2-4. LRL incluyen los derivados de las neuronas auditivas de los núcleos cocleares y los de los núcleos precerebellar que están involucrados en la regulación del equilibrio y el control del motor 5.8. La neurogénesis de la LIF se produce a través de una gran ventana temporal que abarca embrionarias día (E) 9,5 a 16,5 5, 9. Diferentes linajes neuronales emergen de la LIF, como las células posmitóticas (o nacen) durante distintos días de desarrollo durante esta ventana neurogénica.
La electroporación de construcciones de expresión de genes puede ser usado paramanipular la expresión génica en células progenitoras LRL y, potencialmente, puede cambiar el destino de las neuronas que se producen en esta región 10-12. La alteración de la expresión génica de células progenitoras LRL en el ratón mediante electroporación en el útero ha tenido un gran éxito para la manipulación de linajes nacidos en día embrionario E12.5 o 10 más tarde, 12-14. En electroporaciones útero antes de E12.5 no han tenido éxito debido principalmente a la letalidad asociada con la punción de la roofplate cuarto ventrículo, un paso necesario en la entrega de ADN exógeno que se electroporated en el LIF. Sin embargo, muchos linajes LRL derivados se derivan de la LIF anterior a E12.5 9. Estos linajes nacidos a principios incluyen las neuronas que componen el reticular lateral, cuneadas externa, y los núcleos olivar inferior del sistema precerebellar que funcionan para conectar las entradas de la médula espinal y la corteza del cerebelo, 5. Con el fin de manipular la expresión en el LIFde embriones de menos de E12.5, hemos desarrollado un sistema in vitro en el que los embriones se colocan en la cultura después de la electroporación.
Este estudio presenta un método eficiente y eficaz para la manipulación de la expresión de los genes de los progenitores LRL en E11.5. Los embriones electroporadas con la proteína verde fluorescente (GFP), impulsado por el promotor CAG ampliamente activa reproducible expresó GFP después de 24 horas de cultivo. Un aspecto crítico de este ensayo es que la expresión de genes sólo se altera debido a la expresión del gen exógeno y no debido a los efectos secundarios que resultan de la electroporación y técnicas de cultivo. Se determinó que los patrones de expresión de genes endógenos permanecen inalteradas en los embriones electroporated y culta. Este ensayo puede ser utilizado para alterar el destino de las células que surgen de la LIF de embriones menores de E12.5 mediante la introducción de plásmidos para la sobreexpresión o tumbar (a través de ARNi) de diferente pro-factores de transcripción neuronales.
Protocolo
1. Los preparativos antes de la electroporación
- Amplificar el ADN para la electroporación por un máximo de preparación (Prime-It o Qiagen). La concentración del ADN debe ser un mínimo de 1 mg / ml para la absorción eficiente.
- Eliminar 495 l de ADN y se mezcla con 5 l de 0,01% Fast Green en 1 x PBS (tampón fosfato salino) en un tubo de microcentrífuga.
2. Cosecha embrionarias
- Establecer apareamientos programados de ratones CD-1 (Harlan). Verificar la presencia de tapones vaginales y consideran que la fecha se observa un tapón vaginal como el día embrionario (E) 0,5. Los embriones serán cosechados 11 días después de la visualización de enchufe (E11.5).
- Coloque las herramientas esterilizadas en el 70% de etanol. Tratar una campana de flujo laminar con luz ultravioleta durante al menos una hora antes de su uso. Campana Spray, bandeja de disección, y la disección de alcance con el 70% de etanol. Pre-caliente 1 x PBS a 37 ° C.
- En E11.5 la eutanasia de la hembra de acuerdo a las condiciones aprobadas por el Institutoional Comité para el Cuidado y Uso de Animales (ICCUA). Coloque una bandeja de disección en la campana de flujo laminar. Rociar por el abdomen de la hembra con 70% de etanol.
- Abra la cavidad peritoneal y el pin de las paredes de la bandeja de disección. Sacar los cuernos uterinos de forma que descanse dentro de la cavidad peritoneal.
- Corte cuidadosamente abrir la pared de la trompa uterina. Use una cuchara de 20 mm (Bellas Herramientas Científicas) para eliminar suavemente el embrión en el saco vitelino fuera de la placenta. Embriones Colocar en un plato de cultivo de 100 mm de tejido llena previamente con 10 ml de PBS estéril 1 X que se precalienta en 2,2.
- Repita el procedimiento para todos los embriones presentes.
3. La electroporación de embriones E11.5 (figura 1)
- Con una cuchara de 20 mm, transferir el embrión primero en un plato nuevo 100 mm precargado con 10 ml de 1XPBS estériles que fue precalentado a 37 ° C.
- Use unas pinzas 11 cm con una punta de 0,05 x 0,02 mm (Bellas Herramientas Científicas) para volver a cuidadose mueven y desechar el saco vitelino.
- Embrión de posición de modo que su cara dorsal quede hacia arriba de manera que se asemeja a los dibujos animados en la Figura 1A. El uso de electrodos de palas 7 mm (Harvard Apparatus) para sostener suavemente el embrión. Los electrodos deben colocarse en cualquier lado del tubo neural en el nivel del ventrículo rombencéfalo cuarto. El ventrículo es visible a simple vista, pero utilizando un microscopio de disección puede facilitar la colocación exacta de pared. Posicionamiento de las paletas es crítico para la determinación de la región que recibe el ADN electroporado. Si el labio inferior rómbica (LIF) del cerebro posterior dorsal embrionaria se desea, las paletas debe ser el lugar de tal manera que están directamente que flanquean la parte más ancha de la apertura del cuarto ventrículo.
- Use una jeringa de 1 cc para elaborar el ADN del plásmido se mezcla con 0,01% Fast Green. 500 l de la mezcla debe ser suficiente para la electroporación de al menos 8-10 embriones (véase 3,5).
- Suavemente la punción de la OV roofplateerlying el cuarto ventrículo con una aguja 25G tuberculina 5/8 unido a la jeringa de 1 cc y se inyecta la mezcla de ADN-colorante en el ventrículo. Inyecciones exitosos se caracterizan por la mezcla de ADN-colorante de llenado del sistema ventricular completo (Figura 1C). La cantidad de mezcla de ADN-colorante inyectado típicamente es menor que 50 l. Las cantidades exactas son variables entre los embriones como una porción de la mezcla tiende a salirse de ventrículo en el PBS que rodea el embrión. Un medio alternativo de la entrega de la mezcla de ADN-colorante sería a través de acceder al sistema ventricular mediante punción del velo que cubre el cerebro medio. De nuevo, las inyecciones exitosas se caracterizan por la mezcla de ADN-colorante de llenado del sistema ventricular completo.
- Entregar cinco pulsos cuadrados con un generador de impulsos eléctricos (BTX) y 7 palas de electrodos mm. Cada impulso es 50 V duradera 5 ms por impulsos con 500 ms entre cada impulso. El tejido cercano al electrodo cargado positivamente entonces Take hasta el plásmido.
4. Cultivo de embriones
- En una campana de flujo laminar, llenar los pocillos exteriores de una placa de cultivo de 12 pocillos con 2 ml de DMEM/F12 medio suplementado con suero fetal bovino al 10%, 5% de suero equino, 1% de glutamina, 1% de penicilina / estreptomicina que se precalentó a 37 ° C. Las condiciones de cultivo fueron adaptados de los de Diego y sus colegas. 15
- En embriones de campana de flujo laminar pellizco en abdomen (por debajo del corazón) con unas pinzas y quitar la parte posterior del embrión. Colocar la porción anterior en uno de los pozos llenos de la placa de cultivo de 12 pocillos.
- Repita el procedimiento para todos los embriones. Llenar sólo los pozos exteriores de la placa 12-así para evitar la contaminación de los cultivos.
- Embriones de Cultura en una incubadora a 37 ° C con 5% de CO 2. Expresión de la electroporated plásmido debe ser observable dentro de las 24 h.
- Si ya veces de cultivo se desea, llenar los pozos fuera de una nueva placa de 12 bien con 2 ml delos medios utilizados en 4,1. Con una cuchara esterilizada transferir los embriones a un pocillo de la placa nueva. Coloque de nuevo en la incubadora a 37 ° C. Cultura para un máximo de 48 horas es posible.
- Cuando el tiempo de cultivo deseada, fijar embriones para el análisis (véase más adelante).
5. Preparación de embriones para el Análisis
- Enjuagar embriones en 1 x PBS a 4 ° C durante cinco minutos. Repita.
- Fijar para el análisis de los embriones en el 2% de paraformaldehído (PFA) en 1XPBS durante 2 horas a 4 ° C.
- Enjuagar embriones en 1 x PBS a 4 ° C durante cinco minutos. Repita.
- Equilibrar los embriones en el 30% de sacarosa en PBS 1 X la noche a 4 ° C.
- Insertar los embriones en la temperatura óptima de corte (octubre) con un compuesto de hielo seco / etanol baño. Los embriones se pueden almacenar a -20 ° C.
- Sección embriones en un criostato (Leica) en secciones de 30 micras y montar en las diapositivas (VWR, Superfrost Plus). Almacenar a -20 ° C.
6. Immunohistochemistry Análisis
- La inmunohistoquímica se realizó como se describe en 16. Diluciones de anticuerpos primarios utilizados para este estudio incluyen conejo α-GFP (Invitrogen), 1:2500; ratón α-Mash1 (BD Biosciences) 1:100; de conejo α Ngn1-(Johnson Jane) 1:5000; de conejo α-Ptf1a (Jane Johnson ) 1:2500; conejo Math1 (Jane Johnson) 1:100. Incubar corredera plana lado, muestra arriba en una bandeja de tinción a 4 ° C durante la noche.
- Las láminas fueron analizadas en un microscopio compuesto (Olympus BX51).
7. Los resultados representativos
Un esquema de la Figura 1A muestra el experimento de electroporación. Figura 1B muestra una vista sagital de un embrión E11.5 antes de la manipulación. El embrión mismo después de la inyección del CAG plásmido que contiene :: GFP en 0,01% Fast Green se muestra en la Figura 1C y un representante embrión no fijada exhibiendo GFP unilateralexpresión en el cerebro posterior dorsal de la cultura 24 horas siguientes se muestra en la Figura 1D. La extensión de la zona de la LIF que se electroporó éxito es variable y parece ser altamente dependiente de posicionamiento de los electrodos. En nuestros estudios se encontró que 52 de 65 (80%) de los embriones electroporated expresado con éxito GFP. El tejido se considerará que se electroporated éxito si era positivo para las buenas prácticas agrarias en las regiones localizadas en varias secciones posteriores a la fijación y el análisis inmunohistoquímico (ver más abajo). Los embriones que no cumplan estos criterios se calificaron como intentos fallidos de electroporación.
Una evaluación adicional de la eficiencia de la electroporación puede determinarse mediante la realización de inmunohistoquímica contra GFP en secciones transversales de embriones electroporated a nivel del cuarto ventrículo. Figura 2 muestra representativas de serie de secciones de un embrión mostrando unilateralLa expresión de GFP. Figura 2A muestra un esquema idealizado que ilustra que el lado izquierdo del embrión fue hacia el electrodo positivo. Las secciones transversales (a niveles representados por la historieta medio de la Figura 2A) revelan la expresión de GFP localizada exclusivamente en el lado izquierdo del tejido rombencéfalo (Figuras 2C y 2D). El área electroporado del LIF no se extienden todo el eje antero-posterior del tubo neural como examen de las secciones 300 micras rostral o mayor a la mostrada en la Figura 2C no expresa GFP (Figura 2B).
La utilidad de este ensayo para la manipulación de la expresión génica depende de la estabilidad de los dominios de expresión de las proteínas endógenas. El LIF se ha caracterizado como poseedor de dominios únicos progenitoras que se caracterizan por la expresión diferencial de los factores de transcripción proneurales (revisado en 1).Un subconjunto de estos factores (Mash1, Math1, Ngn1 y Ptf1a) fueron elegidos para el análisis debido a su propuesta y / o funciones que se caracterizan en la especificación de precerebellar subtipos neuronales en el LIF, un tema de futuros estudios 16-18. Los cuatro proteínas tienen dominios de expresión muy característicos en el cerebro posterior caudal en E11.5 16-18. Hemos observado que los embriones que fueron colocadas las culturas no aumentan de tamaño y tampoco para iniciar la producción del epitelio del plexo coroideo y la invaginación de la LRL y roofplate, eventos morfológicos que se producen entre E11.5 E12.5 y 5. Basándose en estas observaciones, se determinó que el desarrollo normal en estos embriones se detuvo o se retrasa groseramente y el control comparable para los embriones cultivados debería ser embriones uncultured en E11.5.
Para asegurarse de que la cultura y la electroporación no molestar a los niveles de proteínas endógenas, se analizaron cuatro proteínas diferentes immunohistochemistry (IHC) en 34 embriones diferentes que se electroporated y luego se cultivaron durante al menos 24 horas. La Tabla I muestra el número de embriones analizados para cada marcador y el porcentaje de los embriones analizados que mantuvieron niveles normales de la proteína. La Figura 3 muestra representativa de datos IHC a partir de dos de las proteínas analizadas, Mash1 (Figuras 3A y 3B) y Math1 (Figuras 3C y 3D). Hemos observado que la mayoría de los embriones retenidos los niveles normales de expresión después de la electroporación y la cultura (Figuras 3B y 3D) en comparación con los embriones de control en E11.5 (Figuras 3A y 3C). Es importante destacar que los dominios de expresión característicos de estas proteínas no fueron perturbados.
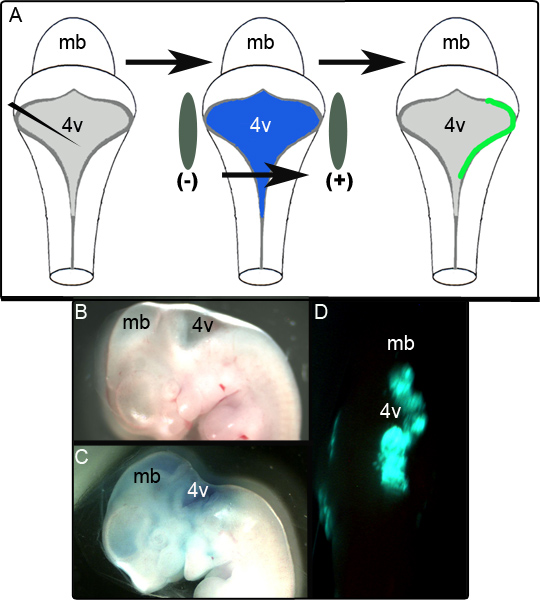
Figura 1. La electroporación de embriones en E11.5. (A) Esquema de THe experimento electroporación. Un embrión E11.5 se aísla y el plásmido de expresión en 0,01% Fast Green se inyecta en el cuarto ventrículo. El embrión se flanqueada por palas de electrodos y se sometió a un pulso de 50 V antes de ser colocado en cultivo (B) vista sagital de un embrión E11.5 antes de la inyección. (C) El mismo embrión E11.5 después de la inyección del plásmido en 0,01% Fast Green. (D) la expresión unilateral de las buenas prácticas agrarias rombencéfalo observado en embriones E11.5 después de 24 horas de cultivo. MB-mesencéfalo; 4v cuarto ventrículo.
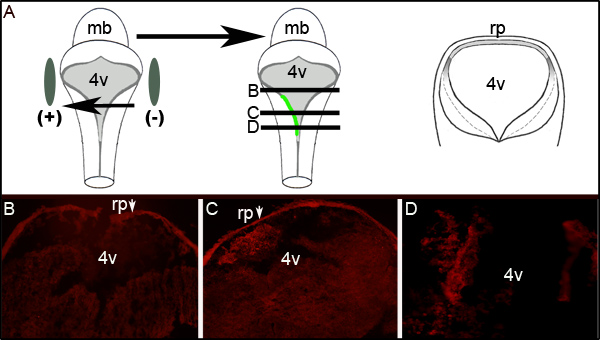
Figura 2. La expresión de GFP en el tejido electroporated. (A) La caricatura de la izquierda representa la colocación de electrodos en torno a un embrión E11.5. Historieta Medio representa la absorción y la expresión de GFP plásmido que codifica en el lado izquierdo del embrión. Caricatura de la derecha es esquemática de una sección transversal idealizada tomada a través del embrión en levels indicado por las líneas negras en la caricatura de media. (B-D) Inmunohistoquímica para las buenas prácticas agrarias en las secciones transversales a través de un embrión E11.5 electroporado después de 24 horas de la cultura. Las flechas indican la roofplate (RP), que atrapa el anticuerpo secundario. Las imágenes se toman con un aumento de 10 veces. Los niveles relativos de las secciones mostradas están representadas por las líneas horizontales a través de la historieta medio en (A). MB-mesencéfalo; l 4v cuarto ventrículo; rp-roofplate.
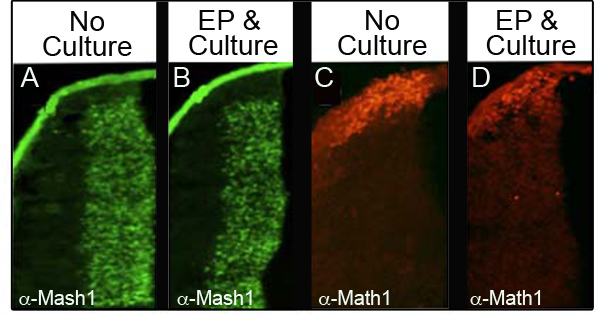
Figura 3. Expresión de proteínas endógenas en el labio inferior rómbico inmunohistoquímica para Mash1 (A y B) o Math1 (C y D) comparando las secciones transversales de embriones E11.5 que no eran cultivadas (A, C) con embriones que se electroporadas con CAG.: : las buenas prácticas agrarias y se cultivaron durante 24 horas (B y D). Imágenes tomadas con un aumento de 10 veces.
| Proneurales Transcriptiel análisis factorial | Número de embriones analizados | Porcentaje de retención patrones normales de expresión |
| Math1 | 15 | 86,7% |
| Mash1 | 12 | 83,3% |
| Ngn1 | 7 | 71,4% |
| Ptf1a | 6 | 100% |
Tabla I. Porcentaje de embriones electroporación y cultivadas de contención normales Dominios proneurales factor de transcripción en el LIF.
Discusión
La técnica de electroporación in vitro presentados en este estudio es una nueva metodología que puede ser utilizada de manera eficiente para manipular la expresión génica en embriones de menos de 12 días de gestación. La colocación de los embriones en cultivo permite la expresión del gen introducido y evita la letalidad observada cuando los embriones electroporadas se les permite permanecer en vivo. Esta técnica permite la manipulación de la expresión génica en células progenitor...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a Jane Johnson para el Math1, Ngn1, y los anticuerpos Ptf1a y Connie Cepko para el pCAG :: GFP plásmido. Este trabajo fue financiado por el NIH R15 1R15HD059922-01.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| Criostato | Leica | CM-1850 | |
| Biologie punta Dumoxel tratado DUMONT fórceps | Bellas Herramientas Científicas | 11252-30 | |
| 20 mm MORIA perforada cuchara | Bellas Herramientas Científicas | 10370-17 | |
| ECM 830 Generador de onda cuadrada electroporación | BTX (VWR) | 47745-928 | |
| Aparato de Harvard 7 Tweezertrodes mm * Electrodos | BTX (Fisher) | BTX450165 | |
| Fisher Isotemp incubadora de CO 2 | Pescador | 1325525 | |
| NAPCO de CO 2 del regulador de gas | Pescador | 15497020 | |
| 12 placas de cultivo tisular | BD Falcon (Fisher) | 877229 | |
| HyClone líquido Medios DMEM/F-12 (1:1); con L-glutamina y HEPES, 500 ml | Thermo Scientific (Fisher) | SH3002301 | |
| HyClone * Donante de suero equino | Thermo Scientific (Fisher) | SH3007402 | |
| Suero bovino fetal, calificado de calor, inactivado | Invitrogen | 16140-063 | |
| Cellgro * 10.000 UI Penicilina, 10.000 mg / ml de estreptomicina | Mediatech (Fisher) | MT-30-002-CI | |
| HyClone * L-Glutamina L-Glutamina, 200mm en 0,85% de NaCl | Thermo Scientific (Fisher) | SH3003401 | |
| Fast-Green | Pescador | AC41053-0250 | 0,01% |
Referencias
- Ray, R. S., Dymecki, S. M. Rautenlippe Redux -- toward a unified view of the precerebellar rhombic lip. Current opinion in cell biology. 21, 741-747 (2009).
- Machold, R., Fishell, G. Math1 is expressed in temporally discrete pools of cerebellar rhombic-lip neural progenitors. Neuron. 48, 17-24 (2005).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Wingate, R. J., Hatten, M. E. The role of the rhombic lip in avian cerebellum development. Development (Cambridge, England). 126, 4395-4404 (1999).
- Altman, J., Bayer, S. A. . Development of Cerebellar System: In relation to its evolution, structure, and function. , (1997).
- Farago, A. F., Awatramani, R. B., Dymecki, S. M. Assembly of the brainstem cochlear nuclear complex is revealed by intersectional and subtractive genetic fate maps. Neuron. 50, 205-218 (2006).
- Wang, V. Y., Rose, M. F., Zoghbi, H. Y. Math1 expression redefines the rhombic lip derivatives and reveals novel lineages within the brainstem and cerebellum. Neuron. 48, 31-43 (2005).
- Rodriguez, C. I., Dymecki, S. M. Origin of the precerebellar system. Neuron. 27, 475-486 (2000).
- Taber-Pierce, E. Histogenesis of the nuclei griseum ponitis, corporis pontobulbaris and reticularis tegmenti pontis (bechterew) in mouse. J. Comp. Neurol. 126, 219-240 (1966).
- Dipietrantonio, H. J., Dymecki, S. M. Zic1 levels regulate mossy fiber neuron position and axon laterality choice in the ventral brain stem. Neuroscience. 162, 560-573 (2009).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155-162 (2002).
- Taniguchi, H., Kawauchi, D., Nishida, K., Murakami, F. Classic cadherins regulate tangential migration of precerebellar neurons in the caudal hindbrain. Development (Cambridge, England). 133, 1923-1931 (2006).
- Kawauchi, D., Taniguchi, H., Watanabe, H., Saito, T., Murakami, F. Direct visualization of nucleogenesis by precerebellar neurons: involvement of ventricle-directed, radial fibre-associated migration. Development (Cambridge, England). 133, 1113-1123 (2006).
- Okada, T., Keino-Masu, K., Masu, M. Migration and nucleogenesis of mouse precerebellar neurons visualized by in utero electroporation of a green fluorescent protein gene. Neuroscience research. 57, 40-49 (2007).
- de Diego, I., Kyriakopoulou, K., Karagogeos, D., Wassef, M. Multiple influences on the migration of precerebellar neurons in the caudal medulla. Development (Cambridge, England). 129, 297-306 (2002).
- Landsberg, R. L. Hindbrain rhombic lip is comprised of discrete progenitor cell populations allocated by Pax6. Neuron. 48, 933-947 (2005).
- Hoshino, M. Ptf1a, a bHLH transcriptional gene, defines GABAergic neuronal fates in cerebellum. Neuron. 47, 201-213 (2005).
- Yamada, M. Origin of climbing fiber neurons and their developmental dependence on. Ptf1a. J. Neurosci. 27, 10924-10934 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados