É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Em Eletroporação vitro do lábio inferior rômbico de embriões de camundongos Midgestation
Neste Artigo
Resumo
Este estudo descreve o desenvolvimento de um In vitro Técnica de electroporação que permite a manipulação da expressão do gene no lábio inferior rômbico de embriões midgestation.
Resumo
O lábio rômbico é um neuroepitélio embrionário localizado no cérebro posterior na junção entre o tubo neural eo roofplate do quarto ventrículo (revisto em 1). O lábio rômbico pode ser subdividido no lábio superior rômbica (URL), que engloba rhombomere 1 (R1) e gera os neurónios do cerebelo eo lábio inferior rômbica (MID), que dá origem a diversas linhagens de tronco cerebral neuronais 2-4. Derivados LRL incluem os neurónios auditivos dos núcleos coclear e aqueles dos núcleos precerebellar que estão envolvidos na regulação do motor e do equilíbrio de controlo 5-8. Neurogênese a partir do LRL ocorre ao longo de uma grande janela temporal que engloba dias embrionários (E) 9,5-16,5 5, 9. Diferentes linhagens neuronais emergir do LRL como células pós-mitóticas (ou nascem) durante diferentes dias de desenvolvimento durante esta janela neurogênica.
Electroporação de construções de expressão de genes pode ser usado paramanipular a expressão do gene em células progenitoras LRL e potencialmente pode mudar o destino dos neurônios produzidos a partir desta região 10-12. Alterando a expressão gênica de células progenitoras LRL no rato através de eletroporação in utero tem sido muito bem sucedida para a manipulação de linhagens nascidos no dia embrionário E12.5 ou mais tarde, 10, 12-14. Em electroporações útero antes E12.5 não tiveram sucesso devido principalmente à letalidade associada a punção da roofplate quarto ventrículo, um passo necessário na entrega de DNA exógeno que é electroporados para o MID. No entanto, muitos LRL linhagens derivadas surgem a partir do LRL mais cedo do que E12.5 9. Estas linhagens anteriormente nascidos incluem os neurónios que compõem a reticular lateral, cuneate externo, e os núcleos olivar inferior do sistema de precerebellar que funcionam de modo a ligar as entradas a partir da medula espinal e do córtex para o cerebelo 5. A fim de manipular expressão na LRLde embriões com menos de E12.5, desenvolvemos um sistema in vitro em que os embriões são colocados em cultura na sequência de electroporação.
Este estudo apresenta um método eficiente e eficaz para manipular a expressão de genes dos progenitores LRL em E11.5. Embriões electroporado com a proteína verde fluorescente (GFP) accionada a partir do promotor CAG amplamente activa reprodutivelmente expressa GFP após 24 horas de cultura. Um aspecto crítico da presente ensaio é que a expressão do gene só podem ser alterados por causa da expressão do gene exógeno e não por causa de efeitos secundários que resultam da electroporação e técnicas de cultura. Foi determinado que os padrões de expressão de genes endógenos permanecer intacta em embriões eletroporados e culta. Este ensaio pode ser utilizado para alterar o destino das células que emergem do LRL de embriões com menos de E12.5 através da introdução de plasmídeos para a superexpressão ou derrubar (através RNAi) de diferentes pró-neurais fatores de transcrição.
Protocolo
1. Preparativos Antes da Eletroporação
- Amplificar o DNA de eletroporação por uma preparação maxi (Prime-It ou Qiagen). A concentração do ADN deve ser no mínimo de 1 mg / mL para a absorção eficiente.
- Remover 495 uL de ADN e de mistura com 5 ul de 0,01% Verde Rápido em 1 X PBS (solução salina tamponada com fosfato) num tubo de microcentrífuga.
2. Colheita embrionário
- Estabelecer acasalamentos programados de CD-1 camundongos (Harlan). Verificar a presença de tampões vaginais e consideram a data um rolhão vaginal é observado como dia embrionário (E) 0,5. Os embriões serão colhidas 11 dias após visualização ficha (E11.5).
- Coloque ferramentas esterilizados em etanol 70%. Tratar uma câmara de fluxo laminar com luz UV durante pelo menos uma hora antes do uso. Pulverização capô, bandeja de dissecação, e dissecando escopo com etanol 70%. Pré-aqueça 1 X PBS a 37 ° C.
- Em E11.5 eutanásia a mulher de acordo com condições aprovadas pelo InstitutComitê ional para o Cuidado e Uso de Animais (ICCUA). Coloque bandeja de dissecação na capela de fluxo laminar. Pulverizar para baixo do abdômen da fêmea com etanol 70%.
- Abrir a cavidade peritoneal e pino as paredes para a bandeja de dissecação. Retirar os cornos uterinos de modo que ele repousa no interior da cavidade peritoneal.
- Corte com cuidado abrir a parede do corno uterino. Use uma colher de 20 mm (Belas Científicos) para remover suavemente o embrião no saco vitelino longe da placenta. Embriões lugar em um prato de cultura 100 milímetros tecido pré-preenchido com 10 mL de estéril 1 X PBS que foi pré-aquecido em 2,2.
- Repita o procedimento para todos os embriões presentes.
3. Electroporação de Embriões E11.5 (Figura 1)
- Usando uma colher de 20 mm, transferência do embrião primeiro a um prato milímetros novo 100 pré-preenchido com 10 mL de 1XPBS estéreis que foi pré-aquecido a 37 ° C.
- Use uma pinça de 11 cm com uma ponta de 0,05 mm x 0,02 (Belas Científicos) para cuidadosamente remover e descartar o saco vitelino.
- Embrião posição de modo que seu lado dorsal está virada para cima para que ele lembra o desenho animado na Figura 1A. Use pás 7 mm de eletrodos (Harvard Apparatus) suavemente para segurar o embrião. Os eléctrodos deverão ser posicionados em ambos os lados do tubo neural ao nível do ventrículo rombencéfalo quarto. O ventrículo é visível a olho nu, mas utilizando um microscópio de dissecção pode facilitar a colocação de pás precisas. Posicionamento das pás é crítico para determinar a região que recebe o DNA electroporado. Se o lábio inferior rômbica (MID), da parte posterior do cérebro embrionário dorsal é desejada, pás deve ser o local de tal forma que eles estão directamente flanqueando a parte mais larga da abertura quarto ventrículo.
- Use uma seringa cc 1 a elaborar o DNA plasmídeo misturado com 0,01% de verde rápido. 500 uL da mistura deve ser suficiente para a electroporação de pelo menos 8-10 embriões (ver 3.5).
- Gentilmente perfurar o ov roofplateerlying quarto ventrículo com uma agulha de 25G tuberculina 5/8 ligada à seringa 1 cc e injectar a mistura de ADN-corante para o ventrículo. Injecções bem sucedidos são caracterizados pela mistura de ADN de corante de enchimento do sistema ventricular inteiro (Figura 1C). A quantidade de DNA de corante-mistura tipicamente injectado é inferior a 50 uL. As quantidades exactas são variáveis entre embriões como uma porção da mistura tende a escapar para fora do ventrículo para o PBS em torno do embrião. Um meio alternativo de fornecer a mistura de corante-DNA seria por meio de acessar o sistema ventricular por punção do véu que cobre o mesencéfalo. Novamente, as injecções bem sucedidos são caracterizados pela mistura de ADN de corante de enchimento do sistema ventricular inteiro.
- Entregar cinco pulsos quadrados com um gerador de pulso elétrico (BTX) e 7 pás de eletrodos mm. Cada pulso é de 50 V duração de 5 ms por pulso com 500 ms entre cada pulso. O tecido mais próximo do eléctrodo carregado positivamente irá então Take se o plasmídeo.
4. Cultura de Embriões
- Em uma câmara de fluxo laminar, encher os poços exteriores de um prato de cultura de 12 poços com 2 mL de DMEM/F12 meios suplementados com 10% de soro fetal de bovino, 5% de soro equino, 1% de glutamina, 1% de penicilina / estreptomicina que foi pré-aquecido a 37 ° C. As condições de cultivo foram adaptados a partir de Diego e colegas 15.
- Em embriões de escoamento laminar de aperto da capa de midsection (abaixo do coração) com uma pinça e remover porção posterior do embrião. Coloque a porção anterior em um dos poços cheios do prato de cultura 12 poços.
- Repita o procedimento para todos os embriões. Encha as cavidades apenas exterior da placa de 12 poços para evitar a contaminação das culturas.
- Embriões cultura em um 37 ° C incubadora com 5% de CO 2. Expressão do plasmídeo electroporado deve ser observável no prazo de 24 horas.
- Caso mais vezes cultura ser desejado, encher os poços para fora de uma placa de 12 poço novo com 2 mL deo material usado na versão 4.1. Com uma colher esterilizada transferir os embriões para um poço na placa de novo. Coloque de volta para a 37 ° C incubadora. Cultura para até 48 hr é possível.
- Quando o tempo de cultura desejada é alcançada, fixar os embriões para análise (ver abaixo).
5. Preparação de Embriões de Análise
- Lavar embriões em 1 X PBS a 4 ° C durante cinco minutos. Repita.
- Corrigir embriões para análise em paraformaldeído a 2% (PFA) em 1XPBS durante 2 horas a 4 ° C.
- Lavar embriões em 1 X PBS a 4 ° C durante cinco minutos. Repita.
- Equilibre embriões em sacarose a 30% em 1 X PBS durante a noite a 4 ° C.
- Incorporar embriões em Optimal composto de corte de temperatura (OCT) usando um banho de gelo / etanol seco. Os embriões podem ser armazenados a -20 ° C.
- Embriões seção em um criostato (Leica) em 30 seções mM e montar em lâminas (VWR, Superfrost Plus). Armazenar a -20 ° C.
6. ImmuAnálise imunohistoquímica
- A imuno-histoquímica foi realizada como descrito em 16. Diluições de anticorpos primários utilizados para este estudo incluem coelho α-GFP (Invitrogen) 1:2500; rato α-Mash1 (BD Biosciences) 1:100; coelho α-Ngn1 (Jane Johnson) 1:5000; coelho α-Ptf1a (Jane Johnson ) 1:2500;-coelho Math1 (Jane Johnson) 1:100. Incubar corrediça lado espécime plana, em cima de uma bandeja de coloração a 4 ° C durante a noite.
- As lâminas foram analisadas num microscópio composto (Olympus BX51).
7. Os resultados representativos
Um diagrama esquemático na Figura 1A mostra a experiência electroporação. A Figura 1B mostra uma vista sagital de um embrião E11.5 antes da manipulação. O embrião mesmo após a injecção do CAG plasmídeo contém :: GFP em 0,01% Verde Rápido é mostrado na Figura 1C e um embrião representante unfixed exibindo GFP unilateralexpressão no cérebro posterior dorsal cultura hr 24 seguinte é mostrado na Figura 1D. A extensão da área do LRL que com êxito é electroporado é variável e parece ser altamente dependente de posicionamento dos eléctrodos. Nos nossos estudos, verificou-se que 52 de 65 (80%) dos embriões eletroporados expressa com sucesso GFP. O tecido foi considerada com sucesso electroporado se era positivo para GFP em regiões localizadas sobre várias secções sequência de fixação e análise imuno-histoquímica (ver abaixo). Os embriões que não cumpriram este critério foram classificados como tentativas fracassadas de eletroporação.
Além disso avaliação da eficiência de electroporação pode ser determinado através da realização de imuno-histoquímica contra GFP em secções transversais de embriões eletroporados ao nível do quarto ventrículo. A Figura 2 mostra representativos secções seriadas de um embrião exibindo unilateralExpressão da GFP 2A. Figura mostra um diagrama esquemático que ilustra idealizada que o lado esquerdo do embrião era para o eléctrodo positivo. Secções transversais (em níveis representados por meio do desenho da Figura 2A) revelam expressão da GFP localizada exclusivamente no lado esquerdo do tecido rombencéfalo (Figuras 2C e 2D). A área electroporado do LRL não alargar o eixo anterior-posterior inteira do tubo neural como exame das secções 300 mm ou maior rostral à mostrada na Figura 2C não expressa a GFP (Figura 2B).
A utilidade deste ensaio para a manipulação da expressão do gene é dependente da estabilidade dos domínios de expressão para as proteínas endógenas. O LRL tem sido caracterizado como possuindo domínios progenitoras únicas caracterizadas pela expressão diferencial de factores de transcrição proneural (revisto em 1).Um subconjunto destes factores (Mash1, Math1, Ngn1, e Ptf1a) foram escolhidos para análise devido à sua proposta e / ou funções caracterizadas na especificação de precerebellar subtipos neurais no LRL, um objecto de estudos futuros 16-18. Todos os quatro proteínas têm domínios de expressão altamente característicos no cérebro posterior caudal em E11.5 16-18. Observou-se que os embriões que foram colocados culturas não conseguiu aumentar em dimensão e também falhou para iniciar a produção do epitélio do plexo coróide e invaginação da LRL e roofplate, eventos que ocorrem entre morfológicas E11.5 e E12.5 5. Com base nestas observações, foi determinado que o desenvolvimento normal em estes embriões foi interrompido ou grosseiramente retardada e controlo comparável para os embriões cultivados deve ser embriões não cultivadas em E11.5.
Para garantir que a cultura ea eletroporação não perturbar os níveis de proteínas endógenas, foram analisados quatro proteínas diferentes por immunohistochemistry (IHC) em 34 embriões diferentes que foram electroporadas e em seguida cultivadas durante pelo menos 24 horas. Tabela I mostra o número de embriões analisados para cada marcador ea percentagem dos embriões analisados que retinham os níveis de proteína normal. A Figura 3 mostra representativa IHC dados a partir de duas das proteínas analisadas, Mash1 (Figuras 3A e 3B) e Math1 (Figuras 3C e 3D). Observou-se que a maioria dos embriões retida níveis normais de electroporação seguinte expressão e cultura (Figuras 3B e 3D), em comparação com os embriões de controlo nas E11.5 (Figuras 3A e 3C). Importante, os domínios de expressão característicos destas proteínas não foram perturbado.
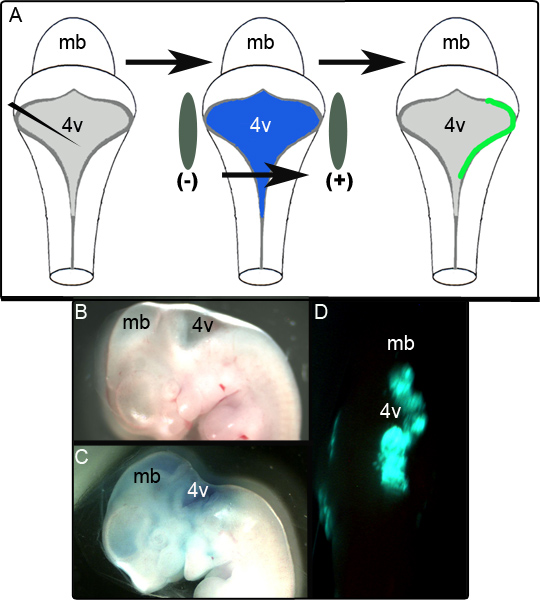
Figura 1. Electroporação de Embriões em E11.5. Esquema (A) de thexperiência e eletroporação. Um embrião E11.5 é isolado e do plasmídeo de expressão em 0,01% Verde Rápido é injectado no quarto ventrículo. O embrião é, então, flanqueado por pás de eléctrodos e submetido a um pulso de 50 V, antes de serem colocadas em cultura (B) vista sagital de um embrião E11.5 antes da injecção. (C) O embrião E11.5 mesmo após a injecção do plasmídeo em 0,01% Verde Rápido. (D) expressão rombencéfalo unilateral de GFP observada em embriões E11.5 após 24 horas de cultura. mb mesencéfalo; 4v quarto ventrículo.
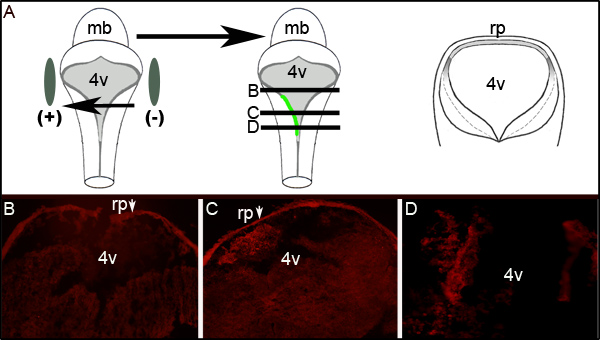
Figura 2. Expressão de GFP em Tecido eletroporados. (A) O desenho à esquerda mostra a colocação dos eletrodos em torno de um embrião E11.5. Dos desenhos mostra a absorção do meio e da expressão da GFP plasmídeo no lado esquerdo do embrião. Desenhos animados em direito é esquemático de uma seção transversal idealizada tomadas através do embrião no levels denotada por linhas pretas em meio caricatura. (B-D) Imunohistoquímica para GFP em seções transversais através de um embrião E11.5 eletroporados após 24 horas de cultura. As setas indicam o roofplate (RP) que retém o anticorpo secundário. As imagens são tomadas com uma ampliação de 10X. Os níveis relativos das secções mostradas são representadas pelas linhas horizontais através do desenho do meio em (A). mb mesencéfalo; ventrículo l 4v quarto; rp-roofplate.
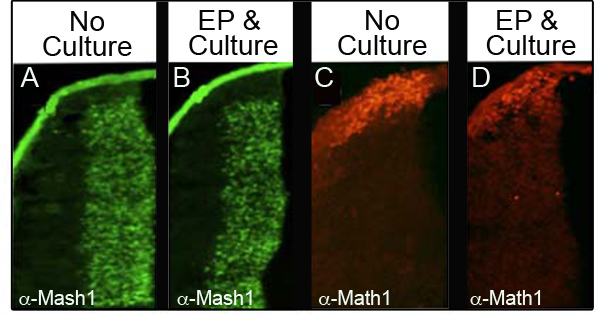
Figura 3. Expressão de proteínas endógenas no lábio inferior rômbico A imuno-histoquímica para Mash1 (A e B) ou Math1 (C e D), comparando secções transversais de embriões E11.5 que não foram cultivadas (A, C) com embriões que foram electroporadas com CAG.: : GFP e cultivadas durante 24 h (B e D). Imagens tomadas com uma ampliação de 10X.
| Transcripti Proneuralem fatores analisados | Número de embriões analisados | Percentagem de retenção Padrões expressão normal |
| Math1 | 15 | 86,7% |
| Mash1 | 12 | 83,3% |
| Ngn1 | 7 | 71,4% |
| Ptf1a | 6 | 100% |
Percentagem Tabela I. de Embriões eletroporados e Cultivadas retenção normais Domínios transcrição Proneural fator na LRL.
Discussão
A técnica in vitro electroporação apresentado neste estudo é uma nova metodologia que pode ser utilizada de forma eficiente para manipular a expressão do gene em embriões de menos de 12 dias de gestação. Colocação dos embriões em cultura permite a expressão do gene introduzido e contorna a letalidade observada quando embriões eletroporados for permitido permanecer in vivo. Esta técnica permite a manipulação da expressão gênica em células progenitoras embrionárias que anteri...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer a Jane Johnson para o Math1, Ngn1 e anticorpos Ptf1a e Connie Cepko para o pCAG :: GFP plasmídeo. Este trabalho foi financiado pelo NIH R15 1R15HD059922-01.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
| Criostato | Leica | CM-1850 | |
| Biologie ponta Dumoxel tratados DUMONT fórceps | Belas Científicos | 11252-30 | |
| 20 milímetros colher perfurada MORIA | Belas Científicos | 10370-17 | |
| ECM 830 Praça Gerador de Eletroporação Onda | BTX (VWR) | 47745-928 | |
| Harvard Apparatus 7 Tweezertrodes mm * Eletrodos | BTX (Fisher) | BTX450165 | |
| Fisher Isotemp incubadora de CO 2 | Pescador | 1325525 | |
| NAPCO CO Regulador de Gás 2 | Pescador | 15497020 | |
| 12 placas de cultura de tecidos | BD Falcon (Fisher) | 877229 | |
| HyClone líquido Meios DMEM/F-12 (1:1); com L-glutamina e HEPES; 500mL | Thermo Scientific (Fisher) | SH3002301 | |
| HyClone * Doador soro eqüino | Thermo Scientific (Fisher) | SH3007402 | |
| Soro fetal bovino, Calor, qualificado inativada | Invitrogen | 16140-063 | |
| cellgro * 10.000 UI de penicilina, estreptomicina 10.000 g / mL | Mediatech (Fisher) | MT-30-002-CI | |
| HyClone * L-Glutamina L-Glutamina, 200mM em NaCl 0,85% | Thermo Scientific (Fisher) | SH3003401 | |
| Fast-Verde | Pescador | AC41053-0250 | 0,01% |
Referências
- Ray, R. S., Dymecki, S. M. Rautenlippe Redux -- toward a unified view of the precerebellar rhombic lip. Current opinion in cell biology. 21, 741-747 (2009).
- Machold, R., Fishell, G. Math1 is expressed in temporally discrete pools of cerebellar rhombic-lip neural progenitors. Neuron. 48, 17-24 (2005).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Wingate, R. J., Hatten, M. E. The role of the rhombic lip in avian cerebellum development. Development (Cambridge, England). 126, 4395-4404 (1999).
- Altman, J., Bayer, S. A. . Development of Cerebellar System: In relation to its evolution, structure, and function. , (1997).
- Farago, A. F., Awatramani, R. B., Dymecki, S. M. Assembly of the brainstem cochlear nuclear complex is revealed by intersectional and subtractive genetic fate maps. Neuron. 50, 205-218 (2006).
- Wang, V. Y., Rose, M. F., Zoghbi, H. Y. Math1 expression redefines the rhombic lip derivatives and reveals novel lineages within the brainstem and cerebellum. Neuron. 48, 31-43 (2005).
- Rodriguez, C. I., Dymecki, S. M. Origin of the precerebellar system. Neuron. 27, 475-486 (2000).
- Taber-Pierce, E. Histogenesis of the nuclei griseum ponitis, corporis pontobulbaris and reticularis tegmenti pontis (bechterew) in mouse. J. Comp. Neurol. 126, 219-240 (1966).
- Dipietrantonio, H. J., Dymecki, S. M. Zic1 levels regulate mossy fiber neuron position and axon laterality choice in the ventral brain stem. Neuroscience. 162, 560-573 (2009).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155-162 (2002).
- Taniguchi, H., Kawauchi, D., Nishida, K., Murakami, F. Classic cadherins regulate tangential migration of precerebellar neurons in the caudal hindbrain. Development (Cambridge, England). 133, 1923-1931 (2006).
- Kawauchi, D., Taniguchi, H., Watanabe, H., Saito, T., Murakami, F. Direct visualization of nucleogenesis by precerebellar neurons: involvement of ventricle-directed, radial fibre-associated migration. Development (Cambridge, England). 133, 1113-1123 (2006).
- Okada, T., Keino-Masu, K., Masu, M. Migration and nucleogenesis of mouse precerebellar neurons visualized by in utero electroporation of a green fluorescent protein gene. Neuroscience research. 57, 40-49 (2007).
- de Diego, I., Kyriakopoulou, K., Karagogeos, D., Wassef, M. Multiple influences on the migration of precerebellar neurons in the caudal medulla. Development (Cambridge, England). 129, 297-306 (2002).
- Landsberg, R. L. Hindbrain rhombic lip is comprised of discrete progenitor cell populations allocated by Pax6. Neuron. 48, 933-947 (2005).
- Hoshino, M. Ptf1a, a bHLH transcriptional gene, defines GABAergic neuronal fates in cerebellum. Neuron. 47, 201-213 (2005).
- Yamada, M. Origin of climbing fiber neurons and their developmental dependence on. Ptf1a. J. Neurosci. 27, 10924-10934 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados