A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
البكتيرية التصوير Bioluminescent
In This Article
Summary
توضح هذه المقالة إدارة لوكس الموسومة البكتيريا على الفئران واللاحقة في الجسم الحي التحليل باستخدام التصوير تلألؤ بيولوجي IVIS.
Abstract
هذا الفيديو يصف استخدام كامل الجسم bioluminesce التصوير (BLI) لدراسة الاتجار البكتيرية في الفئران الحية، مع التركيز على استخدام البكتيريا في الجينات والعلاج بالخلايا لمرض السرطان. البكتيريا تقديم فئة جذابة من ناقلات لعلاج السرطان، وحيازة القدرة الطبيعية على النمو داخل الأورام بعد تفضيلي الإدارة النظامية. بكتيريا مهندسة للتعبير عن الجينات لوكس راديو كاسيت تصريح BLI الكشف عن البكتيريا ومواقع الورم في نفس الوقت. ويمكن تصور موقع ومستويات البكتيريا داخل الأورام مع مرور الوقت درست بسهولة، في اثنين أو ثلاثة أبعاد. هذه الطريقة تنطبق على مجموعة واسعة من الأنواع البكتيرية وأنواع طعم أجنبي الورم. توضح هذه المقالة بروتوكول لتحليل البكتيريا داخل الفئران bioluminescent تحت الجلد تحمل الورم. يوصف أيضا من البكتيريا المتعايشة التصور في القناة الهضمية (GIT) من BLI. هذه قوية، ورخيصة، واستراتيجية في الوقت الحقيقي التصوير تمثيلاTS وسيلة مثالية لدراسة البكتيريا في الجسم الحي في سياق أبحاث السرطان، العلاج الجيني في وجه الخصوص، والأمراض المعدية. هذا الفيديو يوضح الإجراء لدراسة لوكس الموسومة E. القولونية في الفئران الحية، مما يدل على قراءات المكاني والزماني للتحقيق BLI استخدام مع نظام IVIS.
Protocol
1. ورم الحث
- لتحريض الورم روتينية، تم حقن الجرعة مكون للأورام من الخلايا علقت الحد الأدنى في 200 ميكرولتر من مستنبت المصل خالية تحت الجلد (SC) في الجناح الإصابة مجانا 6-8 الاسبوع القديمة الإناث BALB / C أو athymic الفئران MF1-nu/nu ن = 6 (هارلان، أكسفورد، المملكة المتحدة) (1 × 10 6 خلايا 4T1) باستخدام إبرة حقنة 21-قياس. وكان جدوى من الخلايا المستخدمة في التلقيح أكبر من 95٪ كما هو محدد من قبل عدد البصرية باستخدام haemocytometer والتريبان الأزرق استبعاد صبغ (Gibco).
- بعد إنشاء الورم، وسمح أورام لتنمو وتتطور وتم رصدها مرتين أسبوعيا. تم حساب حجم الورم وفقا لصيغة V = (AB 2) Π / 6، حيث هو أطول قطر الورم وب عمودي هو أطول قطر إلى قطر واسع.
2. إعداد البكتيرية
- سلالة بكتيرية المستخدمة في هذا protocoكان ل E. القولونية K-12 MG1655، غير البروتين السم، معربا عن سلالة أو إيواء البلازميد luxABCDE ترميز التي تمكن ليتم الكشف عن البكتيريا عن طريق BLI. E. كانت تزرع القولونية MG1655 التي تحتوي على luxABCDE المتكاملة هوائيا في 37 درجة مئوية في المتوسط LB (سيغما الدريخ، أيرلندا) تستكمل مع 300 ميكروغرام / مل الاريثروميسين (EM). تم إنشاء مشتقة من bioluminescent MG1655 باستخدام بلازميد p16S لوكس الذي يحتوي على HELP P التأسيسي luxABCDE OPERON 1.
- الاستعداد للإدارة على الفئران، وحضنت الثقافات في المتوسط LB C ° 37 في في في 200 دورة في الدقيقة شاكر إلى مرحلة منتصف سجل (الكثافة البصرية في 600 نانومتر). تم حصادها البكتيريا عن طريق الطرد المركزي (6،000 × ز لمدة 5 دقائق)، وغسلها مع برنامج تلفزيوني (سيغما)، ومخففة في PBS 1 × 7 10 وحدة مستعمرة تشكيل (كفو) / مل لإدارة IV، أو 1 × 10 10 للتسمين.
3. البكتيرية اإلداريةنشوئها
- تم تقسيم الفئران عشوائيا إلى مجموعات تجريبية عندما وصلت الأورام حوالي 100 مم 3 في وحدة التخزين. للإعطاء في الوريد، تلقت الفئران ضبط النفس كل 10 6 خلايا في 100 ميكرولتر، حقن في الوريد مباشرة الذيل الأفقي باستخدام إبرة حقنة 28G. تم تحديد عدد قابلة للحياة من كل من اللقاح الطلاء بأثر رجعي.
- للدراسات الاستعمار GIT، كانت تدار شفويا 10 9 الخلايا البكتيرية في 100 ميكرولتر في الماوس بالتزقيم، على ثلاثة أيام متتالية. وانخفضت مستويات الموجودة من قبل البكتيريا المتعايشة قبل تغذية من إضافة الستربتومايسين ملغ / 5 مل في مياه الشرب الماوس لمدة 7 أيام قبل بدء بالتزقيم عن طريق الفم 1.
4. تلألؤ بيولوجي التصوير
- تم إجراء 2D التصوير في الجسم الحي باستخدام BLI IVIS100 (الفرجار). في تعريف إدارة الوقت آخر نقطة البكتيرية، كانت الفئران تخدير باستخدام الفرجار في XGI-8 غاز التخديرتم تنفيذ النظام مع Isofluorane 3٪، وكامل الجسم تحليل الصور في نظام 100 لمدة 2-5 دقيقة IVIS في حساسية عالية.
- للتصوير 3D، وضعت الفئران في تخدير ماوس المكوك التصوير داخل نظام التصوير الضوئي لتصوير الظهرية (IVIS الطيف، الفرجار). للحصول على الصور من إشارة وسيفيراز البكتيرية للإنشاء البصرية 3D، استخدمت موجات الانبعاثات مرشح تتراوح 500 حتي 580 نانومتر مع أوقات بن اقتناء 16 من دقيقة 3-4 في تصفية لتحقيق أقصى قدر من إشارة إلى نسبة الضوضاء. كجزء من هذه الصورة تسلسل الاستحواذ، تم الحصول على صورة ضوء منظم لتحديد خريطة الارتفاع. كان إدخال هذه الخريطة منتشر ضوء التصوير المقطعي (DLIT) اعادة البناء الخوارزميات التي تم استخدامها لتكوين صورة 3D البصرية باستخدام غير سالب الأمثل المربعات الصغرى 2.
- وجرى تحديد المناطق ذات الأهمية وكميا باستخدام برنامج السكن صورة (الفرجار): تحليل الصور.
5. ممثلالنتائج
في هذه الدراسة، والبكتيريا المسببة للأمراض غير المتعايشة القولونية K-12 MG1655 معربا عن OPERON luxABCDE كان IV تدار على فئران تحمل الاورام SC طعم أجنبي 4T1. تم الكشف عن بكتيريا لوكس إشارة تحديدا في أورام الفئران آخر IV-الإدارة (الشكل 2). انتعاش ثقافة البكتيريا من الفئران عينة بالتحقق من صحة وجود علاقة خطية بين الأعداد البكتيرية قابلة للحياة وكمية ضوء الكشف عن (الشكل 3). في الجسم الحي التصوير شفويا يديرها البكتيريا المتعايشة في GIT ويتحقق أيضا باستخدام 3D BLI.
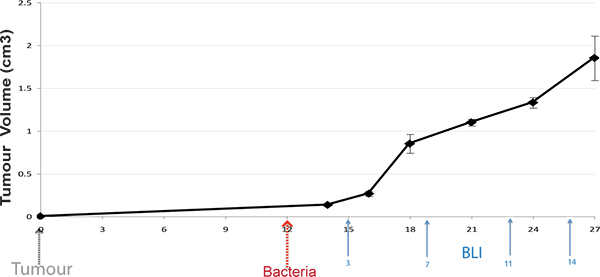
الشكل 1. بروتوكول الجدول الزمني. هي التي يسببها الأورام تحت الجلد في الفئران، والبكتيريا تدار على التنمية الورم (100 مم 3). الفئران الحية هي BLI ايمالذين تتراوح أعمارهم بين الإدارة في مختلف آخر مرة نقاط البكتيرية (الأسهم مرات عرض نموذجي).

الشكل 2. إدارة E. وقد حثت القولونية MG1655 luxABCDE على الفئران الحاملة للورم. تحت الجلد الأورام 4T1 في MF1 نو / نو الفئران وE. القولونية MG1655 luxABCDE تدار على التنمية الورم. تلقى كل حيوان 10 6 خلايا حقن في الوريد مباشرة الذيل الأفقي. تم تصوير الفئران في غضون أربع نقاط خلال الدراسة (نقط سوداء Z-المحور والصور) مع الانتعاش اللاحقة من البكتيريا قادرة على البقاء (كفو) من أورام الفئران عينة ضحى (الرسم البياني بار). زيادة في أعداد البكتيريا والبلازميد التعبير الجيني في الأورام على وجه التحديد لوحظ على مر الزمن (الماوس ممثل يتضح في نقطة زمنية). اضغط هنا لمشاهدتها بشكل اكبر شخصية .
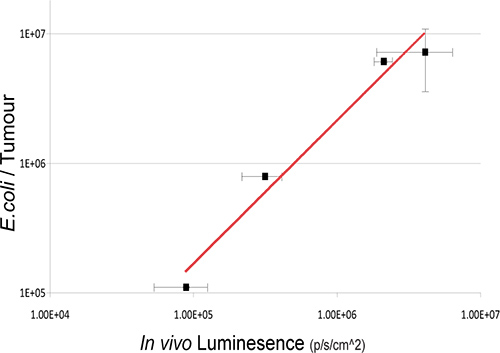
الشكل 3. والعلاقة بين تعداد أرقام الجرثومي Intratumoral وضوء بارد. البكتيريا قادرة على البقاء في الجسم الحي من قبل الثقافة الأورام البكتيرية السابقين من الأورام بعد BLI في مختلف نقاط الساعة الرابعة بعد الإدارة. تسجيل قيم أعداد البكتيريا (كفو) نسبة إلى وحدات في الجسم الحي ورسوم بيانية bioluminesce. ويلاحظ وجود علاقة قوية بين البكتريا وإشارات تلألؤ بيولوجي البكتيرية R 2 = 0.9717 1.
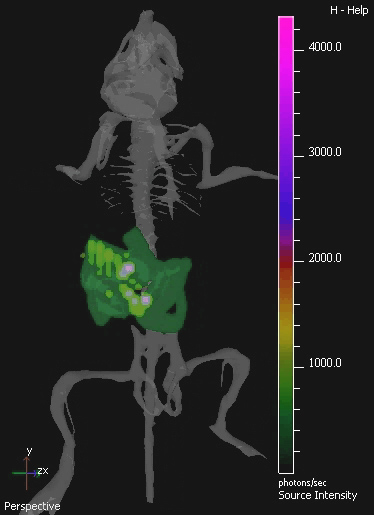
الشكل 4. المستعمر 3D IVIS صورة الجهاز الهضمي المسالك الفئران بواسطة E. MG1655 القولونية. واستعمر GIT من الفئران عن طريق الفم من كفو 9 10 من E. كولاي لمدة ثلاثة أيام متتالية. يظهر صورة العينة المعزولة من التصوير المقطعي 3D من الفأرة المستعمر.الصور تظهر 3D أطلس الماوس الرقمية من الهيكل العظمي لتوفير تسجيل التشريحية. E. القولونية MG1655 تلألؤ بيولوجي واضح باللون الأخضر في انخفاض، والأرجواني على مستويات أعلى.
Discussion
في سياق العلاج الجيني، أظهرت استخدام العوامل البيولوجية لتسليم الجينات العلاجية للمرضى وعدا كبيرا 3-5. مثل الفيروسات، والخصائص البيولوجية الفطرية من البكتيريا تسمح الكفاءة في تنفيذ DNA إلى الخلايا أو الأنسجة، وخاصة في سياق السرطان. وقد تبين أن البكتيريا قادرة ط...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
الكتاب ترغب في الاعتراف الدعم ذات الصلة لهذه المخطوطة من المفوضية الأوروبية البرنامج الإطاري السابع (PIOF-GA-2009-255466) والايرلندي مجلس البحوث الصحية (HRA_POR/2010/138). وكس الموسومة E. كان القولونية النوع هدية من الدكتور جيهان كورماك، كلية جامعة كورك.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | كتالوج رقم | تعليقات |
| 4T1 خلية خط | ATCC | CRL-2539 | مسانج نموذج سرطان الثدي المستمدة من ورم BALB / ج الناشئة بصورة عفوية الثديية |
| DMEM | سيغما الدريخ | D6429 | Dulbecco في معدلة النسر متوسطة |
| PBS | سيغما الدريخ | D8537 | التخزين المؤقت المالحة الفوسفات |
| Xenogen IVIS | الفرجار العلوم الحياتية | IVIS 100 ل2D التصوير؛ IVIS الطيف ل3D. | |
| لوريا مرق ميلر (LB) | سيغما الدريخ | L2542 | متوسطة النمو لE. القولونية |
| الاريثروميسين | سيغما الدريخ | E5389 | مضاد حيوي |
| الستربتومايسين عقار طبي | سيغما الدريخ | S9137 | مضاد حيوي |
| الفئران MF1nu/nu | هارلان (UK) | 069 (نو) / 070 (نو / +) | HSD: Athymic عاري-Foxn1nu |
| BALB / ج الفئران | هارلان (UK) | 066 | النمط الفرداني: H-2 د |
| بالتزقيم إبرة | التعليم والتدريب المهني الحلول التقنية (UK) | DE009 | 22G X 38mm إبرة بالتزقيم على التوالي |
| حقنة للحقن IV | BD العلوم البيولوجية | 309309 حتي 1 مل | حقنة الأنسولين مع 28 بوصة ½ G X الإبرة الدقيقة الرابعة بشكل جيد. |
| حقنة التطعيم للورم | براون | 9161376V | Omnifix 26 G & Xfrac12؛ إبرة بوصة |
References
- Cronin, M., et al. High resolution in vivo bioluminescent imaging for the study of bacterial tumour targeting. PLoS One. 7, e30940 (2012).
- Kuo, C., Coquoz, O., Troy, T. L., Xu, H., Rice, B. W. Three-dimensional reconstruction of in vivo bioluminescent sources based on multispectral imaging. J. Biomed. Opt. 12, 024007 (2007).
- Tangney, M., Ahmad, S., Collins, S. A., O'Sullivan, G. C. Gene therapy for prostate cancer. Postgrad Med. 122, 166-180 (2010).
- Morrissey, D., O'Sullivan, G. C., Tangney, M. Tumour targeting with systemically administered bacteria. Curr. Gene Ther. 10, 3-14 (2010).
- Collins, S. A., et al. Viral vectors in cancer immunotherapy: which vector for which strategy. Curr. Gene Ther. 8, 66-78 (2008).
- Yu, Y. A., Zhang, Q., Szalay, A. A. Establishment and characterization of conditions required for tumor colonization by intravenously delivered bacteria. Biotechnol. Bioeng. 100, 567-578 (2008).
- Baban, C. K., Cronin, M., O'Hanlon, D., O'Sullivan, G. C., Tangney, M. Bacteria as vectors for gene therapy of cancer. Bioeng. Bugs. 1, 385-394 (2010).
- Cronin, M., et al. Orally administered bifidobacteria as vehicles for delivery of agents to systemic tumors. Mol. Ther. 18, 1397-1407 (2010).
- van Pijkeren, J. P., et al. A novel Listeria monocytogenes-based DNA delivery system for cancer gene therapy. Hum. Gene Ther. 21, 405-416 (2010).
- Ahmad, S., et al. Induction of effective antitumor response after mucosal bacterial vector mediated DNA vaccination with endogenous prostate cancer specific antigen. J. Urol. 186, 687-693 (2011).
- Riedel, C. U., et al. Improved luciferase tagging system for Listeria monocytogenes allows real-time monitoring in vivo and in vitro. Appl Environ Microbiol. 73, 3091-3094 (2007).
- Cheng, C. M., et al. Tumor-targeting prodrug-activating bacteria for cancer therapy. Cancer Gene Ther. 15, 393-401 (2008).
- Foucault, M. L., Thomas, L., Goussard, S., Branchini, B. R., Grillot-Courvalin, C. In vivo bioluminescence imaging for the study of intestinal colonization by Escherichia coli in mice. Appl. Environ. Microbiol. 76, 264-274 (2010).
- Collins, S. A., Hiraoka, K., Inagaki, A., Kasahara, N., Tangney, M. PET Imaging For Gene & Cell Therapy. Curr. Gene Ther. , (2012).
- Tangney, M., Francis, K. P. In vivo Optical Imaging in Gene & Cell Therapy. Curr. Gene Ther. , (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved