É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagem bacteriana Bioluminescent
Neste Artigo
Resumo
Este artigo descreve a administração de Lux-marcado Bactérias a ratos e subseqüentes In vivo Análise usando IVIS imagem de bioluminescência.
Resumo
Este vídeo descreve o uso de todo o corpo bioluminesce imaging (BLI) para o estudo de tráfico bacteriana em ratos vivos, com ênfase no uso de bactérias na terapia génica e celular para o cancro. As bactérias presentes uma classe atraente de vetor para terapia de câncer, possuindo uma capacidade natural de crescer preferencialmente dentro de tumores após a administração sistêmica. As bactérias manipuladas para expressar o gene lux cassete autorização BLI detecção das bactérias e simultaneamente locais tumorais. A localização e níveis de bactérias ao longo do tempo dentro de tumores pode ser facilmente examinado, visualizado em duas ou três dimensões. O método é aplicável a uma ampla variedade de espécies bacterianas e tipos de xenoenxertos de tumor. Este artigo descreve o protocolo para a análise de bactérias bioluminescentes dentro ratinhos portadores de tumores subcutâneos. A visualização das bactérias comensais no tracto gastrointestinal (TGI) por BLI é também descrito. Este poderoso e barato, em tempo real representação estratégia de imagemts um método ideal para o estudo da bactéria in vivo no contexto da pesquisa de cancro, em particular, a terapia génica, e doenças infecciosas. Este vídeo descreve o procedimento para estudar lux-marcado E. coli em murganhos vivos, demonstrando a leitura espacial e temporal BLI alcançável utilizando o sistema IVIS.
Protocolo
1. Indução de tumores
- Para a indução do tumor de rotina, a dose tumorigénica mínima de células em suspensão em 200 uL de meio isento de soro da cultura foi injectado por via subcutânea (sc) no flanco de infecção livre 6-8 semanas de idade, ratinhos fêmea Balb / C ou atímicos MF1-nu/nu n = 6 (Harlan, Oxfordshire, Reino Unido) (1 x 10 6 células 4T1), utilizando uma agulha de seringa de calibre 21. A viabilidade de células utilizadas para inoculação foi superior a 95%, tal como determinado por contagem visual utilizando um hemocitómetro e Exclusão Trypan Blue Dye (Gibco).
- Seguindo estabelecimento do tumor, os tumores foram deixados crescer e desenvolver e foram monitorados duas vezes por semana. O volume do tumor foi calculado de acordo com a fórmula V = (ab 2) Π / 6, em que a é o diâmetro maior do tumor e b é o maior diâmetro perpendicular ao diâmetro a.
2. Preparação bacteriana
- A estirpe bacteriana utilizada neste protocoEu era E. coli K-12 MG1655, um não-proteína toxina que expressam, estirpe portadora de um plasmídeo que codifica luxABCDE que permite que as bactérias a ser detectada pelo BLI. E. coli MG1655 contendo o luxABCDE integrado foi cultivada aerobicamente a 37 ° C em meio LB (Sigma-Aldrich, Irlanda) suplementado com 300 ug / ml de eritromicina (Em). O derivado de bioluminescente MG1655 foi criada usando o plasmídeo p16S lux que contém a P AJUDA constitutiva luxABCDE operon 1.
- Para a preparação para a administração a ratinhos, as culturas foram incubadas em meio LB a 37 ° C num agitador a 200 rpm a mid-log de fase (densidade óptica a 600 nm). As bactérias foram colhidas por centrifugação (6000 xg durante 5 min), lavadas com PBS (Sigma), diluído em PBS e 1 x 10 7 unidades formadoras de colónias (ufc) / ml para administração IV, ou 1 x 10 10 por meio de sonda.
3. Administração bacterianação
- Os ratos foram aleatoriamente divididos em grupos experimentais quando os tumores atingiram cerca de 100 mm 3 em volume. Para administração intravenosa, os ratos receberam cada conteve 10 6 células em 100 uL, injectado directamente para dentro da veia lateral da cauda utilizando uma agulha de seringa de 28G. A contagem de viáveis de cada inoculo foi determinada por plaqueamento retrospectiva.
- Para os estudos de colonização GIT, 10 9 células bacterianas foram administradas oralmente em 100 ul por rato por gavagem, em três dias consecutivos. Pré-existentes comensais níveis bacterianos foram reduzidos, antes da alimentação, por adição de 5 mg de estreptomicina / ml, em água potável rato durante 7 dias antes do início de uma sonda oral.
4. Imagem de bioluminescência
- 2D in vivo BLI imagem foi realizado usando o IVIS100 (Caliper). No tempo definido após a administração pontos bacteriana, os ratos foram anestesiados usando XGI-8 Caliper Anestesia GasSistema com Isofluorano 3%, e em todo o corpo a análise de imagens foi realizada nos 100 IVIS sistema para 2-5 min com uma sensibilidade elevada.
- Para imagens em 3D, os ratos anestesiados foram colocados em um ônibus de imagem do rato dentro do sistema de imagem óptico para imagens dorsal (IVIS Spectrum, Caliper). Para a aquisição de imagens do sinal de luciferase bacteriana para a reconstrução 3D óptica, comprimentos de onda de emissão de filtro que variam 500-580 nm foram utilizados com caixa 16 tempos de aquisição de 3-4 min por filtro para maximizar a relação sinal-ruído. Como parte desta sequência de aquisição de imagem, uma imagem de luz estruturada foi obtida para definir um mapa de altura. Este mapa foi difuso de luz de entrada de imagem de tomografia (DLIT) reconstruções algoritmos que foram utilizados para formar uma imagem 3D óptico usando um não-negativo, pelo menos optimização quadrados 2.
- Análise de Imagem: Regiões de interesse foram identificados e quantificados utilizando software imagem viva (Caliper).
5. RepresentanteResultados
Neste estudo, as bactérias não patogénicas de E. coli comensal K-12 MG1655 expressando o operão luxABCDE IV foi administrada a ratos portadores de tumores de xenoenxerto sc 4T1. Bacterial lux sinal foi detectado especificamente em tumores de ratos pós-administração IV (Figura 2). Recuperação da cultura de bactérias a partir de ratinhos de amostra valida a existência de uma relação linear entre o número de bactérias viáveis bem como a quantidade de luz detectada (Figura 3). In vivo imaging-administrados por via oral de bactérias comensais na GIT é também conseguida utilizando 3D BLI.
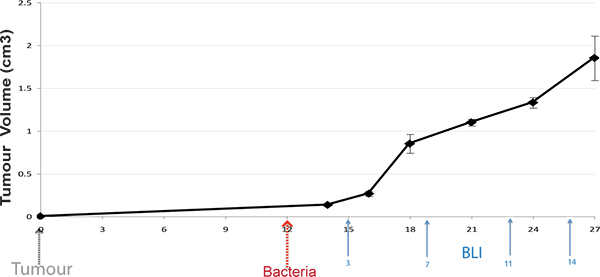
Figura 1. Protocolo Timeline. Tumores subcutâneos são induzidas em ratos, e as bactérias administrado mediante o desenvolvimento de tumores (100 mm 3). Camundongos vivos são BLI imenvelhecido a administração pós vários pontos temporais bacteriana (setas exibir vezes típicas).

Figura 2. A administração de E. luxABCDE coli MG1655 a ratinhos portadores de tumor. tumores subcutâneos 4T1 foram induzidos em MF1 nu / nu e E. luxABCDE coli MG1655 administrado mediante o desenvolvimento de tumores. Cada animal recebeu 10 6 células injectadas directamente na veia lateral da cauda. Ratos foram fotografadas em quatro momentos durante o estudo (pontos pretos eixo z e imagens) com subsequente recuperação de células viáveis (cfu) de tumores de ratinhos sacrificados amostra (gráfico de barras). Aumento no número de bactérias e expressão gênica plasmídeo especificamente nos tumores foi observada ao longo do tempo (mouse representante ilustrado por ponto de tempo). Clique aqui para ver maior figura .
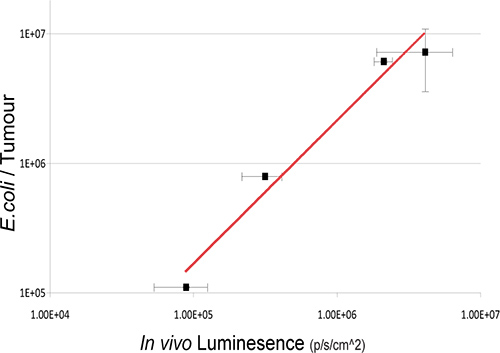
Figura 3. Relação entre intratumoral Números bacteriana e Bioluminescência. Bactérias viáveis em tumores foram enumerados pelo ex vivo cultura bacteriana de tumores após a BLI em vários pontos temporais pós administração IV. Os valores de log de números bacterianas (cfu) em relação a unidades vivo bioluminesce estão representados graficamente. Uma correlação estreita entre as contagens bacterianas e sinais de bioluminescência é observada R 2 = 0,9717 1.
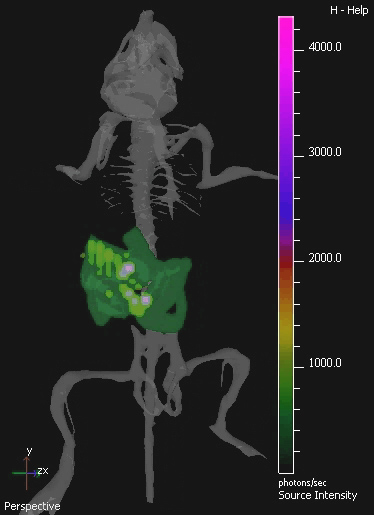
Figura 4. Imagem 3D IVIS do trato gastrointestinal Murino colonizada por E. coli MG1655. O GIT de ratinhos foi colonizada por administração oral de 10 9 CFU de E. coli durante três dias consecutivos. A imagem de amostra isolada de tomografia 3D do mouse colonizado é mostrado.Imagens em 3D mostram um atlas do mouse digital do esqueleto para fornecer registro anatômico. E. bioluminescência coli MG1655 é visível em verde na inferior, e roxo em níveis mais elevados.
Discussão
No contexto da terapia genética, o uso de agentes biológicos para a entrega de genes terapêuticos para pacientes mostrou uma grande promessa 3-5. Como vírus, as propriedades biológicas de bactérias inatas permitir a entrega eficiente do ADN a células ou tecidos, em particular no contexto do cancro. Tem sido demonstrado que as bactérias são naturalmente capazes de homing para tumores quando administrados sistemicamente, resultando em níveis elevados de replicação localmente, quer externas (para nã...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer o apoio relevante para este manuscrito da Comissão Europeia Sétimo Programa-Quadro (PIOF-GA-2009-255466) e do Conselho de Pesquisa irlandês Saúde (HRA_POR/2010/138). Lux-marcado E. coli foi um presente tipo de Dr. Cormac Gahan, Universidade College Cork.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Linha celular 4T1 | ATCC | CRL-2539 | Modelo de cancro da mama singeneico derivado de um tumor espontâneo resultante BALB / c mamária |
| DMEM | Sigma-Aldrich | D6429 | Meio de Dulbecco Modificado de Eagle |
| PBS | Sigma-Aldrich | D8537 | Solução salina tamponada com fosfato |
| Xenogen IVIS | Caliper Life Sciences | IVIS 100 para 2D imagem; IVIS Spectrum para 3D. | |
| Luria Broth Miller (LB) | Sigma-Aldrich | L2542 | O meio de crescimento para E. coli |
| Eritromicina | Sigma-Aldrich | E5389 | Antibiótico |
| Estreptomicina | Sigma-Aldrich | S9137 | Antibiótico |
| Camundongos MF1nu/nu | Harlan (UK) | 069 (nu) / 070 (nu / +) | Hsd: atímicos nu-Foxn1nu |
| Camundongos Balb / c | Harlan (UK) | 066 | Haplotipo H-2 d |
| Agulha de gavagem | Vet-Tech Solutions (UK) | DE009 | 22G x 38mm agulha reta gavagem |
| Seringa para injeção IV | BD BioSciences | 309309-1 ml | Seringa de insulina com 28 x ½ polegadas G micro-agulha fina IV. |
| Seringa para inoculação do tumor | Braun | 9161376V | Omnifix 26 G x ½ agulha polegadas |
Referências
- Cronin, M., et al. High resolution in vivo bioluminescent imaging for the study of bacterial tumour targeting. PLoS One. 7, e30940 (2012).
- Kuo, C., Coquoz, O., Troy, T. L., Xu, H., Rice, B. W. Three-dimensional reconstruction of in vivo bioluminescent sources based on multispectral imaging. J. Biomed. Opt. 12, 024007 (2007).
- Tangney, M., Ahmad, S., Collins, S. A., O'Sullivan, G. C. Gene therapy for prostate cancer. Postgrad Med. 122, 166-180 (2010).
- Morrissey, D., O'Sullivan, G. C., Tangney, M. Tumour targeting with systemically administered bacteria. Curr. Gene Ther. 10, 3-14 (2010).
- Collins, S. A., et al. Viral vectors in cancer immunotherapy: which vector for which strategy. Curr. Gene Ther. 8, 66-78 (2008).
- Yu, Y. A., Zhang, Q., Szalay, A. A. Establishment and characterization of conditions required for tumor colonization by intravenously delivered bacteria. Biotechnol. Bioeng. 100, 567-578 (2008).
- Baban, C. K., Cronin, M., O'Hanlon, D., O'Sullivan, G. C., Tangney, M. Bacteria as vectors for gene therapy of cancer. Bioeng. Bugs. 1, 385-394 (2010).
- Cronin, M., et al. Orally administered bifidobacteria as vehicles for delivery of agents to systemic tumors. Mol. Ther. 18, 1397-1407 (2010).
- van Pijkeren, J. P., et al. A novel Listeria monocytogenes-based DNA delivery system for cancer gene therapy. Hum. Gene Ther. 21, 405-416 (2010).
- Ahmad, S., et al. Induction of effective antitumor response after mucosal bacterial vector mediated DNA vaccination with endogenous prostate cancer specific antigen. J. Urol. 186, 687-693 (2011).
- Riedel, C. U., et al. Improved luciferase tagging system for Listeria monocytogenes allows real-time monitoring in vivo and in vitro. Appl Environ Microbiol. 73, 3091-3094 (2007).
- Cheng, C. M., et al. Tumor-targeting prodrug-activating bacteria for cancer therapy. Cancer Gene Ther. 15, 393-401 (2008).
- Foucault, M. L., Thomas, L., Goussard, S., Branchini, B. R., Grillot-Courvalin, C. In vivo bioluminescence imaging for the study of intestinal colonization by Escherichia coli in mice. Appl. Environ. Microbiol. 76, 264-274 (2010).
- Collins, S. A., Hiraoka, K., Inagaki, A., Kasahara, N., Tangney, M. PET Imaging For Gene & Cell Therapy. Curr. Gene Ther. , (2012).
- Tangney, M., Francis, K. P. In vivo Optical Imaging in Gene & Cell Therapy. Curr. Gene Ther. , (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados