È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Bioluminescent Imaging batterica
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo descrive la somministrazione di Lux-tagged Batteri ai topi e successive In vivo Analisi usando l'imaging bioluminescenza IVIS.
Abstract
Questo video descrive l'uso del corpo intero bioluminesce imaging (BLI) per lo studio di traffico batterica in topi vivi, con un'enfasi sull'uso di batteri in terapia genica e cellulare per il cancro. I batteri presenti una classe interessante di vettore per la terapia del cancro, in possesso di una naturale capacità di crescere preferenzialmente all'interno del tumore dopo somministrazione sistemica. Batteri ingegnerizzati per esprimere il gene lux cassetta rilevamento permesso BLI dei batteri e contemporaneamente siti tumorali. La posizione e livelli di batteri all'interno del tumore nel tempo può essere facilmente esaminato, visualizzati in due o tre dimensioni. Il metodo è applicabile ad una vasta gamma di specie batteriche e tipi xenograft tumorali. In questo articolo si descrive il protocollo per l'analisi dei batteri bioluminescenti in topi portatori di tumore sottocutaneo. Visualizzazione dei batteri commensali del tratto gastrointestinale (GIT) di BLI è anche descritto. Questo potente, ed economico, imaging in tempo reale strategia di rappresentantits un metodo ideale per lo studio dei batteri in vivo nel contesto della ricerca del cancro, in particolare per la terapia genica e le malattie infettive. Questo video illustra la procedura per lo studio lux-tag E. coli in topi vivi, che dimostrano la lettura spaziale e temporale BLI realizzabile utilizzando con il sistema IVIS.
Protocollo
1. Induzione del tumore
- Per l'induzione del tumore di routine, la dose tumorigenica minimo di cellule in sospensione in 200 pl di mezzo privo di siero di coltura è stato iniettato per via sottocutanea (sc) nel fianco di infezione da 6-8 settimane vecchie femmine Balb / C o topi atimici MF1-nu/nu n = 6 (Harlan, Oxfordshire, UK) (1 x 10 6 cellule 4T1) con un ago da 21 gauge siringa. La vitalità delle cellule utilizzate per l'inoculo era maggiore del 95%, come determinato mediante conta visiva utilizzando un emocitometro e Trypan Blue Dye Exclusion (Gibco).
- In seguito all'istituzione del tumore, i tumori è stato permesso di crescere e svilupparsi e sono stati monitorati due volte la settimana. Volume del tumore è stato calcolato secondo la formula V = (ab 2) Π / 6, dove a è il diametro più lungo del tumore e b è il diametro più lungo perpendicolare ad un diametro.
2. Preparazione batterica
- Il ceppo batterico usato in questo protocoEro E. coli K-12 MG1655, una proteina non-tossina-esprimendo ceppo, nascondendo un luxABCDE-plasmide codificante che permette ai batteri di essere rilevato da BLI. E. coli contenenti la MG1655 luxABCDE integrato è stato coltivato in aerobiosi a 37 ° C in terreno LB (Sigma-Aldrich, Irlanda) supplementato con 300 ug / ml eritromicina (Em). Il derivato bioluminescente di MG1655 è stata creata usando il plasmide p16S lux che contiene il AIUTO costitutiva P luxABCDE operone 1.
- Per la preparazione per la somministrazione a topi, le colture sono state incubate in mezzo LB a 37 ° C in un agitatore a 200 rpm a metà log fase (densità ottica a 600 nm). I batteri sono stati raccolti mediante centrifugazione (6000 g per 5 min), lavate con PBS (Sigma), e diluito in PBS 1 × 10 7 unità formanti colonie (ufc) / ml per la somministrazione intravenosa, o 1 x 10 10 per gavage.
3. Batterica ammizione
- Topi sono stati divisi casualmente in gruppi sperimentali quando i tumori raggiunto circa il 100 mm 3 in volume. Per la somministrazione endovenosa, topi trattenuti ciascuno ricevuto 10 6 cellule in 100 pl, iniettato direttamente nella vena caudale laterale usando un ago 28G siringa. Il conteggio vitale di ogni inoculo è stata determinata mediante placcatura retrospettiva.
- Per gli studi di colonizzazione GIT, 10 9 cellule batteriche sono stati somministrati per via orale in 100 microlitri per topo con sonda gastrica, per tre giorni consecutivi. Livelli commensali preesistenti batteriche erano diminuiti prima dell'alimentazione mediante aggiunta di 5 mg / ml di streptomicina in acqua potabile del mouse per 7 giorni prima dell'inizio del gavage orale 1.
4. Imaging bioluminescenza
- 2D in vivo BLI di imaging è stata eseguita utilizzando il IVIS100 (pinza). Al tempo definito dalla somministrazione punti batterica, i topi sono stati anestetizzati con pinza di XGI-8 anestesia gasSistema con 3% isofluorano, e tutto il corpo analisi delle immagini è stata eseguita nel sistema 100 IVIS per 2-5 min ad alta sensibilità.
- Per l'imaging 3D, topi anestetizzati sono stati collocati in una navetta per l'imaging del mouse all'interno del sistema di imaging ottico per l'imaging dorsale (IVIS Spectrum, pinza). Per acquisire immagini del segnale luciferasi batterica per ricostruzione 3D ottico, lunghezze d'onda di emissione del filtro vanno 500-580 nm sono stati usati con bin 16 volte acquisizione di 3-4 min per filtro per massimizzare il rapporto segnale-rumore. Come parte di questa sequenza di acquisizione delle immagini, una immagine di luce strutturata è stata ottenuta per definire una mappa di altezza. Questa mappa era di ingresso di luce diffusa di imaging (tomografia DLIT) algoritmi ricostruzioni che sono stati utilizzati per formare una immagine 3D ottico utilizzando un non negativo almeno ottimizzazione quadrati 2.
- Image Analysis: Regioni di interesse sono stati identificati e quantificati utilizzando il software Living Image (Pinza).
5. RappresentanteRisultati
In questo studio, i batteri non patogeni commensali E. coli K-12 MG1655 che esprime il operone luxABCDE IV è stato somministrato a topi portatori di tumori sc xenotrapianto 4T1. Batterica lux segnale è stato rilevato specificamente in tumori di topi dopo la somministrazione IV (Figura 2). Recupero coltura di batteri da topi campione convalida l'esistenza di una relazione lineare tra il numero di batteri vitali e la quantità di luce rilevata (Figura 3). Imaging in vivo della somministrato oralmente batteri commensali nel GIT si ottiene anche con 3D BLI.
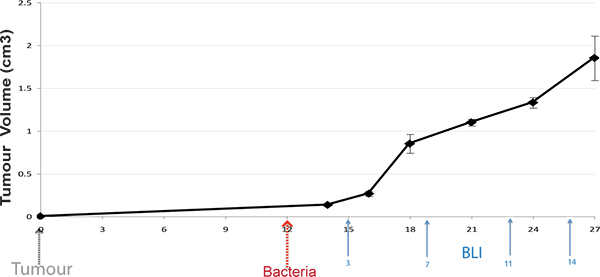
Figura 1. Protocollo Timeline. Tumori sottocutanei sono indotte nei topi, e batteri somministrati sullo sviluppo del tumore (100 mm 3). Topi vivi sono BLI imanni a vari time-point dopo la somministrazione dei batteri (frecce visualizzare tempi tipici).

Figura 2. La somministrazione di E. coli MG1655 luxABCDE di topi affetti da tumore. sottocutaneo tumori 4T1 sono state indotte in MF1 nu / nu topo e E. coli MG1655 luxABCDE somministrato sullo sviluppo del tumore. Ciascun animale ha ricevuto 10 6 cellule iniettate direttamente nella vena caudale laterale. I topi sono stati ripresi in quattro momenti durante lo studio (punti neri asse z e immagini) con successivo recupero di batteri vitali (cfu) da tumori di topi sacrificati campione (grafico a barre). Aumento del numero di batteri e l'espressione genica plasmide particolare nei tumori è stata osservata nel corso del tempo (mouse rappresentante illustrato a punto nel tempo). Clicca qui per ingrandire la figura .
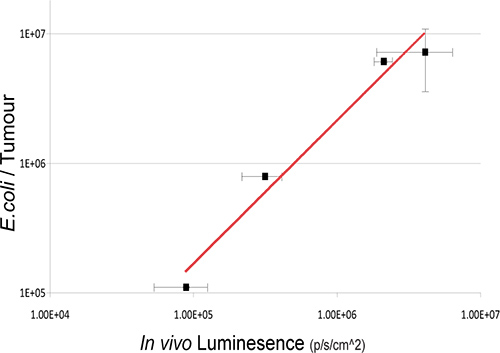
Figura 3. Relazione tra intratumorale Numeri batteriche e bioluminescenza. Batteri vitali nei tumori sono stati enumerati dalla cultura ex vivo batterica da tumori successive BLI a vari time-point dopo somministrazione endovenosa. Entra valori di numeri batteriche (cfu) relativi al vivo unità bioluminesce sono rappresentati graficamente. Una correlazione forte tra la conta batterica e segnali bioluminescenza batterica si osserva R 2 = 0,9717 1.
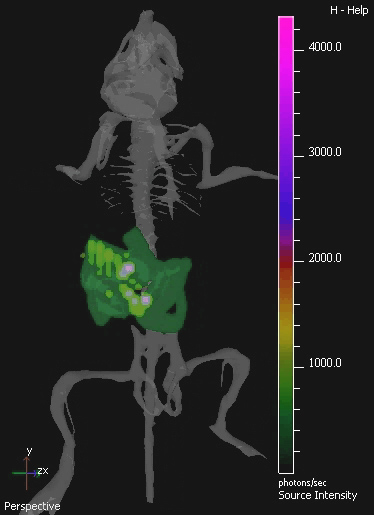
Figura 4. Immagine 3D IVIS di Murine Tratto Gastrointestinale colonizzato da E. coli. MG1655 Il GIT di topi è stato colonizzato da somministrazione orale di 10 9 cfu di E. coli per tre giorni consecutivi. Un'immagine di esempio isolato dalla tomografia 3D del mouse colonizzato viene mostrato.Immagini in 3D mostrano un atlante digitale del mouse dello scheletro per fornire la registrazione anatomica. E. coli MG1655 bioluminescenza è visibile in verde in basso, e viola a livelli più alti.
Access restricted. Please log in or start a trial to view this content.
Discussione
Nel contesto della terapia genica, l'uso di agenti biologici per la consegna dei geni terapeutici per pazienti ha mostrato una grande promessa 3-5. Come virus, le proprietà biologiche innate di batteri consentirà una consegna efficiente DNA di cellule o tessuti, in particolare nel contesto di cancro. E 'stato dimostrato che i batteri sono naturalmente capaci di homing per tumori quando somministrati per via sistemica con conseguente livelli elevati di replica locale, sia esterni (non invasivi specie...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare il sostegno necessario per questo manoscritto della Commissione europea Settimo programma quadro (PIOF-GA-2009-255466) e l'Irish Health Research Board (HRA_POR/2010/138). Lux-tag E. coli è stato un gentile dono del Dr. Cormac Gahan, University College Cork.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
| Linea di cellule 4T1 | ATCC | CRL-2539 | Singenici carcinoma mammario modello derivato da una spontanee BALB / c tumore mammario |
| DMEM | Sigma-Aldrich | D6429 | Medio Dulbecco Modified Eagle |
| PBS | Sigma-Aldrich | D8537 | Soluzione tampone fosfato |
| Xenogen IVIS | Caliper Life Sciences | IVIS 100 per immagini 2D; spettro IVIS per il 3D. | |
| Luria Broth Miller (LB) | Sigma-Aldrich | L2542 | Terreno di coltura per E. coli |
| Eritromicina | Sigma-Aldrich | E5389 | Antibiotico |
| Streptomicina | Sigma-Aldrich | S9137 | Antibiotico |
| MF1nu/nu topi | Harlan (UK) | 069 (nu) / 070 (nu / +) | HSD: nudi atimici-Foxn1nu |
| Topi BALB / c | Harlan (UK) | 066 | Aplotipo: H-2 d |
| Ago gavage | Vet-Tech Solutions (UK) | DE009 | 22G x 38mm dritto ago gavage |
| Siringa per iniezione endovenosa | BD Biosciences | 309.309-1 ml | Siringa da insulina con 28 G x ½ pollici micro-ago sottile IV. |
| Siringa per l'inoculo del tumore | Braun | 9161376V | Omnifix 26 x G ½ ago pollici |
Riferimenti
- Cronin, M., et al. High resolution in vivo bioluminescent imaging for the study of bacterial tumour targeting. PLoS One. 7, e30940(2012).
- Kuo, C., Coquoz, O., Troy, T. L., Xu, H., Rice, B. W. Three-dimensional reconstruction of in vivo bioluminescent sources based on multispectral imaging. J. Biomed. Opt. 12, 024007(2007).
- Tangney, M., Ahmad, S., Collins, S. A., O'Sullivan, G. C. Gene therapy for prostate cancer. Postgrad Med. 122, 166-180 (2010).
- Morrissey, D., O'Sullivan, G. C., Tangney, M. Tumour targeting with systemically administered bacteria. Curr. Gene Ther. 10, 3-14 (2010).
- Collins, S. A., et al. Viral vectors in cancer immunotherapy: which vector for which strategy. Curr. Gene Ther. 8, 66-78 (2008).
- Yu, Y. A., Zhang, Q., Szalay, A. A. Establishment and characterization of conditions required for tumor colonization by intravenously delivered bacteria. Biotechnol. Bioeng. 100, 567-578 (2008).
- Baban, C. K., Cronin, M., O'Hanlon, D., O'Sullivan, G. C., Tangney, M. Bacteria as vectors for gene therapy of cancer. Bioeng. Bugs. 1, 385-394 (2010).
- Cronin, M., et al. Orally administered bifidobacteria as vehicles for delivery of agents to systemic tumors. Mol. Ther. 18, 1397-1407 (2010).
- van Pijkeren, J. P., et al. A novel Listeria monocytogenes-based DNA delivery system for cancer gene therapy. Hum. Gene Ther. 21, 405-416 (2010).
- Ahmad, S., et al. Induction of effective antitumor response after mucosal bacterial vector mediated DNA vaccination with endogenous prostate cancer specific antigen. J. Urol. 186, 687-693 (2011).
- Riedel, C. U., et al. Improved luciferase tagging system for Listeria monocytogenes allows real-time monitoring in vivo and in vitro. Appl Environ Microbiol. 73, 3091-3094 (2007).
- Cheng, C. M., et al. Tumor-targeting prodrug-activating bacteria for cancer therapy. Cancer Gene Ther. 15, 393-401 (2008).
- Foucault, M. L., Thomas, L., Goussard, S., Branchini, B. R., Grillot-Courvalin, C. In vivo bioluminescence imaging for the study of intestinal colonization by Escherichia coli in mice. Appl. Environ. Microbiol. 76, 264-274 (2010).
- Collins, S. A., Hiraoka, K., Inagaki, A., Kasahara, N., Tangney, M. PET Imaging For Gene & Cell Therapy. Curr. Gene Ther. , (2012).
- Tangney, M., Francis, K. P. In vivo Optical Imaging in Gene & Cell Therapy. Curr. Gene Ther. , (2012).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon