需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
生物发光细菌成像
摘要
本文介绍了管理勒克斯标签
摘要
本视频介绍了使用全身生物发光成像(BLI)的细菌贩运活体小鼠为研究对象,利用细菌基因和细胞治疗癌症的重点。存在的细菌有吸引力的载体类用于癌症治疗,全身用药后,肿瘤内优先发展拥有一种天生的能力。细菌的设计,以表达勒克斯基因盒许可证BLI检测的细菌和兼肿瘤部位。肿瘤内随着时间的推移的位置和水平的细菌,可以容易地检查,在两维或三维可视化。的方法,是适用于范围广泛的细菌物种和肿瘤异种移植类型。本文介绍了发光细菌在皮下荷瘤小鼠的协议分析。可视化的共生细菌的胃肠道(GIT)中由BLI也被描述。这种功能强大,而且价格便宜,实时成像战略的代表中TS细菌在体内的背景下,特别是基因治疗,癌症研究,传染病研究的一个理想的方法。此视频概述了研究勒克斯标记E.程序大肠杆菌活体小鼠,展示的空间和时间的读出可以实现利用BLI的IVIS系统。
研究方案
1。诱发肿瘤
- 对于常规的肿瘤诱导,悬浮在200μl的无血清培养基中的细胞的的最低致瘤剂量皮下注射(SC)的到感染的侧翼免费的6-8周龄的雌性Balb / C或无胸腺MF1-nu/nu小鼠的中N = 6(哈伦,英国牛津)(1×10 6 4T1细胞),使用21号注射器针头。用于接种的细胞的存活率大于95%,使用血细胞计数器和台盼蓝染料排除(Gibco)中通过目视计数来确定。
- 肿瘤成立后,肿瘤被允许的成长和发展,并进行了监测,每周两次。根据公式 V =(从头2)Π/ 6, 其中 a为肿瘤的最长直径之和 b是最长的直径垂直的直径为a,计算肿瘤体积。
2。细菌制剂
- 在此protoco使用的细菌菌株L是E。大肠杆菌K-12 MG1655株,非蛋白毒素表达株,窝藏luxABCDE编码,使所要检测的细菌的质粒BLI。E.大肠杆菌 MG1655含有集成luxABCDE的生长需氧条件下,在37℃下在LB培养基(Sigma-Aldrich公司,爱尔兰)与300微克/毫升红霉素(EM)的补充。的生物发光衍生MG1655创建,使用质粒p16S 勒克斯其中包含组成P的帮助 luxABCDE操纵的。
- 对于准备对小鼠给药,在LB培养基中培养的培养物在37℃下在摇床上以200rpm中期日志相(在600nm处的光密度)。收获细菌,通过离心分离(6,000×g离心5 min),用PBS(Sigma公司)洗涤,并稀释在PBS中1×10 7菌落形成单位(cfu)/ ml的静脉注射,或1×10 10管饲法。
3。细菌管理员TION
- 将小鼠随机分为实验组,当肿瘤达到约100毫米的体积。对于静脉内给药,内敛小鼠每个收到的10 6个细胞在100μl,直接注射到横向的尾静脉,用28G注射器针头。每个接种活菌计数进行回顾性电镀。
- GIT殖民研究中,10 9细菌细胞在每100微升鼠标口服灌胃,连续三天。预先存在的共生细菌水平明显下降之前,添加5毫克/毫升链霉素的鼠标饮用水喂养7天前开始口灌胃1。
4。生物发光成像
- 2D 体内 BLI成像进行使用IVIS100(钳)。在特定的时间点后细菌性管理,小鼠Caliper的XGI-8气体麻醉的麻醉在高灵敏度的2-5分钟,用3%的异氟烷,和全身图像分析系统中进行的IVIS 100系统。
- 的三维成像,麻醉小鼠放置在鼠标摄像穿梭背侧成像(IVIS频谱,钳)的光学成像系统的内部。要获得的细菌荧光素酶信号的三维光学重建的图像,发射滤光器的波长范围从500-580纳米,与箱16采集时间3-4分钟每滤波器信噪比最大化使用。该图像采集序列的一部分,结构光图像定义一个高度的地图。本地图的时间输入的漫射光成像体层摄影术(DLIT)重建的算法被用来形成一个三维的光学图像,用一个非负最小二乘优化2。
- 图像分析:利用活体成像软件(钳)地区的利益进行了定性和定量分析。
5。代表结果
在这项研究中,非致病共生细菌的大肠杆菌K-12 MG1655表达luxABCDE操纵子是四轴承SC 4T1异种移植肿瘤的小鼠给药。细菌勒克斯信号,特别是在检测到肿瘤的小鼠IV给药后( 图2)。从样品小鼠细菌培养回收验证存在的活菌数和检测的光的量( 图3)之间的线性关系。 在体内成像口服给药的共生细菌在GIT中也取得了使用3D BLI。
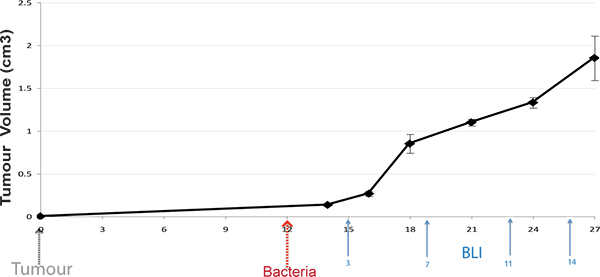
图1。协议的时间轴 。诱导小鼠皮下肿瘤,细菌和管理后,肿瘤发展计划(100毫米)。活体小鼠BLI IM年龄在不同的时间点后细菌性管理(箭头表现出典型的)。

图2。管理E.在MF1 nu / nu小鼠和E. 大肠杆菌 MG1655 luxABCDE荷瘤小鼠皮下 4T1肿瘤诱导大肠杆菌 MG1655 luxABCDE管理后,肿瘤的发展。每个动物接受10 6细胞直接注射到尾静脉。在研究过程中在四个时间点(黑点z轴和图像)与随后的恢复的活菌(菌落形成单位)从样本处死小鼠肿瘤(条形图)对小鼠进行成像。特别是在观察肿瘤随着时间的推移(代表鼠标每个时间点所示)中的细菌数量和质粒基因表达增加。 点击这里查看大图 。
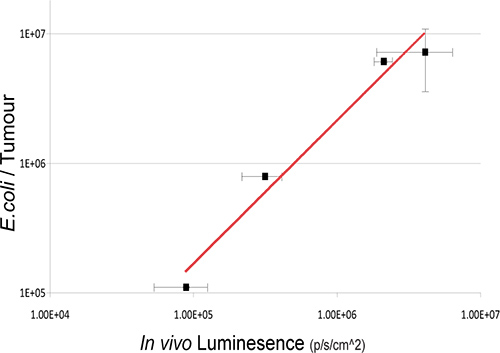
图3。肿瘤后,BLI在不同的时间点后静脉给药, 瘤内细菌数量和生物发光的关系。存活的细菌在肿瘤中列举的体外细菌培养。登录值,细菌总数(CFU)与体内生物发光单元的绘制。一个强大的细菌的数量和细菌的生物发光信号之间的相关性R 2 = 0.9717 1。
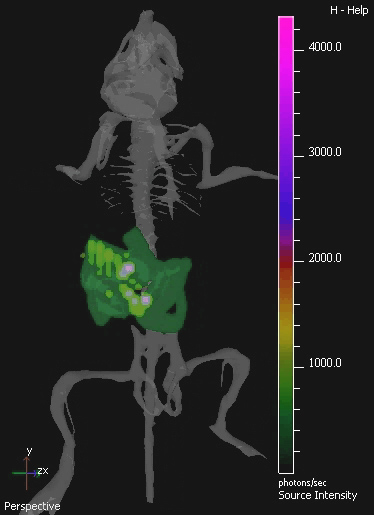
图4。 3D IVIS图片的小鼠胃肠道的殖民地E.大肠杆菌 MG1655的被殖民统治的小鼠口服10 9 cfu的E. GIT 大肠杆菌连续三天。从3D成像的殖民鼠标的样本孤立的形象显示。3D影像显示鼠标数字地图集的骨架,提供解剖学注册。E.大肠杆菌 MG1655的生物发光是在绿色可见在较低的,和紫色在较高的水平。
讨论
在基因治疗的情况下,交付的基因治疗给患者使用生物制剂表现出极大的承诺3-5。如病毒,细菌先天的生物学性质允许高效的DNA传递到细胞或组织,特别是在癌症的上下文中。它已被证明细菌是自然能归巢到肿瘤全身给药时,所得的复制水平高的地方,无论是外部的(非侵入性的物种)或肿瘤细胞(病原体)内。癌特异性的细菌复制最初归因于缺氧的固体肿瘤的性质(低O 2水平)...
披露声明
没有利益冲突的声明。
致谢
作者要感谢支持本稿件相关的力士标记E.欧洲委员会第七框架计划(PIOF-GA-2009-255466)和爱尔兰健康研究委员会(HRA_POR/2010/138)。 大肠杆菌是一种礼物科马克·加恩,科克大学博士。
材料
| Name | Company | Catalog Number | Comments |
| 的试剂的名称 | 公司 | 目录编号 | 评论 |
| 4T1细胞系 | ATCC | CRL-2539 | 同系来自一个自发产生的BALB / c小鼠乳腺肿瘤的乳腺癌模型 |
| DMEM | Sigma-Aldrich公司 | D6429 | Dulbecco改良的Eagle培养基 |
| PBS | Sigma-Aldrich公司 | D8537 | 磷酸盐缓冲液 |
| 精诺真IVIS | 卡尺生命科学 | IVIS 100的二维成像IVIS为3D的频谱。 | |
| 卢里亚肉汤米勒(LB) | Sigma-Aldrich公司 | L2542 | 生长培养基E.大肠杆菌 |
| 红霉素 | Sigma-Aldrich公司 | E5389 | 抗生素 |
| 链霉素 | Sigma-Aldrich公司 | S9137 | 抗生素 |
| MF1nu/nu小鼠 | 哈伦(英国) | 069(女)/ 070(NU / +) | HSD:裸鼠Foxn1nu的 |
| Balb / c小鼠 | 哈伦(英国) | 066 | 单倍型:H-2天 |
| 灌胃针 | 兽医技术解决方案(英国) | DE009 | 22G×38毫米直灌胃针 |
| 注射器静脉注射 | BD Biosciences公司 | 309309 - 1毫升 | 胰岛素注射器与28 G X½英寸的微细四针。 |
| 肿瘤接种的注射器 | 布劳恩 | 9161376V | Omnifix 26 G X&frac12寸毫针 |
参考文献
- Cronin, M., et al. High resolution in vivo bioluminescent imaging for the study of bacterial tumour targeting. PLoS One. 7, e30940 (2012).
- Kuo, C., Coquoz, O., Troy, T. L., Xu, H., Rice, B. W. Three-dimensional reconstruction of in vivo bioluminescent sources based on multispectral imaging. J. Biomed. Opt. 12, 024007 (2007).
- Tangney, M., Ahmad, S., Collins, S. A., O'Sullivan, G. C. Gene therapy for prostate cancer. Postgrad Med. 122, 166-180 (2010).
- Morrissey, D., O'Sullivan, G. C., Tangney, M. Tumour targeting with systemically administered bacteria. Curr. Gene Ther. 10, 3-14 (2010).
- Collins, S. A., et al. Viral vectors in cancer immunotherapy: which vector for which strategy. Curr. Gene Ther. 8, 66-78 (2008).
- Yu, Y. A., Zhang, Q., Szalay, A. A. Establishment and characterization of conditions required for tumor colonization by intravenously delivered bacteria. Biotechnol. Bioeng. 100, 567-578 (2008).
- Baban, C. K., Cronin, M., O'Hanlon, D., O'Sullivan, G. C., Tangney, M. Bacteria as vectors for gene therapy of cancer. Bioeng. Bugs. 1, 385-394 (2010).
- Cronin, M., et al. Orally administered bifidobacteria as vehicles for delivery of agents to systemic tumors. Mol. Ther. 18, 1397-1407 (2010).
- van Pijkeren, J. P., et al. A novel Listeria monocytogenes-based DNA delivery system for cancer gene therapy. Hum. Gene Ther. 21, 405-416 (2010).
- Ahmad, S., et al. Induction of effective antitumor response after mucosal bacterial vector mediated DNA vaccination with endogenous prostate cancer specific antigen. J. Urol. 186, 687-693 (2011).
- Riedel, C. U., et al. Improved luciferase tagging system for Listeria monocytogenes allows real-time monitoring in vivo and in vitro. Appl Environ Microbiol. 73, 3091-3094 (2007).
- Cheng, C. M., et al. Tumor-targeting prodrug-activating bacteria for cancer therapy. Cancer Gene Ther. 15, 393-401 (2008).
- Foucault, M. L., Thomas, L., Goussard, S., Branchini, B. R., Grillot-Courvalin, C. In vivo bioluminescence imaging for the study of intestinal colonization by Escherichia coli in mice. Appl. Environ. Microbiol. 76, 264-274 (2010).
- Collins, S. A., Hiraoka, K., Inagaki, A., Kasahara, N., Tangney, M. PET Imaging For Gene & Cell Therapy. Curr. Gene Ther. , (2012).
- Tangney, M., Francis, K. P. In vivo Optical Imaging in Gene & Cell Therapy. Curr. Gene Ther. , (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。