A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
اشتقاق مدار الساعة من تخليص الغلوتامات مع تحليل Deconvolution من التيارات الناقل نجمي
In This Article
Summary
نحن تصف طريقة تحليلية لتقدير عمر الغلوتامات في الأغشية نجمي من التسجيلات الكهربية من التيارات نقل الغلوتامات في الخلايا النجمية.
Abstract
وتوجد أعلى كثافة من نقل الغلوتامات في الدماغ في الخلايا النجمية. الغلوتامات زوجين نقل الحركة من الغلوتامات عبر الغشاء مع الرئيسين نقل 3 نا + و 1 H + ومكافحة نقل 1 K +. يمكن رصد التيار القياس المتكافئ التي تم إنشاؤها بواسطة عملية النقل مع خلية كاملة التسجيلات التصحيح، المشبك من الخلايا النجمية. يتشكل مدار الساعة من الحالية التي سجلتها مدار الساعة من الملف الشخصي الغلوتامات تركيز التي تتعرض لها الخلايا النجمية، حركية نقل الغلوتامات، وخصائص تيار كهربي السلبي للأغشية نجمي. نحن هنا وصف الطرق التجريبية والتحليلية التي يمكن استخدامها لتسجيل التيارات نقل الغلوتامات في الخلايا النجمية وعزل بالطبع وقت التخليص الغلوتامات من جميع العوامل الأخرى التي تشكل الموجي من التيارات نقل نجمي. الأساليب المذكورة هنا يمكن أن تستخدم لتقدير مدى الحياة سو فلاش uncaged وsynaptically صدر الغلوتامات في الأغشية نجمي في أي منطقة من الجهاز العصبي المركزي أثناء الصحة والمرض.
Introduction
الخلايا النجمية هي واحدة من أنواع الخلايا الأكثر وفرة في الدماغ مع على شكل نجمة التشكل ونتوءات غشاء غرامة التي تمتد في جميع أنحاء neuropil وتصل المجاورة اتصالات متشابك 1،2. هي معبأة غشاء الخلية في الخلايا النجمية "مكتظة مع جزيئات نقل الغلوتامات 3. في ظل الظروف الفسيولوجية، نقل الغلوتامات ربط بسرعة الغلوتامات في الجانب خارج الخلية من غشاء وتحويلها إلى السيتوبلازم الخلية. من خلال القيام بذلك، ونقل حفاظ على انخفاض تركيز القاعدية من الغلوتامات في الفضاء خارج الخلية 4. يتم وضع نقل الغلوتامات في عمليات نجمي غرامة المتاخمة لاستثاري نقاط الاشتباك العصبي في مكان مثالي لربط الغلوتامات صدر خلال الأحداث متشابك كما ينشر بعيدا عن المشقوق متشابك. من خلال القيام بذلك، ونقل أيضا إلى الحد من انتشار الغلوتامات نحو شبه والمناطق خارج متشابك وعلى نقاط الاشتباك العصبي المجاورة، والحد من انتشار المكاني للإشارة مثيرق في الدماغ 5-7.
النقل الغلوتامات هو عملية كهربي بالإضافة إلى stoichiometrically حركة نا 3 + H + 1 وعلى طول بهم الكهروكيميائية والتدرج في مكافحة النقل من 1 K + 8. ويرتبط النقل الغلوتامات مع (ولكن ليس إلى جانب stoichiometrically ل) وهو تصرف أنيوني نفاذا إلى SCN - (ثيوسيانات)> NO 3 - (نترات) ≈ ويتوافق 4 - (بيركلورات)> I -> BR -> الكلورين -> F -، وليس لCH 3 SO 3 - (الميثان سلفونات) وC 6 H 11 O 7 - (غلوكونات) 9-11. كلا التيارين (القياس المتكافئ وغير متكافئة) يمكن تسجيلها من خلال الحصول على كامل الخلية التسجيلات التصحيح، المشبك من الخلايا النجمية، حدد بصريا تحت Dodt الإضاءة أو الأشعة تحت الحمراء الفرق المقابل تدخل (IR-DIC) في acutه شرائح الدماغ 12. المكون متكافئة من التيار المرتبطة بالنقل الغلوتامات عبر الغشاء يمكن أن تكون معزولة باستخدام CH 3 SO 3 -، أو C 6 H 11 O 7 - الحلول المستندة إلى داخل الخلايا ويمكن حركها الغلوتامات فلاش uncaging على الخلايا النجمية 13،14، أو من خلال تفعيل الافراج الغلوتامات من نقاط الاشتباك العصبي المجاورة، إما كهربائيا أو 12 مع جهاز تحكم optogenetic المستهدفة.
يتشكل مدار الساعة من المكون متكافئة من التيار نقل بواسطة عمر الملف الشخصى تركيز الغلوتامات في الأغشية نجمي (أي إزالة الغلوتامات)، حركية نقل الغلوتامات، خصائص الغشاء السلبي من الخلايا النجمية، وخلال التحفيز متشابك، من قبل التزامن من الافراج الغلوتامات عبر نقاط الاشتباك العصبي المنشط 13. نحن هنا وصف بالتفصيل الكامل: (1) على APPR التجريبيةoach لعزل العنصر متكافئة من التيارات نقل الغلوتامات من خلية كاملة التسجيلات التصحيح، المشبك من الخلايا النجمية باستخدام الماوس شرائح الحصين الحادة بمثابة إعداد التجريبية سبيل المثال، (2) نهجا تحليليا لاستخلاص بالطبع وقت التخليص الغلوتامات من هذه التسجيلات 13، 14. هذه الطرق يمكن استخدامها لتسجيل وتحليل التيارات نقل الغلوتامات من الخلايا النجمية في أي منطقة من الجهاز العصبي المركزي.
Protocol
1. إعداد شريحة
- إعداد 500 مل تشريح الحل / التخزين التي تحتوي على (مم): 119 كلوريد الصوديوم، و 2.5 بوكل، 0.5 و CaCl 2، 1.3 MgSO 4 · 7H 2 O، 4 MgCl 2، 26.2 NaHCO 3، 1 ناه 2 ص 4، و 22 الجلوكوز، 320 الميلي أسمول، ودرجة الحموضة 7.4
- استخدام كوب 250 مل لإعداد غرفة الانغمار لشرائح، وملء مع تشريح الحل / تخزين 200 مل، الحارة في حمام الماء عند 34 درجة مئوية، وفقاعة مع 95٪ O 2، 5٪ CO 2.
- الحفاظ على ما تبقى من تشريح الحل / التخزين في زجاجة في 4 درجات مئوية.
- استخدام مادة لاصقة فورية الغراء لإرفاق كتلة آغار الصغيرة (6٪، أعدت في ACSF) على صاحب العينة vibratome وتخزينها في 4 درجات مئوية.
- 30 دقيقة قبل البدء في تشريح، ووضع زجاجة تحتوي على تشريح حل / التخزين في دلو مملوء كريم وفقاعة مع 95٪ O 2، 5٪ CO 2.
ملاحظة: السرعة والدقة لها أهمية قصوى للخطوات تشريح هو موضح أدناه.
- تخدير الماوس (P14-21، C57BL / 6) مع هالوثان / isoflurane و(تم isoflurane وذكرت لتعزيز نجمي امتصاص الغلوتامات 15)، قطع رأس ذلك، وتراجع رأسه في كوب مل تحتوي على 50 الاوكسيجين والبرد تشريح الحل / التخزين.
- إجراء تشريح الدماغ على وضع كيس من الثلج ملفوفة مع المناشف الورقية وتخزينها في -20 درجة مئوية.
- استخدام مشرط لجعل شق الجلد منتصف السهمي على الجانب الظهري للرأس، من أمامي حتى نهاية الذيلية، وفضح الجمجمة.
- ضع شفرة القص أقل من زوج من مقص صغير الجراحية في حفرة القذالي وجعل اثنين من التخفيضات، ونحو اليسار وعلى الجانب الأيمن (زاوية 45 درجة).
- قطع الجمجمة على طول خط منتصف السهمي، من الذيلية إلى نهاية الجبهي.
- إزالة الدماغ مع ملعقة وتراجع في الاوكسيجين والبرد تشريح / التخزين solutiعلى.
- مع مشرط، وجعل خمسة التخفيضات إلى: (1) إزالة بصيلات الشم واللحاء الجبهي، (2) إزالة المخيخ، (3) إزالة الأيسر و(4) الفص الصدغي الأيمن. (5) تفصل بين نصفي الدماغ مع خفض منتصف السهمي.
- الداب شطري الدماغ مع المناشف الورقية لإزالة أي حل الزائدة.
- الغراء السطح الجانبي من كل قسم الدماغ إلى لوحة vibratome قاعدة الباردة: الجانب الظهري من المخ ينبغي أن تواجه شفرة vibratome، ويتعين على الجانب البطني من الدماغ تكون على اتصال مع كتلة آغار، بعيدا عن شفرة vibratome.
ملاحظة: للحصول على شرائح عالية الجودة، فمن المهم أن شطري الدماغ يتم لصقها بإحكام على قاعدة لوحة vibratome. للقيام بذلك، استخدم مادة لاصقة فورية الغراء التي ليست سائلة جدا والتي لا تجف بسرعة كبيرة جدا. - تأمين قاعدة لوحة vibratome إلى غرفة تشريح، تعيين ال شريحةickness عشر إلى 250 ميكرومتر وضبط العرض من المدى شفرة. المضي قدما في تشريح.
ملاحظة: إذا تم كل شيء بشكل صحيح كيفت، وvibratome يجب قطع شرائح مجاور للسهمي من ظهري نحو بطني وسطي من نحو الجانب الوحشي للدماغ. - مرة واحدة وقد مرت النصل من خلال القشرة والحصين، واستخدام مشرط لقطع اللحاء / الحصين من المخ الأوسط ووضع كل شريحة في غرفة الانغمار في 34 ° C.
- تجاهل أول زوجين من شرائح. عادة، 12 شريحة (250 ميكرون سميكة) ويمكن الحصول عليها من الدماغ P14-21 الماوس.
- الحفاظ على شرائح في 34 درجة مئوية لمدة 30 دقيقة، والسماح لهم يبرد إلى درجة حرارة الغرفة لمدة 30 دقيقة قبل استخدامها للتسجيلات الكهربية.
2. تحديد نجمية وتسجيلات
- إعداد الحل الداخلي التي تحتوي على (مم): 120 KCH 3 SO 3، 10 EGTA، 20 HEPES، 2 MgATP، 0.2 NaGTP،5 QX-314Br، و 5 كلوريد الصوديوم، 290 الميلي أسمول، ودرجة الحموضة 7.2.
- يعد حل خارج الخلية التي تحتوي على تسجيل (مم): 119 كلوريد الصوديوم، و 2.5 بوكل، 2.5 و CaCl 2، 1.3 MgSO 4 · 7H 2 O، 1 MgCl 2، 26.2 NaHCO 3، 1 NaHPO 4، و 22 الجلوكوز، 300 الميلي أسمول، ودرجة الحموضة 7.4 ، مشبعة 95٪ O 2، 5٪ CO 2.
- إضافة الأدوية التالية إلى الحل تسجيل خارج الخلية، لمنع تفعيل GluA، GluN، mGluRII، mGluRIII، GABA A، B GABA، ومستقبلات الأدينوزين A1 (في ميكرومتر): 10 2،3-Dioxo-6-نيترو-1، 2،3،4-tetrahydrobenzo [ƒ] quinoxaline-7-السلفوناميد الصوديوم الملح (NBQX)، 10 (RS) -3 - (2-carboxypiperazin-4-YL)-بروبيل-1-الفوسفونيك حامض (CPP)، (2S )-2-الأمينية-2-[(1S، 2S)-2-carboxycycloprop-1-YL] -3 - (xanth-9-YL) propanoic حامض الصوديوم الملح (LY341495)، و 100 (R، S)-α- methylserine-O-الفوسفات (MSOP)، و 100 بيكروتوكسين، 5 3 - [[(3،4-Dichlorophenyl) الميثيل] الأمينية] ن] diethoxymethyl) حمض phosphinic (CGP52432)، 18 cyclopentyl-1 ،3-dipropylxanthine (DPCPX).
- ضبط درجة الحرارة من الحل خارج الخلية في غرفة تسجيل؛ درجات الحرارة النموذجية هي ما بين 34-36 درجة مئوية.
- إعداد أقطاب التصحيح، المشبك من البورسليكات الزجاج الشعيرات الدموية (R ≈ 2.5 MΩ) باستخدام ثنائي المرحلة، والزجاج الصغيرة ماصة مجتذب.
- تأخذ واحدة من شرائح ووضعه في غرفة تسجيل. عقد عليه مع القيثارة المعدن المصنوع من سلك البلاتين وخيوط النايلون.
- تفقد البصر شرائح تحت Dodt إضاءة أو IR-DIC. يمكن التعرف على الخلايا النجمية التي كتبها أجسامهم زنزانة صغيرة (O = 10 ميكرون) ونواة بارزة (الشكل 1).
- لالتحفيز متشابك، ووضع ثنائي القطب غير القابل للصدأ الصلب الكهربائي، ~ 100 ميكرومتر بعيدا عن نجمية التي تخطط لرأب الصدع.
- تصحيح نجمية وكسر في تكوين خلية كاملة من خلال تطبيق الشفط لطيف جدا.
ملاحظة: النجمية وعادة ما يكون منخفض مقاومه مدخلاته (~ 10 MΩ)، hyperpolarized غشاء المحتملة يستريح (~ -90 بالسيارات)، وأي نشاط اطلاق النار. يتم الاحتفاظ الخلايا النجمية في إمكاناتها غشاء يستريح طوال التجارب في وضع الجهد المشبك (أي الحالية عقد يجب قراءة 0 باسكال). قبل كل التحفيز، يتم استخدام 10 مللي hyperpolarizing خطوة الجهد (فولت -3) لرصد سلسلة والمقاومة مدخلات نجمية. - تجاهل التسجيلات إذا كانت التغييرات سلسلة المقاومة> 20٪ أو إذا كان غشاء المحتملة من نجمية يصبح استقطابها. غشاء المحتملة من نجمية يمكن قياسها مباشرة عن طريق التحول من الجهد المشبك إلى الوضع الحالي، المشبك. بدلا من ذلك، أثناء وجوده في وضع الجهد المشبك، وإمكانات غشاء يمكن رصدها من خلال قراءة قيمة احتمال عقد ينتج عنه 0 باسكال عقد الحالي.
- إذا كنت تعمل التحفيز متشابك، المحفزات بديل واحد وإقران (على سبيل المثال 100 ميللي ثانية بعيدا)، كل 10-20 ثانية.
- للأشعة فوق البنفسجية experim التحلل الضوئيالوالدان، توصيل مصباح اكس uncaging إلى ميناء epifluorescence من المجهر وإضافة مركب قفص إلى حل خارج الخلية. التيارات نقل من ~ 100 باسكال سعة يمكن الحصول عليها عندما فلاش uncaging 100 ميكرومتر MNI-L-الغلوتامات في المجال الكامل للعرض (O = 662.5 ميكرومتر عند استخدام هدفا 40X 14). التحفيز تتناوب مع مسار الضوء المفتوحة والمحظورة، كل 10-20 ثانية.
- استحضار العابرين الغلوتامات والتيارات نقل سجل في ظروف الرقابة وفي وجود تركيز تشبع الفرعية للواسعة الطيف الغلوتامات نقل خصم D، L-threo-β-Benzyloxyaspartic حمض (TBOA، و 10 ميكرومتر) للحد من السعة الحالية نقل إلى 30٪ على الأقل من قيمة سيطرتها (انظر القسمين 4 و 5) أو في وجود تركيز عال من TBOA (50-100 ميكرون) لمنع التيارات نقل تماما وعزل K +-مستمرة الحالية (انظر القسم 3) .
3. Pharmacعزل ological من K +-المطرد الحالي
- تسجيل التيارات نجمي في ظروف السيطرة وبحضور عالية، وتركيز تشبع من TBOA (50-100 ميكرون).
- متوسط لا يقل عن 20 الاحتلالات في TBOA (50-100 ميكرون).
- تناسب آثار بلغ متوسط حصلت في 3.2 مع وظيفة:
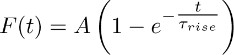
ملاحظة: المكون TBOA الأحرف (أي واحد التي يتم تسجيلها في وجود TBOA (50-100 ميكرون)) يمثل K +-المستدام الحالية. ويقترب بالطبع وقتها بواسطة الدالة أحادية الأسي هو موضح أعلاه. - كرر هذا مناسبا عبر الخلايا النجمية المختلفة واستخلاص قيمة متوسط ارتفاع Τ (أي متوسط زمن صعود مستمر + K-الحالية (انظر القسم 5)).
4. أناتحلول من الجزء الميسر من التيارات الناقل Synaptically المنشط (fSTCs)
- متوسط لا يقل عن 20 الاحتلالات التي تم الحصول عليها مع التحفيز المقترنة، في ظروف السيطرة وفي TBOA (10 ميكرومتر) (الشكل 2A اليسار).
- متوسط عدد مماثل من الاحتلالات التي تم الحصول عليها مع التحفيز واحد، في ظروف السيطرة وفي TBOA (10 ميكرومتر) (الشكل 2A الأوسط).
- مقارنة السعة من متوسط الاستجابة الحالية إلى الجهد بالسيارات -3 خطوة في أربعة آثار بلغ متوسط (مراقبة نبض واحد، ومراقبة المقترنة-البقول، TBOA نبض واحد، TBOA تقرن-البقول).
- إذا كان مدى الاستجابة الحالي هو نفسه في كل آثار أربعة، انتقل إلى الخطوة 4.7.
- إذا اتساع متوسط الاستجابة الحالية يختلف في أي من آثار أربعة، والتحقق من أن كل آثار الفردية كانت مناسبة لإدراجها في المتوسط.
- إذا كانت السعة من المتوسط الحالي يختلف في أي من آثار أربعة، ولكن كل فيآثار dividual مناسبة لإدراجها في المتوسط، تحقق من أن تتبع في كل من حجم موازين fSTC خطيا مع حجم الاستجابة الحالية إلى الجهد خطوة الاختبار. إذا كان هذا هو الحال، توسيع نطاق كل آثار مع الاحترام لبعضهما البعض بحيث الاستجابات الحالية للجهد الخطوة اختبار متساوون جميعا في السعة.
ملاحظة: في ظروف التسجيل الموضحة هنا (أي الخلايا CH 3 SO 3 - أو C 6 H 11 O 7 -)، التحفيز متشابك من المحاور مثير توليد التيارات نجمي مع الطول الموجي المعقدة التي تتكون من حالة ارتفاع سريع متكافئة الداخل عابر الحالية وبطيئة -ارتفاع، أصيب K +-الداخل الحالي يعكس K + إعادة موازنة في الفضاء خارج الخلية بعد انتشار العمل المحتملة على طول محاور عصبية مجاورة. فمن الأهمية بمكان لإزالة هذا K + المطرد في الحالي، مثل أي الحالية المتبقية من شأنه أن يؤدي إلىالمبالغة في تقدير مدى الحياة الغلوتامات. - طرح متوسط التتبع التي تم الحصول عليها مع التحفيز واحدة من المتوسط التتبع التي تم الحصول عليها مع التحفيز الاقتران (الشكل 2A اليمين). تسمح هذه الخطوة عزل متكافئة ومستدامة + K-الحالية التي حركها التحفيز الثانية.
- تحويل متوسط التتبع التي تم الحصول عليها مع التحفيز من جانب واحد فاصل زمني يطابق الفاصل الزمني بين نبضة المستخدمة لتقديم المقترنة-البقول (أي 100 ميللي ثانية) (الشكل 2B).
- طرح في الوقت تحولت متوسط الاستجابة التي تم الحصول عليها مع التحفيز واحد من الاستجابة متوسط إلى تحفيز ثانية حصلت في 4.7 (الشكل 2C). هذه الخطوة يعزل جزء سهلت للتيار نقل التي حركها التحفيز الثاني (fSTC).
- في معظم الحالات، فإن الخطوة السابقة يزيل تماما K +-المستدام الحالية. إذا كان هذا هو الحال، عزلة fSTC كاملة ويمكنك اإلجراءاتإد مع تحليل deconvolution واشتقاق بالطبع وقت التخليص الغلوتامات من الخلايا النجمية. في بعض الحالات، ومع ذلك، K +-المستدام الصغيرة الحالية لا تزال موجودة (الشكل 2D) ومطلوب مزيد من التحليل (انظر القسم 5).
ملاحظة: تذكر أن التحليل هو موضح في 4،7-4،10 يجب أن يؤديها على متوسط آثار التي تم الحصول عليها في ظروف الرقابة وفي TBOA (10 ميكرومتر).
5. الطرح من K +-zdustained المتبقية الحالية من fSTCs
- قياس السعة للK + المستدام المتداولة المتبقية بعد إجراء تحليل وصفها في القسم 4.
- مقياس السعة من وظيفة أحادية الأسي هو موضح في 3.3 إلى اتساع مستمر K +-المتبقية الحالية في قياس 5.1 (الشكل 2D اليسار والوسط). للقيام بذلك، في المعادلة 3.3، تعيين الأجل A يساوي اتساع مستمر K + متداولة عنيasured في 5.1 و على المدى Τ ارتفاع يساوي متوسط قيمة Τ ارتفاعا مقداره 3.4 في.
- طرح الناتج وظيفة أحادية الأسي من K fSTC ومستدامة +-الحالية التي تم الحصول عليها في 4.10 (الشكل 2D اليمين). هذه الخطوة يكمل عزلة fSTC.
6. عزل التيارات الناقل فلاش المنشط (FTCs)
- متوسط لا يقل عن 20 الاحتلالات التي تم الحصول عليها مع مسار الضوء مفتوحة، في ظروف السيطرة وفي TBOA (10 ميكرومتر).
- متوسط عدد مماثل من الاحتلالات التي تم الحصول عليها مع مسار الضوء مغلقة، في ظروف السيطرة وفي TBOA (10 ميكرومتر).
- مقارنة مدى الاستجابة الحالية إلى الجهد بالسيارات -3 خطوة في أربعة آثار بلغ متوسط (مراقبة نبض واحد، ومراقبة المقترنة-البقول، TBOA نبض واحد، TBOA تقرن-البقول).
- إذا كان مدى الاستجابة الحالي هو نفسه في كل آثار أربعة، انتقل إلى الخطوة 6.7.
- وإذا كان اتساع متوسط استجابة الحالية تختلف في أي من آثار أربعة، والتحقق من أن كل آثار الفردية كانت مناسبة لإدراجها في المتوسط.
- إذا كانت السعة من المتوسط الحالي يختلف في أي من آثار أربعة، ولكن كل آثار الفردية هي مناسبة لإدراجها في المتوسط، تحقق من أن في كل التتبع مع مسار الضوء فتح حجم موازين FTC خطيا مع حجم الاستجابة الحالية إلى الجهد خطوة الاختبار. إذا كان هذا هو الحال، توسيع نطاق كل آثار مع الاحترام لبعضهما البعض بحيث الاستجابات الحالية للجهد الخطوة اختبار متساوون جميعا في السعة.
ملاحظة: في ظروف التسجيل الموضحة هنا (أي الخلايا CH 3 SO 3 - أو C 6 H 11 O 7 -)، المحفزات فلاش توليد التيارات نجمي يتكون فقط للارتفاع سريع عابر متكافئة الداخل الحالي. - طرح متوسط التتبع التي تم الحصول عليها مع بات ضوءح منعت من متوسط التتبع التي تم الحصول عليها مع مسار الضوء مفتوح. تسمح هذه الخطوة إزالة قطعة أثرية التحفيز وعزل FTCs.
ملاحظة: يجب إجراء تحليل وصفها في 6.7 في المتوسط آثار التي تم الحصول عليها في ظروف الرقابة وفي TBOA (10 ميكرومتر).
7. تحليل Deconvolution
- تناسب نقل الحالية (fSTC أو FTC) سجلت في ظروف التحكم (الشكل 3A اليسار) وTBOA (10 ميكرومتر) (الشكل 3A اليمين) ومعزولة كما هو موضح في الأقسام 4-6، مع وظيفة متعددة الأسي:

- إنشاء وظيفة ارتفاع الفور أن يضمحل أحادية أضعافا مضاعفة وفقا للوظيفة:
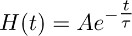
وأن أفضل وصف للمرحلة المتحللة من التيار نقل المسجلة في TBOA (10 ميكرومتر) (الشكل 3B).
ملاحظة: وظيفة وصفها في 7.2 (أي H (T)) يمثل بالطبع وقت التخليص الغلوتامات من الخلايا النجمية في حضور TBOA (10 ميكرومتر). - Deconvolve وظيفة أحادية الأسي التي تم الحصول عليها في 7.2 (الشكل 3B 3C والأوسط) من نوبة من التيار نقل المسجلة في TBOA (10 ميكرومتر) التي تم الحصول عليها في 7.1 (يمين، يسار ج الشكل 3A).
ملاحظة: deconvolution هو عملية حسابية تضمنت في العديد من حزم برامج التحليل مثل (على سبيل المثال مطلب، بيثون). في IgorPro، رمز البرمجة التي نستخدمها عادة لتنفيذ هذا النوع من التحليل، وعملية deconvolution يمكن حسابها بكفاءة كما هو موضح أدناه، وذلك باستخدام فورييه السريع منفصلة يحول. أولا، استخدام عملية الاتحاد الفرنسي للتنس على حساب ديscrete تحويل فورييه السريع وظيفة أحادية الأسي التي تم الحصول عليها في و7.2 من نوبة من التيار نقل المسجلة في TBOA حصلت في 7.1. المقبل، استخدم العملية IFFT لحساب معكوس المنفصلة تحويل فورييه السريع من نسبة وظائف الاتحاد الفرنسي للتنس اثنين. وظيفة الناتجة الأول (ر) يمكن وصفها على النحو التالي: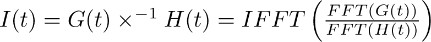
الخطوة موضح في 7.3 يسمح اشتقاق مرشح للنقل الحالي في TBOA (10 ميكرومتر) (الشكل 3C اليمين). مرشح يمثل عوامل التشويه التي تحول عمر الغلوتامات في الأغشية نجمي في نقل معزولة الحالي في الأقسام 4-6 (أي fSTC أو FTC). - Deconvolve مرشح (الشكل 3C الحق، الشكل 3D الأوسط) من نوبة من الناقل الحالي في ظروف التحكم (الشكل 3A اليسار، الشكل 3D اليسار).
ملاحظة: هذه الخطوة تتيح اشتقاق بالطبع وقت التخليص الغلوتامات من الخلايا النجمية في ظروف التحكم (الشكل 3D اليمين). الافتراض الأساسي هذه الخطوة deconvolution هو أن ملف التعريف الزمني للمرشح يبقى دون تغيير في ظروف الرقابة وفي TBOA (10 ميكرومتر). - للحصول على تقدير كمي للدورة الوقت الكلي لإزالة الغلوتامات، وحساب النقطه الوسطى () من الموجي حصلت عليه في الخطوة 7.4. ويتم ذلك عن طريق حساب على النحو التالي:
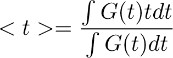
حيث G (T) هو الموجي حصلت عليه في الخطوة 7.1. في المعادلة المذكورة أعلاه، فإن مصطلح تي يتوافق مع الإطار الزمني الذي يتم احتساب يتجزأ.
ملاحظة: عندما تأسست الأسلوب الأول،تم حساب عبر Windows الوقت الذي تركت غير المقيدة 13. هذا النهج يمكن استخدامها طالما تم تعيين إطار التكامل لتكون أوسع من مدة التخليص الغلوتامات ويضمحل الموجي التخليص يعود تماما إلى خط الأساس. إذا لم تكن هذه هي الحالة، ومع ذلك، وهذه الطريقة لتقدير واجه بعض القيود. على سبيل المثال، إذا كان الموجي التخليص لا تتحلل تماما مرة أخرى إلى خط الأساس، ثم يزيد مع عرض النافذة التكامل. لتجنب أي مصدر محتمل لعدم دقة لتقدير ، ونحن الآن حساب ذلك خلال نافذة زمنية الموافق 10٪ من ذروة نقل الحالية، قبل وبعد 14 بدايته. هذا النهج الأخير يحسن الاتساق مع الذي يقاس عبر الخلايا. هذا يأتي في متناول اليدين وخاصة عند تحليل آثار صغيرة من العلاجات الدوائية على مدار الساعة من التطهير.
النتائج
نجاح النهج التحليلي الموصوفة هنا يتوقف بصورة حاسمة على الحصول على التسجيلات الكهربية ذات جودة عالية من التيارات نقل من الخلايا النجمية في أي منطقة من الجهاز العصبي المركزي. في الماوس شرائح الحصين الحادة، والخلايا النجمية يمكن تحديدها بسهولة تحت Dodt إضاءة أو IR-DIC لما ?...
Discussion
نحن هنا وصف نهج تجريبي للحصول على التسجيلات الكهربية من الخلايا النجمية، بروتوكول التحليلية لعزل التيارات نقل الغلوتامات في الخلايا النجمية وطريقة رياضية لاشتقاق بالطبع وقت التخليص الغلوتامات من التيارات نقل نجمي.
نجاح التحلي...
Disclosures
الكتاب تعلن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل المعهد الوطني للاضطرابات العصبية والسكتة الدماغية برنامج بحوث جماعية (NS002986). كما كتب مخطوطة وتنفيذ تحليل deconvolution. وضعت دكتوراه النسخة الأولية من تحليل deconvolution وعلق على النص.
Materials
| Name | Company | Catalog Number | Comments |
| CGP52432 | Tocris | 1246 | |
| (R,S)-CPP | Tocris | 173 | |
| DPCPX | Tocris | 439 | |
| LY341495 disodium salt | Tocris | 4062 | |
| MSOP | Tocris | 803 | |
| NBQX disodium salt | Tocris | 1044 | |
| D,L-TBOA | Tocis | 1223 | |
| Picrotoxin | Sigma | P1675 | |
| MNI-L-glutamate | Tocris | 1490 | |
| Alexa 594 | Life Technologies | A10438 | Optional |
| Matrix electrodes | Frederick Haer Company | MX21AES(JD3) | |
| Borosilicate glass capillaries | World Precision Instruments | PG10165-4 | |
| Dual-stage glass micro-pipette puller | Narishige | PC-10 | |
| Loctite 404 instant adhesive | Ted Pella | 46551 | |
| Xe lamp | Rapp OptoElectronic | FlashMic | |
| Igor Pro 6 | Wavemetrics |
References
- Ventura, R., Harris, K. M. Three-dimensional relationships between hippocampal synapses and astrocytes. J. Neurosci. 19, 6897-6906 (1999).
- Witcher, M. R., Kirov, S. A., Harris, K. M. Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus. Glia. 55, 13-23 (2007).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Herman, M. A., Jahr, C. E. Extracellular glutamate concentration in hippocampal slice. J. Neurosci. 27, 9736-9741 (2007).
- Arnth-Jensen, N., Jabaudon, D., Scanziani, M. Cooperation between independent hippocampal synapses is controlled by glutamate uptake. Nat. Neurosci. 5, 325-331 (2002).
- Barbour, B. An evaluation of synapse independence. J. Neurosci. 21, 7969-7984 (2001).
- Rusakov, D. A., Kullmann, D. M. Extrasynaptic glutamate diffusion in the hippocampus: ultrastructural constraints, uptake, and receptor activation. J. Neurosci. 18, 3158-3170 (1998).
- Zerangue, N., Kavanaugh, M. P. Flux coupling in a neuronal glutamate transporter. Nature. 383, 634-637 (1038).
- Eliasof, S., Jahr, C. E. Retinal glial cell glutamate transporter is coupled to an anionic conductance. Proc. Natl. Acad. Sci. U.S.A. 93, 4153-4158 (1996).
- Wadiche, J. I., Amara, S. G., Kavanaugh, M. P. Ion fluxes associated with excitatory amino acid transport. Neuron. 15, 721-728 (1995).
- Wadiche, J. I., Kavanaugh, M. P. Macroscopic and microscopic properties of a cloned glutamate transporter/chloride channel. J. Neurosci. 18, 7650-7661 (1998).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. J. Neurosci. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H. Neuronal transporters regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. J. Neurosci. 29, 14581-14595 (2009).
- Zuo, Z. Isoflurane enhances glutamate uptake via glutamate transporters in rat glial cells. Neuroreport. 12, 1077-1080 (2001).
- Barbour, B., Brew, H., Attwell, D. Electrogenic uptake of glutamate and aspartate into glial cells isolated from the salamander (Ambystoma) retina. J. Physiol. 436, 169-193 (1991).
- Bergles, D. E., Tzingounis, A. V., Jahr, C. E. Comparison of coupled and uncoupled currents during glutamate uptake by GLT-1 transporters. J. Neurosci. 22, 10153-10162 (2002).
- Diamond, J. S., Jahr, C. E. Synaptically released glutamate does not overwhelm transporters on hippocampal astrocytes during high-frequency stimulation. J. Neurophysiol. 83, 2835-2843 (2000).
- Benediktsson, A. M., et al. Neuronal activity regulates glutamate transporter dynamics in developing astrocytes. Glia. 60, 175-188 (2012).
- Hires, S. A., Zhu, Y., Tsien, R. Y. Optical measurement of synaptic glutamate spillover and reuptake by linker optimized glutamate-sensitive fluorescent reporters. Proc. Natl. Acad. Sci. U.S.A. 105, 4411-4416 (2008).
- Scimemi, A., Meabon, J., Woltjer, R. L., Sullivan, J. M., Diamond, J. S., Cook, D. G. Amyloidβ1-42 slows clearance of synaptically-released glutamate by mislocalizing astrocytic GLT-1. J. Neurosci. 33, 5312-5318 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved