需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
星形细胞转运电流派生谷氨酸间隙的时间进程与反卷积分析
摘要
我们描述了一个分析估计寿命星形胶质膜谷氨酸在星形胶质细胞谷氨酸转运电流的电生理记录的方法。
摘要
发现大脑中的谷氨酸转运体密度最高的星形胶质细胞。谷氨酸转运体的移动耦合谷氨酸穿过细胞膜的与共同运输3的Na +和1 H +和1 K计数器运输+。运输过程中所产生的化学计量电流可以监视从星形胶质细胞与全细胞膜片钳记录。的时间过程中所记录的电流的时间过程中谷氨酸的浓度分布的星形胶质细胞暴露,谷氨酸转运体的动力学,和被动电张性能的星形胶质细胞的膜的形状。这里,我们描述的实验和分析的方法,可用于记录在星形胶质细胞谷氨酸转运体的电流和隔离的谷氨酸间隙从所有的其他因素而形成波形的星形胶质细胞的转运电流的时间过程。这里描述的方法可以被用来估计的生命周期F闪光灯开锁和突触释放的谷氨酸在任何地区的中枢神经系统在健康和疾病中的星形胶质细胞的膜。
引言
星形胶质细胞是大脑中的星形形态和细膜突起,扩展到整个神经纤维到达邻近的突触联系1,2最丰富的细胞类型之一。星形胶质细胞的细胞膜被密密麻麻的与谷氨酸转运分子3。谷氨酸转运体在生理条件下,迅速地结合在细胞外谷氨酸侧膜,并将其转移到细胞的细胞质中。通过这样做,转运保持较低的基底浓度的谷氨酸在细胞外空间4。精美的星形胶质细胞的过程相邻兴奋性突触的谷氨酸转运体在理想的位置,结合谷氨酸突触活动期间发布,因为它远离突触间隙扩散。通过这样做,运输也限制对围绝经期和额外的突触区域到相邻的突触的谷氨酸溢出,减少兴奋信号的空间传播5-7大脑S IN。
谷氨酸转运是一个生电的过程中化学计量的运动耦合到3 Na +和H +的电化学梯度沿它们的1 K + 8的逆运输。谷氨酸运输相关的(但不是化学计量)阴离子电导渗透到SCN - (硫氰酸盐)> NO 3 - (硝酸)≈CLO 4 - (高氯酸盐)> - > - >氯- > F -不CH 3 SO 3 - (甲烷磺酸钠)和C 6 H 11 O 7 - (葡萄糖酸钙)9-11。这两个电流(化学计量的和非化学计量的),可记录,可通过获得全细胞膜片钳记录从星形胶质细胞,视觉识别根据DODT照明或者红外微分干涉对比(IR-DIC)ACUTê大脑切片12。当前与谷氨酸转运穿过膜的化学计量成分,可以分离通过使用CH 3 SO 3 - ,或C 6 H 11 O 7 -基于细胞内的解决方案,可诱发的星形胶质细胞的闪光uncaging谷氨酸对13,14,或从邻近的突触激活谷氨酸释放,无论是电12或有针对性的光遗传学控制。
的化学计量成分的转运电流的时间过程中被成形由谷氨酸浓度资料在星形胶质细胞的膜( 即谷氨酸间隙)的生存期,谷氨酸转运体动力学的,被动的星形胶质细胞的膜性能,并在突触的刺激,由同步跨激活突触13谷氨 酸的释放。在这里,我们描述的全部细节:(1)实验:约oach隔离电流全细胞膜片钳记录从使用急性小鼠海马脑片作为一个例子实验准备的星形胶质细胞谷氨酸转运体的化学成分;(2)分析法得出谷氨酸清除的时间当然从这些录音13, 14。这些方法可用于记录和分析在中枢神经系统的任何区域中星形胶质细胞谷氨酸转运电流。
研究方案
1。切片制备
- 准备500毫升/存储解决方案(单位:mm):119氯化钠,氯化钾2.5 1.3 0.5 氯化钙 , 硫酸镁 ·7H 2 O,4 氯化镁 ,26.2的NaHCO 3,1的NaH 2 PO 4,和22葡萄糖,320切片毫渗量,pH值7.4
- 使用250毫升的烧杯中,准备淹没室,为片,填充200毫升切片/存储解决方案,在水浴加热34°C和95%O2,5%CO2泡沫。
- 保留剩下的切片/存储解决方案的玻璃瓶中,在4°C。
- 使用氰基丙烯酸酯粘接剂vibratome的样本保持器上附加一个小的琼脂块(6%时,制备的人工脑脊液),并将其存储在4℃下
- 前30分钟开始切片,将切片/存储解决方案,在一个桶充满了冰,用95%O 2,5%CO 2的气泡的玻璃瓶中。
注:速度和精度是最重要的解剖步骤如下所述。
- 氟烷麻醉鼠标(P14-21,C57BL / 6)/异氟醚(异氟醚已上报增强星形胶质细胞谷氨酸摄取15),斩首,头浸在50毫升烧杯中含氧,冷切片/存储解决方案。
- 用纸巾包裹,并储存于-20℃下在冰包进行大脑的解剖
- 使用手术刀作出头的背侧正中矢状切开皮肤,从正面尾端,暴露颅骨。
- 将较低的剪切刀片,手术剪一双小枕骨孔和两个切口,向左侧和右手边(45°角)。
- 沿正中矢状线切割颅骨,从尾至额叶结束。
- 取出大脑,用锅铲蘸在含氧,冷的切片/存储的解决方案上。
- 用手术刀,五年削减:(1)取出嗅球和额叶皮层(2)删除小脑;(3)删除(4)左右颞叶(5)分开的两个大脑半球与中矢状切。
- 轻拍大脑的两个部分用纸巾,以消除任何多余的溶液。
- 胶各脑切片的侧表面冷vibratome的基板的大脑背侧应朝向vibratome的叶片腹侧的大脑应该是在琼脂块的接触,相差的vibratome的叶片。
注意:取得最高品质的片,重要的是,这两个部位的脑牢固地粘在vibratome的基板。要做到这一点,使用氰基丙烯酸酯胶粘剂,是不是太液不干燥太快。 - vibratome的底板固定解剖室,设置片日ickness至250μm的宽度,并调整刀片运行。继续与切片。
注意:如果一切正确的方向,vibratome的应切割矢状切片从背侧向腹侧和从内侧向大脑的横向侧。 - 一旦通过大脑皮层和海马的刀刃,用手术刀切的脑皮层/海马淹没室将每个切片在34°C。
- 丢弃的第一对夫妇的切片。通常情况下,可以得到12片(厚度为250μm),从P14-21小鼠脑。
- 片在34℃保持30分钟,并让它们冷却至室温30分钟,然后使用这些电录音。
2。星形胶质细胞的识别和录音
- 准备的内部溶液含有(以mM计):120许3 SO 3,10 EGTA,20 HEPES,2 MgATP,0.2 NaGTP5 QX-314Br的,氯化钠,290毫渗量,pH值7.2。
- 准备外的录音解决方案(单位:mm):119氯化钠,2.5氯化钾, 氯化钙 2.5 1.3硫酸镁4·7H 2 O,1 氯化镁 ,26.2的NaHCO 3,1 NaHPO 4,22葡萄糖,300毫渗量,pH值7.4入95%O 2,5%CO 2,饱和。
- 添加下列药物的细胞外记录溶液,来阻止激活GluA GluN,mGluRII,mGluRIII,γ-氨基丁酸,γ-氨基丁酸乙甲 ,和A1腺苷受体(以μM):10 2,3 -二氧代-6 -硝基-1, 2,3,4 -四氢苯并[ƒ]喹喔啉-7 -磺酰胺钠盐(NBQX),10(RS)-3 - (2 - carboxypiperazin -4 -基) -丙基-1 -膦酸(CPP),(2S )2 - 氨基-2 - [(1S,2S)-2-carboxycycloprop -1 - 基] -3 - (呫吨-9 - 基)丙酸二钠盐(LY341495),100(R,S)-α-甲基丝氨酸-O-磷酸(MSOP),100印防己毒素,5 3 - [[(3,4 - 二氯苯基)甲基]氨基]丙基]二乙氧基甲基)次膦酸(CGP52432),1个8 - 环戊基-1,3 - 二丙基黄嘌呤(DPCPX)。
- 设置的录音室中的细胞外液的温度,典型的温度在34 - 36℃。
- 准备膜片钳电极硼硅玻璃毛细管(R≈2.5MΩ)采用双级,玻璃微吸管车夫。
- 径片之一,并将其放置在录音室。按住它采用了金属与铂丝和尼龙弦的竖琴。
- 目视检查片下DODT照明或IR-DIC。星形胶质细胞可以通过细胞小体(直径= 10微米)和( 图1)突出的髓核。
- 突触的刺激,放置一个双极不锈钢焊条,星形胶质细胞,你打算修补远离〜100微米。
- 修补星形胶质细胞,并打破整个单元配置,通过应用一个非常温和的吸力。
注:星形胶质细胞通常具有较低的输入线电阻Ë(〜10MΩ),极化静息膜电位(〜-90毫伏),以及没有烧成活动。星形胶质细胞保持在电压钳模式下( 即保持电流应读为0 pA的)在整个实验中,其静息膜电位。每次刺激前,一个10毫秒的超极化电压阶跃(-3毫伏)是用来监视的星形胶质细胞的串联输入电阻。 - 如果串联电阻的变化大于20%,或者如果星形胶质细胞的膜电位去极化,丢弃录音。星形胶质细胞的膜电位,可以直接测量,通过切换电压钳电流钳模式。或者,膜电位,而在电压钳模式下,可以监视由读数保持电位的值,结果在0 pA的保持电流。
- 如果突触的刺激,候补单配对刺激( 如相距100毫秒),每次10 - 20秒。
- 对于UV光解实验的树人,连接uncaging的的氙灯落射荧光显微镜的端口,并添加笼化合物外液。转运电流〜100 pA的幅度时,可以得到闪存uncaging的100微米MNI-L-谷氨酸在整个视野(直径= 662.5微米时,使用40X的目标14)。可替代的的刺激光路打开和堵塞,每10 - 20秒。
- 唤起谷氨酸的瞬态和记录转运电流在控制条件下,在一个子的饱和浓度的广谱谷氨酸转运拮抗剂D,L- 苏式 - β-Benzyloxyaspartic的酸(TBOA;10μM)的存在下,以减少转运电流的幅值到至少30%的控制值(见第4,5)的存在下,或在高浓度的TBOA(50 - 100μM)完全阻断转运电流和隔离持续的K +电流(见第3节) 。
3。 PHARMAC生理隔离的K +电流的持续
- 在控制条件下和在高饱和浓度的TBOA(50 - 100μM)的存在下,星形细胞电流记录。
- 一般至少20次在TBOA(50 - 100微米)。
- 飞度平均获得3.2的功能的痕迹:
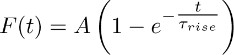
注意:的不敏感TBOA的成分(即在TBOA(50 - 100μM))的存在下被记录的一方表示持续的K +电流。上述单指数函数近似它的时间过程。 - 重复这个适合在不同的星形胶质细胞,并推导出平均值τ 上升 ( 即 K +电流的持续时间平均上升(见第5节))。
4。我染料溶液的突触活性炭运输车电流的(fSTCs促进部分)
- 平均至少20次扫描,获得与配对的刺激,在控制条件和TBOA的(10μM)( 图2a左侧)。
- 平均有相同数目的扫描得到的单一的刺激,在控制条件和TBOA的(10μM)( 图2a中)。
- 的平均电流的四个平均值的痕迹(单脉冲控制,控制成对的脉冲,单脉冲TBOA,TBOA配对脉冲)-3 mV的电压阶跃的响应的振幅进行比较。
- 如果在所有四个痕迹的电流响应的振幅是相同的,则继续到步骤4.7。
- 如果振幅的平均电流的响应是不同的,在四条迹线的任何检查,所有单独的轨迹适当地包括在平均。
- 如果振幅的平均电流是不同的,在任何的四个痕迹,但都在灵敏度独立的痕迹是适当的要包含在平均中,验证在每个跟踪FSTC的大小呈线性变化关系的测试电压阶跃的电流响应的大小。如果是这样的话,相对于彼此缩放的所有痕迹,从而使测试电压阶跃的电流响应,都幅度相等。
注:在这里描述拍摄条件(即细胞内CH 3 SO 3 -或C 6 H 11 O 7 - ),生成星形胶质细胞的兴奋性神经轴突突触的刺激与复杂波形的电流由一个快速上升的瞬态向内化学计量电流和缓慢上升,持续内向K +电流反射K +沿周边轴突动作电位的传播后,在细胞外空间的重新平衡。这是至关重要删除此持续的K +电流,任何剩余电流将导致高估谷氨酸寿命。 - 减去单刺激获得的平均轨迹与配对的刺激( 图2a右)从得到的平均轨迹。这个步骤可让隔离的化学计量和持续的K +电流由第二刺激诱 发。
- 移位单刺激由双脉冲( 即 100毫秒)( 图2b),用于提供相匹配的脉冲间的时间间隔的时间间隔得到的平均轨迹。
- 减去时移单刺激得到的平均响应从4.7( 图2c)中得到的第二个刺激的平均响应。此步骤将隔离转运电流诱发的第二个刺激(FSTC)促进部分。
- 在大多数情况下,在上一步完全消除持续的K +电流。如果是这样的情况下,隔离FSTC完成,可以PROCE反褶积分析,并得出星形胶质细胞谷氨酸清除的时间过程。然而,在某些情况下,一个小的持续的K +电流仍然存在( 图2d),并需要进一步分析(见第5节)。
注意:请记住,在得到控制的条件和在TBOA(10微米)的平均痕迹分析在4.7-4.10必须执行。
5。减法的的剩余zdustained K表+电流从fSTCs
- 测量持续执行第4条中所描述的分析后剩余的K +电流的振幅。
- 缩放单指数函数的振幅在3.3节中的剩余持续Ķ+电流的幅度在5.1( 图2d左边和中间的)测量。要做到这一点,在方程3.3,设置项A等于幅度持续的K +电流5.1 asured的的术语Τ 上升等于3.4Τ 上升估计的平均值。
- 中减去得到的单指数函数从+电流的的FSTC持续Ķ获得在4.10( 图2d权利)。这一步完成FSTC隔离。
6。隔离的闪光激活运输车电流(外贸公司)
- 平均至少20次扫描得到的光通路开放,在控制条件和TBOA的(10μM)。
- 平均有相同数目的扫描获得的光路关闭时,在控制条件和在TBOA(10μM)。
- 的四个平均值的痕迹(单脉冲控制,控制成对的脉冲,单脉冲TBOA,TBOA配对脉冲)-3 mV的电压阶跃的电流响应的振幅进行比较。
- 如果在所有四个痕迹的电流响应的振幅是相同的,则继续到步骤6.7。
- 如果振幅的平均电流的响应是不同的,在四条迹线的任何检查,所有单独的轨迹适当地包括在平均。
- 如果在任何四个痕迹的平均电流的振幅是不同的,但是所有个体的痕迹都适当地包括在平均,验证,在光路中每个跟踪打开FTC的秤的大小的大小呈线性测试电压阶跃的电流响应。如果是这样的话,相对于彼此缩放的所有痕迹,从而使测试电压阶跃的电流响应,都幅度相等。
注:在这里描述拍摄条件(即细胞内CH 3 SO 3 -或C 6 H 11 O 7 - ),闪光刺激产生星形胶质细胞仅包括快速崛起的瞬时计量内向电流的电流。 - 轻拍了拍获得减去平均轨迹ħ阻止从得到的平均轨迹与光通路开放。这一步可以去除刺激伪迹和隔离外贸公司。
注:在6.7中描述的分析,必须执行控制条件和在TBOA(10μM)中得到的平均的痕迹。
7。解卷积分析
- 适合转运电流(FSTC或FTC)记录,可在控制条件下( 图3a左)和TBOA(10μM)( 图3a右)和隔离的第4 - 6中所描述的,与多指数函数:

- 创建一个瞬间上升的衰变函数,根据函数的单成倍:
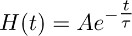
和最能说明(10微米)( 图3b)TBOA记录在转运电流衰减阶段。
注意:在7.2中描述的功能(即H(t))的代表从TBOA(10μM)的存在下的星形胶质细胞的谷氨酸清除的时间过程。 - 反卷积单指数在7.2( 图3B和3C中间)函数从转运电流记录在TBOA(10微米)7.1( 图3a右,C左)获得的拟合。
注:反褶积中包含许多分析软件包,如(如MATLAB,蟒蛇)是一种数学运算。编程代码在IgorPro,我们通常使用的执行这种分析,卷积操作可以有效的计算方法如下所述,通过使用离散快速傅立叶变换。首先,使用了FFT运算,来计算二7.2中得到的单指数函数拟合获得的记录,可在TBOA 7.1转运电流screte快速傅立叶变换。接下来,使用的IFFT运算的逆离散快速傅立叶变换的两个FFT函数的比例来计算。由此产生的函数I(t)的可以被描述如下: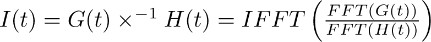
第7.3节中描述的步骤允许导出电流TBOA(10μM)( 图3c右)转运的过滤器。该过滤器代表的失真因素,转换谷氨酸的寿命星形细胞的膜转运电流隔离在第4 - 6(即FSTC或FTC)。 - 反卷积滤波器( 图3c吧, 图3d中间)在控制条件下适合转运电流( 图3a 左, 图3d左)。
注:此步骤可以推导在控制条件下( 图3d权)星形胶质细胞谷氨酸清除的时间过程。假设此解卷积步骤是在控制条件保持不变,并在TBOA(10μM),过滤器的时间的档案。 - 要获得整体谷氨酸清除的时间过程的定量估计,在第7.4步得到的波形计算质心(),。这是通过计算为:
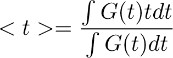
其中G(t)被在步骤7.1中得到的波形。在上述方程中,术语t对应的时间的积分计算。
注意:当成立之初的方法,计算随着时间的推移被留下的窗户,不受约束的13。这种方法可以被使用,只要整合窗口被设置为宽于谷氨酸的间隙的间隙波形衰减的持续时间完全恢复到基线。然而,如果不是这种情况下,这估计的方法遇到一定的局限性。例如,如果间隙波形不完全衰减回基线,然后按集成窗口的宽度增加。以避免任何潜在的误差源为估计,我们现在计算超过转运电流的峰值的10%相对应的一个时间窗口,其发病14之前和之后。后者的做法,提高细胞之间的一致性与测量。这派上用场,特别是当药物治疗效果分析小间隙的时间过程。
结果
这里描述的分析方法的成功严重依赖于获得高质量转运电流从任何地区的中枢神经系统的神经胶质细胞的电生理记录。星形胶质细胞在急性小鼠海马脑片,可以很容易地确定下DODT照明或IR-DIC,因为他们的小细胞体(O = 10微米)和髓核突出( 图1)。其独特的星形的形态与落射荧光,共焦或双光子激光扫描显微镜,可以理解,当加入类似的Alexa 594荧光团(50μM)细胞内的溶液中,(
讨论
这里,我们描述的实验方法得到的星形胶质细胞的电生理记录,协议在星形胶质细胞谷氨酸转运电流隔离的分析和数学方法获得谷氨酸的空隙,星形细胞转运电流的时间过程。
分析的成功依赖于星形胶质细胞的能力,获得高品质的膜片钳记录,用来描述转运电流的拟合算法的准确性。反卷积分析依赖于以下两个假设,(1)的多个进程扭曲谷氨酸的间隙进入实验记录转?...
披露声明
作者宣称没有利益冲突。
致谢
这项工作是由国家神经紊乱和中风院内研究计划(NS002986)。写的手稿和实施反褶积分析。 JSD反褶积分析,并开发了最初的版本上的文字进行了评论。
材料
| Name | Company | Catalog Number | Comments |
| CGP52432 | Tocris | 1246 | |
| (R,S)-CPP | Tocris | 173 | |
| DPCPX | Tocris | 439 | |
| LY341495 disodium salt | Tocris | 4062 | |
| MSOP | Tocris | 803 | |
| NBQX disodium salt | Tocris | 1044 | |
| D,L-TBOA | Tocis | 1223 | |
| Picrotoxin | Sigma | P1675 | |
| MNI-L-glutamate | Tocris | 1490 | |
| Alexa 594 | Life Technologies | A10438 | Optional |
| Matrix electrodes | Frederick Haer Company | MX21AES(JD3) | |
| Borosilicate glass capillaries | World Precision Instruments | PG10165-4 | |
| Dual-stage glass micro-pipette puller | Narishige | PC-10 | |
| Loctite 404 instant adhesive | Ted Pella | 46551 | |
| Xe lamp | Rapp OptoElectronic | FlashMic | |
| Igor Pro 6 | Wavemetrics |
参考文献
- Ventura, R., Harris, K. M. Three-dimensional relationships between hippocampal synapses and astrocytes. J. Neurosci. 19, 6897-6906 (1999).
- Witcher, M. R., Kirov, S. A., Harris, K. M. Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus. Glia. 55, 13-23 (2007).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Herman, M. A., Jahr, C. E. Extracellular glutamate concentration in hippocampal slice. J. Neurosci. 27, 9736-9741 (2007).
- Arnth-Jensen, N., Jabaudon, D., Scanziani, M. Cooperation between independent hippocampal synapses is controlled by glutamate uptake. Nat. Neurosci. 5, 325-331 (2002).
- Barbour, B. An evaluation of synapse independence. J. Neurosci. 21, 7969-7984 (2001).
- Rusakov, D. A., Kullmann, D. M. Extrasynaptic glutamate diffusion in the hippocampus: ultrastructural constraints, uptake, and receptor activation. J. Neurosci. 18, 3158-3170 (1998).
- Zerangue, N., Kavanaugh, M. P. Flux coupling in a neuronal glutamate transporter. Nature. 383, 634-637 (1038).
- Eliasof, S., Jahr, C. E. Retinal glial cell glutamate transporter is coupled to an anionic conductance. Proc. Natl. Acad. Sci. U.S.A. 93, 4153-4158 (1996).
- Wadiche, J. I., Amara, S. G., Kavanaugh, M. P. Ion fluxes associated with excitatory amino acid transport. Neuron. 15, 721-728 (1995).
- Wadiche, J. I., Kavanaugh, M. P. Macroscopic and microscopic properties of a cloned glutamate transporter/chloride channel. J. Neurosci. 18, 7650-7661 (1998).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. J. Neurosci. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H. Neuronal transporters regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. J. Neurosci. 29, 14581-14595 (2009).
- Zuo, Z. Isoflurane enhances glutamate uptake via glutamate transporters in rat glial cells. Neuroreport. 12, 1077-1080 (2001).
- Barbour, B., Brew, H., Attwell, D. Electrogenic uptake of glutamate and aspartate into glial cells isolated from the salamander (Ambystoma) retina. J. Physiol. 436, 169-193 (1991).
- Bergles, D. E., Tzingounis, A. V., Jahr, C. E. Comparison of coupled and uncoupled currents during glutamate uptake by GLT-1 transporters. J. Neurosci. 22, 10153-10162 (2002).
- Diamond, J. S., Jahr, C. E. Synaptically released glutamate does not overwhelm transporters on hippocampal astrocytes during high-frequency stimulation. J. Neurophysiol. 83, 2835-2843 (2000).
- Benediktsson, A. M., et al. Neuronal activity regulates glutamate transporter dynamics in developing astrocytes. Glia. 60, 175-188 (2012).
- Hires, S. A., Zhu, Y., Tsien, R. Y. Optical measurement of synaptic glutamate spillover and reuptake by linker optimized glutamate-sensitive fluorescent reporters. Proc. Natl. Acad. Sci. U.S.A. 105, 4411-4416 (2008).
- Scimemi, A., Meabon, J., Woltjer, R. L., Sullivan, J. M., Diamond, J. S., Cook, D. G. Amyloidβ1-42 slows clearance of synaptically-released glutamate by mislocalizing astrocytic GLT-1. J. Neurosci. 33, 5312-5318 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。