Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Ableitung der zeitliche Verlauf der Glutamate Ausverkauf mit Dekonvolutionsanalyse von Astrozytäre Transporter Currents
In diesem Artikel
Zusammenfassung
Wir beschreiben eine analytische Methode, um die Lebensdauer von Glutamat an astrozytären Membranen schätzen von elektrophysiologischen Ableitungen von Glutamat-Transporter Ströme in Astrozyten.
Zusammenfassung
Die höchste Dichte von Glutamat-Transporter im Gehirn in Astrozyten gefunden. Glutamattransporter Paar die Bewegung von Glutamat durch die Membran mit dem Co-Transport von 3 Na + und H + 1 und der Gegenelektrode Transport von 1 K +. Das stöchiometrische Strom, der durch den Transport Prozess erzeugt wird, kann mit whole-cell Patch-Clamp-Aufnahmen von Astrozyten überwacht werden. Der zeitliche Verlauf der aufgezeichneten Strom wird durch den zeitlichen Verlauf der Glutamatkonzentration Profil auf die Astrozyten ausgesetzt sind, die Kinetik der Glutamat-Transporter, und die passive elektrotonischen Eigenschaften von Astrozyten Membranen geformt. Hier beschreiben wir die experimentellen und analytischen Methoden, die verwendet werden, um Glutamattransporter Ströme in Astrozyten erfassen und isolieren den zeitlichen Verlauf der Glutamat-Clearance von allen anderen Faktoren, die die Wellenform der Astrozyten-Transporter Ströme formen kann. Die hier beschriebenen Methoden können verwendet werden, um die Lebensdauer o abzuschätzenf Flash-uncaged und Glutamat in Astrozyten Membranen in jeder Region des zentralen Nervensystems bei Gesundheit und Krankheit synaptisch-released.
Einleitung
Astrozyten sind eine der am häufigsten vorkommenden Zelltypen im Gehirn mit sternförmigen Morphologie und feine Membran Vorsprünge, die in der gesamten Neuropils erweitern und erreichen benachbarten synaptische Kontakte 1,2. Die Astrozyten 'Zellmembran ist dicht mit Glutamat-Transporter-Moleküle 3 verpackt. Unter physiologischen Bedingungen Glutamattransporter schnell binden Glutamat an der extrazellulären Seite der Membran und überträgt es auf Zytoplasma der Zelle. Auf diese Weise erhalten die Transporter günstig die basale Konzentration von Glutamat in den extrazellulären Raum 4. Glutamat-Transporter in feine Astrozytenfortsätze benachbarten Synapsen erregenden sind ideal positioniert, um Glutamat während der synaptischen Ereignisse veröffentlicht, sobald sie weg aus dem synaptischen Spalt diffundiert binden. Damit die Transporter auch begrenzen Glutamat Spillover auf peri-und extra-synaptischen Regionen und auf benachbarten Synapsen, die Verringerung der räumlichen Ausbreitung der erregenden Signals im Gehirn 5-7.
Glutamate Transport ist ein Prozess elektrogenen stöchiometrisch auf die Bewegung von 3 gekoppelt Na + und H + 1 entlang ihrer elektrochemischen Gradienten und dem Zähler-Transport von 1 K + 8. (Thiocyanat)> NO - 3 - (Nitrat) ≈ ClO 4 - (Perchlorat)> I -> Br -> Cl -> F -, nicht Glutamate Transport mit (aber nicht stöchiometrisch gekoppelt) ein anionisches Leitwert durchlässig SCN verbunden um CH 3 SO 3 - (Methansulfonat) und C 6 H 11 O 7 - (Gluconat) 9-11. Beide Ströme (stöchiometrischen und nicht-stöchiometrischen) durch Erhalten Whole-Cell-Patch-Clamp-Aufnahmen von Astrozyten, visuell unter Dodt Beleuchtungs-oder Infrarot-Differential-Interferenz-Kontrast (IR-DIC) in acut identifiziert aufgezeichnet werdene Gehirnscheiben 12. Das stöchiometrische Komponente des Stroms mit Glutamat Transport über die Membran verbunden sind, können durch Verwendung von CH 3 SO 3 isoliert werden - oder C 6 H 11 O 7 - basierten intrazellulären Lösungen und kann durch Flash-Uncaging Glutamat auf Astrozyten 13,14 hervorgerufen werden, oder durch die Aktivierung Glutamat-Freisetzung aus benachbarten Synapsen, entweder elektrisch 12 oder mit einer gezielten optogenetische Kontrolle.
Der zeitliche Verlauf der stöchiometrischen Komponente des Transporters Strom durch die Lebensdauer des Glutamat-Konzentration in Astrozyten Profil Membranen (zB Glutamat Clearance) geformt, die Kinetik der Glutamat-Transporter, die passive Membran Eigenschaften von Astrozyten und während der synaptischen Reize, durch die Synchronität der Freisetzung von Glutamat in den aktivierten Synapsen 13. Hier beschreiben wir ausführlich: (1) eine experimentelle ca.oach die stöchiometrische Komponente von Glutamat-Transporter Ströme von whole-cell Patch-Clamp-Aufnahmen von Astrozyten mit akuten Maus Hippocampus als Beispiel experimentelle Vorbereitung isolieren, (2) ein analytischer Ansatz zur Ableitung des zeitlichen Verlaufs von Glutamat-Clearance von diesen Aufnahmen 13, 14. Diese Methoden können verwendet werden, um aufzuzeichnen und zu analysieren Glutamattransporter Ströme von Astrozyten in einer beliebigen Region des zentralen Nervensystems werden.
Protokoll
1. Scheibe Vorbereitung
- Bereiten Sie 500 ml Schneiden / Storage-Lösung, die (in mm): 119 NaCl, 2,5 KCl, 0,5 CaCl 2, 1,3 MgSO 4 · 7H 2 O, 4 MgCl 2, 26.2 NaHCO 3, 1 NaH 2 PO 4 und 22 Glucose, 320 mOsm, pH 7,4
- Verwenden Sie einen 250 ml-Becher, ein Untertauchen Kammer für die Scheiben vorzubereiten, füllen Sie es mit 200 ml Schneiden / Storage-Lösung, warm es in einem Wasserbad bei 34 ° C und blase sie mit 95% O 2, 5% CO 2.
- Halten Sie die restlichen Scheiben / Storage-Lösung in einer Glasflasche bei 4 ° C.
- Verwenden Sie einen Cyanacrylatklebstoff eine kleine Agarblock (6%, hergestellt in ACSF) auf der Vibratom Probenhalter befestigen und speichern sie bei 4 ° C.
- 30 min vor Beginn Schneiden, legen Sie die Glasflasche mit dem Schneiden / Storage-Lösung in einen Eimer mit Eis und blase sie mit 95% O 2, 5% CO 2 gefüllt.
Hinweis: Geschwindigkeit und Präzision sind für die Präparation nachfolgend beschriebenen Schritte von größter Bedeutung.
- Anesthetize der Maus (P14-21, C57BL / 6) mit Halothan / Isofluran (Isofluran wurde berichtet, verbessern astrozytären Glutamataufnahme 15), enthaupten, und tauchen Sie den Kopf in einem 50 ml Becherglas mit Sauerstoff, kalte Schneiden / Storage-Lösung.
- Führen Sie die Präparation des Gehirns auf einen Eisbeutel mit Küchenpapier eingewickelt und bei -20 ° C
- Verwenden Sie ein Skalpell, um einen mittsagittale Hautschnitt auf der Rückenseite des Kopfes zu machen, von der frontalen bis zum kaudalen Ende, und setzen den Schädel.
- Setzen Sie den unteren Schermesser eines kleinen Paar chirurgische Schere im Hinterkopf Loch und machen zwei Schnitte in Richtung der linken und auf der rechten Seite (45 ° Winkel).
- Schneiden Sie den Schädel entlang der mittleren sagittalen Linie, von der Schwanzflosse auf die Stirnseite.
- Entfernen Sie das Gehirn mit einem Spatel und tauchen sie in Sauerstoff, kalte Schneiden / storage Löauf.
- Mit einem Skalpell fünf Schnitte: (1) Entfernen Sie die Riechkolben und den frontalen Kortex, (2) entfernen das Kleinhirn, (3) entfernen Sie die linke und (4) rechte Schläfenlappen, (5) trennen die beiden Gehirnhälften mit einem mittsagittale Schnitt.
- Dab die beiden Teile des Gehirns mit Küchenpapier entfernen überschüssige Lösung.
- Kleben Sie die Seitenfläche jedes Gehirn Abschnitt zum kalten Vibratom Grundplatte: die Rückenseite des Gehirns sollte nach den Vibratom Klinge, die Bauchseite des Gehirns sollte in Kontakt mit dem Agar-Block sein, weg von der Vibratom Klinge.
Hinweis: Um die hochwertigsten Scheiben zu erhalten, ist es wichtig, dass die beiden Teile des Gehirns fest mit dem Vibratom Grundplatte verklebt. Um dies zu tun, verwenden Sie einen Cyanacrylatklebstoff, die nicht zu flüssig ist, und das nicht zu schnell austrocknen. - Sichern Sie die Vibratom Grundplatte zum Sezieren Kammer, setzen Sie die Scheibe thickness bis 250 um und passen Sie die Breite der Klinge laufen. Fahren Sie mit dem Schneiden.
Hinweis: Wenn alles korrekt ausgerichtet ist, die Vibratom sollte parasagittal Schneiden von Scheiben von der dorsalen Richtung ventral und von der medialen zur lateralen Seite des Gehirns. - Sobald die Klinge durch den Cortex und Hippocampus passiert hat, verwenden Sie ein Skalpell, um die Rinde / Hippocampus aus dem Mittelhirn schneiden und legen jede Scheibe in dem Untertauchen Kammer bei 34 ° C.
- Entsorgen Sie die ersten paar Scheiben. In der Regel können 12 Scheiben (250 um dick) aus einer P14-21 Gehirn der Maus erreicht werden.
- Halten Sie die Scheiben bei 34 ° C für 30 min und abkühlen lassen auf Raumtemperatur für 30 min, bevor Sie sie für die Elektrophysiologie Aufnahmen.
2. Astrocyte Identifizierung und Recordings
- Bereiten Sie eine interne Lösung, die (in mm): 120 KCH 3 SO 3, 10 EGTA, 20 HEPES, 2 MgATP, 0,2 NaGTP,5 QX-314Br und 5 NaCl, 290 mOsm, pH 7,2.
- Bereiten Sie eine Lösung, die extrazelluläre Aufnahme (in mm): 119 NaCl, 2,5 KCl, 2,5 CaCl 2, 1,3 MgSO 4 · 7H 2 O, 1 MgCl 2, 26.2 NaHCO 3, 1 NaHPO 4 und 22 Glucose, 300 mOsm, pH 7,4 , gesättigt mit 95% O 2, 5% CO 2.
- Fügen Sie die folgenden Medikamente an die extrazelluläre Recording-Lösung, um die Aktivierung von GluA, Glun, mGluRII, mGluRIII, GABA A, GABA B und A1-Adenosin-Rezeptoren (in uM) blockieren: 10 2,3-Dioxo-6-Nitro-1, 2,3,4-tetrahydro-benzo [ƒ] chinoxalin-7-sulfonamid-Dinatriumsalz (NBQX), 10 (RS) -3 - (2-carboxypiperazin-4-yl)-propyl-1-phosphonsäure (CPP), (2S )-2-Amino-2-[(1S, 2S)-2-carboxycycloprop-1-yl] -3 - (xanth-9-yl) propansäure, Dinatriumsalz (LY341495), 100 (R, S)-α- methylserine-O-phosphat (DIP), 100 Picrotoxin 5 3 - [[(3,4-Dichlorphenyl) methyl] amino] propyl] diethoxymethyl) phosphinsäure (CGP52432), 18-Cyclopentyl-1 ,3-dipropylxanthin (DPCPX).
- Stellen Sie die Temperatur der extrazellulären Lösung in der Aufnahme Kammer; typischen Temperaturen liegen zwischen 34 bis 36 ° C.
- Bereiten Sie Patch-Clamp-Elektroden aus Borosilikatglas Kapillaren (R ≈ 2,5 MQ) mit einem Dual-Stage-, Glas-Mikropipette Abzieher.
- Nehmen Sie eine der Scheiben und legen Sie sie in der Aufnahme Kammer. Halten Sie es mit einem Metall-Harfe mit Platindraht und Nylonsaiten gemacht.
- Sichtprüfung der Scheiben unter Dodt Beleuchtung oder IR-DIC. Astrozyten können durch ihre kleinen Zellkörper (Ø = 10 um) und prominente Kern (Abbildung 1) identifiziert werden.
- Für synaptischen Stimulationen, legen Sie eine bipolare Elektrode aus rostfreiem Stahl, ~ 100 um weg von der Astrozyten, die Sie zu flicken planen.
- Flecken Die Astrozyten und brechen in der whole-cell-Konfiguration, indem eine sehr sanfte Saugwirkung.
Hinweis: Astrozyten haben in der Regel niedrige Eingangs resistance (~ 10 MQ), hyperpolarisierte Ruhemembranpotential (~ -90 mV) und kein Brennen Aktivität. Die Astrozyten an seinem Ruhemembranpotenzial während der Experimente in Voltage-Clamp-Modus (dh die Haltestromwert sollte 0 pA lesen) gehalten. Vor jeder Stimulation wird ein 10 ms hyperpolarisierenden Spannung Schritt (-3 mV) verwendet, um die Serie und Eingangswiderstand der Astrozyten überwachen. - Entsorgen Sie die Aufnahmen, wenn die Reihe Widerstand ändert> 20% oder wenn das Membranpotential der Astrozyten wird depolarisiert. Das Membranpotential der Astrozyten direkt durch Umschalten von Voltage-Clamp-Current-Clamp-Modus gemessen werden. Während alternativ in Voltage-Clamp-Modus können das Membranpotential, indem der Wert des Halte-Potential, die zu 0 pA Haltestrom überwacht werden.
- Wenn synaptischen Stimulationen eingesetzt werden, alternative Einzel-und gepaart Reize (z. B. 100 ms auseinander), alle 10 - 20 sek.
- Für die UV-Photolyse experimEltern, schließen Sie ein Uncaging Xe Lampe mit dem Epi-Port des Mikroskops und fügen Sie den Käfig Verbindung an die extrazelluläre Lösung. Transporter Ströme von ~ 100 pA Amplitude kann erhalten werden, wenn Flash-Uncaging 100 pM MNI-L-Glutamat in die ganze Sichtfeld (Ø = 662,5 um bei Verwendung eines 40X-Objektiv 14) werden. Alternate Stimulationen mit dem Lichtweg offen und blockiert alle 10 - 20 sek.
- Evoke Glutamat Transienten und aufzeichnen Transporter Ströme unter Kontrolle Bedingungen und in Gegenwart eines Sub-sättigenden Konzentration des breiten Spektrums Glutamattransporter Antagonist D, L-threo-β-Benzyloxyaspartic Säure (TBOA; 10 uM), um den Transporter Stromamplitude reduzieren auf mindestens 30% seiner Stellgröße (siehe Abschnitte 4, 5) oder in Gegenwart einer hohen Konzentration von TBOA (50 - 100 um) bis Transporter Ströme vollständig zu blockieren und zu isolieren, die nachhaltige K +-Strom (siehe Abschnitt 3) .
3. Pharmacological Isolation des Anhaltende K +-Strom
- Notieren astrozytären Ströme unter Kontrolle Bedingungen und in Gegenwart eines hohen, sättigenden Konzentration von TBOA (50 - 100 uM).
- Durchschnitt mindestens 20 Sweeps in TBOA (50 - 100 uM).
- Fit die gemittelten Spuren in 3.2 mit der Funktion erhalten:
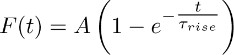
Hinweis: Die TBOA-und Kleinschreibung Komponente (dh derjenige, der in Gegenwart von TBOA (50 aufgezeichnet wird - 100 pM)) stellt die nachhaltige K +-Strom. Seine Zeit Kurs wird von der mono-exponentielle Funktion beschrieben angenähert. - Wiederholen Sie diesen fit in verschiedenen Astrozyten und daraus einen Mittelwert von Τ Anstieg (dh die durchschnittliche Anstiegszeit des anhaltenden K +-Strom (siehe Kapitel 5)).
4. Isolation der erleichterten Portion Synaptisch-Activated Transporter Currents (fSTCs)
- Durchschnitt mindestens 20 Sweeps gepaart mit Anregungen erhalten, die Kontrolle und Bedingungen in TBOA (10 uM) (Abbildung 2a links).
- Durchschnittliche eine identische Anzahl von Sweeps mit einzelnen Stimulationen, die Kontrolle und Bedingungen in TBOA (10 uM) (Abbildung 2a Mitte) erhalten.
- Vergleichen der Amplitude des mittleren Stroms als Reaktion auf die Spannung -3 mV Schritt in den vier gemittelten Spuren (Kontrolle einzelner Impuls, Steuer-Impulse gekoppelt, TBOA einzelnen Impuls, TBOA Paired-Pulse).
- Wenn die Amplitude der aktuellen Antwort ist die gleiche in allen vier Spuren, gehen Sie zu Schritt 4.7.
- Wenn die Amplitude des durchschnittlichen aktuellen Antwort ist anders in jeder der vier Spuren, überprüfen Sie, dass alle einzelnen Spuren angebracht, im Durchschnitt eingeschlossen werden sollten.
- Wenn die Amplitude des durchschnittlichen Strom unterscheidet in jeder der vier Spuren, aber alle ineinzelnen Spuren sind geeignet, um im Durchschnitt eingeschlossen werden, überprüfen Sie, ob in jeder Spur die Größe der FSTC linear mit der Größe der aktuellen Antwort auf die Prüfspannung Schritt. Wenn dies der Fall ist, zu skalieren alle Spuren in Bezug zueinander, so dass die aktuellen Antworten auf die Prüfspannung Schritt alle in der Amplitude gleich sind.
Hinweis: Bei den hier beschriebenen Aufnahmebedingungen (dh intrazelluläre CH 3 SO 3 - oder C 6 H 11 O 7 -), erzeugen synaptische Stimulation von exzitatorischen Axone astrozytären Strömungen mit komplexen Wellenformen aus einer schnell steigenden transiente innen stöchiometrischen aktuellen und einem langsamen steigenden, nachhaltigen innen K +-Strom reflektierenden K + Reäquilibrierung in den extrazellulären Raum nach der Maßnahme potenziellen Ausbreitung entlang benachbarten Axonen. Es ist wichtig, dass diese nachhaltig K +-Strom zu entfernen, wie jeder Reststrom würde ein führenüberschätzen von Glutamat Lebensdauer. - Ziehen Sie den mittleren Verlauf mit einzelnen Stimulationen von der mittleren Spur gepaart mit Stimulationen (Abbildung 2a rechts) erhalten wird. Dieser Schritt ermöglicht die Isolierung des stöchiometrischen und die nachhaltige K +-Strom, der von dem zweiten Reiz ausgelöst.
- Schieben Sie den mittleren Verlauf mit einzelnen Stimulationen durch ein Zeitintervall, das die inter-Pulsintervall zur paarweisen Impulsen (dh 100 ms) (Abb. 2b) liefern übereinstimmt erhalten.
- Subtrahieren der zeitversetzten durchschnittliche Antwortzeit mit einzelnen Stimulationen von der durchschnittlichen Reaktion auf den zweiten Stimulus in 4.7 (2c) erhalten wird. Dieser Schritt trennt die erleichterte Abschnitt des Transporters von der zweiten Impulse (die FSTC) hervorgerufen.
- In den meisten Fällen entfernt der vorherigen Schritt ganz die nachhaltige K +-Strom. Wenn dies der Fall ist, ist die Isolierung des FSTC abgeschlossen und Sie können PROCEed mit dem Dekonvolutionsanalyse und leiten den zeitlichen Verlauf der Glutamat-Clearance von Astrozyten. In einigen Fällen jedoch, ist ein kleines nachhaltige K +-Strom noch vorhanden (Abb. 2d) und weitere Analysen erforderlich (siehe Abschnitt 5).
Hinweis: Beachten Sie, dass die Analyse in 4,7-4,10 beschrieben auf den durchschnittlichen Spuren im Kontrollbedingungen und in TBOA (10 pM) erhalten müssen durchgeführt werden.
5. Subtraktion des Residual zdustained K +-Strom von fSTCs
- Messen Sie die Amplitude des anhaltenden K +-Strom, der nach Durchführung der Analyse in Abschnitt 4 beschrieben.
- Skalieren Sie die Amplitude der mono-exponentiellen Funktion in 3.3 auf die Amplitude des restlichen nachhaltige K +-Strom gemessen in 5,1 (Abbildung 2d links und Mitte). Beschrieben Um dies zu tun, in der Gleichung 3.3, stellen Sie den Begriff A gleich der Amplitude der anhaltenden K +-Strom michasured in 5.1 und der Begriff Τ Anstieg entspricht dem durchschnittlichen Wert von Τ Anstieg 3,4 geschätzt.
- Subtrahieren Sie die resultierende mono-exponentiellen Funktion aus dem FSTC und nachhaltige K +-Strom erhalten in 4.10 (2d rechts). Mit diesem Schritt ist die Isolierung des FSTC.
6. Isolation des Flash-aktivierten Transporter Currents (FTCs)
- Durchschnitt mindestens 20 Sweeps mit dem Lichtweg offen, in Kontrolle und Bedingungen in TBOA (10 pM) erhalten.
- Durchschnittliche eine identische Anzahl von Sweeps mit dem Lichtweg erhalten geschlossen, in Kontrolle und Bedingungen in TBOA (10 uM).
- Vergleichen Sie die Amplitude der aktuellen Antwort auf die -3 mV Spannung Schritt in den vier gemittelten Spuren (Kontrolle einzelner Impuls-, Steuer-Impulse gepaart, TBOA einzigen Impuls, gepaart TBOA-Impulse).
- Wenn die Amplitude der aktuellen Antwort ist die gleiche in allen vier Spuren, gehen Sie zu Schritt 6.7.
- Wenn die Amplitude des durchschnittlichen aktuellen Antwort ist anders in jeder der vier Spuren, überprüfen Sie, dass alle einzelnen Spuren angebracht, im Durchschnitt eingeschlossen werden sollten.
- Wenn die Amplitude des durchschnittlichen Strom unterscheidet in jeder der vier Spuren, aber alle einzelnen Spuren sind geeignet, um im Durchschnitt eingeschlossen werden, sicherzustellen, dass in jeder Spur mit den Strahlengang öffnet die Größe des FTC linear mit der Größe der Strom als Reaktion auf die Prüfspannung Schritt. Wenn dies der Fall ist, zu skalieren alle Spuren in Bezug zueinander, so dass die aktuellen Antworten auf die Prüfspannung Schritt alle in der Amplitude gleich sind.
Hinweis: in der Aufnahme hier beschriebenen Bedingungen (dh intrazelluläre CH 3 SO 3 - oder C 6 H 11 O 7 -), erzeugen Flash Reize astrozytären Strömungen, die nur aus der schnell steigenden transiente stöchiometrischen Einwärtsstrom. - Ziehen Sie den mittleren Verlauf mit dem Licht pat erhaltenh blockiert von der mittleren Spur mit dem Lichtweg offen erhalten. Dieser Schritt ermöglicht das Entfernen des Reizartefakt und Isolieren der FTC.
Hinweis: die Analyse in 6.7 beschrieben sind, müssen auf den durchschnittlichen Spuren im Kontrollbedingungen und in TBOA (10 pM) erhalten durchgeführt werden.
7. Dekonvolutionsanalyse
- Fit der Transporter Strom (FSTC oder FTC) in Kontrollbedingungen (Abb. 3a links) und in TBOA (10 uM) (Abbildung 3a rechts) und isoliert wie in den Abschnitten 4 beschrieben aufgezeichnet - 6, mit dem Multi-Exponentialfunktion:

- Erstellen Sie eine Funktion, die sofort steigenden zerfällt mono-exponentiell nach der Funktion:
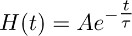
unddas beschreibt am besten die abklingende Phase des Transporters in aktuellen TBOA (10 uM) (Abbildung 3b) aufgezeichnet.
Hinweis: Die Funktion in 7.2 (dh H (t)) beschrieben sind, den zeitlichen Verlauf der Glutamat-Clearance von Astrozyten in Gegenwart von TBOA (10 uM). - Entfalten, die mono-exponentiellen Funktion in 7.2 (3b und 3c Mitte) von der Passform des Transporters in aktuellen TBOA (10 uM) in 7.1 (3a rechts, links c) erhalten aufgezeichnet erhalten.
Hinweis: Entfaltung ist eine mathematische Operation in vielen Analyse-Software-Pakete wie (zB Matlab, Python) enthalten. In IgorPro, der Programmiercode, dass wir in der Regel verwenden, um diese Art von Analyse durchführen, können die Entfaltungsoperation effizient berechnet werden, wie unten beschrieben, durch diskrete schnelle Fourier-Transformationen. Erstens verwenden die FFT-Operation, um den di berechnenscrete schnelle Fourier-Transformation der mono-exponentiellen Funktion in 7.2 erhalten und der Passung des Transporters in aktuellen TBOA aufgezeichnet in 7.1-Transformation. Als nächstes verwendet der IFFT Operation der inversen diskreten schnellen Fourier-Transformation des Verhältnisses der beiden FFT-Funktionen berechnen. Die resultierende Funktion I (t) kann wie folgt beschrieben werden: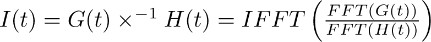
Der Schritt in 7.3 erlaubt die Ableitung der Filter des aktuellen Transporters in TBOA (10 uM) (Abbildung 3c rechts). Der Filter stellt die Verzerrung Faktoren, die die Lebensdauer von Glutamat in Astrozyten umwandeln Membranen in der aktuellen Transporter in den Abschnitten 4 getrennt - 6 (dh die FSTC oder FTC). - Entfalten, den Filter (Abbildung 3c rechts, Abbildung 3d Mitte) von der Passform des Transporters Strom im Kontrollbedingungen (Abb. 3a links, links Abbildung 3d).
Anmerkung: Dieser Schritt ermöglicht die Ableitung des zeitlichen Verlaufs der Glutamat-Clearance von Astrozyten in Kontrollbedingungen (Abbildung 3d rechts). Die zugrunde liegende Annahme dieses Entfaltung Schritt ist, dass der zeitliche Verlauf des Filters unverändert unter Kontrolle und Bedingungen in TBOA (10 uM) bleibt. - Um eine quantitative Abschätzung des gesamten zeitlichen Verlauf von Glutamat Genehmigung zu erhalten, berechnen Sie den Schwerpunkt () der Wellenform in Schritt 7.4 erhalten. Dies wird durch die Berechnung als erledigt:
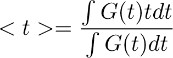
wobei G (t) wird die Wellenform in Schritt 7.1 erhalten. In der obigen Gleichung beschrieben, entspricht der Ausdruck t das Zeitfenster über die das Integral berechnet.
Hinweis: Wenn das Verfahren wurde zunächst festgestellt, wurde im Laufe der Zeit, die Fenster links ungezwungen 13 berechnet wurden. Dieser Ansatz kann so lange verwendet werden, wie die Integration Fenster wird auf breiter sein als die Dauer der Glutamat-Clearance und der Clearance Wellenform zerfällt vollständig zurück zu den Ausgangswerten. Ist dies nicht der Fall ist, trifft jedoch auf dieses Verfahren zur Abschätzung einige Einschränkungen. Zum Beispiel, wenn der Abstand Wellenform nicht exakt wieder zerfallen Grundlinie, dann nimmt mit der Breite des Integrationsfensters. Um potentielle Quelle der Ungenauigkeit der Abschätzung der zu vermeiden, wird nun berechnet wird über ein Zeitfenster, entsprechend 10% der Peak des Transporters Strom vor und nach dem Ausbruch 14. Der letztere Ansatz verbessert die Konsequenz, mit der über Zellen gemessen wird. Das ist praktisch, vor allem bei der Analyse von kleinen Effekten von pharmakologischen Behandlungen auf den zeitlichen Verlauf der Clearance.
Ergebnisse
Der Erfolg der analytischen hier beschriebene Ansatz hängt entscheidend von hoher Qualität zu erhalten elektrophysiologischen Ableitungen von Transporter Ströme von Astrozyten in jeder Region des zentralen Nervensystems. In akuten Maus Hippocampus kann Astrozyten leicht unter Dodt Beleuchtung oder IR-DIC werden wegen ihrer kleinen Zellkörper (Ø = 10 um) und prominente Kern (Abbildung 1) identifiziert. Ihre markante sternförmige Morphologie mit Epifluoreszenz, konfokale oder Zwei-Photonen-Laser-Sca...
Diskussion
Hier haben wir einen experimentellen Ansatz zur elektrophysiologischen Ableitungen von Astrozyten erhalten beschreiben, leiten ein analytisches Protokoll Glutamattransporter Ströme in Astrozyten isolieren und eine mathematische Methode, um den zeitlichen Verlauf der Glutamat-Clearance von Astrozyten-Transporter Ströme.
Der Erfolg der Analyse beruht auf der Fähigkeit, hochwertige Patch-Clamp-Aufnahmen von Astrozyten zu erhalten und auf die Genauigkeit der Anpassungsalgorithmen verwendet, u...
Offenlegungen
Die Autoren erklären, keinen Interessenkonflikt.
Danksagungen
Diese Arbeit wurde durch das National Institute of Neurological Disorders and Stroke Interne Research Program (NS002986) unterstützt. AS schrieb das Manuskript und umgesetzt Dekonvolutionsanalyse. JSD entwickelte die erste Version des Dekonvolutionsanalyse und kommentiert den Text.
Materialien
| Name | Company | Catalog Number | Comments |
| CGP52432 | Tocris | 1246 | |
| (R,S)-CPP | Tocris | 173 | |
| DPCPX | Tocris | 439 | |
| LY341495 disodium salt | Tocris | 4062 | |
| MSOP | Tocris | 803 | |
| NBQX disodium salt | Tocris | 1044 | |
| D,L-TBOA | Tocis | 1223 | |
| Picrotoxin | Sigma | P1675 | |
| MNI-L-glutamate | Tocris | 1490 | |
| Alexa 594 | Life Technologies | A10438 | Optional |
| Matrix electrodes | Frederick Haer Company | MX21AES(JD3) | |
| Borosilicate glass capillaries | World Precision Instruments | PG10165-4 | |
| Dual-stage glass micro-pipette puller | Narishige | PC-10 | |
| Loctite 404 instant adhesive | Ted Pella | 46551 | |
| Xe lamp | Rapp OptoElectronic | FlashMic | |
| Igor Pro 6 | Wavemetrics |
Referenzen
- Ventura, R., Harris, K. M. Three-dimensional relationships between hippocampal synapses and astrocytes. J. Neurosci. 19, 6897-6906 (1999).
- Witcher, M. R., Kirov, S. A., Harris, K. M. Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus. Glia. 55, 13-23 (2007).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Herman, M. A., Jahr, C. E. Extracellular glutamate concentration in hippocampal slice. J. Neurosci. 27, 9736-9741 (2007).
- Arnth-Jensen, N., Jabaudon, D., Scanziani, M. Cooperation between independent hippocampal synapses is controlled by glutamate uptake. Nat. Neurosci. 5, 325-331 (2002).
- Barbour, B. An evaluation of synapse independence. J. Neurosci. 21, 7969-7984 (2001).
- Rusakov, D. A., Kullmann, D. M. Extrasynaptic glutamate diffusion in the hippocampus: ultrastructural constraints, uptake, and receptor activation. J. Neurosci. 18, 3158-3170 (1998).
- Zerangue, N., Kavanaugh, M. P. Flux coupling in a neuronal glutamate transporter. Nature. 383, 634-637 (1038).
- Eliasof, S., Jahr, C. E. Retinal glial cell glutamate transporter is coupled to an anionic conductance. Proc. Natl. Acad. Sci. U.S.A. 93, 4153-4158 (1996).
- Wadiche, J. I., Amara, S. G., Kavanaugh, M. P. Ion fluxes associated with excitatory amino acid transport. Neuron. 15, 721-728 (1995).
- Wadiche, J. I., Kavanaugh, M. P. Macroscopic and microscopic properties of a cloned glutamate transporter/chloride channel. J. Neurosci. 18, 7650-7661 (1998).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. J. Neurosci. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H. Neuronal transporters regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. J. Neurosci. 29, 14581-14595 (2009).
- Zuo, Z. Isoflurane enhances glutamate uptake via glutamate transporters in rat glial cells. Neuroreport. 12, 1077-1080 (2001).
- Barbour, B., Brew, H., Attwell, D. Electrogenic uptake of glutamate and aspartate into glial cells isolated from the salamander (Ambystoma) retina. J. Physiol. 436, 169-193 (1991).
- Bergles, D. E., Tzingounis, A. V., Jahr, C. E. Comparison of coupled and uncoupled currents during glutamate uptake by GLT-1 transporters. J. Neurosci. 22, 10153-10162 (2002).
- Diamond, J. S., Jahr, C. E. Synaptically released glutamate does not overwhelm transporters on hippocampal astrocytes during high-frequency stimulation. J. Neurophysiol. 83, 2835-2843 (2000).
- Benediktsson, A. M., et al. Neuronal activity regulates glutamate transporter dynamics in developing astrocytes. Glia. 60, 175-188 (2012).
- Hires, S. A., Zhu, Y., Tsien, R. Y. Optical measurement of synaptic glutamate spillover and reuptake by linker optimized glutamate-sensitive fluorescent reporters. Proc. Natl. Acad. Sci. U.S.A. 105, 4411-4416 (2008).
- Scimemi, A., Meabon, J., Woltjer, R. L., Sullivan, J. M., Diamond, J. S., Cook, D. G. Amyloidβ1-42 slows clearance of synaptically-released glutamate by mislocalizing astrocytic GLT-1. J. Neurosci. 33, 5312-5318 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten