Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Astrositik Transporter Akımlar bir Dekonvolüsyon Analizi ile Glutamat Gümrükleme gün Dersin türetilmesi
Bu Makalede
Özet
Biz astrositlerde glutamat taşıyıcı akımların elektrofizyolojik kayıtları astrositik membranların de glutamat ömrünü tahmin etmek için analitik bir yöntem açıklanmaktadır.
Özet
Beyinde glutamat taşıyıcıları en yüksek yoğunluğu astrositlerde bulunmuştur. 3 Na +, 1 H, CO-kamyonu + ve 1 K karşı taşıma zarından glutamat glutamat taşıyıcılarının çift hareket +. Taşıma işlemi tarafından oluşturulan stoikiometrik mevcut astrositlerden tam hücre patch-clamp kayıtları ile izlenebilir. Kaydedilen akımın zaman ders astrositler maruz kaldığı glutamat konsantrasyonu profil, glutamat taşıyıcı kinetiği ve astrositik membranların pasif elektrotonik özelliklerinin zaman ders şekillenir. Burada astrositlerde glutamat taşıyıcı akımları kaydetmek ve astrositik taşıyıcı akımların dalga şekli tüm diğer faktörlerden glutamat açıklık zaman ders izole etmek için kullanılabilecek deneysel ve analitik yöntemleri açıklar. Burada açıklanan yöntemlerle kullanım süresi o tahmin etmek için de kullanılabilirf flash Uncaged ve sağlık ve hastalık sırasında merkezi sinir sisteminin herhangi bir bölgesinde astrositik membranlar de glutamat synaptically-yayınladı.
Giriş
Astrositler yıldız şeklinde morfolojisi ve nöropil boyunca uzanır ve komşu sinaptik iletişim 1,2 ulaşmak, ince zar çıkıntıları olan beyinde en bol hücre tipleri vardır. Astrositler 'hücre zarı yoğun glutamat taşıyıcı moleküllerin 3 ile doludur. Fizyolojik koşullar altında, glutamat taşıyıcıları hızla zarın hücre dışı glutamat tarafında bağlanır ve hücre sitoplazması aktarın. Böyle yaparak, nakil dışı alan 4 glutamat düşük bazal konsantrasyonu korumak. Sinaps eksitatör bitişik ince astrositik süreçlerinde glutamat taşıyıcılarının ideal uzak sinaptik yarık gelen yayılır olarak sinaptik olaylar sırasında serbest glutamat bağlamak için konumlandırılmış. Böyle yaparak, taşıyıcılar da uyarıcı sinyal mekansal yayılmasının azaltılmasında, peri-ve ekstra-sinaptik bölgelere doğru ve komşu sinaps üzerine glutamat yayılma sınırı5-7 beyinde n.
Glutamat taşıma stokiyometrik 3 hareketine bağlı olan bir süreçtir Elektrojenik Na + ve 1H bunların elektrokimyasal gradyan boyunca + K + 1 ve 8 arasında karşı taşıma. (Tiyosiyanat)> NO - 3 - (nitrat) ≈ Cıo 4 - (perklorat)> I -> Br -> Cl -> F - değil, glutamat taşıma SCN geçirgen (ancak stokiyometrik olarak birleştirilmiş olmayan) anyonik bir iletkenlik ile ilişkili (metan sülfonat) ve C 6 H 11 O 7 - - (glukonat) 9-11 CH 3 SO 3. Her iki akımları (stokiyometrik ve olmayan stokiyometrik) görsel olarak akut olarak Dodt aydınlatma veya kızılötesi diferansiyel girişim kontrast (IR-DIC) kapsamında belirlenen astrositlerden, gelen tam hücreli yama-kelepçe kayıtları alarak kaydedilebilirE beyin dilimleri 12. Zarından glutamat taşıma ile ilişkili geçerli stoikiometrik bileşeni CH3 SO 3 kullanılarak izole edilebilir - ya da C 6H 11 O - 7 dayalı hücre içi solüsyon ve astrositler 13,14 üzerinde flaş-Uncaging glutamat tarafından uyarılmış olabilir, veya komşu sinaps gelen glutamat serbest etkinleştirerek, ya elektriksel 12 veya hedeflenen optogenetic kontrol.
Taşıyıcı akım stokiyometrik bileşeninin zaman ders astrositik membran (yani glutamat boşluk) de glutamat konsantrasyonu profili ömrü ile şekillenir, glutamat taşıyıcıları, astrositlerde pasif membran özelliklerinin kinetik ve sinaptik uyarımlar, sırasında aktive sinaps 13 arasında glutamat serbest eşzamanlılık. Burada tam ayrıntılı olarak açıklar: (1) deneysel yakörnek deneysel hazırlık olarak akut fare hipokampal dilimleri kullanarak astrositlerden tam hücreli yama-kelepçe kayıtları glutamat taşıyıcı akımların stokiyometrik bileşeni izole etmek için oach, (2) analitik bir yaklaşım bu kayıtları 13, gelen glutamat açıklık zaman ders türetmek için 14. Bu yöntemler, kayıt ve merkezi sinir sistemine ait herhangi bir bölgede astrositlerden glutamat taşıyıcı akımları analiz etmek için kullanılabilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Dilim Hazırlık
- 119 NaCl, 2.5 KCl, 0.5 CaCl2, 1.3 MgSO 4 · 7H 2 O, 4 MgCl2, 26.2 NaHCO3, 1 NaH 2 PO 4, ve 22 glukoz, 320: içeren / depolama çözümü (mM) dilimleme 500 ml hazırlayın mOsm, pH 7.4,
- Dilimleri için bir batma odası hazırlamak için 250 ml beher kullanın, / depolama çözümü dilimleme 200 ml ile doldurun, 34 de bir su banyosunda sıcak ° C ve% 95 O 2,% 5 CO 2 ile balonu bu.
- 4 bir cam şişede kalan dilimleme / depolama çözümü ° C tutun
- Vibratome numune tutucu küçük bir agar blok (% 6, ACSF hazırlanan) ekleyin ve 4 ° C'de saklamak için bir siyanoakrilat yapıştırıcı kullanın
- 30 dakika dilimleme başlamadan önce, buz ve% 95 O 2,% 5 CO 2 ile kabarcık onunla dolu bir kova dilimleme / depolama çözümü içeren cam şişe yerleştirin.
Not: hız ve hassasiyet aşağıda açıklanan diseksiyon adımlar için büyük önem taşımaktadır.
- Halotan ile fare (P14-21, C57BL / 6) anestezisi / izofluran (izofluran astrositik glutamat alımını 15 geliştirmek için bildirilmiştir), bu başını kesmek ve oksijenli, soğuk dilimleme / depolama çözümü içeren 50 ml beher baş daldırma.
- Kağıt havlu ile sarılır ve -20 ° C'de saklanan bir buz paketi üzerinde beyin diseksiyon
- Frontal gelen kuyruk sonuna kadar, başın sırt tarafında bir orta sagital cilt kesi yapmak ve kafatası ortaya çıkarmak için bir neşter kullanın.
- Oksipital delik cerrahi makas küçük bir çift alt kesme bıçağı yerleştirin ve iki kesim, sola doğru ve sağ tarafta (45 ° açı) yapmak.
- Kaudal ikinci ön ucuna, orta sagital hattı boyunca kafatasının kesin.
- Bir spatula ile beyin çıkarın ve oksijenli, soğuk dilimleme / depolama soluti içinde daldırmaüzerinde.
- Bir neşter ile, beş kesim yapmak: (1) koku ampuller ve frontal korteks kaldırmak, (2) beyincik çıkarın, (3) sol çıkarın ve (4) sağ temporal lob, (5) iki beyin hemisfer ayırmak orta sagital kesim ile.
- Dab kağıt havlu ile beynin iki bölümden herhangi bir aşırı çözüm kaldırmak için.
- Tutkal soğuk vibratome taban plakasına her bir beyin bölümünün yan yüzeyi: beyin dorsal tarafına vibratome bıçak dönük olmalıdır; beynin ventral tarafta ve uzakta bulunan vibratome bıçak, agar blok ile temas halinde olmalıdır.
Not: yüksek kalitede dilimler elde etmek için, bu beynin iki parça sıkıca vibratome taban plakasına yapıştırılmış olması önemlidir. Bunu yapmak için, çok sıvı ve çok hızlı kurumasına olmadığını olmayan bir siyanoakrilat yapışkan kullanın. - Diseksiyon odasına vibratome taban plakası Güvenli, dilim inci set250 mikron ickness ve bıçak çalışma alanı genişliğini ayarlayın. Dilimleme ile devam edin.
Not: her şeyin doğru yönlendirilmiş ise, vibratome beynin yan tarafına doğru ventral doğru dorsal gelen ve medial gelen parasagital dilimleri kesme edilmelidir. - Bıçak korteks ve hipokampus ile geçtikten sonra, orta beyin gelen korteks / hipokampus kesip 34 de su altında odasında her dilim yerleştirmek için bir neşter kullanabilirsiniz ° C
- Dilimleri ilk çift atın. Tipik olarak, 12 dilim (250 um kalınlığında), bir P14-21 fare beyninden elde edilebilir.
- 30 dakika boyunca 34 ° C'de tutun dilimleri ve elektrofizyolojik kayıtları için kullanılmadan önce 30 dakika süre ile oda sıcaklığına soğumaya bırakın.
2. Astrosit Kimlik ve Kayıtlar
- 120 KCH SO 3 3, 10 EGTA, 20 HEPES, 2 MgATP, 0.2 NaGTP,: içeren bir iç çözelti (mM olarak) hazırlanması5 QX-314Br ve 5 NaCI, 290 mOsm, pH 7.2.
- 119 NaCl, 2,5 KCl, 2.5 CaCl2, 1.3 MgSO 4 · 7H 2, O, 1 MgCl2, 26.2 NaHCO3, 1 NaHPO 4 ve 22 glikoz, 300 mOsm, pH 7.4: ihtiva eden bir hücre dışı kayıt solüsyonu (mM olarak) hazırlanması ,% 95 O2,% 5 CO2 ile doyurulur.
- GluA, Glun, mGluRII, mGluRIII, GABA A, GABA B ve A1 adenosin reseptörlerinin (uM olarak) aktivasyonunu engellemek için, hücre dışı kayıt çözümü için aşağıdaki ilaçlar ekleyin 10 2,3-Diokso-6-nitro-1, ,2,3,4-tetrahidrobenzo [ƒ] -3 kinoksalin-7-sülfonamid disodyum tuzu (NBKX), 10 (RS) - (2-carboxypiperazin-4-il)-propil-1-fosfonik asit (CPP), (2S )-2-Amino-2-[(1S, 2S)-2-carboxycycloprop-1-il] -3 - (Xanth-9-il) propanoik asit disodyum tuzu (LY341495), 100 (R, S)-α- metilserin-O-fosfat (MSOP), 100 Pikrotoksinin 3, 5 - [[(3,4-diklorofenil) metil] amino] propil] dietoksimetil) fosfinik asit (CGP52432), 18-siklopentil-1 ,3-dipropylxanthine (DPCPX).
- - 36 ° C sıcaklık dereceleri 34 arasında olan, kayıt bölümü içinde hücre dışı çözeltinin sıcaklığını ayarlama
- Bir çift kademeli kullanarak borosilikat cam kılcal (R ≈ 2.5 MQ), cam mikro-pipet çektirmenin yama-kelepçe elektrotlar hazırlayın.
- Dilimleri birini alın ve kayıt odasına yerleştirin. Platin tel ve naylon dizeleri ile yapılan bir metal arp ile basılı tutun.
- Görme Dodt aydınlatma veya IR-DIC altında dilimleri kontrol edin. Astrositler kendi küçük hücre gövdesi (Ø = 10 mikron) ve belirgin çekirdeği (Şekil 1) ile tespit edilebilir.
- Sinaptik uyaranlar için, iki kutuplu bir paslanmaz çelik elektrot yerleştirmek, ~ 100 mikron uzakta yama planladığınız astrosit gelen.
- Astrosit yama ve çok nazik vakum uygulayarak tam hücreli yapılandırma kırmak.
Not: Astrositler genellikle düşük giriş dayanımı vare (~ MQ 10), hiperpolarize istirahat membran potansiyeli (~ -90 mV), ve hiçbir ateş aktivite. Astrositler gerilim-kelepçe modu (yani tutma akımı 0 pA okumalısınız) en deneyler genelinde istirahat membran potansiyeli tutulur. Her stimülasyon önce, gerilim adım (-3 mV) hiperpolarizan bir 10 ms astrosit dizi ve giriş direnci izlemek için kullanılır. - Seri direnç değişiklikleri>% 20 veya astrosit en membran potansiyeli depolarize olursa eğer kayıtları atın. Astrosit arasında membran potansiyeli direkt voltaj-kıskaç ikinci akım kelepçe moduna geçiş ile ölçülebilir. Alternatif olarak, voltaj-kıskaç modunda iken, membran potansiyeli 0 Pa sonuçlanır tutma akımı bu tutma potansiyeli değerinin okuyarak izlenebilir.
- Sinaptik uyarılara istihdam ise, alternatif tek ve eşli uyaranlara (dışında örneğin 100 msn), her 10 - 20 sn.
- UV fotoliz experim içinveliler, mikroskop Epifloresans bağlantı noktasına bir uncaging Xe lambası takın ve hücre dışı çözüm için kafesli bileşik ekleyin. 100 mcM görüş tüm alanında MNI-L-glutamat (Ø = 662,5 mikron bir 40X objektif 14 kullanırken). Flaş uncaging zaman ~ 100 pA genlik taşıyıcı akımları elde edilebilir Açık ve bloke ışık yolu, her 10 ile Alternatif uyarılar - 20 sn.
- Taşıyıcı akım genliği azaltmak için, kontrol koşulları ve geniş spektrumlu taşıyıcı glutamat antagonisti, D, L-treo-β-Benzyloxyaspartic asit (10 uM TBOA) bir alt doymuş konsantrasyon varlığında glutamat geçici ve kayıt taşıyıcı akımlarının uyandırmak tamamen bloke eder ve akım taşıyıcı + akım sürekli K izole etmek için (bkz. Bölüm 3) - en azından 30 olan kontrol değerinin% (bölüm 4, 5) veya TBOA yüksek bir konsantrasyon (100 uM 50) varlığında için .
3. PharmacSürekli K +-akım ological izolasyonu
- Kontrol koşulları ve TBOA yüksek bir, doymuş konsantrasyon (- 100 uM 50) varlığında, astrositik akımları kaydedin.
- TBOA ortalama en az 20 temizleyicileri (50 - 100 mcM).
- Fonksiyonu ile 3.2 elde edilen ortalama izleri Fit:
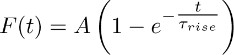
Not: TBOA-duyarlı bileşen (yani TBOA varlığında (50 kayıtlı olan bir - 100 uM)) + akım sürekli K temsil eder. Onun zaman tabii ki yukarıda açıklanan mono-üstel fonksiyonu ile tahmin edilir. - Farklı astrositler arasında bu uyum tekrarlayın ve Τ artış ortalama değeri (sürekli K +-akım ortalama yükselme zamanı (bkz. Bölüm 5) yani) elde.
4. Bensynaptically-Aktif Transporter Akımlar Kolaylaştırılmış kısmı (fSTCs) bir solation
- Kontrolü koşullarda ve TBOA eşleştirilmiş uyaranlar ile elde edilen ortalama en az 20 temizleyicileri, (10 mcM) (Şekil 2a sol).
- Kontrolü koşullarda ve TBOA tek uyarılar, (10 mcM) (Şekil 2a orta) ile elde temizleyicileri ortalama bir aynı sayıda.
- Dört ortalama izleri (kontrol tek darbe, kontrol eşleştirilmiş-bakliyat, TBOA tek darbe, TBOA eşleştirilmiş-bakliyat) en -3 mV gerilim adıma ortalama akım yanıt genliği karşılaştırın.
- Geçerli yanıt genliği dört izleri aynı ise, 4.7 adıma geçin.
- Ortalama akım tepkisi genliği dört iz herhangi farklı ise, tek tek tüm izleri ortalama dahil edilmesi için uygun olduğunu gösterir.
- Ortalama akım genliği dört iz herhangi farklıdır, ancak bütün halindeMünferit izleri ortalama dahil edilmesi uygun, doğrulamak her iz doğrusal test gerilimi adıma geçerli yanıt büyüklüğü ile FSTC ölçekler büyüklüğünde. Bu durumda, test voltajı adıma mevcut yanıtları genlik tüm eşit olacak şekilde birbirlerine göre tüm izlerini ölçeklendirme.
Not: Kayıt koşullarında (yani hücre içi CH 3 SO 3 - veya C 6 H 11 O 7 -) Burada anlatılan, eksitatör akson sinaptik uyarılar mevcut bir hızla yükselen geçici içe stokiyometrik ve yavaş oluşan karmaşık dalga şekilleri ile astrositik akımları oluşturur -Yükselen, içe K sürekli + akım K + yeniden dengeleme komşu akson boyunca aksiyon potansiyeli yayılma takip eden hücre dışı alanda yansıtan. Herhangi bir kaçak akım olarak, +-akım bu sürekli K kaldırmak için kritik bir yol açacakglutamat ömür boyu abartma. - Eşleştirilmiş uyaranlar (Şekil 2a sağda) ile elde edilen ortalama iz gelen tek uyarılar ile elde edilen ortalama iz çıkarın. Bu adım, stokiyometrik ve sürekli K ikinci uyaran tarafından uyarılmış + akım izole sağlar.
- Eşleştirilmiş-bakliyat (örneğin 100 msn) (Şekil 2b) teslim etmek için kullanılan arası nabız aralığı uygun bir zaman aralığı ile tek uyarılar ile elde edilen ortalama iz Shift.
- 4,7 (Şekil 2c) 'de elde edilen ikinci teşvik için ortalama karşılık tek uyarımlar ile elde zaman kaydırmalı ortalama tepki çıkarın. Bu adım, ikinci uyaran (FSTC) tarafından uyarılmış taşıyıcı akımın kolaylaştırdı kısmını izole eder.
- Çoğu durumda, bir önceki adımda tamamen sürekli K + akımı kaldırır. Bu durumda ise, fstc bölgesinin izolasyonu işlemi tamamlandığında ve prosedürü olabilirdeconvolution analiz ed ve astrositlerden glutamat açıklık zaman ders elde. Bazı durumlarda ise, küçük bir sürekli K + akımı hala mevcut olup (Şekil 2d) ve daha fazla analiz (bkz. Bölüm 5) gereklidir.
Not: 4,7-4,10 açıklanan analiz kontrolü koşullarda ve TBOA (10 mcM) elde edilen ortalama izleri üzerinde yapılması gerektiğini unutmayın.
5. Artık zdustained K çıkarma fSTCs gelen + akım
- Bölüm 4 'de tarif edilen bir analiz yapıldıktan sonra kalan + akım sürekli K genliği ölçün.
- Kalıntı sürekli K +-akım genliği 5.1 (Şekil 2d, sol ve orta) ile ölçülür. 3.3 'de tarif edilen mono-üstel fonksiyon genlik ölçeklendirme Bunu yapmak için, Denklem 3.3 'de, bir me + akım sürekli K genliğine eşittir dönem ayarlamak5.1 asured ve dönem Τ artış 3.4 tahmin Τ artış ortalama değerine eşittir.
- FSTC ve sürekli K + akım 4.10 (Şekil 2d sağ) elde. Ortaya çıkan mono-üstel fonksiyonu çıkarma Bu adım, fstc bölgesinin izolasyonu tamamlar.
6. Flash aktive Transporter Akımlar izolasyonu (FTCs)
- Kontrolü koşullarda ve TBOA açık ışık yolu, (10 mcM) ile elde edilen ortalama en az 20 süpürür.
- Işık yolu ile elde temizleyicileri ortalama bir aynı sayıda kontrol koşulları ve TBOA (10 mcM) olarak, kapalı.
- Dört ortalama izleri (kontrol tek darbe, kontrol eşleştirilmiş-bakliyat, TBOA tek darbe, TBOA eşleştirilmiş-bakliyat) en -3 mV gerilim adıma geçerli yanıt genliği karşılaştırın.
- Geçerli yanıt genliği dört izleri aynı ise, 6.7 adıma geçin.
- Ortalama akım tepkisi genliği dört iz herhangi farklı ise, tek tek tüm izleri ortalama dahil edilmesi için uygun olduğunu gösterir.
- Ortalama akım genliği dört iz herhangi farklıdır, ancak tek tek tüm izleri ortalama dahil edilmesi için uygun olan, ışık yolu ile her bir iz içinde büyüklüğü ile doğru orantılı olarak FTC ölçekler büyüklüğü açık olduğunu doğrulamak test gerilimi adıma geçerli yanıt. Bu durumda, test voltajı adıma mevcut yanıtları genlik tüm eşit olacak şekilde birbirlerine göre tüm izlerini ölçeklendirme.
Not: Kayıt koşullarında (yani hücre içi CH 3 SO 3 - veya C 6 H 11 O 7 -) Burada anlatılan, flaş uyarı hızla yükselen geçici stokiyometrik içe akım sadece oluşan astrositik akımları oluşturur. - Işık pat ile elde edilen ortalama iz çıkarmah açık ışık yolu ile elde edilen ortalama iz engellendi. Bu adım uyaran eser kaldırılması ve FTCs izole sağlar.
Not: 6.7 'de tarif edilen analiz kontrol şartlarında ve TBOA (10 uM)' de elde edilen ortalama izleri gerçekleştirilmelidir.
7. Dekonvolüsyon analizi
- Fit kontrol koşulları (Şekil 3a sol) ve gibi bölümlerde 4 açıklandığı TBOA (10 mcM) (Şekil 3a sağda) ve izole kaydedilen akım taşıyıcı (FSTC veya FTC) - çok üstel fonksiyonu ile, 6:

- Bozunur mono-katlanarak işleve göre bir anında yükselen işlevi oluşturmak:
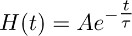
veBu TBOA (10 mcM) (Şekil 3b) kaydedilen taşıyıcı akımın çürüyen aşamasında iyi açıklar.
Not: 7.2 (yani H (t)) 'de tarif edilen işlevi TBOA (10 uM) mevcudiyetinde astrositlerden glutamat açıklık zaman süreci temsil eder. - 7.1 (Şekil 3a doğru, sol C) 'de elde TBOA (10 uM) kaydedilen taşıyıcı akımın uygun 7.2 (Şekil 3b ve 3c orta)' de elde edilen mono-üstel fonksiyon Deconvolve.
Not: deconvolution (örneğin Matlab, Python) gibi birçok analiz yazılım paketleri dahil matematiksel bir işlemdir. IgorPro, biz genellikle bu tür bir analiz gerçekleştirmek için kullandığınız programlama kodu, deconvolution çalışma verimli ayrık hızlı Fourier dönüşümleri kullanılarak, aşağıda açıklandığı gibi hesaplanabilir. İlk olarak, di hesaplamak için FFT işlemini kullanınscrete hızlı Fourier 7.2 'de elde edilen mono-üstel fonksiyonu ve 7.1 elde TBOA kaydedilen taşıyıcı akım uyum dönüşümü. Sonra, iki FFT fonksiyonların oranı ters ayrık hızlı Fourier dönüşümü hesaplamak için IFFT işlemi kullanır. Elde edilen fonksiyonu I (t), aşağıdaki gibi tarif edilebilir: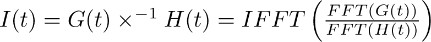
7.3 açıklanan adım TBOA (10 mcM) (Şekil 3c sağ) mevcut taşıyıcı filtre kaynaklanan sağlar. 6 (yani FSTC veya FTC) - Filtre bölümlerde 4 izole taşıyıcı mevcut içine astrositik membran de glutamat ömrü dönüştürmek bozulma faktörleri temsil eder. - (Kontrol koşullarda mevcut taşıyıcı uygun gelen (Şekil 3c sağ, Şekil 3d orta) filtre Şekil 3a Deconvolve sol, Şekil 3d) bıraktı.
Not: Bu adım kontrol koşullarda astrositlerde (Şekil 3d sağ) glutamat açıklık zaman ders kaynaklanan sağlar. Bu deconvolution adım altında yatan varsayım, filtrenin zamansal profil kontrolü koşullarda ve TBOA (10 mcM) içinde değişmeden kalmasıdır. - Glutamat boşluk genel zaman tabii ki bir kantitatif tahmin elde etmek için, adım 7.4 'de elde edilen dalga ağırlık merkezi () hesaplar. Bu olarak hesaplanarak yapılır:
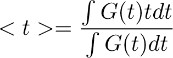
burada G (t), dalga biçimi adım 7.1 'de elde edilir. Yukarıdaki denklem tarif terimi, t tamamlayıcı hesaplanan zaman penceresini karşılık gelir.
Not: yöntem ilk kurulduğu zaman, 13 serbest bırakıldı zaman pencereler üzerinde hesaplandı. Entegrasyon pencere tamamen geri başlangıca glutamat açıklık ve boşluk dalga bozunur süreleri daha geniş olarak ayarlanır gibi bu yaklaşım sürece kullanılabilir. Bu durum bu değilse, ancak, tahmin Bu yöntem, bazı sınırlamalar karşılaşır. Açıklık dalga formu için tam olarak geri temel çürük etmez, örneğin, daha sonra birleştirme penceresinin genişliği artar. Ve tahmin için yanlışlık herhangi bir potansiyel kaynak önlemek için, şimdi başlangıcından 14 öncesi ve sonrası, mevcut taşıyıcı zirvesinde% 10 tekabül eden bir zaman penceresi üzerine hesaplamak. İkinci yaklaşım, hücreler boyunca ölçüldüğü ile tutarlılık artırır. Boşluk sırasında ders farmakolojik tedavilerin küçük etkileri analiz bu özellikle kullanışlı oluyor.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Analitik yaklaşımın başarısı kritik merkezi sinir sisteminin herhangi bir bölgesinde astrositlerden taşıyıcı akımların yüksek kaliteli elektrofizyolojik elde bağlıdır Burada anlatılan. Akut fare hipokampal dilimleri, astrositlerde kolayca nedeniyle küçük hücre gövdesi (Ø = 10 mikron) ve belirgin çekirdeği (Şekil 1) Dodt aydınlatma veya IR-DIC altında tespit edilebilir. Hücre içi bir çözüm, (Şekil 1) Alexa 594 (50 mcM) gibi bir fluorofor eklerken kendi ...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Burada astrositlerden elektrofizyolojik elde etmek için deneysel bir yaklaşım tanımlamak, astrositlerde glutamat taşıyıcı akımlar izole etmek için analitik bir protokol ve bir matematiksel yöntem astrositik taşıyıcı akımlardan glutamat açıklık zaman ders elde.
Analizin başarısı astrositlerden yüksek kaliteli yama kelepçe kayıtları elde etmek için yeteneği ve taşıyıcı akımları tanımlamak için kullanılan uydurma algoritmaları doğruluğunu dayanır. Deconv...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan ederim.
Teşekkürler
Bu çalışma Nörolojik Bozukluklar ve İnme İntramural Araştırma Programı (NS002986) Ulusal Enstitüsü tarafından desteklenmiştir. AS el yazması yazdı ve deconvolution analizi uygulanmıştır. JSD deconvolution analizi ilk versiyonunu geliştirdi ve metin yorumladı.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| CGP52432 | Tocris | 1246 | |
| (R,S)-CPP | Tocris | 173 | |
| DPCPX | Tocris | 439 | |
| LY341495 disodium salt | Tocris | 4062 | |
| MSOP | Tocris | 803 | |
| NBQX disodium salt | Tocris | 1044 | |
| D,L-TBOA | Tocis | 1223 | |
| Picrotoxin | Sigma | P1675 | |
| MNI-L-glutamate | Tocris | 1490 | |
| Alexa 594 | Life Technologies | A10438 | Optional |
| Matrix electrodes | Frederick Haer Company | MX21AES(JD3) | |
| Borosilicate glass capillaries | World Precision Instruments | PG10165-4 | |
| Dual-stage glass micro-pipette puller | Narishige | PC-10 | |
| Loctite 404 instant adhesive | Ted Pella | 46551 | |
| Xe lamp | Rapp OptoElectronic | FlashMic | |
| Igor Pro 6 | Wavemetrics |
Referanslar
- Ventura, R., Harris, K. M. Three-dimensional relationships between hippocampal synapses and astrocytes. J. Neurosci. 19, 6897-6906 (1999).
- Witcher, M. R., Kirov, S. A., Harris, K. M. Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus. Glia. 55, 13-23 (2007).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Herman, M. A., Jahr, C. E. Extracellular glutamate concentration in hippocampal slice. J. Neurosci. 27, 9736-9741 (2007).
- Arnth-Jensen, N., Jabaudon, D., Scanziani, M. Cooperation between independent hippocampal synapses is controlled by glutamate uptake. Nat. Neurosci. 5, 325-331 (2002).
- Barbour, B. An evaluation of synapse independence. J. Neurosci. 21, 7969-7984 (2001).
- Rusakov, D. A., Kullmann, D. M. Extrasynaptic glutamate diffusion in the hippocampus: ultrastructural constraints, uptake, and receptor activation. J. Neurosci. 18, 3158-3170 (1998).
- Zerangue, N., Kavanaugh, M. P. Flux coupling in a neuronal glutamate transporter. Nature. 383, 634-637 (1038).
- Eliasof, S., Jahr, C. E. Retinal glial cell glutamate transporter is coupled to an anionic conductance. Proc. Natl. Acad. Sci. U.S.A. 93, 4153-4158 (1996).
- Wadiche, J. I., Amara, S. G., Kavanaugh, M. P. Ion fluxes associated with excitatory amino acid transport. Neuron. 15, 721-728 (1995).
- Wadiche, J. I., Kavanaugh, M. P. Macroscopic and microscopic properties of a cloned glutamate transporter/chloride channel. J. Neurosci. 18, 7650-7661 (1998).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. J. Neurosci. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H. Neuronal transporters regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. J. Neurosci. 29, 14581-14595 (2009).
- Zuo, Z. Isoflurane enhances glutamate uptake via glutamate transporters in rat glial cells. Neuroreport. 12, 1077-1080 (2001).
- Barbour, B., Brew, H., Attwell, D. Electrogenic uptake of glutamate and aspartate into glial cells isolated from the salamander (Ambystoma) retina. J. Physiol. 436, 169-193 (1991).
- Bergles, D. E., Tzingounis, A. V., Jahr, C. E. Comparison of coupled and uncoupled currents during glutamate uptake by GLT-1 transporters. J. Neurosci. 22, 10153-10162 (2002).
- Diamond, J. S., Jahr, C. E. Synaptically released glutamate does not overwhelm transporters on hippocampal astrocytes during high-frequency stimulation. J. Neurophysiol. 83, 2835-2843 (2000).
- Benediktsson, A. M., et al. Neuronal activity regulates glutamate transporter dynamics in developing astrocytes. Glia. 60, 175-188 (2012).
- Hires, S. A., Zhu, Y., Tsien, R. Y. Optical measurement of synaptic glutamate spillover and reuptake by linker optimized glutamate-sensitive fluorescent reporters. Proc. Natl. Acad. Sci. U.S.A. 105, 4411-4416 (2008).
- Scimemi, A., Meabon, J., Woltjer, R. L., Sullivan, J. M., Diamond, J. S., Cook, D. G. Amyloidβ1-42 slows clearance of synaptically-released glutamate by mislocalizing astrocytic GLT-1. J. Neurosci. 33, 5312-5318 (2013).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır