A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הנובע את מהלך הזמן של חיסול גלוטמט עם ניתוח Deconvolution של זרמי Transporter astrocytic
In This Article
Summary
אנו מתארים שיטה אנליטית להעריך את החיים של גלוטמט בממברנות astrocytic מהקלטות אלקטרו של זרמי טרנספורטר גלוטמט בהאסטרוציטים.
Abstract
הצפיפות הגבוהה ביותר של מובילי גלוטמט במוח נמצאת בהאסטרוציטים. כמה מובילי גלוטמט התנועה של גלוטמט על פני הקרום עם שיתוף ההובלה של 3 Na + ו 1 + H ונגד התחבורה של K + 1. יכול להיות במעקב הנוכחי stoichiometric הנוצרים בתהליך ההובלה עם הקלטות תיקון-מהדק כל התא מתאים כוכביים. כמובן הזמן הנוכחי נרשם מעוצב על ידי את מהלך הזמן של פרופיל גלוטמט הריכוז כדי שהאסטרוציטים חשופים, קינטיקה של מובילי גלוטמט, ואת מאפייני electrotonic הפסיביים של קרומי astrocytic. כאן אנו מתארים את השיטות הניסיוניות ואנליטי, שניתן להשתמש כדי להקליט זרמי טרנספורטר גלוטמט בהאסטרוציטים ולבודד את מהלך הזמן של אישור גלוטמט מכל הגורמים האחרים המעצבים את צורת הגל של זרמי טרנספורטר astrocytic. השיטות שתוארו כאן ניתן להשתמש כדי להעריך את החיים oF פלאש ברח מכלוב וsynaptically-שוחרר גלוטמט בממברנות astrocytic בכל אזור במערכת העצבים המרכזית בבריאות ובחוליים.
Introduction
האסטרוציטים הם אחד מסוגי התאים הנפוצים ביותר במוח עם מורפולוגיה בצורת כוכב ובליטות בממברנה עדינות שמרחיבות לאורך neuropil ולהגיע 1,2 קשרים סינפטיים השכן. קרום התא של האסטרוציטים הוא ארוז בצפיפות עם מולקולות טרנספורטר גלוטמט 3. בתנאים פיסיולוגיים, מובילי גלוטמט במהירות לאגד גלוטמט בצד החוץ התאי של הממברנה ולהעביר אותו אל הציטופלסמה התא. בעשותם כך, מובילי לשמור על ריכוז הבסיס הנמוך של גלוטמט ב4 השטח תאי. מובילי גלוטמט בתהליכי astrocytic משובחים סמוכים לגירוי הסינפסות ממוקמים באופן אידיאלי כדי לאגד גלוטמט שוחרר במהלך אירועים סינפטיים כפי שהוא מפזר ממרווח הסינפטי. בעשותם כך, מובילי גם להגביל גלישת גלוטמט כיוון ו- פרי אזורים נוסף סינפטי ועל הסינפסות שכנות, צמצום הפער המרחבי של אות מעוררתים במוח 5-7.
גלוטמט תחבורה היא תהליך electrogenic stoichiometrically מצמידים את התנועה של 3 Na + ו + 1 H לאורך השיפוע אלקטרוכימי שלהם וללוחמה בהובלה של 1 K + 8. התחבורה גלוטמט קשורה (אבל לא stoichiometrically מצמידים) מוליכות anionic חדירים לSCN - (thiocyanate)> מס '3 - (ניטראט) ≈ CLO 4 - (פרכלורט)> אני -> Br -> Cl -> F -, לא לCH 3 SO 3 - (מתאן sulfonate) ו-C 6 H 11 O 7 - (גלוקונאט) 9-11. שני הזרמים (stoichiometric ולא stoichiometric) ניתן להקליט על ידי קבלת הקלטות תיקון-מהדק כל התא מהאסטרוציטים, שזוהו תחת תאורת Dodt או התערבות ההפרש לעומת זאת אינפרא אדום (IR-DIC) חזותי בacutדואר פרוסות מוח 12. מרכיב stoichiometric של הנוכחי קשורים לתחבורת גלוטמט על פני הקרום יכול להיות מבודד באמצעות CH 3 SO 3 -, או ג 6 11 7 O H - פתרונות תאיים מבוסס ויכול להיות עורר על ידי גלוטמט פלאש משחררות רפרוף על האסטרוציטים 13,14, או על ידי הפעלת שחרור גלוטמט מהסינפסות שכנות, או חשמלי 12 או עם שליטה ממוקדת optogenetic.
מהלך הזמן של רכיב stoichiometric של נוכחי טרנספורטר מעוצב על ידי חיים שלמים של פרופיל ריכוז הגלוטמט בממברנות astrocytic (אישור גלוטמט כלומר), קינטיקה של מובילי גלוטמט, את מאפייני הקרום הפסיביים של האסטרוציטים, ובמהלך הגירויים הסינפטי, על ידי סינכרוניזציה של שחרור גלוטמט פני סינפסות הופעלה 13. כאן אנו מתארים בפירוט מלא: (1) appr ניסיוניתאוח לבודד את מרכיב stoichiometric של זרמי טרנספורטר גלוטמט מהקלטות תיקון-מהדק כל התא מהאסטרוציטים באמצעות פרוסות בהיפוקמפוס חריפות עכבר כהכנה ניסיונית דוגמה, (2) גישה אנליטית לגזור את מהלך הזמן של אישור גלוטמט מהקלטות אלה 13, 14. שיטות אלה יכולים לשמש כדי להקליט ולנתח זרמי טרנספורטר גלוטמט מהאסטרוציטים בכל אזור של מערכת העצבים המרכזית.
Protocol
1. הכנת פרוסה
- הכן 500 מיליליטר חיתוך פתרון / אחסון המכיל (מ"מ): 119 NaCl, KCl 2.5, 0.5 CaCl 2, 1.3 MgSO 4 · 7H 2 O, 4 MgCl 2, 26.2 NaHCO 3, 1 אא 2 PO 4, וגלוקוז 22, 320 mOsm, pH 7.4
- השתמש בכוס 250 מ"ל כדי להכין את חדר טבילה לפרוסות, למלא אותו עם 200 מיליליטר חיתוך פתרון / אחסון, לחמם אותו באמבט מים ב 34 ° C ו בועה אותו עם 95% 2 O, 5% CO 2.
- שמור את הפתרון שנותר החיתוך / האחסון בבקבוק זכוכית ב 4 ° C.
- השתמש בדבק cyanoacrylate לצרף בלוק אגר קטן (6%, שהוכן בACSF) על בעל מדגם vibratome ולאחסן אותו ב 4 ° C.
- 30 דקות לפני תחילת חיתוך, הנח את בקבוק הזכוכית המכיל את הפתרון / אחסון חיתוך בדלי מלא קרח ואת בועה אותו עם 95% 2 O, 5% CO 2.
הערה: מהירות ודיוק הם בעל חשיבות עליונה לצעדי הנתיחה שיפורטו להלן.
- להרדים את העכבר (P14-21, C57BL / 6) עם halothane / isoflurane (isoflurane כבר דווח על מנת לשפר את ספיגת גלוטמט astrocytic 15), לערוף אותו, וטובל את ראשו בכוס 50 מ"ל המכילה חומץ פתרון, קר חיתוך / אחסון.
- לבצע נתיחה של המוח על שקית קרח עטופה במגבות נייר ומאוחסן ב -20 ° C.
- השתמש באזמל כדי להפוך את חתך בעור באמצע sagittal בצד הגב של הראש, מקדמי לקצה הזנב, ולחשוף את הגולגולת.
- מניחים את להב הגזירה התחתון של מספריים קטנים כירורגיות בחור העורפי ולעשות שני חתכים, לכיוון השמאל ועל צד ימין (45 ° זווית).
- חותכים את הגולגולת לאורך קו אמצע sagittal, מהזנב לקצה הקדמי.
- הסר את המוח עם מרית ולטבול אותו בחומץ, קר חיתוך / אחסון solutiב.
- עם אזמל, לעשות חמישה קיצוצים ל: (1) להסיר את נורות חוש הריח וקליפת המוח הקדמית, (2) להסיר את המוח הקטן; (3) להסיר את השמאל ו( 4) אונות הטמפורליות נכונות; (5) להפריד בין שתי האונות במוח עם חתך באמצע sagittal.
- תמרחי את שני חלקים של המוח עם מגבות נייר כדי להסיר כל פתרון עודף.
- דבק לרוחב פני השטח של כל חלק במוח לצלחת בסיס vibratome הקר: צד הגבי של המוח צריך להיות מול להב vibratome; הצד הגחוני של המוח צריך להיות במגע עם הבלוק אגר, הרחק מלהב vibratome.
הערה: כדי לקבל את הפרוסות באיכות הגבוהה ביותר, חשוב ששני החלקים של המוח מודבקים היטב לצלחת בסיס vibratome. כדי לעשות זאת, השתמש בדבק cyanoacrylate שאינו נזילה מדי ושלא יתייבשו מהר מדי. - לאבטח את צלחת בסיס vibratome לתא לנתח, להגדיר את ה פרוסהickness 250 מיקרומטר ולהתאים את רוחב טווח הלהב. להמשיך עם החיתוך.
הערה: אם הכל מכוון כראוי, vibratome צריך להיות חיתוך פרוסות parasagittal מגב לכיוון הגחון וממדיאלי לכיוון הצד לרוחב של המוח. - ברגע שהלהב עבר דרך קליפת המוח וההיפוקמפוס, השתמש באזמל כדי לחתוך את הקליפה / היפוקמפוס מהמוח התיכון ומניח כל פרוסה בתא המטבילה 34 ° C.
- מחק כמה פרוסות הראשונה. בדרך כלל, ניתן לקבל 12 פרוסות (250 מיקרומטר העבה) ממוח P14-21 עכבר.
- שמור את הפרוסות ב34 מעלות צלזיוס למשך 30 דקות ולתת להם להתקרר לטמפרטורת חדר למשך 30 דקות לפני השימוש בהם עבור הקלטות electrophysiology.
2. זיהוי והקלטות astrocyte
- הכן את הפתרון פנימי המכיל (מ"מ): 120 KCH 3 SO 3, 10 EGTA, 20 HEPES, 2 MgATP, 0.2 NaGTP,5 QX-314Br, ו5 NaCl, 290 mOsm, pH 7.2.
- הכן את פתרון תאי המכיל הקלטה (מ"מ): 119 NaCl, KCl 2.5, 2.5 CaCl 2, 1.3 MgSO 4 · 7H 2 O, 1 MgCl 2, 26.2 NaHCO 3, 1 NaHPO 4, וגלוקוז 22, 300 mOsm, pH 7.4 , רווי 95% 2 O, 5% CO 2.
- הוסף את התרופות הבאות לפתרון ההקלטה תאי, כדי לחסום את ההפעלה של GluA, GluN, mGluRII, mGluRIII, GABA, GABA-B, וקולטניים אדנוזין A1 (במיקרומטר): 10 2,3-Dioxo-6-ניטרו-1, 2,3,4-tetrahydrobenzo [ƒ] quinoxaline-7-sulfonamide disodium מלח (NBQX), 10 (RS) -3 - (2-carboxypiperazin-4-י.ל.)-propyl-1-phosphonic חומצה (CPP), (2S )-2-אמינו-2-[(1S, 2S)-2-carboxycycloprop-1-י.ל.] -3 - (xanth-9-י.ל.) propanoic חומצת מלח disodium (LY341495), 100 (R, S) α-- methylserine-O-פוספט (MSOP), 100 picrotoxin, 5 - 3 [[(3,4-Dichlorophenyl) מתיל] אמין] propyl] diethoxymethyl) חומצת phosphinic (CGP52432), 18-cyclopentyl-1 ,3-dipropylxanthine (DPCPX).
- הגדר את הטמפרטורה של הפתרון תאי בתא ההקלטה; טמפרטורות אופייניות הן בין 34-36 ° C.
- הכן אלקטרודות תיקון-מהדק מהתכה של זכוכית בורה נימים (R ≈ 2.5 MΩ) באמצעות כפול במה, זכוכית מיקרו פיפטה חולץ.
- קח אחת מהפרוסות ומניח אותו בתא ההקלטה. החזק אותו עם נבל מתכת עשה עם חוט פלטינה ומיתרים ניילון.
- ראייה לבדוק את הפרוסות תחת Dodt תאורה או IR-DIC. יכולים להיות מזוהים על ידי הגוף שלהם האסטרוציטים תאים הקטן (מ = 10 מיקרומטר) וגרעין בולט (איור 1).
- לגירויים סינפטיים, למקם את האלקטרודה נירוסטה דו קוטבית, ~ 100 מיקרומטר מastrocyte שאתה מתכנן לתיקון.
- תיקון astrocyte ולשבור בתצורה כל התא על ידי החלת שאיבה עדינה מאוד.
הערה: יש לי האסטרוציטים resistanc קלט נמוך בדרך כללדואר (~ 10 MΩ), פוטנציאל הממברנה מנוחה hyperpolarized (~ -90 mV), ואין פעילות ירי. את האסטרוציטים נשמרים בפוטנציאל הממברנה מנוחתה לאורך הניסויים במצב מתח-clamp (כלומר הנוכחיים מחזיק צריכה לקרוא 0 הרשות הפלסטינית). לפני כל גירוי, 10 מילישניות hyperpolarizing צעד מתח (mV -3) משמשת כדי לפקח על הסדרה והתנגדות מבוא של astrocyte. - מחק את ההקלטות אם שינויי התנגדות הסדרה> 20% או אם פוטנציאל הממברנה של astrocyte הופך depolarized. פוטנציאל הממברנה של astrocyte ניתן למדוד ישירות על ידי מעבר ממתח-clamp למצב נוכחי מהדק. לחלופין, כשהוא במצב מתח מהדק, ניתן לנטר את פוטנציאל הקרום על ידי קריאת הערך של פוטנציאל ההחזקה כי תוצאות 0 הרשות הפלסטינית מחזיקות נוכחית.
- אם גירויים סינפטיים מועסקים, גירויים חלופיים בודדים ולזווג (למשל 100 אלפיות שנייה בנפרד), בכל 10 - 20 שניות.
- לexperim photolysis UVמציג, חבר מנורת Xe משחררות רפרוף לנמל epifluorescence של המיקרוסקופ ולהוסיף למתחם כלוב לפתרון תאי. ניתן להשיג זרמי Transporter של ~ משרעת הרשות הפלסטינית 100 כאשר פלאש משחרר רפרוף מיקרומטר משרד תשתיות לאומי-L-גלוטמט 100 בכל שדה הראייה (מ = 662.5 מיקרומטר בעת שימוש אובייקטיבי 40X 14). גירויים חלופיים עם נתיב האור הפתוח וחסום, כל 10 - 20 שניות.
- לעורר ארעיים גלוטמט וזרמי טרנספורטר שיא בתנאי בקרה ובנוכחותו של תת להרוות ריכוז של חומצת אנטגוניסט הספקטרום רחב גלוטמט טרנספורטר D, L-β-threo-Benzyloxyaspartic (TBOA; 10 מיקרומטר) כדי להפחית את משרעת הנוכחית טרנספורטר לפחות 30% משווי שליטתה (ראה סעיפים 4, 5), או בנוכחות ריכוז גבוה של TBOA (50 - 100 מיקרומטר) כדי לחסום זרמי טרנספורטר לחלוטין ולבודד את K המתמשך + שוטף (ראה סעיף 3) .
3. Pharmacבידוד ological של K המתמשכים + השוטף
- הקלט זרמי astrocytic בתנאי בקרה ובנוכחות ריכוז להרוות, גבוה של TBOA (50 - 100 מיקרומטר).
- ממוצע של לפחות 20 במטאטא TBOA (50 - 100 מיקרומטר).
- תתאים את העקבות הממוצעות על 3.2 התקבלו בעם הפונקציה:
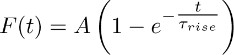
הערה: רכיב TBOA-חסר הרגישות (כלומר אחד שהוא רשם בנוכחות TBOA (50 - 100 מיקרומטר)) מייצג את K-המתמשך + נוכחית. כמובן הזמן שלה מקורב על ידי הפונקציה מונו מעריכי שתוארו לעיל. - חזור על הכושר הזה על פני האסטרוציטים שונים ולהפיק ערך מΤ עלייה ממוצע (כלומר זמן העלייה הממוצע של K + המתמשכת השוטפת (ראה סעיף 5)).
4. אניsolation של פרשת בנחייתם של זרמי Transporter synaptically המופעל (fSTCs)
- ממוצע לפחות 20 מטאטא שהושג עם גירויים לזווג, בתנאי בקרה ובTBOA (10 מיקרומטר) (משמאל איור 2a).
- מספר זהה ממוצע של מטאטא שהושג עם גירויים בודדים, בתנאי בקרה ובTBOA (10 מיקרומטר) (איור 2a באמצע).
- השווה את המשרעת של התגובה הנוכחית הממוצעת לצעד מתח mV -3 בארבע עקבות הממוצע (דופק השליטה יחיד, בקרה לזווג קטניות, דופק יחיד TBOA, TBOA לזווג פולסים).
- אם את המשרעת של התגובה הנוכחית היא אותו הדבר בכל ארבע העקבות, המשך לשלב 4.7.
- אם את המשרעת של התגובה הנוכחית הממוצעת היא שונה בכל אחד מארבע העקבות, לבדוק שכל העקבות הבודדות היו מתאימים להיכלל בממוצע.
- אם את המשרעת של הזרם הממוצע היא שונה בכל אחד מארבע העקבות, אבל בסךעקבות dividual מתאימות להיכלל בממוצע, לוודא שכל עקבות הגודל של קשקשי fSTC ליניארי עם הגודל של התגובה הנוכחית לצעד מתח הבדיקה. אם זה המקרה, בקנה מידה כל העקבות בכבוד זה לזה, כך שהתגובות השוטפות לצעד מתח המבחן כולם שווים באמפליטודה.
הערה: בתנאי ההקלטה שתואר כאן (כלומר תאי CH 3 SO 3 - או C 6 H 11 O 7 -), גירויים סינפטיים של אקסונים מעוררים ליצור זרמי astrocytic עם צורות גל מורכבות בהיקף של stoichiometric עולה במהירות חולף זרם פנימה ואיטי -עולה, ספג K פנימה + נוכחי משקף K + מחדש איזון במרחב תאי בעקבות התפשטות פוטנציאל פעולה לאורך האקסונים שכנים. זה קריטי כדי להסיר K המתמשך הזה + שוטף, כמו כל זרם שיורי יוביל ללהפריז בהערכה של החיים גלוטמט. - הפחת את העקבות הממוצעת שהושגו עם גירויים בודדים מהזכר הממוצע שהושג עם גירויים לזווג (איור 2a מימין). שלב זה מאפשר בידוד stoichiometric והמתמשך K + הנוכחי עורר על ידי הגירוי השני.
- Shift העקבות הממוצעת שהושגו עם גירויים בודדים במרווח זמן שמתאים למרווח בין הדופק המשמש להעברה לזווג קטניות (כלומר 100 אלפיות שנייה) (איור 2b).
- הפחת את התגובה בזמן השתנה הממוצע שהושגה עם גירויים בודדים מהתגובה הממוצעת לגירוי השני שהושג ב4.7 (איור 2 ג). צעד זה מבודד את חלק הקל של טרנספורטר הנוכחי עורר על ידי הגירוי השני (fSTC).
- ברוב המקרים, השלב הקודם מסיר לחלוטין K המתמשך + הנוכחי. אם זה המקרה, את הבידוד של fSTC הושלם ואתה יכול proceאד עם ניתוח deconvolution ולגזור את מהלך הזמן של אישור גלוטמט מהאסטרוציטים. בחלק מהמקרים, לעומת זאת, K מתמשך קטן +-נוכחי הוא עדיין קיים (איור 2) ונדרש ניתוח נוסף (סעיף 5 ראה מסגרת).
הערה: לזכור שהניתוח שמתואר ב4.7-4.10 חייב להתבצע על העקבות הממוצעות שהושגו בתנאי בקרה ובTBOA (10 מיקרומטר).
5. חיסור של K + zdustained שיורי שוטף מfSTCs
- מדוד את המשרעת של K + המתמשכת השוטפת שנותרה לאחר ביצוע הניתוח האמור בסעיף 4.
- הרחב את המשרעת של הפונקציה מונו מעריכי שמתוארת ב3.3 למשרעת של K המתמשך שיורי + שוטף נמדד ב5.1 (איור 2 שמאל ואמצע). כדי לעשות זאת, במשוואה 3.3, להגדיר את המונח שווה למשרעת של K + המתמשכת השוטףasured ב5.1 והטווח Τ העלייה שווה לערך הממוצע של Τ עלייה המוערכת ב3.4.
- להחסיר את הפונקציה מונו מעריכי כתוצאה מK fSTC ומתמשך + שוטף המתקבל ב4.10 (איור 2 מימין). צעד זה משלים את הבידוד של fSTC.
6. בידוד של זרמי Transporter פלאש המופעל (FTCs)
- ממוצע לפחות 20 מטאטא שהושג עם נתיב האור הפתוח, בתנאי בקרה ובTBOA (10 מיקרומטר).
- מספר זהה ממוצע של מטאטא שהושג עם נתיב האור סגור, בתנאי בקרה ובTBOA (10 מיקרומטר).
- השווה את המשרעת של התגובה הנוכחית לצעד מתח mV -3 בארבע עקבות הממוצע (דופק השליטה יחיד, בקרה לזווג קטניות, דופק יחיד TBOA, TBOA לזווג פולסים).
- אם את המשרעת של התגובה הנוכחית היא אותו הדבר בכל ארבע העקבות, המשך לשלב 6.7.
- אם את המשרעת של התגובה הנוכחית הממוצעת היא שונה בכל אחד מארבע העקבות, לבדוק שכל העקבות הבודדות היו מתאימים להיכלל בממוצע.
- אם את המשרעת של הזרם הממוצע היא שונה בכל אחד מארבע העקבות, אבל כל העקבות הבודדות מתאימות להיכלל בממוצע, לוודא שכל עקבות עם נתיב האור לפתוח את גודלו של ה-FTC הקשקשים באופן ליניארי עם הגודל של התגובה הנוכחית לצעד מתח הבדיקה. אם זה המקרה, בקנה מידה כל העקבות בכבוד זה לזה, כך שהתגובות השוטפות לצעד מתח המבחן כולם שווים באמפליטודה.
הערה: בתנאי ההקלטה שתואר כאן (כלומר תאי CH 3 SO 3 - או C H 11 O 6 - 7), גירויי פלאש ליצור זרמי astrocytic המורכבים רק מחולף stoichiometric הזרם פנימה עולה במהירות. - הפחת את העקבות הממוצעת שהושגו עם אור טפיחהשעות חסומות מהזכר הממוצע שהושג עם נתיב האור הפתוח. שלב זה מאפשר הסרת חפץ הגירוי ולבודד את FTCs.
הערה: הניתוח שתואר ב6.7 חייב להתבצע על העקבות הממוצעות שהושגו בתנאי בקרה ובTBOA (10 מיקרומטר).
7. ניתוח deconvolution
- Fit טרנספורטר הנוכחי (fSTC או FTC) נרשם בתנאי בקרה (איור 3 א שמאל) ובTBOA (10 מיקרומטר) (איור 3 א מימין) ומבודדת כפי שתואר בסעיפים 4 - 6, עם הפונקציה רבת מעריכי:

- ליצור פונקציה באופן מיידי עולה כי דועך מונו באופן אקספוננציאלי, בהתאם לפונקציה:
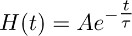
ו -בצורה הטובה ביותר מתארת את השלב הנוכחי של מתפורר טרנספורטר נרשם בTBOA (10 מיקרומטר) (איור 3).
הערה: הפונקציה שמתוארת ב7.2 (כלומר H (t)) מייצגת את מהלך הזמן של אישור גלוטמט מהאסטרוציטים בנוכחות TBOA (10 מיקרומטר). - Deconvolve הפונקציה מונו מעריכי שהושגו ב7.2 (איור 3 וג 3 באמצע) מההתקף של טרנספורטר הנוכחי נרשם בTBOA (10 מיקרומטר) המתקבל ב7.1 (איור 3 א נכון, ג משמאל).
הערה: deconvolution הוא פעולה מתמטית כלולה בחבילות תוכנת ניתוח רבות כמו (למשל Matlab, Python). בIgorPro, קוד תכנות, כי בדרך כלל אנו משתמשים כדי לבצע סוג זה של ניתוח, ניתוח deconvolution ניתן לחשב ביעילות כפי שיתואר להלן, על ידי שימוש פורייה מהיר הופך דיסקרטית. ראשית, להשתמש בפעולת FFT כדי לחשב את דיscrete מהיר התמרה פורה של הפונקציה מונו מעריכי שהושגה ב7.2 ושל ההתקף של טרנספורטר הנוכחי נרשם בTBOA הושג ב7.1. בשלב הבא, השתמש בפעולת IFFT כדי לחשב את המהירות ההפוכה דיסקרטי ההתמרה של היחס של שתי פונקציות FFT. ניתן לתאר את הפונקציה אני כתוצאה (t) באופן הבא: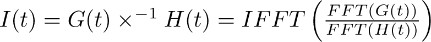
הצעד המתואר ב7.3 מאפשר נובע מסנן של טרנספורטר הנוכחי בTBOA (10 מיקרומטר) (איור 3 ג מימין). המסנן מייצג את גורמי העיוות כי להמיר את חייו של גלוטמט בממברנות astrocytic לטרנספורטר הנוכחי מבודד בסעיפים 4 - 6 (כלומר fSTC או ה-FTC). - Deconvolve המסנן (איור 3 ג הנכון, איור 3D באמצע) מההתקף של טרנספורטר הנוכחי בתנאי בקרה (איור 3 א שמאל, איור 3D משמאל).
הערה: שלב זה מאפשר הנובע כמובן עת שחרור גלוטמט מהאסטרוציטים בתנאי בקרה (איור 3D מימין). ההנחה העומדת בבסיס צעד deconvolution זה היא שהפרופיל הזמני של המסנן נותר ללא שינוי בתנאי בקרה ובTBOA (10 מיקרומטר). - כדי לקבל אומדן כמותי של מהלך הזמן הכולל של אישור גלוטמט, לחשב centroid () של צורת הגל המתקבל בשלב 7.4. הדבר נעשה על ידי חישוב כ:
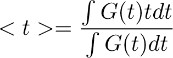
כאשר G (t) הוא צורת הגל המתקבל בשלב 7.1. במשוואה שתוארה לעיל, לא המונח מתאים לחלון הזמן שבו נפרד מחושב.
שים לב: כאשר השיטה הייתה ראשונה שהוקמה, חושב על חלונות זמן שנותרו בלתי מוגבל 13. גישה זו יכולה לשמש כל עוד חלון האינטגרציה מוגדר להיות רחב יותר מאשר משך הזמן של אישור גלוטמט ודועך צורת גל הסיקול לחלוטין חזרה לנקודת התחלה. אם זה לא המקרה, עם זאת, שיטה זו של הערכת פוגשת כמה מגבלות. לדוגמה, אם צורת גל הסיקול אינה להירקב בדיוק חזרה לנקודת התחלה, ולאחר מכן עם מגדיל את הרוחב של חלון האינטגרציה. כדי להימנע מכל מקור אפשרי לחוסר דיוק לאומדן , עכשיו אנחנו מחשבים אותו על פני חלון זמן מקביל ל -10% מהשיא של טרנספורטר הנוכחי, לפני ואחרי 14 הופעת המחלה. הגישה השנייה משפרת את העקביות שבי נמדדת על פני תאים. זה שימושי במיוחד בעת ניתוח השפעות קטנות של טיפולים תרופתיים על המהלך של שחרור.
תוצאות
ההצלחה של הגישה אנליטית שתוארה כאן באופן ביקורתי תלויה בהשגת הקלטות אלקטרו באיכות גבוהה של זרמי טרנספורטר מהאסטרוציטים בכל אזור של מערכת העצבים המרכזית. בחתכי היפוקמפוס עכבר חריפים, האסטרוציטים ניתן לזהות בקלות תחת Dodt תאורה או IR-DIC בגלל הגוף שלהם תאים הקטן (O מיקרומט...
Discussion
כאן אנו מתארים גישה ניסויית להשיג קלטות אלקטרו מהאסטרוציטים, פרוטוקול אנליטי לבודד את זרמי טרנספורטר גלוטמט בהאסטרוציטים ושיטה מתמטית כדי להפיק את מהלך הזמן של אישור גלוטמט מזרמי טרנספורטר astrocytic.
ההצלחה של הניתוח מסתמכת על היכ?...
Disclosures
המחברים מצהירים שאין ניגוד העניינים.
Acknowledgements
עבודה זו נתמכה על ידי המכון הלאומי להפרעות נוירולוגיות ושבץ תכנית מחקר עירונית (NS002986). AS כתב את כתב היד ויישם את ניתוח deconvolution. JSD פיתחה את הגרסה הראשונית של ניתוח deconvolution והגיב על הטקסט.
Materials
| Name | Company | Catalog Number | Comments |
| CGP52432 | Tocris | 1246 | |
| (R,S)-CPP | Tocris | 173 | |
| DPCPX | Tocris | 439 | |
| LY341495 disodium salt | Tocris | 4062 | |
| MSOP | Tocris | 803 | |
| NBQX disodium salt | Tocris | 1044 | |
| D,L-TBOA | Tocis | 1223 | |
| Picrotoxin | Sigma | P1675 | |
| MNI-L-glutamate | Tocris | 1490 | |
| Alexa 594 | Life Technologies | A10438 | Optional |
| Matrix electrodes | Frederick Haer Company | MX21AES(JD3) | |
| Borosilicate glass capillaries | World Precision Instruments | PG10165-4 | |
| Dual-stage glass micro-pipette puller | Narishige | PC-10 | |
| Loctite 404 instant adhesive | Ted Pella | 46551 | |
| Xe lamp | Rapp OptoElectronic | FlashMic | |
| Igor Pro 6 | Wavemetrics |
References
- Ventura, R., Harris, K. M. Three-dimensional relationships between hippocampal synapses and astrocytes. J. Neurosci. 19, 6897-6906 (1999).
- Witcher, M. R., Kirov, S. A., Harris, K. M. Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus. Glia. 55, 13-23 (2007).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Herman, M. A., Jahr, C. E. Extracellular glutamate concentration in hippocampal slice. J. Neurosci. 27, 9736-9741 (2007).
- Arnth-Jensen, N., Jabaudon, D., Scanziani, M. Cooperation between independent hippocampal synapses is controlled by glutamate uptake. Nat. Neurosci. 5, 325-331 (2002).
- Barbour, B. An evaluation of synapse independence. J. Neurosci. 21, 7969-7984 (2001).
- Rusakov, D. A., Kullmann, D. M. Extrasynaptic glutamate diffusion in the hippocampus: ultrastructural constraints, uptake, and receptor activation. J. Neurosci. 18, 3158-3170 (1998).
- Zerangue, N., Kavanaugh, M. P. Flux coupling in a neuronal glutamate transporter. Nature. 383, 634-637 (1038).
- Eliasof, S., Jahr, C. E. Retinal glial cell glutamate transporter is coupled to an anionic conductance. Proc. Natl. Acad. Sci. U.S.A. 93, 4153-4158 (1996).
- Wadiche, J. I., Amara, S. G., Kavanaugh, M. P. Ion fluxes associated with excitatory amino acid transport. Neuron. 15, 721-728 (1995).
- Wadiche, J. I., Kavanaugh, M. P. Macroscopic and microscopic properties of a cloned glutamate transporter/chloride channel. J. Neurosci. 18, 7650-7661 (1998).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. J. Neurosci. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H. Neuronal transporters regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. J. Neurosci. 29, 14581-14595 (2009).
- Zuo, Z. Isoflurane enhances glutamate uptake via glutamate transporters in rat glial cells. Neuroreport. 12, 1077-1080 (2001).
- Barbour, B., Brew, H., Attwell, D. Electrogenic uptake of glutamate and aspartate into glial cells isolated from the salamander (Ambystoma) retina. J. Physiol. 436, 169-193 (1991).
- Bergles, D. E., Tzingounis, A. V., Jahr, C. E. Comparison of coupled and uncoupled currents during glutamate uptake by GLT-1 transporters. J. Neurosci. 22, 10153-10162 (2002).
- Diamond, J. S., Jahr, C. E. Synaptically released glutamate does not overwhelm transporters on hippocampal astrocytes during high-frequency stimulation. J. Neurophysiol. 83, 2835-2843 (2000).
- Benediktsson, A. M., et al. Neuronal activity regulates glutamate transporter dynamics in developing astrocytes. Glia. 60, 175-188 (2012).
- Hires, S. A., Zhu, Y., Tsien, R. Y. Optical measurement of synaptic glutamate spillover and reuptake by linker optimized glutamate-sensitive fluorescent reporters. Proc. Natl. Acad. Sci. U.S.A. 105, 4411-4416 (2008).
- Scimemi, A., Meabon, J., Woltjer, R. L., Sullivan, J. M., Diamond, J. S., Cook, D. G. Amyloidβ1-42 slows clearance of synaptically-released glutamate by mislocalizing astrocytic GLT-1. J. Neurosci. 33, 5312-5318 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved