このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アストロサイトトランスポーター電流のデコンボリューション解析グルタミン酸クリアランスの時間経過の導出
要約
私たちは、アストロサイトにおけるグルタミン酸トランスポーター電流の電気生理学的記録から、アストロサイトの膜にグルタミン酸の寿命を推定するための分析方法について説明します。
要約
脳内のグルタミン酸トランスポーターの最高密度はアストロサイトに含まれています。グルタミン酸トランスポーターのカップル3のNa +と1 Hの共同輸送+と1のK +の逆輸送と膜を横切ってグルタミン酸の動き。輸送プロセスによって生成された化学量論的な電流は、星状細胞からの全細胞パッチクランプ記録を監視することができる。記録された電流の時間経過は、星状細胞がさらされるグルタミン酸濃度プロファイル、グルタミン酸輸送体の速度論、及び星状膠細胞膜の受動的電気緊張特性の経時変化によって成形される。ここでは、アストロサイトにおけるグルタミン酸トランスポーター電流を記録し、アストロサイトトランス電流の波形を整形する他のすべての要素からグルタミン酸クリアランスの経時変化を単離することができる実験·分析方法が記載されている。ここで説明する方法は、寿命、oを推定することができるfの健康と病気の間に、中枢神経系の任意の領域におけるアストロサイトの膜にグルタミン酸フラッシュuncagedとシナプスリリース。
概要
アストロサイトは、星型の形態と神経網全体に拡張し、隣接したシナプスの接点1,2達する細かい膜突起と脳の中で最も豊富な種類の細胞の一つである。アストロ'細胞膜が密グルタミン酸トランスポーター分子3が満載されています。生理学的条件下で、グルタミン酸輸送体は急速に膜の細胞側にグルタミン酸を結合し、細胞の細胞質に転送する。そうすることによって、輸送体は、細胞外空間4におけるグルタミン酸の低い基底濃度を維持する。シナプスの興奮に隣接細かいアストロサイトのプロセスにおけるグルタミン酸トランスポーターは、理想的に、それが離れてシナプス間隙から拡散するようにシナプスのイベントの際に放出グルタミン酸をバインドするために配置されている。そうすることにより、輸送体はまた興奮性信号の空間的な広がりを低減し、周囲と余分シナプス地域に向けて、隣接するシナプスへのグルタミン酸スピルオーバー制限5-7脳内の。
グルタミン酸輸送は、化学量論的に3のNa +と1 H +彼らの電気化学的勾配に沿って1の逆輸送への動きK + 8に結合された起電プロセスです。 (チオシアン酸)> NO 3 - - (硝酸塩)≈のClO 4 - (過塩素酸)> I - > Brの- > Cl -の> F -はなく、グルタミン酸輸送はSCNに対して透過性(ただし、化学量論的に結合されていない)のアニオン性コンダクタンスに関連付けられています(メタンスルホン酸)とC 6 H 11 O 7 - - (グルコン)9-11 CH 3 SO 3へ。両方の電流(化学量論的および非化学量論的)Dodt照明やacutで赤外微分干渉コントラスト(DIC-IR)の下で視覚的に識別、星状細胞から全細胞パッチクランプ記録を取得することによって記録することができる電子脳スライス12。膜を通過するグルタミン酸トランスポートに関連付けられた現在の化学量論的成分がCH 3 SO 3を用いて単離することができる- 、またはC 6 H 11 O 7 -ベース内のソリューションとアストロ13,14上のフラッシュアンケージンググルタミン酸によって誘発することができ、または近隣のシナプスからのグルタミン酸放出を活性化することによって、どちらか電気12またはターゲットoptogeneticコントロール付き。
現在のトランスポーターの化学量論的成分の時間経過は、によって、星状細胞膜( すなわちグルタミン酸クリアランス)、グルタミン酸トランスポーターの動態、アストロサイトの受動的膜特性、時およびシナプスの刺激時のグルタミン酸濃度プロファイルの寿命によって形作られているアクティブシナプス13渡るグルタミン酸放出のシンクロニシティ。ここでは、完全な詳細に説明します:(1)実験グラムApproachは、例えば実験的製剤として急性マウス海馬スライスを使用して星状細胞から全細胞パッチクランプ記録からグルタミン酸トランス電流の化学量論的成分を単離するステップと、(2)分析的アプローチは、これらの記録から13グルタミン酸クリアランスの経時変化を導出するために、 14。これらの方法は、中枢神経系の任意の領域におけるアストロサイトからのグルタミン酸トランス電流を記録して分析するために使用することができる。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1。スライス標本
- 119のNaCl、2.5 KClを、0.5のCaCl 2、1.3硫酸マグネシウム4·7H 2 O、4のMgCl 2、26.2のNaHCO 3、1のNaH 2 PO 4、および22グルコース、320:含む/ストレージソリューション(単位:mm)スライス500ミリリットルを準備mOsm、pHは7.4
- 200ミリリットルの溶液をスライス/ストレージで塗りつぶし、スライス浸水室を調製した250mlビーカーを使用し、34℃の水浴中°C、95%O 2、5%CO 2泡に温める。
- 4でガラス瓶の残りのスライス/ストレージソリューション℃で保つ
- ビブラトームサンプルホルダーに小さな寒天ブロック(6%、ACSFで準備)を添付して、それは4℃で保存するためにシアノアクリレート系接着剤を使用して、
- スライスを開始する30分前には、95%O 2、5%CO 2と氷とバブルそれを充填したバケツにスライス/貯蔵溶液を含むガラス瓶を置く。
注意:スピードと精度は下記の解剖の手順については、最優先事項です。
- ハロタン/イソフルランでマウス(P14-21、C57BL / 6)を麻酔(イソフルランはアストロサイトのグルタミン酸摂取15を高めることが報告されている)、それを斬ると、酸素、冷スライス/貯蔵溶液を入れた50mlビーカーにヘッドを浸し。
- ペーパータオルで包み、-20℃で保存されたアイスパックで脳の解剖を行い
- 正面から尾の端まで、頭部の背側の半ば矢皮膚切開を行い、頭蓋骨を露出するためにメスを使用してください。
- 後頭部の穴に外科はさみの小さなペアの下せん断刃を置き、左に向かって、右側にある2つのカット、(45°角度)を作る。
- 尾から正面最後に、半ば矢状線に沿って頭蓋骨をカットします。
- へらで脳を取り出し、酸素でそれを浸し、スライシング/コールドストレージsoluti上。
- メスで、に5カットを行います(1)嗅球と前頭皮質を除去し、(2)小脳を除去し、(3)左を削除し、(4)右の側頭葉、(5)2の脳半球を分離半ば矢状カットで。
- 軽く余分な溶液を除去するためにペーパータオルで脳の二つの部分。
- のり冷たいビブラトームベースプレートに各脳切片の側面:脳の背側はビブラトームブレードが直面すべきである、脳の腹側は車ビブラトームブレードから、寒天ブロックに接触しなければなりません。
注:最高品質のスライスを得るために、それが脳の二つの部分がしっかりとビブラトームベースプレートに接着されていることが重要である。これを行うには、あまりにも液体ではなく、それがあまりにも速く乾くしないシアノアクリレート系接着剤を使用しています。 - 解剖室へビブラトームベースプレートを固定し、スライス番目を設定250μmまでicknessとブレードランの幅を調整します。スライスに進みます。
注:すべてが正しい方向である場合、ビブラトームは腹側に向かって背側から、脳の側方に向かって内側から矢のスライスをカットする必要があります。 - ブレードは皮質と海馬を通過した後は、中脳から大脳皮質/海馬をカットし、34で水没チャンバー内に各スライスを配置するためにメスを使用し℃に
- スライスの最初のカップルを捨てる。典型的には、スライス12(厚さ250μm以下)を、P14-21マウス脳から得ることができる。
- 30分間34℃でスライスを維持し、それらが電気生理学の録音のためにそれらを使用する前に、30分間室温まで冷却することができます。
2。アストロサイトの識別と記録
- 120 KCH 3 SO 3、10 EGTA、20 HEPES、2 MgATP、0.2 NaGTP、:含む内部溶液(単位:mm)を準備5 QX-314Br、および5のNaCl、290 mOsm、pHは7.2。
- のNaCl、2.5 KClを、2.5のCaCl 2、1.3呈4、および22グルコース、300 mOsm、pHは7.4のNaHCO 3、1 O、1のMgCl 2、26.2·7H 2 MgSO 4を119:含む細胞外記録溶液(単位:mm)を準備、95%O 2、5%CO 2で飽和。
- GluA、GluN、mGluRII、mGluRIII、GABA A、GABA B、およびA1アデノシン受容体(μM)での活性化を阻止するために、細胞外記録液には、次の薬を追加します:10 2,3 -ジオキソ-6 -ニトロ-1、 2,3,4 -テトラヒドロベンゾ[ƒ] -3キノキサリン-7 -スルホン酸二ナトリウム塩(NBQX)、10(RS) - (2 - carboxypiperazin -4 -イル) -プロピル-1 -ホスホン酸(CPP)、(2S )-2 - アミノ-2 - [(1S、2S)-2 - carboxycycloprop -1 - イル] -3 - (xantho-の異形-9 - イル)プロパン酸二ナトリウム塩(LY341495)、100(R、S)-α-メチルセリン-O-リン酸(MSOP)、100ピクロトキシン、5 3 - [[(3,4 - ジクロロフェニル)メチル]アミノ]プロピル]エトキシメチル)ホスフィン酸(CGP52432)、18 - シクロペンチル-1,3 - ジプロピルキサンチン(DPCPX)。
- 録音室における細胞外溶液の温度を設定し、典型的な温度は、34の間にある - 36℃、
- デュアルステージを使用してホウケイ酸ガラスキャピラリー(R≈2.5MΩ)、ガラスマイクロピペットプラーからパッチクランプ電極を準備します。
- スライスの1つを取り、記録室に配置します。白金線とナイロン弦で作られた金属製のハープでそれを押したままにします。
- 視覚Dodt照明やIR-DIC下にスライスを検査します。星状細胞は、その小細胞体(φ= 10ミクロン)及び顕著な核( 図1)によって識別することができる。
- シナプス刺激の場合、パッチを計画しているアストロサイトから〜100μm程度離れて、双極ステンレス鋼電極を配置。
- アストロサイトにパッチを適用し、非常に穏やかな吸引を適用することにより、全細胞の構成で破る。
注:アストロサイトは、通常、低入力resistancを持っているE(MΩ〜10)、過分極静止膜電位(〜-90 mVで)、無発火活動。アストロサイトは、電圧クランプモード( すなわち保持電流が0 pAのをお読みください)での実験を通してその静止膜電位に保たれている。各刺激の前に、10msの過分極電圧ステップ(-3 mVの)は、星状細胞の一連の入力抵抗を監視するために使用される。 - 直列抵抗が変化する> 20%またはアストロサイトの膜電位が脱分極になった場合ば録音を破棄します。星状細胞の膜電位を直接クランプ電圧から電流クランプモードに切り替えて測定することができる。代替的に、電圧クランプモード中に、膜電位を0 pAをもたらすが、現在保持している保持電位の値を読み取ることによって監視することができる。
- シナプス刺激が採用されている場合は、別のシングルとペアの刺激(離れ例えば 100ミリ秒)ごとに10から20秒。
- UV光分解experim用エントは、顕微鏡の落射蛍光ポートにアンケージングのXeランプを接続し、細胞外液にケージド化合物を追加します。 100μM視野全体におけるMNI-L-グルタミン酸(Ø= 662.5μmの40X客観14を使用している場合)。をフラッシュ-アンケージング時〜100 pAの振幅のトランスポーター電流を得ることが可能となるオープンとブロック光路、すべての10と交互に刺激 - 20秒。
- トランスポーター電流振幅を低減するために、制御条件や広域グルタミン酸輸送体アンタゴニストD、L- トレオ -β-ベンジルオキシ安息香酸(10μMTBOA)のサブ飽和濃度の存在下でグルタミン酸トランジェントとレコード輸送電流を呼び起こす完全にトランスポーター電流を遮断し、+電流持続Kを隔離する(セクション3を参照) -少なくとも30その制御値の%(セクション4,5を参照)またはTBOAの高濃度(100μM50)の存在下に。
3。 Pharmac持続的なK +電流のological離
- 制御条件やTBOAの高い、飽和濃度( - 100μM50)の存在下でアストロサイトの電流を記録します。
- TBOAの平均少なくとも20スイープを(50 - 100μM)。
- 関数で3.2で得られた平均痕跡を合わせる:
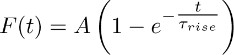
注:TBOA小文字を区別しないコンポーネントは、(すなわちTBOAの存在(50に記録されているもの- 100μM))持続的なK +電流を表します。その経時変化は、上述したモノ指数関数によって近似される。 - 異なるアストロ渡っこのフィットを繰り返し、Τ 上昇 (持続K(セクション5を参照)+電流の平均立ち上がり時間をIE)の平均値を導出する。
4。私シナプス活性化トランスポーター電流のファシリテーター部分(fSTCs)のゾル化
- 制御条件やTBOA(10μM)( 図2aの左)で、対になった刺激を用いて得られた平均的な少なくとも20スイープ。
- 制御条件およびTBOAの単一刺激(10μM)(図2a中央)で得られたスイープの平均同じ数。
- 4平均痕跡で-3 mVの電圧ステップ(制御シングルパルス、制御ペアリング·パルス、TBOA単一パルス、TBOAペアリング·パルス)への平均電流応答の振幅を比較してください。
- 電流応答の振幅がすべての4つのトレースで同じである場合には、4.7に進みます。
- 平均電流応答の振幅は4つのトレースのいずれかに異なっている場合、すべての個々のトレースは、平均的に含めることが適切であったことを確認する。
- 平均電流の振幅は、4つのトレースのいずれかが異なるが、すべての場合分離したトレースが平均に含めることが適切であり、試験電圧ステップに応答して電流の大きさを直線的に各トレースにfSTCスケールの大きさのことを検証する。このような場合には、試験電圧ステップに応答電流の振幅が全て等しくなるように、互いに対してすべてのトレースを縮小。
注:ここで説明した記録条件では(すなわち、細胞内CH 3 SO 3 - 、またはC 6 H 11 O 7 - )、興奮性軸索のシナプスの刺激には、現在の、遅い速い立上り過渡内側ストイキから成る複雑な波形とアストロサイトの電流を発生昇、近隣の軸索に沿って活動電位の伝播後に細胞外空間内向きK +電流を反映したK +再平衡化を支えた。残留電流につながるとして、それは、+ -現在、この持続的なKを除去することが重要ですグルタミン酸生涯の過大評価。 - ペアの刺激(図2a右)で得られた平均的なトレースから単一の刺激を用いて得られた平均的なトレースを引きます。このステップでは、化学量論および第二刺激によって誘発持続K +電流を分離することができます。
- ペアリング·パルス( すなわち 100ミリ秒)(図2b)を送達するために使用されるパルス間の間隔と一致する時間間隔によって、単一の刺激を用いて得られた平均的なトレースをシフトします。
- 4.7( 図2c)で得られた第二の刺激に対する平均応答から単一の刺激を用いて得られたタイムシフトの平均応答を引きます。このステップでは、第二の刺激(fSTC)により誘発されるトランスポーター電流の促進の部分を分離します。
- ほとんどの場合、前のステップでは、完全に持続的なK +電流を除去します。この場合は、fSTCの単離は完了し、proceすることができデコンボリューション解析とエドとアストロサイトからグルタミン酸クリアランスの経時変化を導き出す。場合によっては、しかしながら、小さい徐K +電流がまだ存在している( 図2D)、さらなる分析(第5節参照)が要求される。
注:4.7から4.10に記載されて分析が制御条件やTBOA(10μM)で得られた平均トレース上で実行されなければならないことを覚えておいてください。
5。 fSTCsから残留zdustained K +電流の減算
- セクション4で説明した解析を実行した後、残りの持続K +電流の振幅を測定します。
- 5.1( 図2D左と中央)で測定された残留持続K +電流の振幅に3.3で説明モノ指数関数の振幅をスケーリングする。これを行うには、式3.3に、私は+電流持続Kの振幅に等しい期間を設定する5.1でasuredそして用語Τ 上昇は 3.4で推定Τ 上昇の平均値に等しい。
- fSTCかつ持続K 4.10( 図2dの右側)で得られた+電流に起因モノ指数関数を引きます。このステップは、fSTCの分離を完了します。
6。フラッシュ活性化トランスポーター電流のアイソレーション(FTCS)
- 制御条件およびTBOAで開いて光路(10μM)を用いて得られた平均的な少なくとも20スイープ。
- 光路を用いて得られたスイープの平均同一の数が制御条件やTBOA(10μM)で、閉じた。
- 4平均トレース(制御シングルパルス、制御ペアリング·パルス、TBOA単一パルス、TBOAペアリング·パルス)で-3 mVの電圧ステップに対する電流応答の振幅を比較してください。
- 電流応答の振幅がすべての4つのトレースで同じである場合には、6.7に進みます。 は、すべての個々のトレースは平均に含めることが適切であったことを確認してください。
- 平均電流の振幅は4つのトレースのいずれかが異なるが、すべての個々のトレースを平均的に含めることが適切である場合には、光路と各トレースでのサイズに対して直線的にFTCスケールの大きさを開いていることを確認試験電圧ステップに電流応答。このような場合には、試験電圧ステップに応答電流の振幅が全て等しくなるように、互いに対してすべてのトレースを縮小。
注:ここで説明した記録条件では(すなわち、細胞内CH 3 SO 3 - 、またはC 6 H 11 O 7 - )、フラッシュ刺激は内向き電流、高速の立上り過渡ストイキのみで構成されるアストロサイトの電流を発生。 - 光パット付き得られた平均トレースを減算hは開い光路を用いて得られた平均的なトレースからブロック。このステップでは、刺激アーチファクトを除去し、FTCSを分離することができます。
注意:6.7で説明した分析が制御条件やTBOA(10μM)で得られた平均トレース上で実行する必要があります。
7。デコンボリューション解析
- フィット制御条件( 図3aは左)やなどのセクション4で説明TBOA(10μM)( 図3Aの右)と隔離された中で記録された現在のトランスポーター(fSTCまたはFTC) -多指数関数と、6:

- 減衰モノ指数関数に従ってという瞬時上昇関数を作成します:
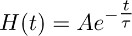
とそれはTBOA(10μM)(図3b)に記録されているトランスポーター電流の減衰位相を最もよく表し。
注:7.2(すなわち、H(t))がに記載関数はTBOA(10μM)の存在下でのアストロサイトからのグルタミン酸クリアランスの経時変化を表している。 - 7.1( 図3aは 、右、cは左)で得られたTBOA(10μM)に記録されているトランスポーター電流のフィットから7.2(図3b、3cの真ん中)で得られたモノ指数関数をデコンボリューション。
注:デコンボリューション(例えばMatlabの、Pythonの)のような多くの解析ソフトウェア·パッケージに含まれている数学的な操作です。離散フーリエ変換を用いることにより、後述するようにIgorPro、我々は一般的にこの種の分析を実行するために使用するプログラミング·コードでは、デコンボリューション動作を効率的に計算することができる。まず、ジを計算するためにFFT演算を用いる7.2で得られたモノ指数関数および7.1で得られたTBOAに記録されているトランスポーター電流の適合screte高速フーリエ変換。次に進む二FFT関数の比の逆離散フーリエ変換を計算するためにIFFT演算を使用する。結果として機能I(t)は次のように説明することができます: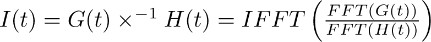
7.3で説明したステップがTBOAで現在のトランスポーター(10μM)( 図3c右)のフィルタを導出することができます。 6(すなわちfSTCまたはFTC) -フィルタは、セクション4で単離され、現在のトランスポーターにアストロサイトの膜にグルタミン酸の寿命を変換歪み要因を表します。 - 制御条件( 図3Aに現在のトランスポーターのフィットから( 図3c右、 図3d中央)フィルタをデコンボリューションの左、 図3dの左)。
注:このステップは、コントロール条件におけるアストロサイト( 図3dの右)からグルタミン酸クリアランスの経時変化を導出することができます。このデコンボリューションのステップの基礎となる仮定は、フィルタの時間プロファイルは、コントロール条件のとTBOA(10μM)で変更されないということです。 - グルタミン酸クリアランスの全体的な時間経過の定量的な推定値を得るためには、ステップ7.4で得られた波形の重心()を計算。これは、次のようにを計算することによって行われます。
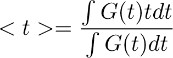
ここで、G(t)は 、ステップ7.1で得られた波形である。上述の式において、用語tは積分が計算される時間窓に対応する。
注:メソッドが最初に確立された、の制約を受け、13残された時間枠にわたって計算した。積分窓が完全に戻ってベースライングルタミン酸クリアランスとクリアランス波形減衰の持続時間よりも広くなるように設定されているように、このアプローチであれば用いることができる。この条件が満たされない場合、しかしながら、のを推定するこの方法にはいくつかの制限に遭遇する。クリアランス波形がベースラインに戻って正確に減衰していない場合、その後、統合のウィンドウの幅が増大する。 の推定のための不正確さの潜在的な源を避けるために、我々は現在、発病14前後の輸送電流のピークの10%に相当する時間窓の上にそれを計算する。後者のアプローチははセル間で測定されるとの整合性を向上させます。隙間の時間経過に薬理学的治療の小さな影響を分析する際には、特に便利です。
Access restricted. Please log in or start a trial to view this content.
結果
分析的アプローチの成功は非常に中枢神経系の任意の領域におけるアストロサイトからトランスポーター電流の高品質の電気生理学的記録を取得するに依存し、ここで説明。急性マウス海馬スライスでは、アストロサイトは容易にため、その小さな細胞体(Ø= 10μm)の著名な核( 図1)のDodt照明やIR-DICの下で識別することができます。細胞内液、( 図1)にアレ?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ここでは、アストロサイトから電気生理学的記録を取得するための実験的なアプローチ、アストロサイトおよびアストロサイトのトランスポーター電流からグルタミン酸クリアランスの経時変化を導出する数学的方法ではグルタミン酸トランスポーター電流を分離する分析プロトコルを記述します。
分析の成功は、アストロサイトからのトランスと電流を記述するため?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、利害の対立を宣言しません。
謝辞
この作品は、神経疾患の国立研究所と脳卒中学内研究プログラム(NS002986)によってサポートされていました。 AS原稿を書いて、デコンボリューション解析を実施しました。 JSDは、デコンボリューション解析の最初のバージョンを開発し、テキストについてコメント。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| CGP52432 | Tocris | 1246 | |
| (R,S)-CPP | Tocris | 173 | |
| DPCPX | Tocris | 439 | |
| LY341495 disodium salt | Tocris | 4062 | |
| MSOP | Tocris | 803 | |
| NBQX disodium salt | Tocris | 1044 | |
| D,L-TBOA | Tocis | 1223 | |
| Picrotoxin | Sigma | P1675 | |
| MNI-L-glutamate | Tocris | 1490 | |
| Alexa 594 | Life Technologies | A10438 | Optional |
| Matrix electrodes | Frederick Haer Company | MX21AES(JD3) | |
| Borosilicate glass capillaries | World Precision Instruments | PG10165-4 | |
| Dual-stage glass micro-pipette puller | Narishige | PC-10 | |
| Loctite 404 instant adhesive | Ted Pella | 46551 | |
| Xe lamp | Rapp OptoElectronic | FlashMic | |
| Igor Pro 6 | Wavemetrics |
参考文献
- Ventura, R., Harris, K. M. Three-dimensional relationships between hippocampal synapses and astrocytes. J. Neurosci. 19, 6897-6906 (1999).
- Witcher, M. R., Kirov, S. A., Harris, K. M. Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus. Glia. 55, 13-23 (2007).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Herman, M. A., Jahr, C. E. Extracellular glutamate concentration in hippocampal slice. J. Neurosci. 27, 9736-9741 (2007).
- Arnth-Jensen, N., Jabaudon, D., Scanziani, M. Cooperation between independent hippocampal synapses is controlled by glutamate uptake. Nat. Neurosci. 5, 325-331 (2002).
- Barbour, B. An evaluation of synapse independence. J. Neurosci. 21, 7969-7984 (2001).
- Rusakov, D. A., Kullmann, D. M. Extrasynaptic glutamate diffusion in the hippocampus: ultrastructural constraints, uptake, and receptor activation. J. Neurosci. 18, 3158-3170 (1998).
- Zerangue, N., Kavanaugh, M. P. Flux coupling in a neuronal glutamate transporter. Nature. 383, 634-637 (1038).
- Eliasof, S., Jahr, C. E. Retinal glial cell glutamate transporter is coupled to an anionic conductance. Proc. Natl. Acad. Sci. U.S.A. 93, 4153-4158 (1996).
- Wadiche, J. I., Amara, S. G., Kavanaugh, M. P. Ion fluxes associated with excitatory amino acid transport. Neuron. 15, 721-728 (1995).
- Wadiche, J. I., Kavanaugh, M. P. Macroscopic and microscopic properties of a cloned glutamate transporter/chloride channel. J. Neurosci. 18, 7650-7661 (1998).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. J. Neurosci. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H. Neuronal transporters regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. J. Neurosci. 29, 14581-14595 (2009).
- Zuo, Z. Isoflurane enhances glutamate uptake via glutamate transporters in rat glial cells. Neuroreport. 12, 1077-1080 (2001).
- Barbour, B., Brew, H., Attwell, D. Electrogenic uptake of glutamate and aspartate into glial cells isolated from the salamander (Ambystoma) retina. J. Physiol. 436, 169-193 (1991).
- Bergles, D. E., Tzingounis, A. V., Jahr, C. E. Comparison of coupled and uncoupled currents during glutamate uptake by GLT-1 transporters. J. Neurosci. 22, 10153-10162 (2002).
- Diamond, J. S., Jahr, C. E. Synaptically released glutamate does not overwhelm transporters on hippocampal astrocytes during high-frequency stimulation. J. Neurophysiol. 83, 2835-2843 (2000).
- Benediktsson, A. M., et al. Neuronal activity regulates glutamate transporter dynamics in developing astrocytes. Glia. 60, 175-188 (2012).
- Hires, S. A., Zhu, Y., Tsien, R. Y. Optical measurement of synaptic glutamate spillover and reuptake by linker optimized glutamate-sensitive fluorescent reporters. Proc. Natl. Acad. Sci. U.S.A. 105, 4411-4416 (2008).
- Scimemi, A., Meabon, J., Woltjer, R. L., Sullivan, J. M., Diamond, J. S., Cook, D. G. Amyloidβ1-42 slows clearance of synaptically-released glutamate by mislocalizing astrocytic GLT-1. J. Neurosci. 33, 5312-5318 (2013).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved