È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Derivando La durata di Liquidazione glutammato con una analisi Deconvoluzione delle Correnti Transporter astrociti
In questo articolo
Riepilogo
Descriviamo un metodo analitico per stimare la durata del glutammato a membrane di astrociti da registrazioni elettrofisiologiche delle correnti trasportatore del glutammato negli astrociti.
Abstract
La più alta densità di trasportatori del glutammato nel cervello è trovato in astrociti. Glutammato trasportatori coppia il movimento del glutammato attraverso la membrana con il co-trasporto di Na + e 3 1 H + e la contro-trasporto di K + 1. La corrente stechiometrico generata dal processo di trasporto può essere monitorato con cellule intere registrazioni di patch-clamp da astrociti. L'andamento temporale della corrente registrata è modellato dalla decorso temporale del profilo glutammato concentrazione a cui sono esposti gli astrociti, la cinetica di trasportatori del glutammato, e le proprietà elettrotoniche passivi di membrane astrociti. Qui si descrivono i metodi sperimentali e analitici che possono essere utilizzati per registrare le correnti trasportatore del glutammato negli astrociti e isolare l'andamento nel tempo della clearance di glutammato da tutti gli altri fattori che determinano la forma d'onda delle correnti trasportatore astrociti. I metodi qui descritti possono essere utilizzati per stimare la durata of flash-Uncaged e sinapticamente-glutammato rilasciato a membrane astrocitici in qualsiasi regione del sistema nervoso centrale durante salute e di malattia.
Introduzione
Astrociti sono uno dei più abbondanti tipi di cellule nel cervello con morfologia a forma di stella e sporgenze sottili membrane che si estendono per tutta la neuropil e raggiungono limitrofi sinaptica contatti 1,2. Membrana cellulare Le astrociti 'è densamente ricco di glutammato molecole trasportatrici 3. In condizioni fisiologiche, trasportatori del glutammato legano rapidamente glutammato extracellulare a lato della membrana e trasferirlo al citoplasma cellulare. Così facendo, i trasportatori mantenere bassa la concentrazione basale di glutammato nello spazio extracellulare 4. Trasportatori del glutammato nei processi astrocitici sottili adiacenti eccitatori sinapsi sono in posizione ottimale per legare il glutammato rilasciato durante gli eventi sinaptici come si diffonde lontano dalla fessura sinaptica. In questo modo, i trasportatori limitano anche spillover glutammato verso e peri-regioni extra-sinaptici e sulla sinapsi vicine, riducendo la diffusione spaziale del segnale eccitatorios nel cervello 5-7.
Trasporto di glutammato è un processo elettrogenico stechiometricamente accoppiato al movimento di 3 Na + e 1 H + lungo il loro gradiente elettrochimico e alla contro-trasporto di K + 1 8. Trasporto di glutammato è associata con (ma non stechiometricamente accoppiata a) una conduttanza anionica permeabile SCN - (tiocianato)> NO 3 - (nitrato) ≈ ClO 4 - (perclorato)> I -> Br -> Cl -> F -, non a CH 3 SO 3 - (metano sulfonato) e C 6 H 11 O 7 - (gluconato) 9-11. Entrambe le correnti (stechiometrico e non stechiometrico) possono essere registrati mediante l'ottenimento di cellule intere registrazioni di patch-clamp da astrociti, identificati visivamente sotto illuminazione Dodt o infrarossi contrasto di interferenza differenziale (IR-DIC) in acutposta del cervello fette 12. La componente stechiometrica della corrente associata trasporto di glutammato attraverso la membrana può essere isolato utilizzando CH 3 SO 3 -, o H 11 O 7 C 6 - soluzioni intracellulari based e può essere evocato dal glutammato flash-uncaging sugli astrociti 13,14, o attivando il rilascio di glutammato da sinapsi vicine, sia elettricamente 12 o con un controllo optogenetic mirato.
L'andamento temporale della componente stechiometrica della corrente trasportatore è modellato dalla durata del profilo di concentrazione glutammato in astrociti membrane (cioè clearance della glutammato), la cinetica di trasportatori del glutammato, le proprietà di membrana passivi di astrociti, e durante stimolazioni sinaptiche, dal sincronicità del rilascio di glutammato attraverso le sinapsi attivate 13. Qui si descrive in dettaglio: (1) un appr sperimentaleoach di isolare la componente stechiometrica delle correnti trasportatore del glutammato da cellule intere registrazioni di patch-clamp da astrociti utilizzando acute del mouse fettine di ippocampo come esempio la preparazione sperimentale, (2) un approccio analitico per ricavare l'andamento nel tempo della clearance di glutammato da queste registrazioni 13, 14. Questi metodi possono essere usati per registrare e analizzare le correnti trasportatore del glutammato dagli astrociti in qualsiasi regione del sistema nervoso centrale.
Protocollo
1. Fetta di preparazione
- Preparare 500 ml di soluzione di affettare / archiviazione contenente (in mM): 119 NaCl, 2.5 KCl, 0,5 CaCl 2, 1,3 MgSO 4 · 7H 2 O, 4 MgCl2, 26,2 NaHCO 3, 1 NaH 2 PO 4, e 22 di glucosio, 320 mOsm, pH 7.4
- Utilizzare un bicchiere da 250 ml per preparare una camera di immersione per le fette, riempirlo con 200 ml di soluzione di affettare / archiviazione, scaldarlo a bagnomaria a 34 ° C e la bolla con il 95% di O 2, 5% di CO 2.
- Mantenere il restante affettatura soluzione / memorizzazione in una bottiglia di vetro a 4 ° C.
- Utilizzare un adesivo cianoacrilato per fissare un piccolo blocco di agar (6%, preparato in ACSF) sul supporto del campione vibratome e conservarlo a 4 ° C.
- 30 minuti prima di iniziare il taglio, posizionare la bottiglia di vetro contenente la soluzione di affettare / storage in un secchio pieno di ghiaccio e la bolla con il 95% di O 2, 5% di CO 2.
Nota: la velocità e la precisione sono di primaria importanza per le fasi di dissezione di seguito descritti.
- Anestetizzare il mouse (P14-21, C57BL / 6) con alotano / isoflurano (isoflurano è stato segnalato per migliorare astrociti glutammato assorbimento 15), decapitare, e immergere la testa in un bicchiere da 50 ml contenente ossigenato, freddo affettare soluzione / storage.
- Eseguire la dissezione del cervello su un impacco di ghiaccio avvolto con carta da cucina e conservati a -20 ° C.
- Utilizzare un bisturi per fare un'incisione cutanea sagittale sul lato dorsale della testa, dal frontale alla fine caudale, ed esporre il cranio.
- Posizionare la lama di taglio inferiore di un piccolo paio di forbici chirurgiche nel foro occipitale e fare due tagli, verso sinistra e sulla destra (45 °).
- Tagliare il cranio lungo la linea sagittale, dal caudale all'estremità frontale.
- Rimuovere il cervello con una spatola e immergerlo in ossigenato, freddo affettare / storage solution.
- Con un bisturi, fare cinque tagli a: (1) togliere i bulbi olfattivi e la corteccia frontale, (2) rimuovere il cervelletto; (3) togliere la sinistra e (4) lobo temporale destro, (5) separare i due emisferi cerebrali con un taglio sagittale.
- Tamponare le due parti del cervello con i tovaglioli di carta per rimuovere la soluzione in eccesso.
- Colla superficie laterale di ciascuna sezione cervello alla piastra di base vibratome freddo: il lato dorsale del cervello deve essere rivolto la lama vibratome; la faccia ventrale del cervello dovrebbe essere in contatto con il blocco agar, distanti dalla lama vibratome.
Nota: per ottenere le fette più alta qualità, è importante che le due parti del cervello sono saldamente incollati alla piastra di base vibratome. Per fare questo, utilizzare un adesivo cianoacrilato che non sia troppo liquido e che non si asciughi troppo in fretta. - Fissare la piastra di base vibratome alla camera di dissezione, impostare la fetta esimoickness a 250 pm, regolare l'ampiezza della corsa della lama. Procedere con il taglio.
Nota: se tutto è orientato correttamente, il vibratome opportuno taglio fette parasagittali dalla dorsale verso il ventrale e dalla mediale verso il lato laterale del cervello. - Una volta che la lama è passato attraverso la corteccia e nell'ippocampo, utilizzare un bisturi per tagliare la corteccia / ippocampo dal mesencefalo e posizionare ogni fetta nella camera di sommersione a 34 ° C.
- Scartare il primo paio di fette. Tipicamente, 12 fette (250 micron di spessore) possono essere ottenute da un cervello P14-21 del mouse.
- Mantenere le fette a 34 ° C per 30 minuti e lasciarli raffreddare a temperatura ambiente per 30 minuti prima di utilizzarli per le registrazioni elettrofisiologiche.
2. Identificazione astrociti e Registrazioni
- Preparare una soluzione interna contenente (in mm): 120 KCH 3 SO 3, 10 EGTA, 20 HEPES, 2 MgATP, 0.2 NaGTP,5 QX-314Br, e 5 NaCl, 290 mOsm, pH 7,2.
- Preparare una soluzione extracellulare registrazione contenente (in mM): 119 NaCl, 2.5 KCl, 2,5 CaCl 2, 1,3 MgSO 4 · 7H 2 O, 1 MgCl2, 26,2 NaHCO 3, 1 NaHPO 4, e 22 di glucosio, 300 mOsm, pH 7.4 , saturato con 95% di O 2, 5% di CO 2.
- Aggiungere i seguenti farmaci per la soluzione di registrazione extracellulare, per bloccare l'attivazione del Glua, Glun, mGluRII, mGluRIII, GABA A, GABA B, e recettori dell'adenosina A1 (in mM): 10 2,3-Dioxo-6-nitro-1, 2,3,4-tetrahydrobenzo [ƒ] quinoxaline-7-sulfonamide sale disodico (NBQX), 10 (RS) -3 - (2-carboxypiperazin-4-il)-propil-1-fosfonico (CPP), (2S )-2-ammino-2-[(1S, 2S)-2-carboxycycloprop-1-il] -3 - (xanth-9-yl) propanoico sale disodico (LY341495), 100 (R, S)-α- methylserine-O-fosfato (MSOP), 100 picrotoxin, 5 3 - [[(3,4-Dichlorophenyl) metil] ammino] propil] diethoxymethyl) acido fosfinico (CGP52432), 18-ciclopentil-1 ,3-dipropylxanthine (DPCPX).
- Impostare la temperatura della soluzione extracellulare nella camera di registrazione; temperature tipiche sono comprese tra 34 - 36 ° C.
- Preparare elettrodi patch-clamp da vetro borosilicato capillari (R ≈ 2,5 MW) utilizzando un doppio stadio, vetro micropipetta estrattore.
- Prendete una delle fette e posizionarlo nella camera di registrazione. Tenere premuto il pulsante con l'arpa in metallo realizzato con filo di platino e corde di nylon.
- Ispezionare visivamente le fette sotto Dodt illuminazione o IR-DIC. Astrociti possono essere identificati dal loro piccolo corpo cellulare (Ø = 10 micron) e nucleo prominente (Figura 1).
- Per stimoli sinaptici, posizionare un elettrodo in acciaio inossidabile bipolare, ~ 100 micron di distanza dal astrociti che si prevede di applicare patch.
- Patchare il astrociti e rompere nella configurazione whole-cell applicando una aspirazione molto delicato.
Nota: Gli astrociti hanno tipicamente basso resistanc ingressoe (~ 10 MW), hyperpolarized potenziale di membrana a riposo (~ -90 mV), e nessuna attività di tiro. Gli astrociti sono conservati presso il suo potenziale di membrana a riposo durante gli esperimenti in modalità voltage-clamp (cioè la corrente di mantenimento dovrebbe leggere 0 Pa). Prima di ogni stimolazione, a 10 ms hyperpolarizing gradino di tensione (-3 mV) viene utilizzato per monitorare la serie e resistenza di ingresso dello astrociti. - Eliminare le registrazioni se la resistenza serie modifiche> 20% o se il potenziale di membrana della astrociti diventa depolarizzato. Il potenziale di membrana della astrociti può essere misurata direttamente passando dalla tensione-clamp in modalità current-clamp. Alternativamente, mentre in modalità di tensione-clamp, il potenziale di membrana può essere monitorato leggendo il valore del potenziale di mantenimento che provochi 0 pA corrente di mantenimento.
- Se sono impiegati stimoli sinaptici, stimoli alternano singoli e in coppia (ad esempio 100 msec a parte), ogni 10 - 20 sec.
- Per experim fotolisi UVgenitori, collegare una lampada a Xe uncaging alla porta epifluorescenza del microscopio e aggiungere il composto in gabbia alla soluzione extracellulare. Correnti Transporter di ~ 100 ampiezza pA si può ottenere quando il flash-uncaging 100 micron MNI-L-glutammato in tutto il campo di vista (Ø = 662,5 micron quando si utilizza un obiettivo 40X 14). Stimolazioni alternarsi con il percorso della luce aperta e bloccata, ogni 10 - 20 sec.
- Evocare transienti glutammato e correnti trasportatore registrare in condizioni di controllo e in presenza di una concentrazione sub-saturazione dell'acido ampio spettro glutamato trasportatore antagonista D, L-treo-β-Benzyloxyaspartic (TBOA; 10 pM) per ridurre l'ampiezza della corrente trasportatore ad almeno il 30% del suo valore di controllo (vedere paragrafi 4, 5) o in presenza di una elevata concentrazione di TBOA (50 - 100 mM) per bloccare le correnti trasportatore completamente e isolare il K +-sostenuta corrente (vedere Sezione 3) .
3. PharmacIsolamento ological del sostenuta K +-corrente
- Registrare le correnti astrociti in condizioni di controllo e in presenza di una, ad alta concentrazione di saturazione di TBOA (50 - 100 micron).
- Media di almeno 20 scansioni in TBOA (50 - 100 micron).
- Montare le tracce medi ottenuti in 3.2 con la funzione di:
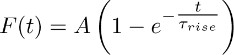
Nota: il componente TBOA-insensitive (cioè quella che viene registrato in presenza di TBOA (50 - 100 mM)) rappresenta la costante K +-corrente. Suo sviluppo nel tempo è approssimata dalla funzione mono-esponenziale descritto sopra. - Ripetere questa forma attraverso diversi astrociti e di ricavare un valore medio di Τ aumento (cioè il tempo medio di aumento della costante K + corrente (vedi sezione 5)).
4. Isolation della quota agevolata delle Correnti Transporter sinapticamente-attivati (fSTCs)
- Media di almeno 20 scansioni ottenute con stimoli appaiati, in condizioni di controllo e in TBOA (10 mM) (Figura 2a a sinistra).
- Media identico numero di scansioni ottenute con singole stimolazioni, in condizioni di controllo e in TBOA (10 mM) (Figura 2a centro).
- Confrontare l'ampiezza della risposta corrente media al gradino di tensione mV -3 nelle quattro tracce medi (controllo singolo impulso, controllo accoppiato-impulsi, TBOA impulso singolo, TBOA accoppiato-impulsi).
- Se l'ampiezza della risposta corrente è la stessa in tutti i quattro tracce, procedere al punto 4.7.
- Se l'ampiezza della risposta corrente media è differente in una delle quattro tracce, verificare che tutte le singole tracce erano appropriate da includere nella media.
- Se l'ampiezza della corrente media è diversa in una delle quattro tracce, ma tutti individuale tracce sono appropriate per essere inclusi nella media, verificare che in ciascun tracciato le dimensioni delle scaglie FSTC lineare con la dimensione della risposta attuale al gradino di tensione di prova. Se questo è il caso, scalare ogni traccia uno rispetto all'altro che le attuali risposte il gradino di tensione di prova sono tutti uguali in ampiezza.
Nota: Nelle condizioni di registrazione qui descritto (cioè intracellulare CH 3 SO 3 - o C 6 H 11 O 7 -), stimoli sinaptici di assoni eccitatori generano correnti astrociti con forme d'onda complesse costituite da un rapido aumento transitorio verso l'interno corrente stechiometrica e una lenta -aumento, sostenuto verso l'interno K + corrente riflette K + riequilibrio nello spazio extracellulare a seguito dell'azione potenziale propagazione lungo gli assoni vicini. E 'fondamentale per rimuovere questo sostenuta K +-corrente, come ogni corrente residua determinerebbe unsovrastima della vita glutammato. - Sottrarre la traccia medio ottenuto con i singoli stimoli dalla traccia medio ottenuto con stimoli associati (Figura 2a a destra). Questa fase consente di isolare i stechiometrico e il K +-sostenuta corrente evocata dal secondo stimolo.
- Spostare la traccia medio ottenuto con i singoli stimoli da un intervallo di tempo che corrisponde all'intervallo tra impulsi utilizzato per fornire coppia-impulsi (cioè 100 msec) (Figura 2b).
- Sottrarre la differita di risposta medio ottenuto con i singoli stimoli dalla risposta media al secondo stimolo ottenuto in 4.7 (Figura 2c). Questo passo isola la porzione facilitato della corrente trasportatore evocata dal secondo stimolo (la FSTC).
- Nella maggior parte dei casi, il passaggio precedente rimuove completamente il costante K +-corrente. Se questo è il caso, l'isolamento del FSTC è completa e si può procendr con l'analisi di deconvoluzione e ricavare l'andamento nel tempo della clearance di glutammato dagli astrociti. In alcuni casi, tuttavia, una piccola sostenuta K +-corrente è ancora presente (figura 2d) ed è necessaria un'ulteriore analisi (vedere la sezione 5).
Nota: ricordate che l'analisi descritto 4,7-4,10 deve essere eseguita sulle tracce medi ottenuti in condizioni di controllo e in TBOA (10 micron).
5. Sottrazione del residuo zdustained K +-corrente da fSTCs
- Misurare l'ampiezza del sostenuta K +-corrente residua dopo aver eseguito l'analisi di cui al punto 4.
- Scalare l'ampiezza della funzione mono-esponenziale descritta 3.3 all'ampiezza del residuo sostenuta K +-corrente misurata in 5.1 (figura 2d sinistra e centrale). Per fare questo, nell'equazione 3.3, impostare il termine di A è uguale alla ampiezza della K +-sostenuta corrente miasured in 5.1 e il termine Τ aumento è pari al valore medio di Τ aumento stimato in 3.4.
- Sottrarre la funzione mono-esponenziale derivante dalla FSTC e sostenuta K +-corrente ottenuta in 4.10 (Figura 2d a destra). Questo passaggio completa l'isolamento della FSTC.
6. Isolamento delle Correnti Transporter Flash-attivati (FTC)
- Media di almeno 20 scansioni ottenute con il percorso della luce aperta, in condizioni di controllo e in TBOA (10 micron).
- Media identico numero di sweep ottenuto con il percorso ottico chiuso, in condizioni di controllo e in TBOA (10 mM).
- Confrontare l'ampiezza della risposta attuale al gradino di tensione mV -3 nelle quattro tracce medi (controllo singolo impulso, controllo accoppiato-impulsi, TBOA impulso singolo, TBOA accoppiato-impulsi).
- Se l'ampiezza della risposta corrente è la stessa in tutti i quattro tracce, procedere al punto 6.7.
- Se l'ampiezza della risposta corrente media è differente in una delle quattro tracce, verificare che tutte le singole tracce erano appropriate da includere nella media.
- Se l'ampiezza della corrente media è diversa in una delle quattro tracce, ma tutte le singole tracce sono appropriate da includere nella media, verificare che in ciascun tracciato con il percorso ottico aprire la dimensione della bilancia FTC linearmente con la dimensione la risposta corrente al gradino di tensione di prova. Se questo è il caso, scalare ogni traccia uno rispetto all'altro che le attuali risposte il gradino di tensione di prova sono tutti uguali in ampiezza.
Nota: nelle condizioni di registrazione qui descritto (cioè intracellulare CH 3 SO 3 - o C 6 H 11 O 7 -), Flash stimoli generano correnti astrocitiche costituiti unicamente il rapido aumento transitorio stechiometrico corrente verso l'interno. - Sottrarre la traccia medio ottenuto con la luce path bloccato dalla traccia medio ottenuto con il percorso della luce aperta. Questo passaggio consente di rimuovere l'artefatto di stimolo e di isolare i FTCs.
Nota: l'analisi descritta in 6.7 deve essere eseguita sulle tracce medi ottenuti in condizioni di controllo e in TBOA (10 micron).
7. Analisi Deconvoluzione
- Montare la corrente trasportatore (FSTC o FTC) registrato in condizioni di controllo (Figura 3a a sinistra) e in TBOA (10 micron) (Figura 3a a destra) e isolate come descritto nei paragrafi 4-6, con la funzione multi-esponenziale:

- Creare una funzione crescente istantaneamente che decade mono-esponenziale secondo la funzione di:
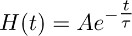
eche meglio descrive la fase di decadimento della corrente trasportatore registrato nel TBOA (10 micron) (Figura 3b).
Nota: la funzione descritta al 7.2 (cioè H (t)) rappresenta l'andamento nel tempo della clearance glutammato dagli astrociti in presenza di TBOA (10 mM). - Deconvolve la funzione mono-esponenziale ottenuto in 7.2 (Figura 3b e 3c centrale) dal fit della corrente trasportatore registrato in TBOA (10 pM) ottenuto in 7.1 (figura 3a a destra, a sinistra c).
Nota: deconvoluzione è una operazione matematica inclusa in molti pacchetti software di analisi come (ad esempio Matlab, Python). In IgorPro, il codice di programmazione che noi di solito usiamo per eseguire questo tipo di analisi, l'operazione di deconvoluzione può essere efficacemente calcolato come descritto di seguito, utilizzando Fourier veloce discreto trasforma. Prima, utilizzare l'operazione per calcolare la FFT discrete veloce trasformata di Fourier della funzione di mono-esponenziale ottenuto in 7.2 e del fit della corrente trasportatore registrato in TBOA ottenuto in 7.1. Successivamente, utilizzare l'operazione IFFT calcolarne l'inversa discreta trasformata rapida di Fourier del rapporto delle due funzioni FFT. La funzione risultante I (t) può essere descritto come segue: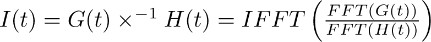
Il passo descritto in 7.3 permette derivare il filtro della corrente trasportatore in TBOA (10 mM) (Figura 3c destra). Il filtro rappresenta i fattori di distorsione che convertono la durata del glutammato a membrane di astrociti nella corrente trasportatore isolato in sezioni di 4-6 (cioè il FSTC o FTC). - Deconvolve il filtro (figura 3c destra, Figura 3d centro) dalla misura della corrente trasportatore in condizioni di controllo (Figura 3a a sinistra, figura 3d a sinistra).
Nota: questo passaggio consente derivante l'andamento nel tempo della clearance di glutammato dagli astrociti in condizioni di controllo (Figura 3d a destra). Il presupposto fondamentale di questa fase deconvoluzione è che il profilo temporale del filtro rimane inalterata in condizioni di controllo e in TBOA (10 mM). - Per ottenere una stima quantitativa del corso tempo complessivo di liquidazione glutammato, calcolare il centroide () della forma d'onda ottenuta nella fase 7.4. Questo viene fatto calcolando come:
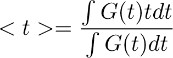
dove G (t) è la forma d'onda ottenuta nella fase 7.1. Nell'equazione di cui sopra descritto, il termine t corrisponde alla finestra di tempo in cui l'integrale è calcolato.
Nota: quando il metodo è stato stabilito in primo luogo, è stato calcolato su finestre temporali che sono stati lasciati senza vincoli 13. Questo approccio può essere utilizzato fintanto che la finestra di integrazione è impostato per essere più largo della durata di liquidazione glutammato e le forme d'onda di liquidazione decadimenti completamente nuovo al basale. Se questo non è il caso, tuttavia, questo metodo di stima incontra alcune limitazioni. Ad esempio, se la forma d'onda di liquidazione non decade esattamente sulla linea di base, poi aumenta con la larghezza della finestra di integrazione. Per evitare qualsiasi potenziale fonte di imprecisione per la stima di , ora calcoliamo sopra una finestra temporale corrispondente al 10% del picco della corrente trasportatore, prima e dopo l'esordio 14. Quest'ultimo approccio migliora la coerenza con cui si misura attraverso le cellule. Questo è utile soprattutto quando si analizzano piccoli effetti dei trattamenti farmacologici in corso di tempo di gioco.
Risultati
Il successo di questo approccio analitico descritto qui dipende criticamente ottenere registrazioni elettrofisiologiche alta qualità delle correnti Trasportatori dagli astrociti in qualsiasi regione del sistema nervoso centrale. In acute del mouse fettine di ippocampo, astrociti possono essere facilmente identificati sotto Dodt illuminazione o IR-DIC causa del loro piccolo corpo cellulare (Ø = 10 micron) e nucleo prominente (Figura 1). Loro caratteristico morfologia a stella può essere apprezzato con...
Discussione
Qui si descrive un approccio sperimentale per ottenere registrazioni elettrofisiologiche da astrociti, un protocollo analitico per isolare le correnti trasportatore del glutammato negli astrociti e un metodo matematico per ricavare l'andamento nel tempo della clearance di glutammato dalle correnti transporter astrociti.
Il successo della analisi si basa sulla capacità di ottenere alta qualità registrazioni di patch clamp dagli astrociti e sulla precisione dei algoritmi di adattamento u...
Divulgazioni
Gli autori dichiarano assenza di conflitto di interessi.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institute of Neurological Disorder and Stroke del programma di ricerca intramurale (NS002986). Come ha scritto il manoscritto e implementato l'analisi di deconvoluzione. JSD ha sviluppato la versione iniziale dell'analisi deconvoluzione e commentato il testo.
Materiali
| Name | Company | Catalog Number | Comments |
| CGP52432 | Tocris | 1246 | |
| (R,S)-CPP | Tocris | 173 | |
| DPCPX | Tocris | 439 | |
| LY341495 disodium salt | Tocris | 4062 | |
| MSOP | Tocris | 803 | |
| NBQX disodium salt | Tocris | 1044 | |
| D,L-TBOA | Tocis | 1223 | |
| Picrotoxin | Sigma | P1675 | |
| MNI-L-glutamate | Tocris | 1490 | |
| Alexa 594 | Life Technologies | A10438 | Optional |
| Matrix electrodes | Frederick Haer Company | MX21AES(JD3) | |
| Borosilicate glass capillaries | World Precision Instruments | PG10165-4 | |
| Dual-stage glass micro-pipette puller | Narishige | PC-10 | |
| Loctite 404 instant adhesive | Ted Pella | 46551 | |
| Xe lamp | Rapp OptoElectronic | FlashMic | |
| Igor Pro 6 | Wavemetrics |
Riferimenti
- Ventura, R., Harris, K. M. Three-dimensional relationships between hippocampal synapses and astrocytes. J. Neurosci. 19, 6897-6906 (1999).
- Witcher, M. R., Kirov, S. A., Harris, K. M. Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus. Glia. 55, 13-23 (2007).
- Danbolt, N. C. Glutamate uptake. Prog. Neurobiol. 65, 1-105 (2001).
- Herman, M. A., Jahr, C. E. Extracellular glutamate concentration in hippocampal slice. J. Neurosci. 27, 9736-9741 (2007).
- Arnth-Jensen, N., Jabaudon, D., Scanziani, M. Cooperation between independent hippocampal synapses is controlled by glutamate uptake. Nat. Neurosci. 5, 325-331 (2002).
- Barbour, B. An evaluation of synapse independence. J. Neurosci. 21, 7969-7984 (2001).
- Rusakov, D. A., Kullmann, D. M. Extrasynaptic glutamate diffusion in the hippocampus: ultrastructural constraints, uptake, and receptor activation. J. Neurosci. 18, 3158-3170 (1998).
- Zerangue, N., Kavanaugh, M. P. Flux coupling in a neuronal glutamate transporter. Nature. 383, 634-637 (1038).
- Eliasof, S., Jahr, C. E. Retinal glial cell glutamate transporter is coupled to an anionic conductance. Proc. Natl. Acad. Sci. U.S.A. 93, 4153-4158 (1996).
- Wadiche, J. I., Amara, S. G., Kavanaugh, M. P. Ion fluxes associated with excitatory amino acid transport. Neuron. 15, 721-728 (1995).
- Wadiche, J. I., Kavanaugh, M. P. Macroscopic and microscopic properties of a cloned glutamate transporter/chloride channel. J. Neurosci. 18, 7650-7661 (1998).
- Bergles, D. E., Jahr, C. E. Synaptic activation of glutamate transporters in hippocampal astrocytes. Neuron. 19, 1297-1308 (1997).
- Diamond, J. S. Deriving the glutamate clearance time course from transporter currents in CA1 hippocampal astrocytes: transmitter uptake gets faster during development. J. Neurosci. 25, 2906-2916 (2005).
- Scimemi, A., Tian, H. Neuronal transporters regulate glutamate clearance, NMDA receptor activation, and synaptic plasticity in the hippocampus. J. Neurosci. 29, 14581-14595 (2009).
- Zuo, Z. Isoflurane enhances glutamate uptake via glutamate transporters in rat glial cells. Neuroreport. 12, 1077-1080 (2001).
- Barbour, B., Brew, H., Attwell, D. Electrogenic uptake of glutamate and aspartate into glial cells isolated from the salamander (Ambystoma) retina. J. Physiol. 436, 169-193 (1991).
- Bergles, D. E., Tzingounis, A. V., Jahr, C. E. Comparison of coupled and uncoupled currents during glutamate uptake by GLT-1 transporters. J. Neurosci. 22, 10153-10162 (2002).
- Diamond, J. S., Jahr, C. E. Synaptically released glutamate does not overwhelm transporters on hippocampal astrocytes during high-frequency stimulation. J. Neurophysiol. 83, 2835-2843 (2000).
- Benediktsson, A. M., et al. Neuronal activity regulates glutamate transporter dynamics in developing astrocytes. Glia. 60, 175-188 (2012).
- Hires, S. A., Zhu, Y., Tsien, R. Y. Optical measurement of synaptic glutamate spillover and reuptake by linker optimized glutamate-sensitive fluorescent reporters. Proc. Natl. Acad. Sci. U.S.A. 105, 4411-4416 (2008).
- Scimemi, A., Meabon, J., Woltjer, R. L., Sullivan, J. M., Diamond, J. S., Cook, D. G. Amyloidβ1-42 slows clearance of synaptically-released glutamate by mislocalizing astrocytic GLT-1. J. Neurosci. 33, 5312-5318 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon