Method Article
الماوس الجينوم الهندسية عن طريق Nucleases مصمم
In This Article
Summary
nucleases مصمم مثل nucleases إصبع الزنك (ZFNs) والنسخ مثل المنشط nucleases المستجيب (TALENs) يمكن استخدامها لتعديل جينوم الفأر الأجنة سابق للانغراس عن طريق إحداث كلا نهاية امتماثلان الانضمام (NHEJ) وإعادة التركيب مثلي (HR) مسارات. هذه التطورات تمكين جيل من الفئران السريع مع التعديلات الجينية دقيقة.
Abstract
الفئران المعدلة وراثيا تحمل تعديلات في مواقع محددة الجينوم (خروج المغلوب، الضربة القاضية في) هي ذات أهمية حيوية لتشريح النظم البيولوجية المعقدة، فضلا عن الأمراض التي تصيب الإنسان لنمذجة واختبار الاستراتيجيات العلاجية. التطورات الحديثة في استخدام nucleases مصمم مثل nucleases إصبع الزنك (ZFNs)، والنسخ مثل المنشط nucleases المستجيب (TALENs)، وتتجمع interspaced بانتظام يكرر المتناوب قصيرة (CRISPR) / (CAS) المرتبطة CRISPR 9 نظام للموقع الهندسة الجينوم محددة فتح إمكانية لإجراء تعديل سريع الجينوم المستهدفة في الواقع أي الأنواع المختبر دون الحاجة إلى الاعتماد على الجذعية الجنينية (ES) تكنولوجيا الخلايا. يبدأ تجربة تحرير الجينوم عادة مع تحديد المواقع المستهدفة نوكلياز مصمم ضمن الجينات في المصالح تليها بناء المجالات الحمض النووي ملزم مخصصة لتوجيه النشاط نوكلياز إلى موضع الجيني محددة المحقق. البلازميدات مصمم نوكلياز في المختبر <م /> كتب لتوليد مرنا لMicroinjection من البويضات المخصبة الماوس. هنا، ونحن نقدم بروتوكول لتحقيق المستهدف تعديل الجينوم عن طريق الحقن المباشر للTALEN مرنا في البويضات المخصبة الماوس.
Introduction
الفئران هي الآن الأكثر شعبية منصة لتوليد النماذج الحيوانية المعدلة وراثيا. الأدوات تنوعا للهندسة الوراثية للجنين الفأر 1-3 وقد تم تمديد مؤخرا من قبل نهج التحرير الجينوم على أساس nucleases مصمم مثل nucleases إصبع الزنك (ZFN) 4-6، والنسخ مثل المنشط nucleases المستجيب (TALEN) 7،8، وتتجمع interspaced بانتظام يكرر المتناوب قصيرة (CRISPR) / (CAS) 9 المرتبط CRISPR نظام 9. ZFN وظيفة TALEN كما أزواج اثنين من المجالات مصمم خصيصا البروتين على أساس ملزم الحمض النووي (صفائف من الزنك الاصبع البروتينات وتكرار متغير ثنائي بقايا (RVDs)، على التوالي) التي تقترن كل لنوكلياز داخلية FokI 10-12. على العكس، يتم توفير خصوصية Cas9 بوساطة الانقسام الحمض النووي عن طريق transactivating الرنا CRISPR (crRNA وtracrRNA، والتي يمكن أيضا أن تكون مجتمعة في واحدة جزيء RNA خيالية تسمى دليل الحمض النووي الريبي) 11 التي تعمل في مجمع معالبروتين CRISPR.
TALENs مع تسلسل محدد من RVDs يمكن بناؤها بسرعة عن طريق المجربون الفردية مع العديد من الاستراتيجيات لاختيار التجمع 13-17. CRISPR/Cas9 عود الجيل كثيفة العمالة حتى أقل من nucleases مصمم، ولكن خصوصية دليل الحمض النووي الريبي الحمض النووي ملزمة لم يتم حل تماما 18،19. جيل من ZFNs مخصص وقد تم حتى الآن تقتصر على مختبرات الأكاديمية المتخصصة والتجارية للموردين مثل Sangamo العلوم البيولوجية والخدمة سيغما CompoZr.
بشكل عام، يهدف الجينوم التحرير مع nucleases مصمم على تقديم فواصل حبلا مزدوجة (DSB) في مواضع محددة الجيني، والتي تجذب فيما بعد نهاية امتماثلان الانضمام (NHEJ) أو إعادة التركيب مثلي (HR) الأجهزة إصلاح الحمض النووي 10،12. إصلاح NHEJ بوساطة من جهاز تسوية المنازعات غالبا ما يؤدي إلى إدخال الإدراج والحذف على مقربة من موقع الإصلاح. NHEJ بالتالي إصلاح جويمكن استغلالها لضرب وظيفة الجين المستهدف من خلال إدخال طفرة الإطار تحول في الجينات ترميز بروتين تسلسل 4،7،9. بدلا من ذلك، بالإضافة إلى تعريف أو استبدال المعلومات الوراثية يمكن أن يتحقق من خلال توفير المانحة الحمض النووي مع nucleases المصمم. وتضم الجهات المانحة والحمض النووي تسلسل الحمض النووي مصمم المحقق يحيط بها مناطق التماثل مع مكان الهدف، وبالتالي تخدم كنموذج لإصلاح جهاز تسوية المنازعات عن طريق الموارد البشرية. كلا البلازميدات 5،6،20 واحد أليغنوكليوتيد] الذين تقطعت بهم السبل 8،9،21 وقد استخدمت بنجاح الجهات المانحة. لا تتطلب NHEJ-HR ولا بوساطة الجينوم تحرير إدخال علامة اختيار في جينوم الجنين الماوس، الأمر الذي يجعل هذه الاستراتيجيات لا سيما مناسبة تماما لخلق تغييرات صغيرة في تسلسل النوكليوتيدات من دون إزعاج العمارة الوراثية بشكل عام.
في هذا البروتوكول وصفنا جميع الإجراءات الضرورية لتحرير الجينوم فيجنين فأر باستخدام TALENs. وتشمل هذه 1) تحديد موقع الهدف TALEN 22، 2) بناء TALENs كتبها golden بوابة الاستنساخ 13، 3) في المختبر توليف TALEN مرنا، 4) Microinjection من TALEN مرنا في البويضات المخصبة الماوس، 5) العمليات الجراحية لنقل الأجنة و6) تحليل الطفرات المستحثة TALEN في الحيوانات مؤسس. ونحن نركز على TALEN مرنا حقن مكروي والفرز من المؤسسين لNHEJ التي يسببها الإدراج / حذف. لهذا الغرض، ونحن قد ولدت يبني TALEN bifunctional التي تسمح على حد سواء التعبير في خلايا الثدييات عندما transfected البلازميدات وكما في التوليف المختبر من TALEN مرنا لحقن مكروي في أجنة الفئران. تتكون هذه التركيبات حكاية العمود الفقري اقتطاع 23 تنصهر لheterodimeric FokI النطاقات 24،25 الأمثل لتحرير الجينوم في خلايا الثدييات. ويمكن أيضا أن يعتمد هذا البروتوكول لMicroinjection من غيرها nucleases مصمم أو حقن مشتركة من nucleases مصممويبني المانحة (وقد وصفت تصميم المانحين الحمض النووي في المطبوعات الفنية الممتازة التي Wefers آخرون 26،27).
بيان الأخلاقية
أجريت جميع التجارب على الحيوانات وفقا للمبادئ التوجيهية واللوائح من المكتب البيطري كانتون كانتون زيوريخ.
Protocol
1. تحديد المواقع المستهدفة TALEN
- زيارة الموقع 2.0 TAL المستجيب النوكليوتيدات Targeter (http://tale-nt.cac.cornell.edu) واختيار "TALEN Targeter".
- أدخل تسلسل الجين المستهدف. إذا يبني pCAG-T7-TALEN التعبير الذي يتم استخدامه (الشكل 1C) اختيار "ميلر وآخرون، 2011" تحت عنوان "استخدام الهندسة المعمارية مسبقا" من أجل التنبؤ المواقع المستهدفة التي يمكن أن تكون مستهدفة مع طول الفاصل المثلى (15-20 بي بي) وأعداد RVDs حكاية (15-20) لهذه العمارة TALEN.
- اختيار "NN" تحت عنوان "G البديل" (غوانوزين محددة RVDs NH تتوفر أيضا ولكن ليس بعد اختبارها على نطاق واسع لTALEN التجميع).
- اختياري: لإعدادات وخيارات أخرى، يرجى اتباع التعليمات الموجودة على الموقع والروابط الموجودة هناك.
- يتم إنشاء ملف نصي التي يمكن استخدامها في المواقع المستهدفة، التي يمكن أن تكون المستوردة إلى برنامج جدول بيانات للعرض أكثر ملاءمة. اختر الزوج TALEN ل جولدن جيت التجمع.
- اختياري: تسلسل الجينوم المنطقة من الاهتمام في سلالة الفأر التي سيتم استخدامها لحقن مكروي ممكن للكشف عن الأشكال المتعددة للتركيبات النووية المنفردة (النيوكلوتايد) التي قد لا تكون محسوبة في قواعد البيانات العامة ويحتمل منع نوكلياز ملزمة.
- اختياري: يرجى الرجوع إلى الجدول رقم 3 لمصمم المتعلقة nucleases الموارد على الانترنت إضافية.
- معظم البلازميدات اللازمة لZFN وTALEN البناء يمكن الحصول عليها من Addgene:
http://www.addgene.org/special-collections/
وتقدم Addgene معرفات لعدة جولدن جيت TALEN والثدييات بنيات التعبير TALEN في الجدول 2.
بدلا من ذلك، خاصة وحدات وظيفية مثل المجالات إصبع الزنك يمكن أن يؤمر من مزود الخدمة التوليف الجيني.
"jove_title"> 2. جولدن جيت الجمعية TALEN
يصف هذا القسم تجميع TALENs باستخدام بروتوكول نشرته سيرماك وآخرون. هي التي شيدت 13 TALENs كامل طول باستخدام اثنين اللاحقة جولدن جيت الاستنساخ الخطوات (الشكل 1). هذا النهج يتيح إدراج أي عدد من RVDs بين 12 و 31 في بنيات التعبير النهائي. وقد تم تكييف البروتوكول التجميع لناقلات الوجهة مصممة لmRNAs و(الشكل 1C) التي تعبر عن توليد TALENs نشطة للغاية التالية البويضة حقن مكروي. يرجى الرجوع أيضا إلى بروتوكول الإنترنت من مجموعة جولدن جيت TALEN لإنشاء وصيانة المكتبة البلازميد ( http://www.addgene.org/TALeffector/goldengateV2/ ).
- اليوم 1 - جولدن جيت التفاعل رقم 1 - جمعية RVD صالحة في pFUS المتجهات
- اختياري: لكل زوج TALEN مصممة في Protocol 1، أدخل تسلسل الحمض النووي للموقعين الهدف (بما في ذلك تي الأولي، 5 'إلى 3') في جدول البيانات TALEN_Voytas_Pipetting لتوليد مخطط pipetting للكل رد فعل جولدن جيت (أيضا إدخال تركيزات جميع البلازميدات المستخدمة في المجالس ). ويوفر جدول البيانات أيضا تسلسل الحمض النووي المتوقع من جميع RVDs التي يمكن استخدامها لمحاذاة نتائج التسلسل في القسم 2.5.2.
- لتصميم كل فريدة من نوعها TALEN في البروتوكول 1:
إذا طول TALEN هو 12-21 (الموحدة)، حدد تكرار متغير ثنائي بقايا (RVDs) 1-10 وناقلات الوجهة pFUS_A. حدد المتبقية RVDs ومتجه جهة pFUS_B، على سبيل المثال لTALEN مع 15 RVDs (بما في ذلك تكرار الماضي، والتي ستضاف إلى التجميع النهائي في القسم 2.3.3، حدد RVDs 11-14 وpFUS_B4 ناقلات الوجهة (الشكل 1A).
إذا طول TALEN هو 22-31، 1-10 RVDs استخدام والمقصد هاءالمنشئ pFUS_A30A. اختيار RVDs 11-20 وناقلات الوجهة pFUS_A30B. حدد المتبقية RVDs وناقلات pFUS_Bdestination، على سبيل المثال لTALEN مع 24 RVDs اختيار RVDs 21-23 وناقلات الوجهة pFUS_B3. - إعداد غولدن غيت رد فعل # 1 لكل pFUS + مزيج RVD على حدة، أي 1-10 + pFUS_A والمتبقية RVDs + pFUS_B ناقلات منها أو لTALEN أطول من 21 RVDs، 1-10 + pFUS_A30A، 11-20 pFUS_A30B، وRVDs المتبقية + pFUS_B ناقلات منها. استخدام 150 نانوغرام لكل ناقلات RVD، 150 نانوغرام من pFUS ناقلات، 1 ميكرولتر BsaI، 1 ميكرولتر الحمض النووي يغاز T4، 2 ميكرولتر العازلة 10X T4 DNA يغاز، وH 2 O إلى 20 ميكرولتر حجم رد الفعل الكلي. (مأخوذة عن طريق جديدة من T4 العازلة يغاز كل جولة من المجالس جولدن جيت ينصح منذ المتكررة الذوبان / تجميد T4 العازلة يغاز يمكن أن تقلل من كفاءة ردود الفعل.)
- وضع ردود فعل جولدن جيت في cycler الحرارية.
برنامج:
37 ° C 5 دقائق
16 ° C 10 دقيقة
10 دورات
50 ° C 5 دقائق
80 ° C 5 دقائق - إضافة 1 ميكرولتر 10 ملي ATP و 1 ميكرولتر-البلازميد الآمن نوكلياز إلى كل مزيج واحتضان عند 37 درجة مئوية لمدة 1 ساعة. وهذا العلاج إزالة الخطية منتجات ربط غير مكتملة يمكن المستنسخة في ناقلات الوجهة في الجسم الحي إعادة التركيب مثلي في البكتيريا تحول.
- تحويل E. القولونية مع ردود الفعل الفردية ربط (electrocompetent أو كيميائيا المختصة كولاي التي تسهل α-تكامل مثل XL1 أزرق أو DH5α يمكن استخدامها هنا في والتحولات اللاحقة).
- البكتيريا وحة على سبكتينوميسين (50 ميكروغرام / مل) لوحات مع X-غال وIPTG (40 ميكروغرام / مل لكل منهما) للأزرق / اختيار مستعمرة بيضاء.
- اليوم 2 - إقرار تصحيح الجمعية pFUS-RVDs
- باستخدام مستعمرة PCR مع الاشعال pCR8_F1 وpCR8_R1 (انظر الجدول 1 لمتواليات التمهيدي) شاشة بيضاء 1-3المستعمرات من كل لوحة. تظهر الصحيح pFUS-RVDs المجالس عادة الفرقة المقابلة لطول مجتمعة من جميع RVDs المستنسخة (على سبيل المثال حوالي 1.1 كيلو بايت لمدة 10 RVDs) و "سلم" من العصابات أقل بروزا أصغر (الشكل 1B).
PCR البرنامج:
95 ° C 3 دقيقة
95 ° C 30 ثانية
55 ° C 30 ثانية
72 ° C 1 دقيقة و 45 ثانية
30-35 دورات
72 ° C 10 دقيقة - وأكد استخدام الحيوانات المستنسخة لبدء الثقافة بين عشية وضحاها (2-5 مل LB مع 50 ميكروغرام / مل سبكتينوميسين).
- باستخدام مستعمرة PCR مع الاشعال pCR8_F1 وpCR8_R1 (انظر الجدول 1 لمتواليات التمهيدي) شاشة بيضاء 1-3المستعمرات من كل لوحة. تظهر الصحيح pFUS-RVDs المجالس عادة الفرقة المقابلة لطول مجتمعة من جميع RVDs المستنسخة (على سبيل المثال حوالي 1.1 كيلو بايت لمدة 10 RVDs) و "سلم" من العصابات أقل بروزا أصغر (الشكل 1B).
- اليوم 3 - غولدن غيت الرد # 2 - صالحة RVD في TALEN ناقلات التعبير
- أداء "minipreps" لعزل التجمعات pFUS-RVD (اعتمادا على عدد من RVDs إما pFUS_A وpFUS_B أو pFUS_A30A، pFUS_A30B، وpFUS_B).
- اختياري: تسلسل الفردية ناقلات pFUS باستخدام بادئات pCR8_F1، pCR8_R1 (انظر الجدول رقم 1 لمتواليات التمهيدي). ويمكن أيضا أن يؤديها على التسلسل وإينال TALEN يبني (القسم 2.5.2)؛ ومع ذلك، لفترة أطول TALENs كاملة يقرأ جميع RVDs قد لا يكون من الممكن استخدام سانجر التسلسل.
- إعداد غولدن غيت رد فعل # 2 لكل TALEN واحد. 150 نانوغرام لكل ناقلات pFUS، 150 نانوغرام من بلر-HD، بلر-NG، بلر-NI، بلر-NN (مشاركة "نصف تكرار") وفقا لتصميم تسلسل RVD وللل EFT TALEN استخدام 75 نانوغرام من pCAG-T7-TALEN-ELD-الوجهة وعن الحق وTALEN استخدام 75 نانوغرام pCAG-T7-TALEN-KKR-الوصول (أو العكس بالعكس). إضافة 1 ميكرولتر Esp3I، 1 ميكرولتر الحمض النووي يغاز T4، 2 ميكرولتر العازلة 10X T4 يغاز الحمض النووي، H 2 O إلى 20 ميكرولتر حجم رد الفعل الكلي.
- وضع ردود فعل جولدن جيت في cycler الحرارية.
برنامج:
37 ° C 5 دقائق
16 ° C 10 دقيقة
10 دورات
37 ° C 15 دقيقة
80 ° C 5 دقائق - استخدام ردود الفعل من القسم 2.3.4 لتحويل E. القولونية.
- <قوية> يوم 4 - إقرار تصحيح الجمعية TALEN
- الشاشة 1-3 مستعمرات بيضاء من كل لوحة من قبل مستعمرة PCR مع الاشعال TAL_F1 وTAL_R2 (انظر الجدول رقم 1 لمتواليات التمهيدي). TALENs تجميعها بشكل صحيح تظهر منتج PCR مع طول المقابلة لعدد من RVDs أدرجت (1D الشكل، هذه الفرقة من الصعب في بعض الأحيان للكشف في حين أن "تأثير سلم" يمثل مؤشرا قويا التجمع ناجحة).
PCR البرنامج:
95 ° C 3 دقيقة
95 ° C 30 ثانية
55 ° C 30 ثانية
72 ° C 3 دقيقة
30-35 دورات
72 ° C 10 دقيقة - وأكد استخدام الحيوانات المستنسخة الصحيح لبدء الثقافات البكتيرية بين عشية وضحاها (2-5 مل LB مع 100 ميكروغرام / مل الأمبيسلين).
- الشاشة 1-3 مستعمرات بيضاء من كل لوحة من قبل مستعمرة PCR مع الاشعال TAL_F1 وTAL_R2 (انظر الجدول رقم 1 لمتواليات التمهيدي). TALENs تجميعها بشكل صحيح تظهر منتج PCR مع طول المقابلة لعدد من RVDs أدرجت (1D الشكل، هذه الفرقة من الصعب في بعض الأحيان للكشف في حين أن "تأثير سلم" يمثل مؤشرا قويا التجمع ناجحة).
- اليوم 5 - تأكيد تصحيح الجمعية TALEN
- أداء "minipreps" لعزل البلازميدات pCAG-T7-TALEN.
- إذا لم يتم تنفيذ التسلسل في حد ذاتهكشن 2.3.2، الاشعال استخدام TAL_Seq_5-1 وTAL_R2 (انظر الجدول رقم 1 لمتواليات التمهيدي) لتحديد التجميع RVD الصحيح في كامل طول TALEN.
3. نوكلياز مرنا التجميعي
- جيل من قالب الحمض النووي
- إعداد ميدي عالية الجودة أو maxipreps من البلازميدات pCAG-T7-TALEN لتخليق مرنا.
- خطي 10 ميكروغرام من TALEN أو ZFN مرنا التوليف البلازميد باستخدام انزيم التقييد الذي يشق تفضيلي المصب وعلى مقربة من محطة كودون نوكلياز (للناقلات pCAG-T7-TALEN استخدام SACI). وتشمل البلازميدات التوليف مرنا عادة T7 أو SP6 فج مروج المنبع من تسلسل الترميز نوكلياز.
- تشغيل 200-500 نانوغرام من البلازميد هضمها على 0،7-1٪ هلام الاغاروز للتحقق من الهضم الكامل.
- إزالة الأملاح من البلازميد هضم بواسطة عجل الحمض النووي مع خلات الصوديوم 0.1 حجم و3 مجلدات الإيثانول لمدة 1 ساعة في درجة حرارة الغرفةه. بيليه الحمض النووي عن طريق الطرد المركزي في XG 14،000 أو أكثر لمدة 10 دقيقة، ويغسل بيليه مع 200 ميكرولتر الايثانول 70٪، وتدور لمدة 5 دقائق أخرى، وإزالة الإيثانول، الهواء الجاف بيليه و resuspend في حجم مناسب من الماء مجانا ريبونوكلياز. تنقية البلازميد خطي من الممكن أيضا استخدام نظام قائم على العمود، على سبيل المثال QIAquick PCR تنقية كيت.
- تحديد تركيز القالب الخطية واستخدام 1 ميكروغرام في إقامتها في النسخ المختبر.
- مرنا التجميعي وتذييل بعديد الأدينيلات
- لفي المختبر النسخ من pCAG-T7-TALEN البلازميدات استخدام كيت الترا mMESSAGEmMACHINE T7. إعداد رد فعل النسخ لكل TALEN على الجليد: ل20 ميكرولتر مع nuclease خالية من المياه، و 10 ميكرولتر T7 2X NTP / ARCA، 2 ميكرولتر T7 الاحتياطي الرد 10X، 1 ميكروغرام من الحمض النووي القالب، 2 ميكرولتر T7 مزيج الانزيم. خلط رد فعل واحتضان لمدة 1-2 ساعة عند 37 درجة مئوية.
- استخدام كامل 20 ميكرولتر transcripنشوئها مزيج رد فعل لإعداد رد فعل تذييل بعديد الأدينيلات على الجليد: 36 ميكرولتر من nuclease خالية من المياه، و 20 ميكرولتر 5X EPAP العازلة، 10 ميكرولتر 25 ملي MnCl2، 10 ميكرولتر 10 ملي ATP. خلط وإزالة 2.5 ميكرولتر من مزيج رد فعل كعينات السيطرة L1 و R1 (لنوكلياز اليسار واليمين، على التوالي). إضافة 4 ميكرولتر من انزيم E-PAP واحتضان رد فعل ل45-60 دقيقة عند 37 درجة مئوية. إزالة 2.5 ميكرولتر مزيج آخر من رد فعل كعينات السيطرة L2 و R2.
- مرنا تنقية
- استخدام NucAway أعمدة سبين لتنقية مرنا (تبادل العازلة وإزالة النيوكليوتيدات الفردية). الاستفادة من الأعمدة لتسوية هلام الجافة في أسفل العمود. العمود هيدرات مع 650 ميكرولتر من العازلة ريبونوكلياز خالية حقن مكروي (1 ملي تريس، الكلور، 0.1 EDTA، ودرجة الحموضة 7.5). كأب، والدوامة، والاستفادة من فقاعات الهواء، وهيدرات لل5-15 دقيقة في درجة حرارة الغرفة.
- وضع عمود في أنبوب جمع وتدورفي 750 x ج، 4 درجة مئوية لمدة 2 دقيقة لإزالة السائل الخلالي الزائد. تجاهل أنبوب جمع ومكان العمود في أنبوب 1.5 مل شطف.
- تطبيق الكامل مزيج رد فعل من القسم 3.2.2 إلى العمود وتدور في 750 x ج، 4 درجة مئوية لمدة 2 دقيقة. سيتم حله الآن نوكلياز مرنا في المخزن حقن مكروي. إزالة 2.5 ميكرولتر من العينات النقية وL3 R3.
- متجر مرنا في -80 درجة مئوية حتى يتم إعداد مأخوذة حقن مكروي.
- مرنا جل الكهربائي
- تنظيف غرفة هلام لإزالة التلوث ريبونوكلياز باستخدام 10٪ محلول SDS أو RNaseZAP.
- إعداد agarose هلام 1٪ في 1xTBE العازلة على التوالي.
- مزيج كل عينة الحمض النووي الريبي L1/R1، L2/R2، L3/R3 مع 3 مجلدات من NorthernMax الفورمالديهايد تحميل صبغ واحتضان لمدة 15 دقيقة عند 65 درجة مئوية.
- عينات الحمل وسلم حجم الحمض النووي الريبي (RNA مثل الألفية حجم علامة) على هلاموتشغيل هلام في 10 V / سم في 1X TBE حتى تصل الصبغة التحميل نهاية هلام.
- وصمة عار الجل باستخدام SYBR حل الخضراء (إينفيتروجن) لمدة 30-60 دقيقة مع الإثارة في درجة حرارة الغرفة.
- صورة هلام ومقارنة أحجام L1/R1 مع L2/R2 وL3/R3. عينات L2/R2 وL3/R3 ينبغي أن تظهر عصابات من حجم زيادة نسبة إلى L1/R1 مبينا تذييل بعديد الأدينيلات ناجحة في (الشكل 2).
- تحديد تركيز مرنا باستخدام مقياس الطيف.
- إعداد مأخوذة مرنا للإبر دقيقة جدا عن طريق خلط نوكلياز اليسار ومرنا نوكلياز الحق في نسبة 1:1. نوصي إعداد مأخوذة مع التركيز الكلي من 200 نانوغرام / ميكرولتر (100 نانوغرام / ميكرولتر من كل نوكلياز) عن طريق تمييع مع العازلة حقن مكروي. مأخوذة متجر مرنا في -80 درجة مئوية.
4. عزل الجنين وحقن مكروي
- عزل الجنين. وقد استخدم هذا البروتوكول بنجاح مع C57BL/6J وسلالة BDF1ق ويمكن على الأرجح أن تتكيف مع سلالات أخرى تستخدم عادة في التجارب حقن مكروي مثل FVB أو CBF1. ويعيش الفئران تحت ضوء الظلام دورة 12 ساعة لمدة 12 ساعة في درجة حرارة والرطوبة التي تسيطر عليها مرفق مع الغذاء والماء بالمال وبالشهرة أيضا الإعلانية.
- الإناث المانحة Superovulate لزيادة الغلة من الأجنة. وsuperovulated 16 الإناث (4 أسابيع من العمر) من قبل داخل الصفاق (IP) حقن المصل موجهة الغدد التناسلية 5 وحدة دولية الفرس الحامل (PMSG)، تليها حقن الملكية الفكرية من 5 وحدة دولية موجهة الغدد التناسلية المشيمية البشرية (قوات حرس السواحل الهايتية) في وقت لاحق 48 ساعة.
- تتزاوج الإناث 16 إلى 16 superovulated سن التكاثر (2-8 أشهر) الذكور مباشرة بعد الحقن قوات حرس السواحل الهايتية.
- التضحية الإناث باستخدام بروتوكول القتل الرحيم وافق مثل CO 2 الاستنشاق.
- استرداد البويضات المخصبة. يتم جمع البويضات من ناقلة البيضات في صباح اليوم التالي ومن ثم تحررت من أي خلايا ركامية المتبقية قبل العلاج 3-5 دقيقة في هيالورونيداز البقري 0.1٪ الذائبة في M2 المتوسطة. اعتمادا على الأداء التزاوج والسلالة المستخدمة قد تختلف العائد الجنين. 16 الإناث C57BL/6J عادة ما تنتج 150-250، في حين BDF1 تسفر 300-400 البويضات المخصبة، على التوالي.
- الجنين حقن مكروي
- حقن نوكلياز مرنا. وعادة ما يتم حقن البويضات مرحلة Pronuclear في فترة ما بعد الظهر في وقت مبكر. ويتم حقن مكروي حشوية مرنا في M2 المتوسطة تحت الزيوت المعدنية باستخدام مجهر مقلوب مجهزة Nomarski مدينة دبي للإنترنت باستخدام الهدف 20X ومع micromanipulators الجنين وكذلك وحدة الحقن. نوصي البدء في حقن TALEN مرنا في تركيز 10 نانوغرام / ميكرولتر (20 نانوغرام / ميكرولتر في المجموع).
- نضح البويضة مع الشعرية عقد وحقن مرنا نوكلياز في السيتوبلازم من الجنين وتجنب الاتصال مع pronuclei. يجب أن يكون الحقن الضحلة، بالقرب من غشاء البلازما. يجب أن تبقى في حجم الحقن منخفض ويجب ان يكون إبرة حقن مكروي الطرافةhdrawn في أول بادرة من انتفاخ حشوية. سوف تتكون سلسلة حقن مكروي عادة من 100-300 البويضات. عادة، يجب أن لا يقل عن 80-90٪ من الأجنة البقاء على قيد الحياة دون تحلل الحقن المباشر.
- حقن مكروي التالية، وضع الأجنة لمدة 1 ساعة في M16 (سيغما) المتوسطة عند 37 درجة مئوية و 5٪ CO 2 ونقل الأجنة على قيد الحياة إلى الأمهات الحاضنة pseudopregnant.
5. الجراحية نقل الأجنة
- إعداد متلقي الجنين pseudopregnant (تشجيع الأمهات) قبل مرنا حقن مكروي يوم واحد. الإناث الناضجة (3-6 أشهر من العمر) من سلالة الأباعد قوية، مثل CD-1، ومناسبة تماما للدور. حمل حمل كاذب عن طريق التزاوج الإناث على اليوم السابق مع الذكور أجريت لهم هذه العمليات إما جراحيا أو وراثيا 28. وتستخدم فقط 0.5 الإناث DPC مع المكونات كوبولاتوري اضحة كمتلقين الأجنة. في الإناث غير المستخدمة يختفي حمل كاذب بعد حوالي 3 ويكانساس السماح باستخدامها المتكرر.
- تخدير DPC الحاضنة الأم الإناث 0.5 عن طريق الحقن الملكية الفكرية من الكيتامين، زيلازين (120 ملغ / كغ و 16 ملغم / كغم، على التوالي). هذه الضمانات صياغة ~ 30 دقيقة وقت التسامح الجراحية هي أكثر من كافية للمرة العملية المتوقعة من 5-10 دقيقة.
- وضع الحيوان مخدرة على البطن على سطح دافئ وتطهير المنطقة من شق مع مطهر المناسبة مثل الايثانول 70٪ أو الكلورهيكسيدين وخليط الكحول.
- شق الجلد على ظهر الحيوان وفتح التجويف البريتوني مع مقص العقيمة.
- تصور وتخريج قرن الرحم عن طريق سحب على وسادة من الدهون التي تعلق على المبيض. الحفاظ على الأجهزة رطبة دافئة باستخدام 0.9٪ كلوريد الصوديوم الحل. نأخذ في الاعتبار أن الموقع الجراحي قد يكون من الضروري رايات مع ضمادة معقمة أو حلق لتتفق مع المبادئ التوجيهية البيطرية المحلية.
- شل الجهاز التناسلي من قبل لقطة لوحة الدهون المبيض مع المشبك بولدوج.
- فهم بلطف قناة البيض فقط المنبع من أمبولة مع ملقط ساعاتي واستخدام إبرة تحت الجلد 30 G لخلق ثقب صغير في جدار قناة البيض.
- سحب الإبرة ومعاودة الشعرية الزجاج رقيقة تحتوي على أجنة في حفرة السماح للوضع الأجنة في أمبولة التي تهب بلطف في سان حال صاحب الشعرية. سحب شعري مرة واحدة تودع الأجنة في أمبولة واستبدال الأجهزة التناسلية مرة أخرى في تجويف الجسم.
- إغلاق التجويف البريتوني مع سلسلة من الغرز العقيمة (البرولين 6-0).
- إغلاق الجلد باستخدام 1-2 مقاطع الجرح (Autoclip 9 ملم) اعتمادا على حجم الفتحة.
- بعد عملية إعادة الحيوانات إلى أقفاصها والإشراف عليها حتى تأثير التخدير يزول.
- من أجل تقليل الإجهاد، وإيواء الفئران في مجموعات اجتماعية مستقرة (2-4 الحيوانات / النوع الثالث القفص) كلما كان ذلك ممكنا.
- تطبيق مسكن بعد العمليات الجراحيةق في شكل Dafalgan تضاف إلى مياه الشرب (باراسيتامول 200 ملغ / كجم من وزن الجسم) لمدة 3 أيام بعد الجراحة.
6. تحليل PCR من قبل المؤسسين وT7 نوكلياز داخلية أو تقييد انزيم الهضم
- الاشعال تصميم لتضخيم المنطقة بين 200-700 سنة مضت حول الموقع ملزمة نوكلياز. المسافات إلى الأمام المنطقة الفاصل التمهيدي نوكلياز ونوكلياز فاصل الإقليم عكس التمهيدي ينبغي أن يكون مختلفا بما فيه الكفاية للسماح للكشف عن شريطين منفصلة للمنتجات هضمها على agarose هلام (أنظر الشكلين 3 و 4 للحصول على أمثلة).
- تشغيل PCR مع الظروف الأمثل. تحقق PCR حجم AMPLICON على agarose هلام.
- اختياري: منتجات تنقية PCR، على سبيل المثال مع QIAquick PCR تنقية كيت لإزالة الأملاح والنيوكليوتيدات من مزيج PCR. العديد من الانزيمات تقييد تنشط في عينات PCR تستكمل مع المخزن المؤقت انزيم تقييد المناسبة وتنقية ليست هناك حاجة. لدينا أيضا ناجحهتستكمل تستخدم LLY نوكلياز داخلية T7 العازلة في QiagenTaq PCR مع NEBuffer 2.
- T7 نوكلياز داخلية الفحص. مزيج 17 ميكرولتر من الناتج PCR مع 2 ميكرولتر من NEBuffer 2 وتشغيل تشكيل مضاعف متغاير (الشكل 3B) برنامج في thermocycler:
95 ° C 2 دقيقة
95 درجة مئوية إلى 85 درجة مئوية (-2 ° C / ثانية)
85 ° C إلى 25 ° C (-0.1 ° C / ثانية)
4 ° C الانتظار.
إضافة 1 ميكرولتر من T7 نوكلياز داخلية لكل عينة واحتضان عند 37 درجة مئوية لمدة 20 دقيقة. (الفحص مساح (Transgenomic)، الذي يعتمد على CEL 1 نوكلياز، ويمكن أيضا أن تستخدم هنا. يرجى الرجوع إلى تعليمات الشركة الصانعة.) - خلاصة القيد من الناتج PCR. مزيج 17 ميكرولتر من الناتج PCR مع 2 ميكرولتر من 10X العازلة انزيم التقييد و 1 ميكرولتر من انزيم التقييد. هضم في درجة حرارة مناسبة لمدة 1 ساعة أو أكثر.
- T7 نوكلياز داخلية الفحص. مزيج 17 ميكرولتر من الناتج PCR مع 2 ميكرولتر من NEBuffer 2 وتشغيل تشكيل مضاعف متغاير (الشكل 3B) برنامج في thermocycler:
- إضافة الحمض النووي لعينات صبغ التحميل وتشغيلها على 2٪ هلام الاغاروز للكشف عن الهضم متميزةأنماط من نوع الحيوانات البرية ومؤسسي تحمل الأليلات تحور. أنظر الشكلين 3 و 4 للنتائج المتوقعة.
- المنتجات استنساخ PCR من مؤسسي إيجابي للالأليلات تحور لسانجر تسلسل (مثلا عن طريق الاستنساخ في TA-pGEM-T Easyor تسلسل مباشرة خليط من المنتجات PCR باستخدام الجيل المقبل من التسلسل.
النتائج
اقمنا البلازميدات الوجهة متوافق مع التجمع الذهبي GateTALEN نشرته سيرماك وآخرون 13 التي تسمح للتعبير عن TALENs في خلايا الثدييات وكذلك في المختبر التوليف مرنا من المروج T7 فج (الشكل 1C). هذه البلازميدات تحمل المجالات FokI heterodimeric (ELD أو KKR الطفرات) التي ثبت للحد من آثار خارج الهدف النسبي لhomodimers FokI وتعزيز النشاط الانقسام بالمقارنة مع الجيل الأول FokI heterodimers 25،29. ردود الفعل التجمع البوابة الذهبية رقم 1 ورقم 2 وعادة ما تكون فعالة جدا وكل مستعمرة بيضاء، عند تحليلها من قبل مستعمرة PCR، ويظهر النمط المتوقع لعدد معين من RVDs المستنسخة (الأرقام 1B و 1D).
تحليل هلام في المختبر توليفها مرنا (الشكل 2) يجب أن تكشف عن وجود الفرقة مميزة واحدة مع مسحة ضئيلة أو معدومة لتحليل كل عينة. يجب أن يكون هناك تحول واضح بين حجم العينات L1/R1 وL2/R2، L3/R3، مما يدل على تذييل بعديد الأدينيلات ناجحة.
مؤسس الحيوانات يمكن فرزهم لNHEJ التي يسببها الأليلات تحور باستخدام التنميط الجيني PCR تليها إما الهضم T7 نوكلياز داخلية (الشكل 3) أو تقييد هضم باستخدام الانزيم الذي يشق تسلسل نوع البرية في المنطقة فاصل من الزوج نوكلياز (الشكل 4). مقايسة T7 نوكلياز داخلية قابلة للتطبيق على أي نوع من الطفرة بغض النظر عن التسلسل الجيني محددة داخل المنطقة فاصل من الزوج نوكلياز حقن؛ ومع ذلك، فإنه يكشف عدم التطابق بين جدائل الحمض النووي فقط في المنتجات PCR مضاعف متغاير. وبالتالي، في حالة نادرة أن مؤسس يحمل اثنين من الأليلات تحور مماثل، ومنتجات PCR لن تظهر أي نمط T7 الهضم. مثل هذا التمييز هو، ومع ذلك، من الممكن دائما عندما يقع موقع قيود محددة داخل المنطقة الفاصل نوكلياز التي سيتم القضاء عليه من خلال NHEJالتي يسببها الإدراج / حذف (الشكل 5). هنا، والعصابات غير مهضوم تشير إلى وجود الطفرات، وعدم وجود أي منتجات هضمها يوحي بقوة مؤسس تحمل طفرات في كل من الأليلات من الجينات المستهدفة (التي تحمل العلامات النجمية في الشكل 4B).
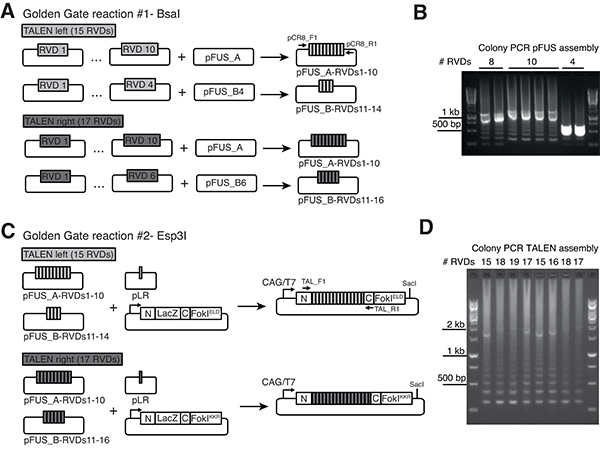
الشكل 1. جولدن جيت استنساخ TALEN RVDs في heterodimeric pCAG-T7-الوجهة ناقلات ألف) جمعية صفائف RVD في ناقلات pFUS. هنا يظهر مثال لزوج TALEN مع صفائف حكاية فردية تضم 15 RVDs و 17 RVDs، على التوالي (للصفائف حكاية أطول من 21 RVDs، هناك حاجة إلى ثلاث pFUS-RVDs الجمعيات، لا تظهر). السهام تشير الاشعال لpFUS محددة تفاعلات مستعمرة PCR. ب) المنتجات PCRتضخيمه من التجميعات pFUS الصحيح عادة تظهر الفرقة المقابلة لطول مجتمعة من جميع RVDs المستنسخة (على سبيل المثال حوالي 1.1 كيلو بايت لمدة 10 RVDs) و "سلم" من العصابات أقل بروزا أصغر نظرا لطبيعة المتكررة من صفائف RVD. C) التجميع النهائي صفائف pFUS-RVD والبلازميد التي تحتوي على تكرار الماضي (بلر) في heterodimeric TALEN ناقلات تعبير وFokIELD وFokIKKR المتغيرات، على التوالي. العمود الفقري TALEN (المشروح في N و C) تمثل العمارة التي نشرتها ميلر وآخرون 23 CAG (CMV عنصر محسن المبكر / الدجاج بيتا الأكتين) مروج يضمن مستويات عالية التعبير في خلايا الثدييات transfected، في حين يسمح المروج T7 فج في المختبر مرنا التوليف (استخدام SACI عن الخطية من ناقلات المصب من نوكلياز إيقاف كودون). D) مستعمرة PCR باستخدام بادئات يتبين من السهام في C) يسمح تحديد تجميعها بشكل صحيح TALENs. كامل lengtح المنتجات PCR غالبا ما تكون أقل وضوحا في حين أن "تأثير سلم" يمثل مؤشرا قويا التجمع ناجحة. اضغط هنا لمشاهدة صورة بشكل اكبر .
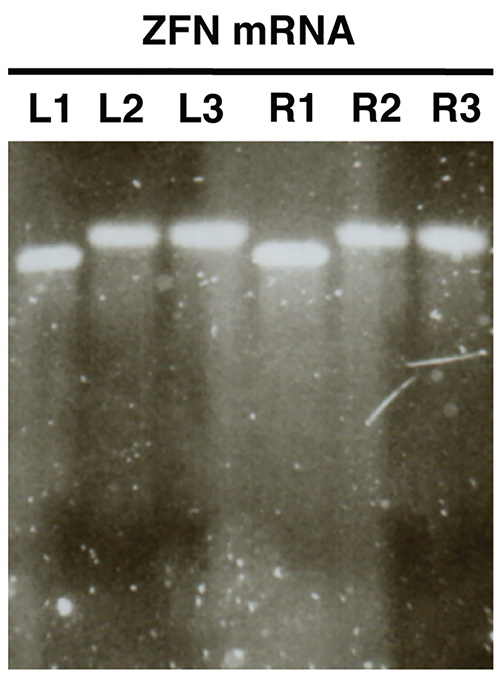
الشكل 2. . مراقبة جودة نوكلياز مرنا في تركيب المختبر باستخدام الاغاروز الكهربائي للهلام ترد mRNAs وZFN كمثال (L، غادر ZFN؛ R، الحق ZFN). عينات L1/R1 تظهر مرنا قبل تذييل بعديد الأدينيلات، وعينات L2/R2 المعرض مذيل بعديد الأدينيلات مرنا وL3/R3 تظهر مرنا مذيل بعديد الأدينيلات المنقى. اضغط هنا لمشاهدة صورة بشكل اكبر .
بديل = "الشكل 3" FO: محتوى العرض = "6in" FO: SRC = "/ files/ftp_upload/50930/50930fig3highres.jpg" سرك = "/ files/ftp_upload/50930/50930fig3.jpg" العرض = "600" />
الرقم 3. مثال على نوكلياز داخلية مقايسة T7 تستخدم لتحديد الحيوانات مؤسس تحمل الطفرات التي يسببها نوكلياز من موضع الهدف. A) وقد صمم زوج TALEN ليلتصق داخل المنطقة الترميز من الفأرة بروتين بريون الجين (Prnp، يمكن تقديم تسلسل الهدف TALEN عند الطلب). يتم إنشاء المنتج PCR باستخدام التمهيدي إلى الأمام (F) تقع 110 سنة مضت المنبع والتمهيدي العكسي (R) 250 سنة مضت المصب من موقع الانقسام TALEN. ب) يخضع المنتج PCR لاحقا إلى تشكيل مضاعف متغاير وT7 نوكلياز داخلية الهضم. C) وكشف الطفرات المستحثة TALEN داخل المنطقة الجيني المستهدفة من مؤسسي واحد عن طريق وجود كامل طول PCR المنتج مع منتجات الهضم من 250 و 110 نقطة أساس.50930/50930fig3highres.jpg "الهدف =" _blank "> اضغط هنا لمشاهدة صورة أكبر.

الشكل 4. مثال على تقييد هضم منتجات PCR تستخدم لتحديد الحيوانات مؤسس تحمل الطفرات التي يسببها نوكلياز من موضع الهدف. ZFN محددة للفأر Rosa26 موضع الهدف 29 موقع تقييد XbaI داخل إنترون 1. تم فحص A) من قبل المؤسسين التنميط الجيني PCR باستخدام التمهيدي إلى الأمام (F) يقع على بعد 500 سنة مضت المنبع والتمهيدي العكسي (R) 250 سنة مضت المصب من موقع الانقسام. ب) هضم منتجات PCR مع XbaI يكشف أنماط الهضم مما يدل الفئران مع الطفرات ثنائية أليلية (المشار إليها بعلامة النجمة)، مونو -أليلية الطفرات (العصابات هضمها وعسر الهضم، مثل الحيوان 2)والفئران وزن (الهضم كاملة، مثل الحيوان 21). C) تسلسل من الفئران مع تعديلات ثنائية أليلية المحتملة يظهر إلى 3 (الحيوانية 24) مميزة الإدراج / حذف. اضغط هنا لمشاهدة صورة بشكل اكبر .
| اسم التمهيدي | تسلسل 5 'إلى 3' |
| pCR8_F1 | ttgatgcctggcagttccct |
| pCR8_R1 | cgaaccgaacaggcttatgt |
| TAL_F1 | ttggcgtcggcaaacagtgg |
| TAL_R2 | ggcgacgaggtggtcgttgg |
| TAL_Seq_5-1 | catcgcgcaatgcactgac |
الجدول 1. تسلسل الاشعال المستخدمة في تقارير إتمام المشروعات مستعمرة وتسلسلها داخل التجمع جولدن جيت TALENالبروتوكول.
| البلازميد / كوكتيل | مساهم | Addgene ID | تعليقات |
| جولدن جيت TALEN وTAL المستجيب كيت 2.0 | Voytas المختبر | 1000000024 | يحتوي على جميع البلازميدات اللازمة لجولدن جيت TALEN التجمع |
| pCAG-T7-TALEN -KKR/ELD ناقلات الوجهة | Pelczar المختبر | 40131، 40132 | إضافة على البلازميدات لTALEN التعبير في خلايا الثدييات والتوليف مرنا في المختبر |
الجدول 2. ويمكن الحصول على البلازميدات ومجموعات البلازميد اللازمة لجولدن جيت TALEN التجمع من Addgene ( www.addgene.org ).
| على الانترنتمورد | تعليقات |
| http://tale-nt.cac.cornell.edu | تصميم TALEN؛ TALEN التنبؤ خارج الهدف |
| http://zifit.partners.org/ZiFiT/ | تصميم TALEN، مفتوح ZFN، كودا ZFN، CRISPR/Cas9 |
| http://www.genome-engineering.org | تصميم TALEN، CRISPR/Cas9؛ CRISPR/Cas9 خارج الهدف التنبؤ |
| http://baolab.bme.gatech.edu/Research/BioinformaticTools/assembleTALSequences.html | جمعية TALEN متواليات لتأكيد نتائج التسلسل |
| http://pgfe.umassmed.edu/ZFPmo dularsearchV2.html | تصميم وحدات التجميع ZFN |
| www.genomecenter.ucdavis.edu/s egallab / segallabsoftware | تصميم وحدات التجميع ZFN |
الجدول 3. الموارد على الانترنت لتصميم ZFN، TALEN، وCRISPR/Cas9.
Discussion
مصمم يحركها نوكلياز الجينوم النهج التحرير قمنا بمد بشكل كبير من مجموعة من الأنواع قابلة للتعديلات التي تستهدف جينوم كل منهما 10،12. في الفئران، وقد تم في خلايا ES-استهداف الجينات تقنية قياسية لأكثر من عقدين من الزمن؛ ومع ذلك، فقد ثبت صعوبة في التكيف مع الخلايا الجذعية الجنينية من الأنواع الأخرى من الماوس، وإن كان هناك بعض النجاح الذي تحقق مؤخرا في الفئران خلايا ES. حتى مع توافر "قبالة الجاهزة للاستخدام" الماوس ES استنساخ الخلايا المستهدفة الجينات التي تقدمها اتحادات مثل EUCOMM، KOMP، أو NorCOMM 3 الجينوم التحرير من قبل ZFN وTALEN يوفر أعلى من الدقة والمرونة فيما يتعلق الطيف من التعديلات التي يمكن أن تكون أدخلت جينوم الفأر. الحيوانات مؤسس تحمل طفرات بوساطة نوكلياز يبدو أن غاية الجرثومية خط المختصة 4-6،20،21، وهي ليست الحال دائما للالوهم القادمة من حقن الكيسة الخلايا ES. وبالتالي، في بعض الحالات Microinjection من قصريمكن nucleases igner يؤدي إلى توليد أسرع بكثير من خطوط الماوس رواية مع بعض التعديلات الجينوم المستهدفة.
الجيل الناجح من الفئران خروج المغلوب عن طريق الحقن من ZFN وTALEN يعتمد إلى حد كبير على نشاط الزوج نوكلياز حقن. وقد ثبت TALENs أن يكون لها نسبة نجاح عالية في استهداف مجموعة واسعة من الجينات في عدد من الكائنات الحية؛ ومع ذلك، تشير الدراسات الحديثة أن TALEN ملزمة حساس للالسيتوزين مثيلة 30،31. وهكذا، ولدت حديثا نوكلياز أزواج، على سبيل المثال TALENs المستنسخة في ناقلات pCAG-T7، يمكن عابر في خط الخلية الماوس مثل NIH-3T3 أو العصبية -2A، التي تحاكي الدولة لونين من الجنين الماوس إلى حد ما. هنا، والنشاط نوكلياز يمكن تقديرها باستخدام نوكلياز داخلية مقايسة T7 أو تقييد هضم المنتج PCR كما هو موضح في القسم 5 قبل التوليف مرنا وحقن مكروي. نوصي التسلسل الجيني في المنطقة من مصلحة في احترامإيف خط الخلية وسلالة الماوس تستخدم للتجارب حقن مكروي.
في بيضات ملقحة الماوس، سوف TALEN مختلفة أو ZFN أزواج تعمل على النحو الأمثل بتركيزات مختلفة مرنا وبالتالي فإن تركيز العمل الأمثل للنوكلياز مرنا microinjected قد تضطر إلى أن تحدد تجريبيا. اعتمادا على الزوج نوكلياز، وتركيز منخفض جدا يؤدي إلى أي انشقاق في حين مرتفعة جدا يمكن أن يؤدي إلى الجنين الفتك. اعتمادا على الزوج نوكلياز، لقد حققنا نجاحا باستخدام مجموع تركيزات منخفضة مرنا قدر 2 نانوغرام / ميكرولتر ويصل إلى 200 ميكروغرام / شباط. هذه الآثار يصعب التنبؤ بها من التجارب في خلية ثقافة والأمثل تركيز نوكلياز لكلا بقاء الجنين ومعدل تعديل موضع الهدف يحتاج إلى أن تحدد تجريبيا.
ZFN نشطة للغاية أو TALEN يمكن يلتصق تسلسل هدفهم تجاوز مرحلة خلية واحدة من الجنين، وبالتالي يسبب microinjected أنماط معقدة من الطفرات ود الاصباغ في المؤسسين. نحن وآخرون 4 لاحظت ثلاثة أو أكثر من الأليلات تحور واضح في مؤسس واحد (الشكل 5C). وبالتالي، عند إنشاء خط الفأرة الجديدة من هؤلاء المؤسسين، والأبناء لا بد من فحص بعناية من قبل تسلسل لوجود الطفرة مواتية منذ المقايسات الهضم تقديم الدليل الوحيد على أن طفرة غير معروف موجودا.
واحدة من الانتقادات في كثير من الأحيان اعرب ضد أنظمة ZFN وTALEN هو احتمال أن هذه nucleases هي أيضا قادرة على الشق تسلسل الحاضر في مكان آخر في الجينوم التي تشبه إلى المواقع المستهدفة. وقد لوحظت هذه التأثيرات خارج الهدف مع الكواشف الجيل المبكر باستخدام المجال homodimeric FokI، وصممت ثوابت مغاير للتخفيف من آثار خارج الهدف 25. يمكن التنبؤ مواقع خارج هدفا محتملا إلى حد ما في سيليكون 32،33 وفرزهم من قبل PCR والتسلسل. ميزة واضحة سو باستخدام ZFNs وTALENs لتوليد الفئران بدلا من خطوط الخلايا هي إمكانية إزالة من الطفرات الهدف المنشود غير المرتبطة لتعديل الجينوم عن طريق إجراء العديد من backcrosses لسلالة من النوع البري في الاختيار. لتحليل عدد كبير من الفئران مؤسس، الجيل القادم التسلسل العميقة للمنتجات PCR ولدت من موضع استهداف ونوكلياز في سيليكون توقع خارج الهدف مواضع قد تقدم قراءات النوعي والكمي بديل لفحوصات هضم منتجات PCR.
هي الأمثل للتقنيات المساعدة على الإنجاب وصفها في هذا البروتوكول لسلالات الفئران القياسية المستخدمة في التجارب حقن مكروي مثل C57BL/6J أو B6D2F1. الفئران من أصول مختلفة، مثل سلالات الأباعد، يمكن من حيث المبدأ أن تستخدم لنهج تحرير الجينوم ويمكن أن توفر خلفية وراثية أكثر ملاءمة للأسئلة بحثية محددة. أداء تقنيات الإنجاب المساعدة مثل فرط الإباضة يمكن أن يكون prediالمديرية لعدد من سلالات 34-36 ولكن قد تحتاج إلى مزيد من التحسين لسلالات غير قياسي من أجل الحصول على عدد كاف من الأجنة لحقن مكروي نوكلياز.
إلى جانب ZFN وTALEN، والآن أدخلت nucleases مصمم جديدة مثل موجهة RNA نظام CRISPR/Cas9 9،37،38 لتطبيقات التحرير الجينوم. جميع الطرق لحقن مكروي وتحليل الحيوانات مؤسس وصفها هنا قابلة للتطبيق على CRISPR/Cas9 وسائط مستقبل تحرير الجينوم أيضا.
Disclosures
الكتاب تعلن أي تضارب مصالح.
Acknowledgements
نود أن نشكر مونيكا Tarnowska، كورنيليا ألبرخت، وإيوا Skoczylas للمساعدة التقنية الممتازة. وقد تم تمويل هذه الدراسة من قبل الجبهة الوطنية الصومالية SINERGIA منحة CRSI33-125073 لPP.
Materials
| Name | Company | Catalog Number | Comments |
| BsaI | NEB | R0535S or L | |
| Esp3I | Thermo Scientific | ER0451 | |
| T4 Ligase | NEB | M0202S or L | |
| Spectinomycin | Sigma | S0692-1ML | |
| Ampicillin | Sigma | A0166 | |
| X-Gal | Sigma | B4252 | |
| IPTG | Sigma | I6758 | |
| Plasmid-Safe nuclease | Epicentre | E3101K | |
| QIAprep Spin Miniprep Kit | Qiagen | 27106 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAquick PCR Purification Kit | Qiagen | 28106 | |
| mMESSAGE mMACHINE T7 Ultra Kit | Invitrogen | AM1345 | |
| NucAway Spin Columns | Invitrogen | AM10070 | |
| RNaseZAP | Sigma | R2020-250ML | |
| NorthernMax Formaldyde Load Dye | Invitrogen | AM8552 | |
| RNA Millennium Markers | Invitrogen | AM7150 | |
| 10x TBE buffer | Thermo Scientific | B52 | |
| T7 endonuclease | NEB | M0302S or L | |
| pGEM-T EasyVector System I | Promega | A3600 | |
| SYBR Green I Nucleic Acid Gel Stain | Invitrogen | S-7563 | |
| pregnant mare's serum gonadotrophin (PMSG) | Sigma | G4877 | |
| human chorionic gonadotropin (hCG) | Sigma | CG5 | |
| M2 embryo culture medium | Sigma | M7167 | |
| M16 embryo culture medium | Sigma | M7292 | |
| Mineral oil, embryo tested | Sigma | M8410 | |
| Ketamine | CentraVet | Ket 201 | |
| Xylazine | Sigma Aldrich | 46995 | |
| Equipment/Tools | |||
| Inverted microscope with Nomarski DIC optics (for example Nikon Eclipse TE200) | Nikon | ||
| Micromanipulator units (for example Narishige, NT88NF) | Narishige | ||
| Embryo holding capillaries | Sutter Instruments | B100-75-10 | |
| Embryo injection capillaries | Narishige | GD-1 | |
| Capillary puller (for example Sutter P97) | Sutter Instruments | ||
| Microforge (for example Narishige MF-900) | Narishige | ||
| Walton skin scissors | FST | 14077-10 | |
| Surgical scissors | FST | 14041-10 | |
| Surgical probe | FST | 10140-03 | |
| Reflex wound clip system (9 mm) | FST | 12031-09 | |
| Reflex wound clips (9 mm) | FST | 12032-09 | |
| Dumont fine forceps 5 | FST | 11254-20 | |
| Moria curved forceps | FST | 11370-31 | |
| Moria fine forceps | FST | 11399-80 | |
| Dietrich bulldog clamp | FST | 18038-45 | |
| C57BL/6J mice | Jackson Labs | strain code 000664 | |
| CD-1 mice | Charles River | strain code 000664 | |
References
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat. Rev. Genetics. 6, 507-512 (2005).
- Johansson, T., et al. Building a zoo of mice for genetic analyses: a comprehensive protocol for the rapid generation of BAC transgenic mice. Genesis. 48, 264-280 (2010).
- Skarnes, W. C., et al. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Carbery, I. D., et al. Targeted genome modification in mice using zinc-finger nucleases. Genetics. 186, 451-459 (2010).
- Meyer, M., de Angelis, M. H., Wurst, W., Kuhn, R. Gene targeting by homologous recombination in mouse zygotes mediated by zinc-finger nucleases. Proc. Natl. Acad. Sci. U.S.A. 107, 15022-15026 (2010).
- Cui, X., et al. Targeted integration in rat and mouse embryos with zinc-finger nucleases. Nat. Biotechnol. 29, 64-67 (2011).
- Sung, Y. H., et al. Knockout mice created by TALEN-mediated gene targeting. Nat. Biotechnol. 31, 23-24 (2013).
- Wefers, B., et al. Direct production of mouse disease models by embryo microinjection of TALENs and oligodeoxynucleotides. Proc. Natl. Acad. Sci. U.S.A. 110, 3782-3787 (2013).
- Wang, H., et al. One-Step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nat. Rev. Genetics. 11, 636-646 (2010).
- ZFN, T. A. L. E. N. CRISPR/Cas-based methods for genome engineering. Trends Biotechnol. 31, 397-405 (2013).
- Joung, J. K., Sander, J. D. TALENs: a widely applicable technology for targeted genome editing. Nat. Rev. Mol. Cell Biol. 14, 49-55 (2013).
- Cermak, T., et al. Efficient design and assembly of custom TALEN and other TAL effector-based constructs for DNA targeting. Nucleic Acids Res. 39, (2011).
- Reyon, D., et al. FLASH assembly of TALENs for high-throughput genome editing. Nat. Biotechnol. 30, 460-465 (2012).
- Sanjana, N. E., et al. A transcription activator-like effector toolbox for genome engineering. Nat. Protoc. 7, 171-192 (2012).
- Kim, Y., et al. A library of TAL effector nucleases spanning the human genome. Nat. Biotechnol. 31, 251-258 (2013).
- Schmid-Burgk, J. L., Schmidt, T., Kaiser, V., Honing, K., Hornung, V. A ligation-independent cloning technique for high-throughput assembly of transcription activator-like effector genes. Nat. Biotechnol. 31, 76-81 (2013).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat. Biotechnol. 31, 827-832 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat. Biotechnol. 31, 822-826 (2013).
- Hermann, M., et al. Evaluation of OPEN zinc finger nucleases for direct gene targeting of the ROSA26 locus in mouse embryos. PLoS ONE. 7, (2012).
- Meyer, M., Ortiz, O., Hrabe de Angelis, M., Wurst, W., Kuhn, R. Modeling disease mutations by gene targeting in one-cell mouse embryos. Proc. Natl. Acad. Sci. U.S.A. 109, 9354-9359 (2012).
- Doyle, E. L., et al. TAL Effector-Nucleotide Targeter (TALE-NT) 2.0: tools for TAL effector design and target prediction. Nucleic Acids Res. 40, 117-122 (2012).
- Miller, J. C., et al. A TALE nuclease architecture for efficient genome editing. Nat. Biotechnol. 29, 143-148 (2011).
- Guo, J., Gaj, T., Barbas, C. F. Directed evolution of an enhanced and highly efficient FokI cleavage domain for zinc finger nucleases. J. Mol. Biol. 400, 96-107 (2010).
- Doyon, Y., et al. Enhancing zinc-finger-nuclease activity with improved obligate heterodimeric architectures. Nat. Methods. 8, 74-79 (2011).
- Wefers, B., et al. . Current Protocols in Mouse Biology. , (2011).
- Wefers, B., Wurst, W., Kühn, R. . Current Protocols in Mouse Biology. , (2011).
- Haueter, S., et al. Genetic vasectomy-overexpression of Prm1-EGFP fusion protein in elongating spermatids causes dominant male sterility in mice. Genesis. 48, 151-160 (2010).
- Perez-Pinera, P., Ousterout, D. G., Brown, M. T., Gersbach, C. A. Gene targeting to the ROSA26 locus directed by engineered zinc finger nucleases. Nucleic Acids Res. 40, 3741-3752 (2012).
- Bultmann, S., et al. Targeted transcriptional activation of silent oct4 pluripotency gene by combining designer TALEs and inhibition of epigenetic modifiers. Nucleic Acids Res. 40, 5368-5377 (2012).
- Valton, J., et al. Overcoming TALE DNA binding domain sensitivity to cytosine methylation. J. Biol. Chem. 287, 38427-38432 (2012).
- Cradick, T. J., Ambrosini, G., Iseli, C., Bucher, P., McCaffrey, A. P. ZFN-Site searches genomes for zinc finger nuclease target sites and off-target sites. BMC Bioinform. 12, (2011).
- Doyle, E. L., et al. TAL Effector-Nucleotide Targeter (TALE-NT) 2.0: tools for TAL effector design and target prediction. Nucleic Acids Res. 40, 117-122 (2012).
- Byers, S. L., Payson, S. J., Taft, R. A. Performance of ten inbred mouse strains following assisted reproductive technologies (ARTs). Theriogenology. 65, 1716-1726 (2006).
- Luo, C., et al. Superovulation strategies for 6 commonly used mouse strains. J. Am. Assoc. Lab. Animal Sci. 50, 471-478 (2011).
- Pease, S., Saunders, T. L. . International Society for Transgenic Technologies. Advanced protocols for animal transgenesis : an ISTT manual. , (2011).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339, 819-823 (2013).
- Mali, P., et al. RNA-Guided human genome engineering via Cas9. Science. 339, 823-826 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved