Method Article
Tasarımcı nükleazlar kullanılması Fare Genom Mühendisliği
Bu Makalede
Özet
Örneğin çinko parmak nükleazlara (ZFNs) ve transkripsiyon aktivatörü gibi efektör nükleazlara (TALENS) olarak tasarımcı nükleazlar homolog olmayan uç birleştirme (NHEJ) ile homolog yeniden birleştirmeye (HR) yolaklar tetikleyerek fare preimplantasyon embriyoların genomunu değiştirmek için kullanılabilir. Bu gelişmeler kesin genetik değişiklikler farelerde hızlı üretimini sağlar.
Özet
Site özel genom değişiklikler (nakavt, knock-in) taşıyan transgenik fareler karmaşık biyolojik sistemleri diseksiyon yanı sıra insan hastalıklarının modelleme ve tedavi stratejileri test etmek için hayati önem taşımaktadır. Böyle çinko parmak nükleazlardır (ZFNs), transkripsiyon aktivatörü gibi efektör nükleazlardır (Talens) ve kümelenmiş düzenli interspaced kısa yineleyen tekrarlar (CRISPR) / için CRISPR-ilişkili (Cas) 9 sistemi yerinde gibi tasarımcı nükleazların kullanımı son gelişmeler Belirli bir genom mühendislik embriyonik kök (ES) hücre teknolojisi güvenmek gerek kalmadan hemen hemen herhangi bir laboratuvar türlerde hızlı hedef genom modifikasyonu gerçekleştirmek için olasılığını açığa çıkarır. Bir genom düzenleme deney tipik olarak tanımlı bir araştırmacı genomik nükleaz aktivitesi yönlendirmek için özel DNA bağlayıcı etki yapımında ardından ilgi konusu bir gen içinde bir tasarımcı nükleaz hedef siteye belirlenmesi ile başlar. Tasarımcı nükleaz plazmidler in vitro olarak '/ Em> döllenmiş fare oosit mikroenjeksiyon için mRNA oluşturmak için transkripsiyonu. Burada, döllenmiş fare oositlerine TALEN mRNA'nın direkt enjeksiyonu ile hedef genom modifikasyonu elde edilmesi için bir protokol sağlar.
Giriş
Fareler transgenik hayvan modelleri oluşturmak için ana kadar en popüler platform tarafından bulunmaktadır. Fare embriyo 1-3 genetik mühendisliği için çok yönlü bir araç son zamanlarda, örneğin çinko parmak nükleazlara (ZFN) gibi tasarımcı nükleazlara göre genom düzenleme yaklaşımlarla 4-6, transkripsiyon aktivatör gibi efektör nükleazlar (TALEN) 7,8 uzatıldı ve kümelenmiş düzenli interspaced kısa palindromık tekrarlar (CRISPR) / CRISPR-ilişkili (Cas) 9 9. ZFN ve her Fokl endonükleaz 10-12 birleştirilir (sırasıyla çinko parmak proteinlerin dizileri ve tekrar-değişken di-tortuları (RVDs),), iki özel olarak tasarlanmış protein bazlı DNA-bağlayıcı etki çiftleri olarak işlev TALEN. Tersine, Cas9-aracılı DNA parçalanmasının özgüllüğü (aynı zamanda, tek bir kimerik RNA molekülü olarak geçecek kılavuz RNA birleştirilebilir crRNA ve tracrRNA) CRISPR RNA transaktive tarafından sağlanan ile bir kompleks içinde hareket 11CRISPR proteini.
RVDs tanımlanmış bir dizi ile Talens hızla 13-17 seçmek için montaj stratejileri çok sayıda bireysel deneyciler tarafından inşa edilebilir. CRISPR/Cas9 ancak kılavuz RNA-DNA özgünlüğü hala tam 18,19 çözülmüş değil bağlama, tasarımcı nükleazların daha az emek-yoğun nesil vaat ediyor. Özel ZFNs nesil şimdiye kadar uzman akademik laboratuarları ve bu Sangamo Biyobilimlerdeki ve Sigma CompoZr hizmet olarak ticari tedarikçiler ile sınırlı olmuştur.
Genel olarak, tasarımcı nükleazlara ile düzenleme genom sonradan katılan homolog olmayan uç (NHEJ) veya homolog rekombinasyon (HR) DNA onarım makine 10,12 çekmek tanımlanan genomik loci, at çift iplikli sonları (DSB) tanıtmayı amaçlamaktadır. Bir DSB aracılı NHEJ onarım genellikle tamir yerinde yakın eklemeler ve silmeler getirilmesi ile sonuçlanır. Böylece NHEJ onarım cBir genlerin protein kodlama sekansı 4,7,9 içinde bir çerçeve kayma mutasyonu getirerek, bir hedef genin işlevi nakavt için yararlanılabilir. Alternatif olarak, ek veya tanımlanmış genetik bilginin değiştirilmesi tasarımcı nükleazlar ile birlikte bir DNA donör temin edilmesiyle elde edilebilir. Bir DNA donör Böylece HR ile DSB onarım için bir şablon olarak hizmet veren hedef alan ile homoloji bölgeleri ile çevrili araştırmacı tasarlanmış DNA dizileri içerir. Plazmidler 5,6,20 ve tek sarmallı oligonükleotid 8,9,21 Hem verici olarak başarılı bir şekilde kullanılmıştır. NHEJ-nor HR-aracılı genom düzenleme ne genel genetik mimari bozmadan nükleotid sekansında küçük değişikliklere oluşturmak için bu stratejiler özellikle uygun hale getirir, fare embriyo, genomuna bir seçilebilir markerin giriş gerektirir.
Bu protokolde genom düzenleme için gerekli tüm prosedürler açıklanmaktadırTalens kullanılarak fare embriyosu. Bunlar TALEN hedef site 22 1) tanımlanmasını içerir, golden gate klonlama 13 tarafından Talens 2) yapım, TALEN mRNA, döllenmiş fare oosit, embriyo transferi için 5) cerrahi girişimler içine TALEN mRNA 4) mikroenjeksiyon 3) in vitro sentez ve 6) kurucusu hayvanlarda TALEN kaynaklı mutagenez analizi. Biz TALEN mRNA mikroenjeksiyon ve NHEJ kaynaklı eklemeler / silmeler için kurucularından tarama odaklanmak. Bu amaçla plazmid olarak ve fare embriyoları mikro enjeksiyon için TALEN mRNA in vitro sentezi transfekte zaman memeli hücrelerinde hem de ifade edilmesine olanak iki fonksiyonlu TALEN yapıları yarattı. Bu yapılar, heterodimerik Foki kaynaşmış bir kesik TALE omurga 23 Memeli hücrelerinde optimum genom düzenleme için 24,25 etki içermektedir. Bu protokol, aynı zamanda, diğer tasarım nükleazlara mikroenjeksiyonu için veya tasarımcı nükleazlara birleşik enjeksiyon için kabul edilebilirve verici yapıları (DNA donör tasarım Wefers et al. 26,27 ile mükemmel bir teknik yayınlarda tarif edilmiştir).
Etik Bildirimi
Tüm hayvan deneyleri Kanton Zürih Kanton Veteriner Ofisi kurallara ve yönetmeliklere uygun olarak yapıldı.
Protokol
1.. TALEN Hedef Siteleri Tanıtımı
- TAL Efektör Nükleotid Targeter 2.0 web sitesi (http://tale-nt.cac.cornell.edu) ziyaret edin ve "TALEN targeter" seçin.
- Hedef geni dizisini girin. PCAG-T7-TALEN ifadesi kullanılıyor oluşturuyorsa (Şekil 1C) seçin "Miller ve diğ., 2011" altında (optimal boşluk uzunluğu ile hedef alınabilir hedef siteleri tahmin etmek amacıyla "bir Preset Mimarlık kullanın" 15-20 bp) ve bu TALEN mimarisi için MASALI RVDs (15-20) numaraları.
- "G Substitute" altında "NN" seçiniz (Guanozin özel NH RVDs da mevcuttur ancak henüz yaygın TALEN montaj için test).
- İsteğe bağlı: diğer ayarlar ve seçenekler için web sitesinde talimatları ve orada sağlanan bağlantıları takip edin.
- Potansiyel bir hedef siteleri ile metin dosyası olabilir, oluşturulurdaha rahat izleme için bir elektronik tablo programı içine ithal. Golden Gate montaj için TALEN çift (ler) seçin.
- İsteğe bağlı: Dizi kamu veritabanlarında sorumluydu ve olmayabilir mümkün tek nükleotid polimorfizmleri (SNP) tespit etmek mikroenjeksiyon için kullanılacak fare zorlanma ilgi genomik bölgenin potansiyel bağlama nükleazı önleyebilir.
- İsteğe bağlı: Ek tasarımcı nükleazlar ilgili çevrimiçi kaynaklara için Tablo 3'e bakın.
- ZFN ve TALEN yapımı için gerekli en plazmidler Addgene elde edilebilir:
http://www.addgene.org/special-collections/
Golden Gate TALEN kiti ve memeli sentezleme konstruktları için TALEN Addgene et Tablo 2'de verilmiştir.
Alternatif olarak, çinko parmak alanları gibi belirli fonksiyonel modüller bir gen sentezi servis sağlayıcıdan sipariş edilebilir.
2 "jove_title". Golden Gate TALEN Meclisi
Bu bölüm, Cermak et al. 13 tam uzunlukta TALENS birbirini takip eden iki Golden Gate klonlama adımları (Şekil 1) kullanılarak inşa edilmektedir tarafından yayınlanan bir protokol kullanılarak TALENS montajını tarif eder. Bu yaklaşım nihai ekspresyon yapılarına 12 ve 31 arasında herhangi bir sayıda RVDs dahil edilmesini sağlar. Montaj protokol oosit mikroenjeksiyon aşağıdaki derece aktif Talens ifade üreten mRNA'lardan (Şekil 1C) için tasarlanmış hedef vektörlere adapte edilmiştir. Ayrıca (kuran ve plazmid kütüphane korumak için Golden Gate TALEN kitinin çevrimiçi protokolüne bakınız http://www.addgene.org/TALeffector/goldengateV2/ ).
- 1. Gün - Golden Gate Tepki # 1 - pfus Vektörleri içine RVD Dizilerin Meclisi
- İsteğe bağlı: P tasarlanmış her çifti için TALENotokol 1, her bir altın Gate reaksiyon için bir pipetleme düzeni oluşturmak için TALEN_Voytas_Pipetting elektronik tabloya ('3', ilk T, 5 de dahil olmak üzere) bu iki hedef siteye DNA dizisini girmek (aynı zamanda derlemeler için kullanılan tüm plasmidlerin konsantrasyonları girmek .) Tablo ayrıca bölüm 2.5.2 'de dizileme sonuç hizalanması için kullanılabilecek tüm RVDs beklenen DNA dizisini temin etmektedir.
- Her tekil TALEN Protokol 1 dizayn için:
TALEN uzunluğu 12-21 (standart), seçeneğini tekrar değişken di-artıkları (RVDs) 1-10 ve hedef vektör pFUS_A ise. Kalan RVDs ve bölüm 2.3.3 'te son montaj eklenecektir son tekrarı, seçeneğini RVDs 11-14 ve hedef vektör pFUS_B4 (Şekil 1A) dahil 15 RVDs (bir Yeten için örneğin bir pFUS_B hedef vektörü seçin.
TALEN uzunluğu 22-31 ise, kullanım RVDs 1-10 ve hedef A.Ş.ctor pFUS_A30A. RVDs 11-20 ve hedef vektör pFUS_A30B seçin. Kalan RVDs ve 24 RVDs RVDs 21-23 ve hedef vektör pFUS_B3 almak ile Yeten için örneğin bir pFUS_Bdestination vektörü seçin. - Daha uzun 21 RVDs, 1-10 + pFUS_A30A, 11-20 pFUS_A30B ve kalan RVDs her pfus + RVD kombinasyonu ayrı ayrı, yani 1-10 + pFUS_A ve kalan RVDs + ilgili pFUS_B vektör veya Yeten için Golden Gate reaksiyon 1. kurmak + ilgili pFUS_B vector. 20 ul toplam reaksiyon hacmi için her RVD vektörün 150 ng vektör pfus 150 ng, 1 ul Bsal, 1 ul T4 DNA ligazı, 2 ul 10x T4 DNA ligaz tampon, ve H, 2 O kullanın. (T4 ligaz tampon tekrarlanan çözülme / donma reaksiyonların etkinliğini azaltabilir beri Golden Gate meclislerinin her tur için T4 ligaz tamponu taze hacimde kullanılması tavsiye edilir.)
- Bir termo döngüleyici içinde Golden Gate reaksiyonları yerleştirin.
Program:
37 ° C 5 dakika
16 ° C 10 dk
10 döngü
50 ° C 5 dakika
80 ° C 5 dakika - Her bir karışımı 1 ul 10 mM ATP ve 1 ul plazmit-Safe nükleaz ilave edilir ve 1 saat boyunca 37 ° C'de inkübe edin. Bu tedavi, transforme edilen bakterilerden in vivo homolog rekombinasyon ile hedef vektörlere klonlanabilir doğrusal eksik Ligasyon ürünleri kaldırır.
- E. Transform ayrı ligasyon reaksiyonları ile coli (örneğin, XL1-Blue ya da DH5a gibi α-tamamlanmasını sağlamak, elektrik ya da kimyasal olarak, yeterli E. coli, burada ve sonraki dönüşümlerde kullanılabilir).
- X-Gal ve IPTG ile spektinomisin levhalar bakteriler (50 ug / ml) plakaları mavi / beyaz koloni seçimi (40 ug / ml her biri).
- Gün 2 - Doğru pfus-RVDs Meclis Onayı
- Primerler pCR8_F1 ve pCR8_R1 ile koloni PCR kullanarak (primer dizileri için Tablo 1'e bakınız) ekran 1-3 beyazHer levhadan koloniler. Doğru pfus-RVDs derlemeler genellikle kombine klonlanmış tüm RVDs (10 RVDs örneğin yaklaşık 1.1 kb) uzunluğu ve karşılık gelen bir grup göstermek daha küçük daha az belirgin bantları (Şekil 1B) "merdiven".
PCR programı:
95 ° C 3 dk
95 ° C 30 saniye
55 ° C 30 saniye
72 ° C 1 dk 45 sn
30-35 döngüleri
72 ° C'de 10 dakika - Kullanım (50 ug / ml spektinomisin sahip 2-5 ml LB) gece boyunca kültürü başlatmak için klonlar doğruladı.
- Primerler pCR8_F1 ve pCR8_R1 ile koloni PCR kullanarak (primer dizileri için Tablo 1'e bakınız) ekran 1-3 beyazHer levhadan koloniler. Doğru pfus-RVDs derlemeler genellikle kombine klonlanmış tüm RVDs (10 RVDs örneğin yaklaşık 1.1 kb) uzunluğu ve karşılık gelen bir grup göstermek daha küçük daha az belirgin bantları (Şekil 1B) "merdiven".
- 3. Gün - Golden Gate Reaksiyon # 2 - TALEN İfade Vektörleri içine RVD Diziler
- (RVDs pFUS_A ve pFUS_B veya pFUS_A30A, pFUS_A30B ve pFUS_B ya sayısına bağlı olarak) pfus-RVD derlemeler izole etmek "miniprepleri" gerçekleştirin.
- İsteğe bağlı: astarlar pCR8_F1, pCR8_R1 (primer dizileri için bakınız Tablo 1) kullanılarak dizisi bireysel pfus vektörler. Dizi da f yapılabilirinal TALEN yapıları (bölüm 2.5.2); Ancak, uzun Talens tamamlanana için Sanger sıralama kullanarak mümkün olmayabilir tüm RVDs okur.
- Tek tek her Yeten için Golden Gate reaksiyon 2. ayarlayın. Her pfus vektör 150 ng, RVD dizisinin tasarımı ve l eft TALEN 75 ng kullanmak için uygun PLR-HD, PLR-NG, PLR-NI, PLR-NN (son "yarı-repeat") 150 ng pCAG-T7-TALEN-ELD-Hedef ve sağ TALEN 75 ng pCAG-T7-TALEN-KKR-Hedef (veya tersi) kullanmak için. 1 ul Esp3I, 1 ul T4 DNA ligazı, 2 ul 10x T4 DNA ligaz tampon ekleme, H 2 O 20 ul toplam reaksiyon hacmi.
- Bir termo döngüleyici içinde Golden Gate reaksiyonları yerleştirin.
Program:
37 ° C 5 dakika
16 ° C 10 dk
10 döngü
37 ° C 15 dakika
80 ° C 5 dakika - E. dönüştürmek için bölüm 2.3.4 tepkisini kullanın coli.
- 4. Gün - Doğru TALEN Meclis Onayı
- Koloni primerleri ile PCR TAL_F1 ve TAL_R2 her plaka ekran 1-3 beyaz koloniler (primer dizileri için Tablo 1 'e bakınız). Doğru monte Talens bir uzunluk (Şekil 1D, bu grup "merdiven etkisi" başarılı montaj sağlam bir göstergesini temsil ederken tespit etmek bazen zor) dahil RVDs toplam sayısına karşılık gelen bir PCR ürünü göstermektedir.
PCR programı:
95 ° C 3 dk
95 ° C 30 saniye
55 ° C 30 saniye
72 ° C 3 dakika
30-35 döngüleri
72 ° C'de 10 dakika - Kullanım bakteri kültürleri, gece boyunca (2-5 ml 100 ug / ml ampisilin ile LB) başlamak için doğru klonları doğruladı.
- Koloni primerleri ile PCR TAL_F1 ve TAL_R2 her plaka ekran 1-3 beyaz koloniler (primer dizileri için Tablo 1 'e bakınız). Doğru monte Talens bir uzunluk (Şekil 1D, bu grup "merdiven etkisi" başarılı montaj sağlam bir göstergesini temsil ederken tespit etmek bazen zor) dahil RVDs toplam sayısına karşılık gelen bir PCR ürünü göstermektedir.
- Gün 5 - Doğru TALEN Meclis Onayı
- PCAG-T7-TALEN plasmidlerini izole etmek "miniprepleri" gerçekleştirin.
- Dizileme se yapılmadı isection 2.3.2, kullanım astarlar TAL_Seq_5-1 ve TAL_R2 tam uzunlukta Yeten doğru RVD takımını belirlemek için (primer dizileri için bakınız Tablo 1).
3. Nükleaz mRNA sentezi
- Şablon DNA üretilmesi
- Yüksek kaliteli midi veya mRNA sentezi için pCAG-T7-TALEN plazmidler maksi hazırlayın.
- Tercihen böler alt ve nükleaz durma kodonuna yakın (pCAG-T7-TALEN vektörleri için SacI kullanın) bir sınırlandırıcı enzim kullanılarak veya TALEN ZFN mRNA sentezi plazmidin 10 ug linearize. mRNA sentezi plazmidler, tipik olarak nükleaz kodlama dizisinin üst akışında bir T7 ya da SP6 faj promoteri bulunmaktadır.
- Tam sindirim kontrol etmek için bir% 0.7-1 agaroz jel üzerinde sindirilmiş plazmid 200-500 ng çalıştırın.
- Isı oda sıcaklığında 1 saat boyunca 0,1 hacim sodyum asetat ve 3 hacim etanol ile DNA çökeltme ile sindirimi plazmidinden tuzları çıkarmake. Etanol, hava RNAse içermeyen uygun bir su hacminde pelet ve tekrar süspansiyon kurutun, başka bir 5 dakika için, 200 ul% 70 etanol ile bir dönüş pelet yıkama, 10 dakika boyunca 14,000 x g ya da daha fazla santrifüjleme ile DNA Pelet. , Doğrusallaştırılmış plasmidin saflaştırılması kolon tabanlı bir sistem, örneğin, QIAquick PCR Saflaştırma Kiti kullanılması da mümkündür.
- Doğrusal şablonun konsantrasyonunu belirleyin ve in vitro transkripsiyon kurmak için 1 mikrogram kullanın.
- mRNA sentezi ve poliadenilasyon
- PCAG-T7-talen in vitro transkripsiyonu için plasmidler mMESSAGEmMACHINE T7 Ultra Kit kullanın. Nükleaz içermeyen su ile 20 ul, 10 ul 2x T7 NTP / Arca, 2 ul 10x reaksiyon tamponu, T7, DNA şablonunun 1 ug, 2 ul T7 enzim karışımı: buz üzerinde her yetenekleri yeri için transkripsiyon reaksiyonu ayarlayın. Reaksiyonu karıştırın ve 37 ° C'de 1-2 saat süreyle inkübe
- Tam 20 ul transkripsiyon kullanınnükleaz içermeyen su içinde 36 ul, 20 ul 5x EPAP tampon maddesi, 10 ul 25 mM MnCl2, 10 ul 10 mM ATP: buz üzerinde poliadenilasyon reaksiyon ayarlamak için tion reaksiyon karışımı. Karıştır ve (sırası ile, sol ve sağ nükleaz için) kontrol numuneleri L1 ve R1 gibi reaksiyon karışımı 2.5 ul çıkarın. E-PAP enzim 4 ul ilave edin ve 37 ° C'de 45-60 dakika boyunca reaksiyonu inkübe Kontrol numuneleri L2 ve R2 ile reaksiyon karışımı bir 2.5 ul çıkarın.
- mRNA Saflaştırma
- MRNA saflaştırma (tampon değişimi ve tüzel kişiliği olmayan nükleotidlerin çıkarılması) için NucAway Spin Sütunları kullanın. Sütunun altındaki kuru jel yerleşmek sütunları dokunun. RNAse içermeyen mikroenjeksiyon tamponu (1 mM Tris-CI, 0.1 EDTA, pH 7.5) içinde 650 ul hidrat kolon. Cap, girdap, hava kabarcıklarını dışarı dokunun, ve oda sıcaklığında 5-15 dakika boyunca hidrat.
- Bir toplama tüpüne ve spin sütunu yerleştirin750 x g, 4 ° C, 2 dakika için fazla interstisyel sıvı çıkarmak için kullanılır. 1.5 ml elüsyon tüp toplama tüpü ve yer sütun atın.
- 750 xg, 2 dakika süreyle 4 ° C'de sütuna ve spin bölüm 3.2.2 komple bir reaksiyon karışımı uygulayın. Nükleaz mRNA hemen mikroenjeksiyon tamponu içinde çözüldü olacaktır. Saflaştınlmış numuneler L3 ve R3 2.5 ul çıkarın.
- -80 ° C'de saklayın mRNA mikroenjeksiyon parça hazırlandı kadar.
- mRNA Jel Elektroforez
- % 10 SDS çözeltisi veya RNaseZAP kullanarak RNAz kirlilikler kaldırmak için bir jel odasını temizleyin.
- 1xTBE çalışan tampon maddesi içinde bir% 1 agaroz jeli hazırlayın.
- NorthernMax Formaldehit Yük Boya 3 hacim, her RNA numunesi L1/R1, L2/R2, L3/R3 karıştırın ve 65 ° C'de 15 dakika boyunca inkübe
- Yük örnekleri ve jel üzerinde bir RNA boyutu merdiven (örn. RNA Millennium boyutu işaretleyici)yükleme boyası jelin sonuna ulaşıncaya kadar ve 1 x TBE, 10 V / cm jel ile çalıştırın.
- Oda sıcaklığında, çalkalama ile, 30-60 dakika boyunca SYBR yeşil bir çözelti (Invitrogen) kullanılarak jel leke.
- Görüntü jel ve L2/R2 ve L3/R3 ile L1/R1 boyutları karşılaştırın. Örnekler L2/R2 ve L3/R3 (Şekil 2) başarılı bir poliadenilasyon gösteren L1/R1 göre artan bir büyüklükte bantlar göstermelidir.
- Bir spektrofotometre kullanılarak mRNA konsantrasyonu belirleyin.
- 1:1 oranında, sol ve sağ nükleaz nükleaz mRNA karıştırılarak mikroenjeksiyon için mRNA alikotları hazırlayın. Biz, mikroenjeksiyon tamponu ile seyreltilerek 200 ng / ul bir toplam konsantrasyonda (her nükleaz 100 ng / ul) ile alikotları hazırlanması önerilir. -80 ° C'de saklayın mRNA alikotları
4. Embriyo İzolasyon ve Mikroenjeksiyon
- Embriyo İzolasyonu. Bu protokol başarıyla C57BL/6J ve BDF1 gerginlik ile kullanılır olmuşturs ve büyük olasılıkla genellikle bu tür FVB ve CBF1 gibi mikro-enjeksiyon deneylerinde kullanılan diğer suşlar için adapte edilebilir. Fareler, yiyecek ve su ad libitum ile bir ısı-ve nem-kontrollü bir tesis, 12 saat-12 saat ışık-karanlık çevrimi altında muhafaza edilmiştir.
- Superovulate kadın donör embriyo veriminin arttırılması için. (4 haftalık), 16 kadın, 48 saat sonra 5 IU insan koryonik gonadotropin (hCG) ip enjeksiyonu, ardından 5 IU gebe kısrak serum gonadotropini (PMSG) intraperitoneal (ip) enjeksiyonu ile süper ovülasyon edilir.
- 16 üreme çağında (2-8 ay) 16 süperovulasyonu kadın Mate hCG enjeksiyonundan hemen sonra erkekler.
- Böyle CO 2 inhalasyon gibi onaylı bir ötanazi protokolünü kullanan kadın kurban.
- Döllenmiş oosit kurtarın. Oositler ertesi sabah yumurta kanalından toplanmış ve M2 ortam içinde çözülmüş,% 0.1 sığır hiyaluronidaz içinde 3-5 dakika işlenerek geri kalan kümülüs hücrelerinin kurtulur. Çiftleşme performans ve kullanılan suşu bağlı olarak embriyo verim değişebilir. BDF1 sırasıyla 300-400 döllenmiş oosit elde edilir, oysa 16 C57BL/6J dişiler, genellikle 150-250 üretir.
- Embriyo Mikroenjeksiyon
- Nükleaz mRNA enjekte edilir. Pronükleer aşama oosit genellikle erken öğleden sonra enjekte edilir. Sitoplazmik mRNA mikroenjeksiyon 20X objektif kullanılarak Nomarski, DIC ve embriyo mikromanipülatörler yanı sıra enjeksiyon ünitesi ile donatılmış bir ters mikroskop kullanılarak mineral yağ altında M2 bir ortam içinde gerçekleştirilmektedir. Biz, 10 ng / ul 'lik bir konsantrasyonda (toplam 20 ng / ul) ile TALEN mRNA enjeksiyon başlamadan önerilir.
- Bir tutma kılcal ile oositin aspire ve ön çekirdek ile temasından kaçınarak embriyonun sitoplazmasında nükleaz mRNA enjekte edilir. Enjeksiyon plazma zarına yakın, sığ olmalıdır. Enjeksiyon hacmi düşük tutulmalıdır ve mikroenjeksiyon iğne zekâ olmalıdırsitoplazmik gerilmenin ilk işareti hdrawn. Bir mikroenjeksiyon serisi normalde 100-300 oosit oluşacaktır. Tipik olarak, embriyoların en az% 80-90 hemen liziz olmaksızın enjeksiyon hayatta gerekir.
- Mikroenjeksiyon, 37 ° C 'de M16 (Sigma) ortamında 1 saat boyunca embriyoların yerleştirin ve% 5 CO2 ve yalancı üvey anne içine kalan embriyo aktarımı.
5. Cerrahi Embriyo Transferi
- Yalancı embriyo alıcılara (üvey anneler) mRNA mikroenjeksiyon bir gün önce hazırlayın. Sağlam outbred gerginlik, CD-1, iyi rolü için böyle uygundur edilir (3-6 aylık) Olgun kadın. Ya cerrahi ya da genetik vasektomize erkeklerde 28 ile bir önceki gün kadın çiftleşme tarafından yalancı Induce. Açık bir çiftleşme fişle sadece 0.5 DPC kadın embriyolar alıcı olarak kullanılır. Kullanılmayan kadınlarda yalancı gebelik yaklaşık 3 haftadan sonra kaybolurOnların tekrar kullanımı sağlayan ks.
- Ketamin ip enjeksiyonu ile 0,5 DPC üvey anne kadın uyuşturan, ksilazin (sırasıyla 120 mg / kg ve 16 mg / kg). Bu formülasyon garanti ~ 30 dakika cerrahi tolerans süresi 5-10 dakika arasında öngörülen çalışma sürelerinden için fazlasıyla yeterli.
- Sıcak bir yüzey üzerindeki karın anestezi hayvan yerleştirin ve bu% 70 etanol veya klorheksidin ve alkol karışımı gibi uygun bir dezenfektan ile kesi alanı dezenfekte.
- Hayvanın arka yüzeyini İnsizyon ve steril makas ile periton boşluğuna açın.
- Görselleştirmek ve yumurtalık bağlı yağ yastığı çekerek uterin boynuz yansıtmak. Sıcak% 0.9 NaCl solüsyonu kullanarak nemli organları tutun. Cerrahi alan steril sargı ile bol dökümlü veya yerel veteriner yönergelere uymak amacıyla traş gerekebilir unutmayın.
- Bir bulldog kelepçe ile yumurtalık yağ yastığı kırpma ile üreme organları hareketsiz.
- Yavaşça saatçi forseps ile ampulla hemen yukarısında yumurta kanalının kavramak ve yumurtalığa duvarında küçük bir delik oluşturmak için bir 30 G derialtı iğne kullanın.
- Iğneyi ve yavaşça kılcal sahibinin ağızlık içine üfleme ile ampulla embriyoların yerleşimini sağlayan deliğe embriyoları içeren ince bir cam kılcal takın. Embriyolar ampulla yatırılır kez kılcal çekiniz ve arka vücut boşluğunda üreme organları değiştirin.
- Steril ameliyat dikiş iplikleri (Prolene 6-0) bir dizi periton boşluğuna kapatın.
- Açıklığın boyutuna bağlı olarak 1-2, yara klipsleri (Autoclip 9 mm) kullanarak cilt kapatın.
- Operasyon evlerine kafesine hayvanların dönmek ve anestezi etkisi geçene kadar bunları denetlemek ardından.
- , Stresi en aza indirmek (2-4 hayvan / tip III kafes) mümkün istikrarlı sosyal gruplar fareler ev için.
- Post-operatif ağrı kesici UygulaDafalgan şeklinde s ameliyattan sonra 3 gün boyunca içme suyu (Parasetamol 200 mg / kg BW) ilave edildi.
6. PCR ve T7 endonükleaz ya da restriksiyon enzim sindirimi ile analiz Kurucular
- Nükleaz bağlanma yerinin yaklaşık 200-700 bp arasında bir bölümünün yükseltilmesi için primerler dizayn. Mesafeler ileri primer-nükleaz boşluk bölgesi ve nükleaz boşluk bölge Ters primer, bir agaroz jeli üzerinde sindirilmiş ürünler için iki ayrı bant tespiti (örnekler için Şekil 3 ve 4'e bakın) imkan vermek için yeterince farklı olmalıdır.
- Optimize PCR koşulları çalıştırın. Bir agaroz jel üzerinde PCR amplikonu boyutunu kontrol edin.
- İsteğe bağlı: PCR karışımı tuzları ve nükleotidler kaldırmak QIAquick PCR Saflaştırma Kiti ile, örneğin Arındırmak PCR ürünleri,. Birçok sınırlama enzimleri, uygun kısıtlayıcı enzim tamponu ve arıtma için PCR ile tamamlanabilir örneklerinde aktif gerekli değildir. Biz de successfu varQiagenTaq PCR tamponunda Lly kullanılan T7 endonükleaz NEBuffer 2 tamamlanmaktadır.
- T7 endonükleaz deneyi. NEBuffer 2 2 ul PCR ürünü 17 ul karıştırın ve hetero oluşumunu çalıştırın (Şekil 3b) bir PCR programı:
95 ° C 2 dk
95 ° C ile 85 ° C (2 ° C / sn)
85 ° C ila 25 ° C (-0.1 ° C / sn)
4 ° C tutun.
Her bir örnek için T7 endonükleaz 1 ul ilave edin ve 20 dakika boyunca 37 ° C'de inkübe edin. (CEL 1 nükleazı dayanan bilirkişi tayini (Transgenomic), aynı zamanda. Üreticinin talimatlarına bakın burada da kullanılabilir.) - PCR ürününün Kısıtlama özet. 10x sınırlama enzim tamponu ve 2 ul kısıtlama enzimi 1 ul PCR ürünü 17 ul karıştırın. 1 saat ya da daha fazla uygun bir sıcaklıkta Digest.
- T7 endonükleaz deneyi. NEBuffer 2 2 ul PCR ürünü 17 ul karıştırın ve hetero oluşumunu çalıştırın (Şekil 3b) bir PCR programı:
- Örnekler DNA yükleme boya eklenir ve sindirim ayrı tespit etmek için, bir% 2 agaroz jel üzerineyabani tip hayvanlar ve mutasyona uğramış allel taşıyan kurucular için desenleri. Beklenen sonuçlar için Şekil 3 ve 4'e bakın.
- Klonlama PCR pGEM-T içine Easyor TA-klonlama doğrudan bir sonraki nesil dizilemesi kullanılarak, PCR ürünlerinin karışımları, örneğin sırası ile Sanger sekanslama için mutasyon alleli (pozitif kurucular ürünleri.
Sonuçlar
Bu memeli hücrelerinde TALENS sentezlenmesini hem de T7 faj promoteri (Şekil 1C) için in vitro mRNA sentezine izin vermek Cermak'ın et al. 13 tarafından yayınlanan Altın GateTALEN düzeneği ile uygun hedef plazmidleri yapılmıştır. Bu plazmidler Fokl homodimerler göre hedef dışı etkileri azaltmak ve Fokl 25,29 heterodimerler ilk nesil ile karşılaştırıldığında bölünme etkinliğini arttırmak için gösterilmiştir heterodimerik Fokl etki (ELD veya KKR mutasyonlar) taşır. Altın kapı montaj reaksiyonlar # 1 ve # 2 genellikle çok verimli ve her beyaz koloni, koloni PCR ile analiz edildiğinde, klonlanmış RVDs (Şekil 1B ve 1D) belirli sayıda için beklenen modelini gösterir.
In vitro sentezlenen mRNA Jel analizi (Şekil 2) ile analiz edilir, her bir numune için çok az veya hiç smear ile tek bir bant açığa ayırt edilmelidir. Başarılı poliadenilasyona gösterir örnekleri L1/R1 ve L2/R2, L3/R3 arasında net bir boyut değişim var olmalıdır.
Kurucu hayvanların bir enzim kullanılarak, ya T7 endonükleaz sindirimi ve ardından genotipleme PCR (Şekil 3) ya da bir sınırlandırma sindirimi kullanan NHEJ indüklenen mutasyona uğramış aleller için taranabilir nükleaz çiftinin boşluk bölgesi içinde yaran vahşi tip sekans (Şekil 4),. T7 endonükleaz deney bağımsız enjekte nükleaz çiftinin boşluk bölgesi içinde belirli bir genomik sekansın mutasyonu herhangi bir uygulanabilir; Bununla birlikte, bu heterodupleks PCR ürünleri DNA elyaf arasında sadece uyumsuzluklarını bulgulamaktadır. Böylece, kurucu iki aynı mutasyona uğramış allel taşıyan nadir durumlarda, PCR ürünleri herhangi T7 sindirim desen göstermek olmaz. Belirli bir kısıtlama alanı NHEJ tarafından yok edilecek nükleaz boşluk bölgesi içinde yer almaktadır Bu tür bir ayrım her zaman, ancak, mümkünEklemeler / silmeler (Şekil 5) ile indüklenen. Burada, sindirilmemiş bantları mutasyonların varlığını gösterir ve her sindirilmiş ürünlerin yokluğu güçlü (Şekil 4b'de yıldız ile işaretlenmiştir) hedeflenen genin her iki allel içinde mutasyonlar taşıyan bir kurucu göstermektedir.
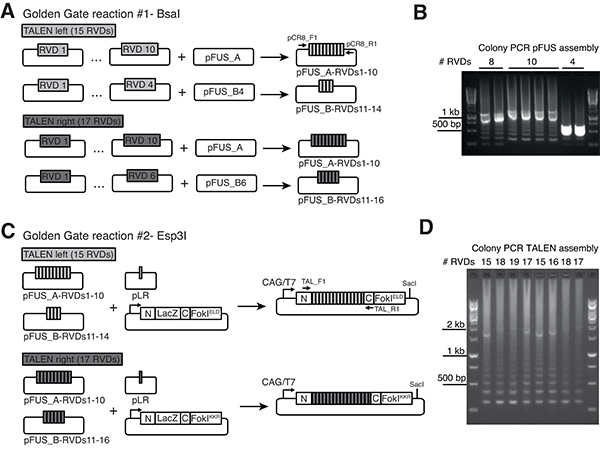
Şekil 1. Pfus vektörlere RVD diziler Heterodimerik pCAG-T7-Hedef vektörlere TALEN RVDs Golden Gate klonlama. A) Meclis. İşte bir örnek birey MASALI diziler, sırasıyla, 15 ve 17 RVDs RVDs oluşan bir TALEN çifti için gösterilmiştir (uzun 21 RVDs daha MASALI diziler için, üç pfus-RVDs meclisleri gösterilmez, gerekli). Oklar pfus spesifik koloni PCR reaksiyonları. B) PCR ürünleri belirtmek için primerlerDoğru pfus meclisleri büyütüldü tipik) bir grup klonlanmış tüm RVDs (10 RVDs örneğin yaklaşık 1.1 kb) ve bir bitiş RVD dizilerin tekrarlayan doğa için daha küçük daha az önemli gruplarından "merdiven". C'nin kombine uzunluğuna tekabül göstermek son montaj pfus-RVD dizileri sırasıyla FokIELD ve FokIKKR varyantları ile heterodimerik TALEN ekspresyon vektörleri içine, son tekrar (plr) ihtiva eden bir plazmid. (N-ve C açıklamalı) TALEN omurga T7 faj promoteri de sağlar iken CAG (CMV erken güçlendirici element / tavuk beta-aktin) promoteri, transfekte memeli hücrelerinde yüksek düzeyde ekspresyon sağlayan Miller et al. 23 tarafından yayınlanan benzer bir mimari nitro mRNA sentezi (nükleaz STOP kodonu alt vektörün doğrusallaştırılması için SacI kullanım). D) C oklarla gösterilen primerler kullanılarak koloni PCR) doğru monte TALENS tanımlanmasını sağlar. Tam lengt"merdiven etkisi" başarılı montaj sağlam bir göstergesini temsil ederken h PCR ürünleri genellikle daha az belirgindir. resmi büyütmek için buraya tıklayın .
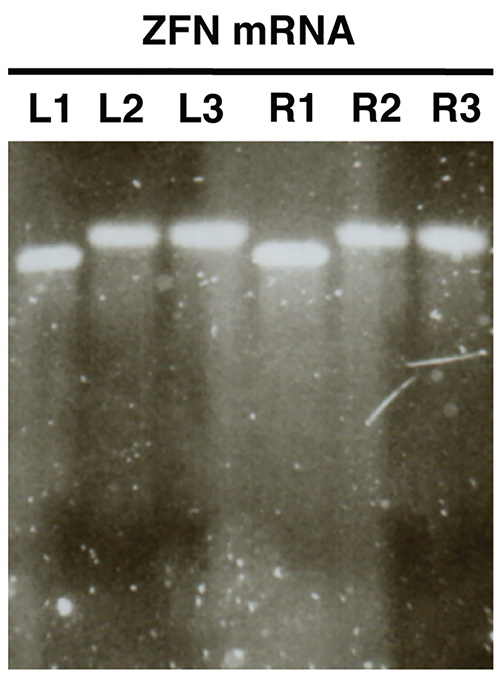
Şekil 2. . Agaroz jel elektroforezi kullanılarak in vitro sentezi nukleaz mRNA kalite kontrol ZFN mRNAlarının bir örnek olarak gösterilmiştir (L, ZFN sol, R, sağ ZFN). Numuneler önce poliadenilasyonunun mRNA göstermek L1/R1, mRNA ve L3/R3 poliadenillenmiş örnekleri L2/R2 gösteri saflaştırılmış poliadenile mRNA göstermektedir. resmi büyütmek için buraya tıklayın .
içerik-genişliği fo = "6in": src = "/ files/ftp_upload/50930/50930fig3highres.jpg" src = "/ files/ftp_upload/50930/50930fig3.jpg" width = "600" fo alt = "Şekil 3" />
Şekil 3,. Hedef lokusunun nükleaz ile indüklenen mutasyon taşıyan Kurucu hayvanların tanımlanması için kullanılan bir T7 endonükleaz tahlilin örneği. A) TALEN çift fare prion proteini geni (PRNP kodlayıcı bölge içinde bölmek için tasarlanmıştır, TALEN hedef sekansı), istek üzerine temin edilebilir. Bir PCR ürünü, PCR ürünü daha sonra oluşum ve T7 endonükleaz sindirim hetero tabi tutulur, 110 bp yukarı yer alan bir ileri primer (F) ve ters primer (R) TALEN bölünme sitesinin. B alt 250 bp) kullanılarak oluşturulur. ° C) tek kurucu hedeflenen genomik bölge içinde TALEN kaynaklı mutagenez sindirim 250 ürün ve 110 baz ile tam uzunlukta PCR ürününün varlığı ile ortaya çıkar.50930/50930fig3highres.jpg "target =" _blank "> büyük resmi görebilmek için buraya tıklayın.

Şekil 4. Hedef lokusunun nükleaz ile indüklenen mutasyon fare Rosa26 lokusu 29 hedef intron 1 içinde bir Xbal kısıtlama alanı için. ZFN özgü taşıma Kurucu hayvanların belirlenmesi için kullanılan PCR ürünleri restriksiyon dijest örneği. A) Kurucular kullanılarak PCR ile taranmıştır genotiplenmesi ileri primer (F) 500 bp üst baş ve ters primer (R) yarılma sitesi. B alt 250 bp) Xbal ile PCR ürünleri sindirim yıldız işareti ile işaretlenmiştir iki alelik mutasyonlarla fareleri () gösteren sindirim desenler ortaya, mono bulunduğu -alelik mutasyon (sindirilmiş ve sindirilmemiş grupları, örneğin, hayvan 2)potansiyel bi-alel değişiklikler ile farelerin ve wt fareler (tam sindirim, örneğin, hayvan 21). C) Dizi 3 (hayvan 24) farklı eklemeler / silmeler kadar gösterir. resmi büyütmek için buraya tıklayın .
| Primer Adı | 'Ila 3' sekans 5 |
| pCR8_F1 | ttgatgcctggcagttccct |
| pCR8_R1 | cgaaccgaacaggcttatgt |
| TAL_F1 | ttggcgtcggcaaacagtgg |
| TAL_R2 | ggcgacgaggtggtcgttgg |
| TAL_Seq_5-1 | catcgcgcaatgcactgac |
Tablo 1. Golden Gate TALEN takımı içinde koloni PCR analizleri ve sekanslama için kullanılan primerlerin dizileriprotokolü.
| Plazmid / Koleksiyon | Iştirakçi | Addgene Kimliği | Yorumlar |
| Golden Gate TALEN ve TAL Efektör Kit 2.0 | Voytas laboratuvar | 1000000024 | Golden Gate TALEN montaj için gerekli tüm plazmidler İçeriyor |
| pCAG-T7-TALEN -KKR/ELD hedef vektörleri | Pelczar laboratuvar | 40131, 40132 | Eklenti, memeli hücreleri ve in vitro mRNA sentezindeki TALEN ifadesi için plazmidler |
Tablo 2. Golden Gate TALEN montaj için gerekli olan plasmidler ve plasmid koleksiyon Addgene (elde edilebilir www.addgene.org ).
| ÇevrimiçiKaynak | Yorumlar |
| http://tale-nt.cac.cornell.edu | Yeten Tasarımı; TALEN hedef dışı tahmini |
| http://zifit.partners.org/ZiFiT/ | Yeten, AÇIK ZFN, CoDA ZFN, CRISPR/Cas9 Tasarımı |
| http://www.genome-engineering.org | Yeten, CRISPR/Cas9 Tasarımı; CRISPR/Cas9 hedef dışı tahmini |
| http://baolab.bme.gatech.edu/Research/BioinformaticTools/assembleTALSequences.html | Yeten Meclisi sıralama sonuçlarının doğrulanması için dizileri |
| http://pgfe.umassmed.edu/ZFPmo dularsearchV2.html | Modüler montaj ZFN tasarımı |
| www.genomecenter.ucdavis.edu/s egallab / segallabsoftware | Modüler montaj ZFN tasarımı |
Tablo 3. ZFN, Yeten, ve CRISPR/Cas9 tasarımı için online kaynaklar.
Tartışmalar
Tasarımcı Nükleaza odaklı genom düzenleme yaklaşımları önemli ölçüde kendi genomları 10,12 hedeflenen değişiklikler için uygun türlerin yelpazesini genişletmiştir. Farelerde, gen hedefleme ES hücrelerinin iki yıldır standart bir teknik olmuştur; fare ES hücreleri, bazı son başarılı olmuştur, ancak bununla birlikte, bu, fare dışındaki türlerden ES hücrelerine adapte zor olduğu kanıtlanmıştır. Hatta böyle EUCOMM, KOMP veya ZFN ve TALEN yüksek hassasiyet olabilir ve değişiklikler yelpazenin ilgili esneklik sağlar tarafından NorCOMM 3 genom düzenleme gibi konsorsiyumlar tarafından sunulan "off-the-raf" gen-hedefli fare ES hücre klonlarının durumu ile fare genomuna sokulur. Nükleaz aracılı mutasyonlar taşıyan Kurucu hayvanların her zaman ES hücrelerinin enjeksiyonu blastosist kaynaklanan kimera için durum böyle değildir yüksek germ-hattı yetkili 4-6,20,21, görünmektedir. Bu nedenle, bazı durumlarda des mikroenjeksiyon inigner nükleazlar hedef genom modifikasyonlarla yeni fare hatları önemli ölçüde daha hızlı üretimi ile sonuçlanabilir.
ZFN ve yetenekleri yeri püskürtülmesiyle knockout farelerde başarılı bir şekilde üretimi enjekte nükleaz çiftinin aktivitesi üzerinde büyük ölçüde bağlıdır. TALENS organizma bir dizi gen geniş bir hedef yüksek başarı oranına sahip olduğu gösterilmiştir; Bununla birlikte, son çalışmalar TALEN bağlayıcı sitozin metilasyon 30,31 duyarlı olduğunu göstermektedir. Böylece, yeni üretilen nükleaz çiftleri, örneğin TALENS pCAG-T7 vektörlerine klonlanır, örneğin NIH-3T3 veya Nöro gibi bir fare hücre hattı içine geçici olarak transfekte edilebilir bir ölçüde fare embriyo kromatin durumunu taklit-2a. Burada, nükleaz aktivitesi önceden mRNA sentezi ve mikroenjeksiyon bölüm 5'de tarif edildiği gibi T7 endonükleaz analizi ya da PCR ürünü bir sınırlama sindirimi kullanan tahmin edilebilir. Bu bağlamda ilgili genomik bölgenin sıralama tavsiyehücre çizgisi ve mikro-enjeksiyon deneyleri için kullanılan fare suşu ive.
Fare zigot, farklı TALEN veya ZFN çiftleri farklı mRNA konsantrasyonlarda en iyi şekilde çalışır ve bu nedenle mikro-enjekte nükleaz mRNA'nın en uygun çalışma konsantrasyonu deneysel olarak tespit edilmesi gerekebilir. Çok yüksek embriyo ölümcül neden olabilir, oysa nükleaz çift bağlı olarak, çok düşük bir konsantrasyonunun bir yarılmaya neden olur. Nukleaz çifti bağlı olarak, 2 ng / ul ve 200 mikrogram / ul gibi yüksek kadar düşük toplam mRNA konsantrasyonları kullanarak başarı oldu. Bu etkiler, hücre kültürü ve embriyo hayatta kalma ve hedef lokusunun modifikasyonu oranı her iki deneysel olarak tespit edilmesi gerekmektedir için optimum konsantrasyon nükleaz deney tahmin etmek güçtür.
Yüksek aktif ZFN veya TALEN mikroenjeksiyon embriyo tek hücreli aşamada ötesinde hedef sekansı ayrılması ve bu nedenle mutagenez An karmaşık kalıpları neden olabilirkurucuları d mozaisizm. Biz ve diğerleri 4, tek bir kurucu (Şekil 5C) üç veya daha fazla farklı mutasyona uğramış allelleri gözlemledik. Bu kurucuları yeni bir fare hattı kurulması Böylece, yavrular dikkatle sindirim deneyler, tanımlanmamış bir mutasyon mevcut tek olduğunu kanıtlar sağlarlar uygun mutasyonun varlığı için sıralanmasıyla taranmalıdır.
Eleştirilerden biri sık sık ZFN ve TALEN sistemlerine karşı dile getirdiği bu nükleazlar da hedef sitelere benzer genomunda başka bir yerde mevcut dizilerini klivajlayabilen olasılığıdır. Bu gibi hedef dışı etkiler homodimerik Fokl alanı kullanarak erken üretimi reaktifleri ile gözlenmiştir ve heterodimer konstruktları hedef dışı etkiler 25 hafifletmek için dizayn edilmiştir. Olası hedef dışı siteleri silico 32,33 bir dereceye kadar öngörülen ve PCR ve dizileme ile taranabilir. Bariz bir avantaj of yerine hücre çizgileri daha farelerin üretilmesi için ZFNs ve TALENS kullanan tercih edilen bir vahşi tip suşu için çeşitli çaprazlamaların gerçekleştirerek arzu edilen genom modifikasyona bağlanmamış hedef mutasyonları kapalı kaldırma olasılığıdır. Kurucu farelerin çok sayıda, nükleaz hedefli lokusundan üretilir ve siliko hedef dışı tahmin edilen PCR ürünlerinin nesil derin sekanslama analizi için noktalar, PCR ürünlerinin sindirim deneyleri için alternatif bir nicel ve nitel okuma sunabilir.
Bu protokol açıklanan yardımla üreme teknikleri gibi C57Bl/6J veya B6D2F1 gibi mikroenjeksiyon deneyleri için kullanılan standart fare suşları için optimize edilmiştir. Bu tür suşlar outbred gibi farklı orijinlerden Fareler, prensip olarak genom düzenleme yaklaşımlar için kullanılabilir ve özel araştırma soru için daha uygun bir genetik arka planı sağlayabilir. Böyle süperovülasyon gibi yardımla üreme tekniklerinin performansı predi olabilirsuşları 34-36 bir dizi cted ama nükleaz mikroenjeksiyon için embriyo yeterli sayıda elde etmek için standart olmayan suşlar için daha fazla optimizasyon gerektirebilir.
ZFN ve Yeten yanı sıra, bu tür RNA-güdümlü CRISPR/Cas9 sistemi 9,37,38 gibi yeni tasarımcı nükleazlar şimdi genom düzenleme uygulamaları için getirilmiştir. Mikroenjeksiyon ve burada tarif edilen kurucu hayvan analiz için tüm yöntemler de CRISPR/Cas9 ve genom düzenleme gelecek modları için de geçerlidir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan ederim.
Teşekkürler
Biz mükemmel teknik yardım için Monika Tarnowska, Cornelia Albrecht, ve Ewa Skoczylas teşekkür etmek istiyorum. Bu çalışma SNF Sinergia hibe CRSI33-125073 PP tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BsaI | NEB | R0535S or L | |
| Esp3I | Thermo Scientific | ER0451 | |
| T4 Ligase | NEB | M0202S or L | |
| Spectinomycin | Sigma | S0692-1ML | |
| Ampicillin | Sigma | A0166 | |
| X-Gal | Sigma | B4252 | |
| IPTG | Sigma | I6758 | |
| Plasmid-Safe nuclease | Epicentre | E3101K | |
| QIAprep Spin Miniprep Kit | Qiagen | 27106 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAquick PCR Purification Kit | Qiagen | 28106 | |
| mMESSAGE mMACHINE T7 Ultra Kit | Invitrogen | AM1345 | |
| NucAway Spin Columns | Invitrogen | AM10070 | |
| RNaseZAP | Sigma | R2020-250ML | |
| NorthernMax Formaldyde Load Dye | Invitrogen | AM8552 | |
| RNA Millennium Markers | Invitrogen | AM7150 | |
| 10x TBE buffer | Thermo Scientific | B52 | |
| T7 endonuclease | NEB | M0302S or L | |
| pGEM-T EasyVector System I | Promega | A3600 | |
| SYBR Green I Nucleic Acid Gel Stain | Invitrogen | S-7563 | |
| pregnant mare's serum gonadotrophin (PMSG) | Sigma | G4877 | |
| human chorionic gonadotropin (hCG) | Sigma | CG5 | |
| M2 embryo culture medium | Sigma | M7167 | |
| M16 embryo culture medium | Sigma | M7292 | |
| Mineral oil, embryo tested | Sigma | M8410 | |
| Ketamine | CentraVet | Ket 201 | |
| Xylazine | Sigma Aldrich | 46995 | |
| Equipment/Tools | |||
| Inverted microscope with Nomarski DIC optics (for example Nikon Eclipse TE200) | Nikon | ||
| Micromanipulator units (for example Narishige, NT88NF) | Narishige | ||
| Embryo holding capillaries | Sutter Instruments | B100-75-10 | |
| Embryo injection capillaries | Narishige | GD-1 | |
| Capillary puller (for example Sutter P97) | Sutter Instruments | ||
| Microforge (for example Narishige MF-900) | Narishige | ||
| Walton skin scissors | FST | 14077-10 | |
| Surgical scissors | FST | 14041-10 | |
| Surgical probe | FST | 10140-03 | |
| Reflex wound clip system (9 mm) | FST | 12031-09 | |
| Reflex wound clips (9 mm) | FST | 12032-09 | |
| Dumont fine forceps 5 | FST | 11254-20 | |
| Moria curved forceps | FST | 11370-31 | |
| Moria fine forceps | FST | 11399-80 | |
| Dietrich bulldog clamp | FST | 18038-45 | |
| C57BL/6J mice | Jackson Labs | strain code 000664 | |
| CD-1 mice | Charles River | strain code 000664 | |
Referanslar
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat. Rev. Genetics. 6, 507-512 (2005).
- Johansson, T., et al. Building a zoo of mice for genetic analyses: a comprehensive protocol for the rapid generation of BAC transgenic mice. Genesis. 48, 264-280 (2010).
- Skarnes, W. C., et al. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Carbery, I. D., et al. Targeted genome modification in mice using zinc-finger nucleases. Genetics. 186, 451-459 (2010).
- Meyer, M., de Angelis, M. H., Wurst, W., Kuhn, R. Gene targeting by homologous recombination in mouse zygotes mediated by zinc-finger nucleases. Proc. Natl. Acad. Sci. U.S.A. 107, 15022-15026 (2010).
- Cui, X., et al. Targeted integration in rat and mouse embryos with zinc-finger nucleases. Nat. Biotechnol. 29, 64-67 (2011).
- Sung, Y. H., et al. Knockout mice created by TALEN-mediated gene targeting. Nat. Biotechnol. 31, 23-24 (2013).
- Wefers, B., et al. Direct production of mouse disease models by embryo microinjection of TALENs and oligodeoxynucleotides. Proc. Natl. Acad. Sci. U.S.A. 110, 3782-3787 (2013).
- Wang, H., et al. One-Step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nat. Rev. Genetics. 11, 636-646 (2010).
- ZFN, T. A. L. E. N. CRISPR/Cas-based methods for genome engineering. Trends Biotechnol. 31, 397-405 (2013).
- Joung, J. K., Sander, J. D. TALENs: a widely applicable technology for targeted genome editing. Nat. Rev. Mol. Cell Biol. 14, 49-55 (2013).
- Cermak, T., et al. Efficient design and assembly of custom TALEN and other TAL effector-based constructs for DNA targeting. Nucleic Acids Res. 39, (2011).
- Reyon, D., et al. FLASH assembly of TALENs for high-throughput genome editing. Nat. Biotechnol. 30, 460-465 (2012).
- Sanjana, N. E., et al. A transcription activator-like effector toolbox for genome engineering. Nat. Protoc. 7, 171-192 (2012).
- Kim, Y., et al. A library of TAL effector nucleases spanning the human genome. Nat. Biotechnol. 31, 251-258 (2013).
- Schmid-Burgk, J. L., Schmidt, T., Kaiser, V., Honing, K., Hornung, V. A ligation-independent cloning technique for high-throughput assembly of transcription activator-like effector genes. Nat. Biotechnol. 31, 76-81 (2013).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat. Biotechnol. 31, 827-832 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat. Biotechnol. 31, 822-826 (2013).
- Hermann, M., et al. Evaluation of OPEN zinc finger nucleases for direct gene targeting of the ROSA26 locus in mouse embryos. PLoS ONE. 7, (2012).
- Meyer, M., Ortiz, O., Hrabe de Angelis, M., Wurst, W., Kuhn, R. Modeling disease mutations by gene targeting in one-cell mouse embryos. Proc. Natl. Acad. Sci. U.S.A. 109, 9354-9359 (2012).
- Doyle, E. L., et al. TAL Effector-Nucleotide Targeter (TALE-NT) 2.0: tools for TAL effector design and target prediction. Nucleic Acids Res. 40, 117-122 (2012).
- Miller, J. C., et al. A TALE nuclease architecture for efficient genome editing. Nat. Biotechnol. 29, 143-148 (2011).
- Guo, J., Gaj, T., Barbas, C. F. Directed evolution of an enhanced and highly efficient FokI cleavage domain for zinc finger nucleases. J. Mol. Biol. 400, 96-107 (2010).
- Doyon, Y., et al. Enhancing zinc-finger-nuclease activity with improved obligate heterodimeric architectures. Nat. Methods. 8, 74-79 (2011).
- Wefers, B., et al. . Current Protocols in Mouse Biology. , (2011).
- Wefers, B., Wurst, W., Kühn, R. . Current Protocols in Mouse Biology. , (2011).
- Haueter, S., et al. Genetic vasectomy-overexpression of Prm1-EGFP fusion protein in elongating spermatids causes dominant male sterility in mice. Genesis. 48, 151-160 (2010).
- Perez-Pinera, P., Ousterout, D. G., Brown, M. T., Gersbach, C. A. Gene targeting to the ROSA26 locus directed by engineered zinc finger nucleases. Nucleic Acids Res. 40, 3741-3752 (2012).
- Bultmann, S., et al. Targeted transcriptional activation of silent oct4 pluripotency gene by combining designer TALEs and inhibition of epigenetic modifiers. Nucleic Acids Res. 40, 5368-5377 (2012).
- Valton, J., et al. Overcoming TALE DNA binding domain sensitivity to cytosine methylation. J. Biol. Chem. 287, 38427-38432 (2012).
- Cradick, T. J., Ambrosini, G., Iseli, C., Bucher, P., McCaffrey, A. P. ZFN-Site searches genomes for zinc finger nuclease target sites and off-target sites. BMC Bioinform. 12, (2011).
- Doyle, E. L., et al. TAL Effector-Nucleotide Targeter (TALE-NT) 2.0: tools for TAL effector design and target prediction. Nucleic Acids Res. 40, 117-122 (2012).
- Byers, S. L., Payson, S. J., Taft, R. A. Performance of ten inbred mouse strains following assisted reproductive technologies (ARTs). Theriogenology. 65, 1716-1726 (2006).
- Luo, C., et al. Superovulation strategies for 6 commonly used mouse strains. J. Am. Assoc. Lab. Animal Sci. 50, 471-478 (2011).
- Pease, S., Saunders, T. L. . International Society for Transgenic Technologies. Advanced protocols for animal transgenesis : an ISTT manual. , (2011).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339, 819-823 (2013).
- Mali, P., et al. RNA-Guided human genome engineering via Cas9. Science. 339, 823-826 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır