A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
في القياسات الكهربية فيفو على الأعصاب ماوس الوركي
In This Article
Summary
قياسات خصائص التوصيل العصبية في الجسم الحي تجسد أداة قوية لتوصيف مختلف النماذج الحيوانية من الأمراض العصبية والعضلية. هنا، نقدم بروتوكول سهلة وموثوقة يمكن من خلالها إجراء تحليل الكهربية على الأعصاب الوركي من الفئران تخدير.
Abstract
تسمح الدراسات الكهربية تصنيف عقلانية لمختلف الأمراض العصبية والعضلية وهي من مساعدة، جنبا إلى جنب مع تقنيات نيوروباثولوغيكال، في فهم الفيزيولوجيا المرضية الكامنة 1. نحن هنا تصف طريقة لإجراء دراسات الكهربية على الماوس الأعصاب الوركي في الجسم الحي.
يتم تخدير الحيوانات مع isoflurane وبغية ضمان تسكين للفئران اختبار ودون عائق بيئة العمل خلال القياسات التي تأخذ حوالي 30 دقيقة / الحيوان. يتم الاحتفاظ درجة حرارة الجسم ثابتة من 37 درجة مئوية بواسطة لوحة التدفئة وقياسها باستمرار من قبل الحرارية التحقيق المستقيم 2. بالإضافة إلى ذلك، يتم تسجيل رسم القلب (ECG) بشكل روتيني خلال القياسات من أجل رصد باستمرار الحالة الفسيولوجية للحيوانات التحقيق.
يتم إجراء التسجيلات الكهربية على العصب الوركي، أكبر العصب من اله الجهاز العصبي المحيطي (السندات الإذنية)، توريد الماوس هند أطرافهم مع مساحات الألياف على حد سواء حركية وحسية. في بروتوكول لدينا، تبقى الأعصاب الوركي في الموقع وبالتالي لا بد من استخراج أو المكشوفة، والسماح القياسات دون أي تهيج العصب السلبية جنبا إلى جنب مع التسجيلات الفعلية. باستخدام أقطاب الإبرة المناسبة 3 نقوم سواء القريبة والبعيدة التحفيز العصبية، التي تنتقل عن طريق تسجيل الامكانيات مع أقطاب في عضلات الساق الاستشعار. بعد معالجة البيانات وموثوقة ومتسقة للغاية القيم لسرعة التوصيل العصبي (NCV) ومجمع إمكانات العمل الحركي (CMAP)، يمكن تحقيق المعايير الأساسية لتقدير إجماليه عمل الأعصاب الطرفية.
Introduction
القياسات الكهربية هي أداة لا غنى عنها لسلامة التحقيق وظيفية من الأعصاب الطرفية في كل من بيئات السريرية والمخبرية. في البشر، وعدد كبير من الاضطرابات العصبية والعضلية والأعصاب تعتمد على القياسات الكهربية في التشخيص. من خلال قياس الخصائص العصبية كما سرعة التوصيل أو سعة المحتملة للإشارة، فمن الممكن أن تميز المنشأ الخام من أمراض الأعصاب الطرفية.
في سرعة التوصيل العصبي تعتمد بشكل كبير على انتشار الإشارة السريعة مكن تكون الميالين. لذلك، تظهر عمليات المزيل عموما انخفضت سرعات التوصيل 4. إمكانية عمل المحرك المركب (CMAP) - ربط مع عدد من المحاور الفنية - هو مؤشر عن الأضرار محور عصبي عندما خفضت بشكل كبير 5.
بالتالي، عن طريق أساليب الكهربية مسببات تلف الأعصاب الطرفيةيمكن أن يكون هناك تمييز، مثل لاعتلال الأعصاب وراثية 6،7، 8،9 الاعتلال العصبي السكري، التهابات مزمنة polyneuropathies المزيل (CIDP) 10، أو اعتلال الأعصاب الأيض 11.
عادة، في تطبيق البشرية ويفضل التسجيلات موسع على العصب الزندي أو الربلي. في الفئران، فإنه واضح ومباشر لتحليل خصائص العصب الوركي الأعصاب، أكبر العصبية في الجهاز العصبي المحيطي (السندات الإذنية) تحتوي على كل كبيرة - والمحاور ذات العيار الصغير من نظام حركية وحسية.
الإجراء كما هو موضح هنا هو طريقة سريعة وسهلة وموثوقة لقياس جميع القيم القياسية ذات الصلة للالكهربية على الأعصاب الطرفية في الماوس سليمة. من خلال اتخاذ التسجيلات من كائن الحفاظ عليها، ويضمن الظروف الفسيولوجية للبيئة العصبية.
Protocol
وقد أجريت هذه الدراسة وفقا لقانون حماية الحيوانات من جمهورية ألمانيا الاتحادية (Tierschutzgesetz دير Bundesrepublik دويتشلاند) وتمت الموافقة من قبل مكتب الدولة تورينغن لسلامة الأغذية وحماية المستهلك (Thüringer Landesamt FÜR Lebensmittelsicherheit اوند Verbraucherschutz).
1. إعداد لأعلى المقاييس
- تخدير الفئران عن طريق isoflurane و/ O 2 استنشاق - لبدء التخدير 3٪، 2٪ للصيانة في isoflurane والأكسجين 100٪ (الشكل 1). تأكيد التخدير كافية عن طريق اختبار ردود الافعال بسيطة مثل ردود الافعال الحركة واختبار حساسية للألم بدرجة منخفضة. فمن المستحسن استخدام مرهم على العينين لمنع جفاف أثناء التخدير ولكن لا غنى عنه لأن الإجراء عادة ما يستغرق 30 دقيقة فقط / الحيوان في المجموع. في حالة البقاء على قيد الحياة تجارب وإدارة الوقت المناسب يعد المسكنات تعمل لإدارة الألم بعد العملية الجراحية.
- حلق الفراء تغطي أطرافه الخلفية مع الحلاقة الكهربائية وإجراء إزالة الشعر مع متاحة تجاريا الشعر كريم إزالة الحيوانات بينما هي بالفعل تحت التسكين. من أجل الحفاظ على الوضع خالية من مسببات الأمراض في جميع أنحاء الداخلي، وارتداء قفازات معقمة واستخدام أدوات دائما تنظيفها بعناية مع الايثانول 70٪.
- الجسم السيطرة على الاستقرار درجة الحرارة عن طريق ردود الفعل التي تسيطر عليها لوحة التدفئة والمستقيم التحقيق الحرارية (الشكل 2). إذا لزم الأمر، يرجى استخدام ثنى العقيمة لتغطية لوحة التدفئة بين الحيوانات من اجل الحفاظ على بيئة معقمة التجريبية. وعلاوة على ذلك، فمن المستحسن استخدام لوحة التدفئة، والتي يتم التحكم إلكترونيا عبر جهاز استشعار متكاملة للحد من درجة حرارة التدفئة ل≤ 40 درجة مئوية وذلك لتجنب تلف الأنسجة.
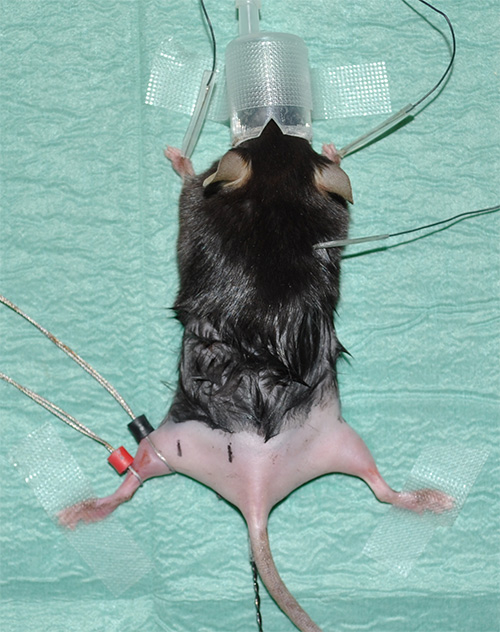
الشكل 1. إكسبالإعداد erimental مبديا الماوس تخدير مع أطرافه الخلفية حليق. - اتخاذ كهربية (ECG) تسجيلات لرصد معدل ضربات القلب كمعلمة حيوية. تثبيت ثلاثة أقطاب للتسجيلات ECG على النحو التالي: القطب واحد تحت الجلد كل forelimb والقطب واحد تحت الجلد في منطقة الرقبة.
- أقطاب مكان حلقة باستخدام هلام الاتصال لالأمثل المقاومة الموصلية / نقل. يوضع القطب الاستشعار (المسمى في الأسود) في موقف حيث عضلة الساق لديه الحد الأقصى قطرها. يوضع القطب المرجعية (المشار إليها باللون الأحمر) فقط تحت القطب الاستشعار عن بعد.
ملاحظة: يرجى الاطلاع على "جدول المواد" للحصول على تفاصيل المعدات. - بمناسبة المواضع الصحيحة القياس مع مسافات محددة سلفا ولكن متناسقة بين الداني والقاصي تحفيز العصب الوركي والقطب الرصاص. اقتراح التجريبية: على مسافة 4 ملم من القطب الاستشعار عن بعد، فإن التحفيز القاصي تأخذ مكان.في مسافة 16 ملم إلى القطب الاستشعار عن بعد، وسيتم تنفيذ التحفيز القريبة من (الشكل 2).

الشكل 2. صورة الممثل تبين حالة تجريبية قبيل بداية القياسات. يشير السهم الأبيض موقف الاستشعار (أسود) والإشارة (الحمراء) الكهربائي في عضلة الساق من أطرافه الخلفية اليسرى. سيتم تنفيذ التحفيز بواسطة إبرة كهربائية في مواقف محددة فيما يتعلق القطب الاستشعار سوداء. نقطة من التحفيز البعيدة (علامة سوداء مع "س" في أطرافهم الخلفيتين اليسرى) لديها مسافة 4 ملم من القطب الاستشعار؛ مكان التحفيز الداني (علامة سوداء مع "فرع فلسطين") هو 16 ملم بعيدا. خط أحمر على أطرافهم هند الحق يظهر تقريبا آي ميت بالطبع التشريحية للعصب الوركي. علاوة على ذلك، يتم عرض مواقف الخام من العضلات الخلفية أطرافهم ذات الصلة والمعالم. العلامة النجمية يشير التحقيق الحرارية المستقيم.
2. القياس
- المبدأ: تنفيذ سلسلة من التحفيز العصبية مع إنشاؤها بشكل متكرر واحد البقول مربع موجة من 0.1 ميللي ثانية مدتها عن طريق أقطاب المتاح إبرة 28 G أحادي القطب (معدل الرسوب 200 ميللي ثانية، وانظر الشكل 3A). لتحليل البيانات خارج الخط، فمن المستحسن للحصول على إشارات في وقت واحد جنبا إلى جنب مع تحفيز منحنى استجابة ظيفة العصبية والعضلية (الشكل 3B) وذلك بسبب تحفيز العصب. متوسط سلسلة من ردود القصوى ("ممثل العصبي العضلي استجابة ظيفة") لتحليل البيانات اللاحقة. من أجل إنتاج بيانات موثوق بها، وسجل متوسط في وقت لاحق لا يقل عن 3 مستقلة، منحنيات الاستجابة المثلى لكل موقع التحفيز والحيوانية.
p_upload/51181/51181fig3highres.jpg "سرك =" / files/ftp_upload/51181/51181fig3.jpg "/>
الرقم 3. الإجراءات للحصول على البيانات وتحليلها (العرض التخطيطي). يتم تطبيق النبضات المتولدة بتكرار إلى العصب الوركي عبر أقطاب الإبرة (الصف العلوي في الشكل 3A). في وقت واحد، يتم تسجيل العديد من المنحنيات المقابلة استجابة العصبية والعضلية (الصف السفلي في الشكل 3A). عندما بلغ متوسط وتضخيم، منحنيات الاستجابة العصبية والعضلية بسبب البقول التحفيز (الصف العلوي في الشكل 3B) تظهر الخصائص التالية مميزة (الصف السفلي في الشكل 3B): الكمون للاستجابة إشارة وكذلك تتم الإشارة إلى المدة والسعة للإشارة، ويمكن يمكن الحصول على حسابات وإحصاءات اللاحقة. التوصيل إشارة غير النظامية و / أو تسجيلات الأمثل يؤدي عادة في مختلف التشوهات إشارة مع أكثر من واحد فقط الإيجابية والسلبية انحراف واحد أو إشارة تشوه(شكل النسقين) مع انخفاض السعة (الشكل 3C). - أداء التحفيز الداني مع القطب إبرة في موقف العزم ("ملاحظة" في الشكل 2).
- من أجل تحقيق أفضل ظروف التسجيل مع أقصى سعة، تصور منحنيات الاستجابة الفعلية في وقت واحد في عملية التحفيز. من خلال القيام بذلك، المجرب يكون قادرا على تقييم شكل منحنيات الاستجابة فضلا عن حجم السعة على الفور.
- إذا لزم الأمر، وقليلا بعناية التلاعب الموقف و / أو زاوية الإبرة التحفيز فيما يتعلق العصب الوركي. هذا التحسين لطيف من الظروف التحفيز يسمح الوصول إلى سعة مستمر مع أكبر قيمة ممكنة ومنحنى استجابة شكل ثنائي الطور نموذجي (الشكل 4).
- أداء التحفيز القاصي مع القطب إبرة في موقف العزم ("س" في الشكل 2).
- بعد completioن القياس، ونقل الماوس اختبارها لقفص منفصل حتى استعاد وعيه أنها كافية للحفاظ على الاستلقاء القصية. لا تترك حيوان غير المراقب في الشركة والحيوانات الأخرى حتى تعافى تماما من التخدير. إدارة الوقت المناسب يعد المسكنات تعمل لإدارة الألم بعد العملية الجراحية. ينصح الإدارة النظامية من العقاقير المضادة للالتهابات (المسكنات) والمواد الأفيونية لمدة 1-3 أيام.
- بدلا من ذلك، تضحية الماوس لا يزال تخدير بطريقة سريعة وإنسانية دون أي ألم للحيوان مزيد، مثلا عن طريق خلع الرقبة.
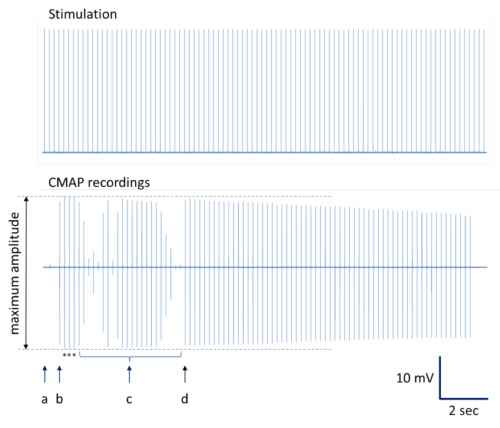
الشكل 4. توضيحات لتحديد تسجيلات CMAP مع أقصى سعة. يتم تقديم سلسلة كاملة تسجيل. (أ ) نقطة الإدراج مع الحد الأدنى من الاستجابة CMAP. (ب) نتائج الحركة تحفيز طفيف إبرة في التسجيلات CMAP مع أقصى سعة. (ج) تغييرات إضافية في موضع إبرة إنتاج تسجيلات CMAP مع سعة مختلفة بما في ذلك شبه أقصى سعة. (د) تحفيز استبدال إبرة مع المسلسل التسجيلات CMAP القريبة من أقصى سعة. ملاحظة: يمكن أن يحدث إنقاص النموذجية في سعة CMAP خلال التحفيز المتكرر في موقع التحفيز الأمثل 12، 13. العلامات النجمية تشير التسجيلات CMAP مع أقصى سعة لليصور المتوسط.
3. تحليل
- استخراج المعلمات التوصيل العصبي يعتمد على ممثل العصبي العضلي مجموعة البيانات استجابة ظيفة باستخدام حزمة البرامج المناسبة (على سبيل المثال AtisaPro).
ملاحظة: يرجى تحديد التعامل مع البيانات المتعلقة الوقت مع رعاية خاصة لتحديد نقطة انعطاف من مجمع عاء عمل المحركential (CMAP) بداية وإنهاء يمكن أن يكون صعبا. ويرد الإجراء مع استنساخ التحقق في الشكل 3B، حيث تستخدم الظلال على الانحرافات إشارة بعد بداية وقبل الإنهاء. - حساب 'الكمون إشارة "والقيم" CMAP'.
- الكمون 'يمثل التأخير الزمني بين التحفيز وCMAP بداية، في حين أن الفترة الزمنية بين ظهور CAMP من انحراف سلبي الأولي المبدئي العودة إلى ما يسمى خط الأساس' مدة CMAP '. استخدام الفرق بين الإختفاء القاصي والداني لحساب سرعة التوصيل مع المسافة بين المواقع التحفيز القاصي والداني.
سرعة التوصيل = الكمون / المسافة بين المواقع التحفيز - يمثل CMAP '(مجمع إمكانات العمل الحركي) حجم السعة القصوى بين نقطة التحول الإيجابية والسلبية للإشارة CMAP (بالنظر في بالسيارات).
'نقطة تحول إيجابية' CMAP = القيمة - قيمة 'سلبية تحول بوالباحث '
- الكمون 'يمثل التأخير الزمني بين التحفيز وCMAP بداية، في حين أن الفترة الزمنية بين ظهور CAMP من انحراف سلبي الأولي المبدئي العودة إلى ما يسمى خط الأساس' مدة CMAP '. استخدام الفرق بين الإختفاء القاصي والداني لحساب سرعة التوصيل مع المسافة بين المواقع التحفيز القاصي والداني.
النتائج
أجرينا سلسلة من القياسات الكهربية في الجسم الحي على الأعصاب الوركي من 12 الفئران في مجموع لهذه الدراسة: 6 الحيوانات من كل من الجنسين. أجريت القياسات مع بروتوكول المقدمة وتسليم النتائج التالية:
عرض كل من الفئران الذكور والإ...
Discussion
يوفر بروتوكول صفها وسيلة سهلة وموثوقة لتحديد العصب الوركي خصائص التوصيل على الفئران تخدير دون الحاجة لفضح العصب من الفائدة. ومع ذلك، فإن هذا الإجراء التجريبي يسبب إصابات الأنسجة عن طريق ثقب الإبرة. وبالتالي فإنه هو خيار معقول للتضحية الحيوانات بعد الانتهاء من التسج...
Disclosures
والكتاب ليس لديهم ما يكشف.
Acknowledgements
وأيد هذا العمل من قبل SFB 604، DFG MO 1421/2-1 وKrebshilfe 107089 (لجلالة). وكما هو حاصل على جائزة الباحث الصغير من ورم الأطفال مؤسسة (نيويورك، الولايات المتحدة الأمريكية).
Materials
| Name | Company | Catalog Number | Comments |
| Concentric Needle Electrodes (Stimulation) | Natus Medical Incorporated, San Carlos, CA, USA | 9013S0901 | |
| Digital Ring Electrodes (Recording) | Natus Medical Incorporated, San Carlos, CA, USA | 9013S0302 | |
| ToM - Tower of Measurement (A/D converter) | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| AtisaPro, data acquisition and analysis software | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| HSE-Stimulator T | Hugo Sachs Elektronik, Hugstetten, Germany |
References
- Kimura, J. 3rd ed. Electrodiagnosis in Diseases of Nerve and Muscle. , (2001).
- Rutkove, S. B. Effects of temperature on neuromuscular electrophysiology. Muscle Nerve. 24, 867-882 (2001).
- Xia, R. H., Yosef, N., Ubogu, E. E. Dorsal caudal tail and sciatic motor nerve conduction studies in adult mice: technical aspects and normative data. Muscle Nerve. 41, 850-856 (2010).
- Zielasek, J., Martini, R., Toyka, K. V. Functional abnormalities in P0-deficient mice resemble human hereditary neuropathies linked to P0 gene mutations. Muscle Nerve. 19, 946-952 (1996).
- Raynor, E. M., Ross, M. H., Shefner, J. M., Preston, D. C. Differentiation between axonal and demyelinating neuropathies: identical segments recorded from proximal and distal muscles. Muscle Nerve. 18, 402-408 (1995).
- Pareyson, D., Scaioli, V., Laura, M. Clinical and electrophysiological aspects of Charcot-Marie-Tooth disease. Neuromol. Med. 8, 3-22 (2006).
- Schulz, A., et al. Merlin isoform 2 in neurofibromatosis type 2-associated polyneuropathy. Nat. Neurosci. 16, 426-433 (2013).
- Lamontagne, A., Buchthal, F. Electrophysiological studies in diabetic neuropathy. J. Neurol. Neurosurg. Psychiatry. 33, 442-452 (1970).
- Andersen, H., Nielsen, J. F., Nielsen, V. K. Inability of insulin to maintain normal nerve function during high-frequency stimulation in diabetic rat tail nerves. Muscle Nerve. 17, 80-84 (1994).
- Magda, P., et al. Comparison of electrodiagnostic abnormalities and criteria in a cohort of patients with chronic inflammatory demyelinating polyneuropathy. Arch. Neurol. 60, 1755-1759 (2003).
- Lindberg, R. L., et al. Motor neuropathy in porphobilinogen deaminase-deficient mice imitates the peripheral neuropathy of human acute porphyria. J. Clin. Invest. 103, 1127-1134 (1999).
- Massey, J. M. Electromyography in disorders of neuromuscular transmission. Sem. Neurol. 10, 6-11 (1990).
- Stalberg, E., Falck, B. The role of electromyography in neurology. Electroencephalogr. Clin. Neurophysiol. 103, 579-598 (1997).
- Osuchowski, M. F., Teener, J., Remick, D. Noninvasive model of sciatic nerve conduction in healthy and septic mice: reliability and normative data. Muscle Nerve. 40, 610-616 (2009).
- Oh, S. S., Hayes, J. M., Sims-Robinson, C., Sullivan, K. A., Feldman, E. L. The effects of anesthesia on measures of nerve conduction velocity in male C57Bl6/J mice. Neurosci. Lett. 483, 127-131 (2010).
- Dilley, A., Lynn, B., Pang, S. J. Pressure and stretch mechanosensitivity of peripheral nerve fibres following local inflammation of the nerve trunk. Pain. 117, 462-472 (2005).
- Vleggeert-Lankamp, C. L., et al. Electrophysiology and morphometry of the alpha- and beta-fiber populations in the normal and regenerating rat sciatic nerve. Exp. Neurol. 187, 337-349 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved