このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウス坐骨神経に生体内電気生理学的測定値の
要約
インビボでの神経伝導特性の測定は、神経筋疾患の種々の動物モデルを特徴づける強力なツールを例示する。ここでは、麻酔したマウスの坐骨神経に対する電気生理学的分析を実施することのできる、簡単で信頼性の高いプロトコルを提示する。
要約
電気生理学的研究は、基礎となる病態生理1の理解を、一緒に神経病理学的技術と、様々な神経筋疾患の合理的な分類を可能にし、助けている。ここでは、 生体内でのマウスの坐骨神経に電気生理学的研究を行うための方法が記載されている。
動物は約30分/動物を取り、測定中に試験したマウスと邪魔されずに作業環境のための鎮痛を確保するために、イソフルランで麻酔する。 37℃の一定の体温は、加熱プレートによって保持され、連続的に、直腸サーモプローブ2によって測定される。さらに、心電図(ECG)が日常的に連続的に調査した動物の生理学的状態を監視するために、測定中に記録される。
電気生理学的記録は、坐骨神経、目の最大の神経で実行されます運動の感覚の両方繊維路でマウス後肢を供給E、末梢神経系(PNS)。我々のプロトコルでは、坐骨神経は、その場に残り、したがって、抽出または露出されている必要はありませんが、実際の録音と一緒に不利な神経の炎症のない測定が可能。適切な針電極3を使用して、我々は腓腹筋で検出電極を用いて送信ポテンシャルを登録し、近位および遠位の神経刺激の両方を行う。データ処理の後、信頼性が高く、神経伝導速度(NCV)および化合モータ活動電位(CMAP)のために高度に一貫した値、総末梢神経機能の定量化のための重要なパラメータは、達成することができる。
概要
電気生理学的測定は、臨床および実験室環境の両方で、末梢神経の機能的完全性を調査するための不可欠なツールである。ヒトでは、神経筋障害および神経障害の多くは、診断電気生理学的測定に依存しています。伝導速度、または信号の電位振幅のような神経の特性を測定することにより、末梢神経疾患の大まかな起源を特徴付けることが可能である。
神経伝導速度は髄鞘では有効になって急速な信号伝播に大きく依存している。そのため、脱髄プロセスは、一般伝導速度を4減のショー。化合モータ活動電位(CMAP) -機能軸索の数と相関が-かなり5に減少軸索損傷の指標である。
したがって、電気生理学的方法により末梢神経損傷の病因そのような遺伝性神経障害6,7、糖尿病性神経障害8,9、慢性炎症性脱髄性多発ニューロパシー(CIDP)10、または代謝性ニューロパシー11として、識別することができる。
通常、ヒトへの適用に腓腹または尺骨神経上の非侵襲的記録が好ましい。そして運動の感覚系の小口径の軸索 - マウスにおいて、坐骨神経の神経性、大型の両方を含む末梢神経系(PNS)の最大の神経を分析することは簡単である。
ここに示されているように手順がそのままマウスの末梢神経に電気生理学に関連するすべての標準的な値を測定するためには、迅速、簡単かつ信頼できる方法である。保存生物から録音を取ることによって、神経環境の生理学的条件が保証されています。
プロトコル
本研究は、ドイツ連邦共和国の動物保護法(Tierschutzgesetzデル·ドイツ連邦共和国)に従って行ったし、食品安全·消費者保護(テゥーリンガーLandesamtエリーゼLebensmittelsicherheitウントVerbraucherschutz)がチューリンゲン州政府によって承認された。
1。測定の設定
- イソフルラン/ O 2吸入によりマウスを麻酔-麻酔3%の開始のために、100%酸素中のメンテナンスを2%イソフルラン( 図1)。このような動きの反射神経と低悪性度の痛みに対する感度のテストのような単純な反射神経をテストすることによって、十分な麻酔を確認してください。手順は、通常、合計でわずか30分/動物がかかるため、麻酔中の乾燥を防ぐために、目に軟膏を使用することが推奨されますが、必須ではない。生存実験の場合には、術後疼痛を管理するためのタイムリーな長い作用する鎮痛薬を投与する。
- 電気かみそりで後肢をカバー毛皮を剃ると動物が鎮痛下に既にある間、市販の脱毛クリームで脱毛を行います。作業中は病原体を含まない状態を維持するために、無菌手袋を着用し、常に慎重に70%エタノールで洗浄楽器を使用しています。
- フィードバック制御された加熱プレートおよび直腸サーモプローブ( 図2)により制御体温の安定性。必要に応じて、無菌実験環境を維持するために、動物の間の熱板をカバーするために、滅菌ドレープを使用してください。さらに、組織の損傷を回避するために40°Cを≤ために加熱温度を制限するために統合されたセンサを介して電子的に制御される加熱プレートを使用することが推奨される。
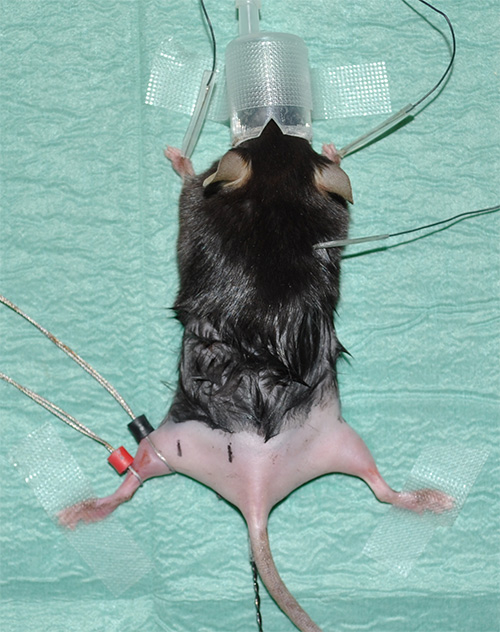
図1。経験剃毛後肢で麻酔マウスを示すerimentalセットアップ。 - 重要なパラメータとして心拍数を監視する心電図(ECG)記録を取る。各前肢の皮膚の下に一方の電極と首領域内の皮膚の下に一つの電極を次のようにECG記録のための3つの電極を取り付けます。
- 最適な導電率/抵抗転写用コンタクトゲルを使用して行わリング電極。 (黒色で表示)感知電極は、腓腹筋がその最大直径を有する位置に配置されている。 (赤色で表示)参照電極は単に感知電極の下に配置されている。
注意:機器の詳細については、「素材の表」を参照してください。 - 近位および遠位の坐骨神経刺激とリード電極との間に所定のが、一貫性のある距離の測定の正確な位置をマークします。実験的な提案は:検知電極から4mmの距離では、遠位の刺激が行われる。感知電極へ16mmの距離では、近位刺激( 図2)を実施する。

図2。直前の測定値の先頭に実験状況を示す代表的な画像。白い矢印は、センシング(黒)と基準(赤)左後肢の腓腹筋の電極の位置を示している。針電極による刺激は、黒検知電極に関連して定義された位置で行われる。遠位刺激のポイント(左後肢に「DS」でブラックマーク)は、検知電極から4ミリメートルの距離が、近位の刺激(「PS」でブラックマーク)の場所が離れて16ミリメートルである。右後肢の赤い線は、約を示しています坐骨神経の解剖学コースをimate。さらに、関連する後肢の筋肉の大まかな位置はランドマークとして表示されます。アスタリスクは、直腸サーマルプローブを示している。
2。測定
- 原則:単極使い捨て28 G針電極により0.1ミリ秒の持続時間の繰り返し生成された単一の方形波パルスで神経刺激のシリーズを実行します(繰り返しレート200ミリ、 図3(a)参照 )。オフラインデータ分析のために、同時にによる神経刺激に対する神経筋機能応答曲線( 図3B)と一緒に刺激信号を取得することが推奨される。平均その後のデータ解析のための最大応答のシリーズ(「代表的な神経筋機能応答」)。信頼性の高いデータ、レコードおよびそれ以降平均刺激部位および動物あたり少なくとも3つの独立した、最適な応答曲線を生成するため。
p_upload/51181/51181fig3highres.jpg "SRC =" / files/ftp_upload/51181/51181fig3.jpg "/>
データ収集と分析のための図3。手順(概略図)。繰り返し発生するパルスは、針電極を介して、坐骨神経( 図3A上段)に適用されます。同時に、いくつかの対応する神経応答曲線( 図3Aの下段)に記録されている。平均化され、拡大された場合には、刺激パルスに起因する神経筋応答曲線( 図3(b)の上段)は、次の特性( 図3(b)の下段)を示しています。信号応答のレイテンシだけでなく、信号の持続時間と振幅を示したことができているその後の計算および統計を得ることが。不規則な信号伝導および/または準最適な録音は通常は1の正と負たわみや変形信号よりも様々な信号の変形につながる減少した振幅( 図3C)と(二峰形状)。 - 決定された位置での針状電極( 図2の「PS」)と近位の刺激を実行します。
- 最大振幅が最適な記録条件を達成するために、刺激の処理に同時実際の応答曲線を可視化。そうすることにより、実験者は直ちに応答曲線の形状並びに振幅の大きさを評価することができる。
- 必要に応じて、若干、慎重に位置および/または坐骨神経に関して刺激針の角度を操作します。刺激条件のこの穏やかな最適化が可能な最大値と、典型的な二相性形状( 図4)の応答曲線を一定の振幅に達することができます。
- 決定された位置( 図2の「DS」)に針電極を遠位刺激を実行します。
- completio後に測定のN、それは胸骨横臥位を維持するのに十分な意識を取り戻したまでは別々のケージにテストされ、マウスを転送します。それは完全に麻酔から回復するまで無人と他の動物の会社で動物を放置しないでください。術後疼痛を管理するためのタイムリーな長い演技鎮痛薬を管理します。非ステロイド性抗炎症薬(NSAID)およびオピオイドの全身投与は、1〜3日に推奨される。
- 代わりに、首の脱臼などによって動物のためのこれ以上の痛み、せずに、迅速かつ人道的なやり方で、まだ麻酔したマウスを生け贄に捧げる。
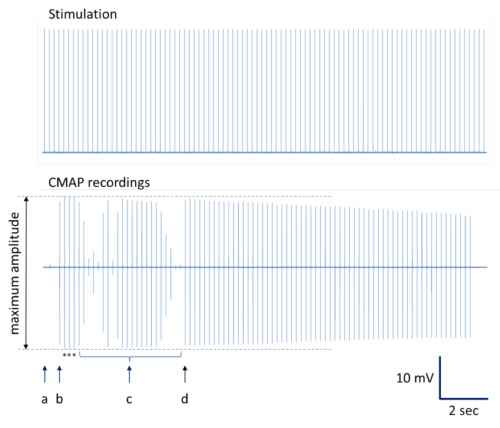
図4。最大振幅とCMAPの録音を決定するためのイラスト。完全な登録シリーズが発表されている。 (A )挿入ポイント。 (b)は、わずかな刺激針の動きは、最大振幅のCMAP記録をもたらす。 (C)針配置の追加の変更がほぼ最大振幅を含む様々な振幅のCMAPの録音を生産する。ほぼ最大振幅のシリアルCMAPの録音と(d)の刺激針の交換。注意:CMAP振幅の典型的な減少量は、最適な刺激部位12、13で反復刺激中に発生する可能性があります。アスタリスクは、平均化に描かれた最大振幅でCMAP記録を示している。
3。分析
- 適切なソフトウェアパッケージ( 例えば、AtisaPro)を用いて、代表的な神経筋機能応答データセットに基づいて神経伝導パラメータを抽出する。
注:特別な注意を払って時間に関連するデータ判定を処理してくださいので、化合モーターアクションポットの変曲点決定差動(CMAP)開始と終了が困難な場合があります。検証、再現性の手順は、発症後および終了前の信号たわみに接線が使用されている。図3(b)に示す。 - '信号の待ち時間'と 'CMAP'値を計算します。
- レイテンシーCMAP持続時間 ''初期陰性波のキャンプ発症の間の時間間隔がベースラインに戻った当初のに対し、刺激とCMAP発症の間の時間遅延を表すが呼び出されます '。遠位および近位の刺激部位間の距離と共に伝導速度を計算するために遠位端と近位待ち時間との差を使用する。
刺激部位間の伝導速度=レイテンシー/距離 - CMAP '(化合モータ活動電位)振幅(mV単位で与えられる)CMAP信号の最大の正および負の折り返し点との間の大きさを表す。
CMAP = value 'の正の方向転換点」 -値'負のターンアラウンドPOINT '
- レイテンシーCMAP持続時間 ''初期陰性波のキャンプ発症の間の時間間隔がベースラインに戻った当初のに対し、刺激とCMAP発症の間の時間遅延を表すが呼び出されます '。遠位および近位の刺激部位間の距離と共に伝導速度を計算するために遠位端と近位待ち時間との差を使用する。
結果
各性別の6匹の動物:我々は、この研究のため、合計で12匹のマウスの坐骨神経にin vivoでの電気生理学的測定のシリーズを行った。測定は、提示されたプロトコルを用いて実施し、以下の結果が配信された。
両方の雄および雌のマウスは、約20m /秒の平均坐骨神経伝導速度( 図5)を表示する。これは、文献中の他の測定値と一致する。さらに、雄?...
ディスカッション
記載されたプロトコールは、関心のある神経を露出することなく、麻酔したマウスに坐骨神経伝導特性を決定するための簡単で信頼できる方法を提供する。それにもかかわらず、この実験手順は、針穿刺による組織損傷の原因となる。したがって、録音を終えた後、動物を犠牲にする合理的な選択肢である。しかし、従来の記録に神経の露出を必要とする他のより侵襲的な処置と比較し?...
開示事項
著者らは、開示することは何もありません。
謝辞
この作品は、SFB 604、DFGミズーリ1421/2-1とKrebshilfe 107089(HM)によりサポートされていました。 ASは、子供の腫瘍財団(米国ニューヨーク州)からの若手研究者賞を受賞です。
資料
| Name | Company | Catalog Number | Comments |
| Concentric Needle Electrodes (Stimulation) | Natus Medical Incorporated San Carlos, CA 94070, USA | 9013S0901 | |
| Digital Ring Electrodes (Recording) | Natus Medical Incorporated San Carlos, CA 94070, USA | 9013S0302 | |
| ToM - Tower of Measurement (A/D converter) | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| AtisaPro, Data acquisition & analysis software | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| HSE-Stimulator T | Hugo Sachs Elektronik, Hugstetten, Germany | ||
参考文献
- Kimura, J. 3rd ed. Electrodiagnosis in Diseases of Nerve and Muscle. , (2001).
- Rutkove, S. B. Effects of temperature on neuromuscular electrophysiology. Muscle Nerve. 24, 867-882 (2001).
- Xia, R. H., Yosef, N., Ubogu, E. E. Dorsal caudal tail and sciatic motor nerve conduction studies in adult mice: technical aspects and normative data. Muscle Nerve. 41, 850-856 (2010).
- Zielasek, J., Martini, R., Toyka, K. V. Functional abnormalities in P0-deficient mice resemble human hereditary neuropathies linked to P0 gene mutations. Muscle Nerve. 19, 946-952 (1996).
- Raynor, E. M., Ross, M. H., Shefner, J. M., Preston, D. C. Differentiation between axonal and demyelinating neuropathies: identical segments recorded from proximal and distal muscles. Muscle Nerve. 18, 402-408 (1995).
- Pareyson, D., Scaioli, V., Laura, M. Clinical and electrophysiological aspects of Charcot-Marie-Tooth disease. Neuromol. Med. 8, 3-22 (2006).
- Schulz, A., et al. Merlin isoform 2 in neurofibromatosis type 2-associated polyneuropathy. Nat. Neurosci. 16, 426-433 (2013).
- Lamontagne, A., Buchthal, F. Electrophysiological studies in diabetic neuropathy. J. Neurol. Neurosurg. Psychiatry. 33, 442-452 (1970).
- Andersen, H., Nielsen, J. F., Nielsen, V. K. Inability of insulin to maintain normal nerve function during high-frequency stimulation in diabetic rat tail nerves. Muscle Nerve. 17, 80-84 (1994).
- Magda, P., et al. Comparison of electrodiagnostic abnormalities and criteria in a cohort of patients with chronic inflammatory demyelinating polyneuropathy. Arch. Neurol. 60, 1755-1759 (2003).
- Lindberg, R. L., et al. Motor neuropathy in porphobilinogen deaminase-deficient mice imitates the peripheral neuropathy of human acute porphyria. J. Clin. Invest. 103, 1127-1134 (1999).
- Massey, J. M. Electromyography in disorders of neuromuscular transmission. Sem. Neurol. 10, 6-11 (1990).
- Stalberg, E., Falck, B. The role of electromyography in neurology. Electroencephalogr. Clin. Neurophysiol. 103, 579-598 (1997).
- Osuchowski, M. F., Teener, J., Remick, D. Noninvasive model of sciatic nerve conduction in healthy and septic mice: reliability and normative data. Muscle Nerve. 40, 610-616 (2009).
- Oh, S. S., Hayes, J. M., Sims-Robinson, C., Sullivan, K. A., Feldman, E. L. The effects of anesthesia on measures of nerve conduction velocity in male C57Bl6/J mice. Neurosci. Lett. 483, 127-131 (2010).
- Dilley, A., Lynn, B., Pang, S. J. Pressure and stretch mechanosensitivity of peripheral nerve fibres following local inflammation of the nerve trunk. Pain. 117, 462-472 (2005).
- Vleggeert-Lankamp, C. L., et al. Electrophysiology and morphometry of the alpha- and beta-fiber populations in the normal and regenerating rat sciatic nerve. Exp. Neurol. 187, 337-349 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved