Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В Vivo Электрофизиологические измерения на мышь седалищного нервов
В этой статье
Резюме
Измерения нервных свойств проводимости в естественных условиях примером мощный инструмент для характеристики различных животных моделях нервно-мышечных заболеваний. Здесь мы представляем простой и надежный протокол, по которому электрофизиологические анализ на седалищного нервов наркозом мышей может быть выполнено.
Аннотация
Электрофизиологические исследования позволяют рациональную классификацию различных нервно-мышечных заболеваний и помощи вместе с нейропатологических методов, в понимании патофизиологии 1. Здесь мы опишем метод для выполнения электрофизиологические исследования по мыши седалищного нервов в естественных условиях.
Животных анестезируют изофлураном, чтобы обеспечить обезболивание для тестируемых мышей и спокойно рабочей среды во время измерений, которые принимают около 30 мин / животное. Постоянная температура тела 37 ° С поддерживают с помощью нагревательной плиты и постоянно измеряется с помощью ректального термо датчика 2. Кроме того, записывается обычно электрокардиограммы (ЭКГ) во время измерений в целях постоянного мониторинга физиологического состояния исследуемых животных.
Электрофизиологические записи выполняются на седалищный нерв, крупнейший нерв-гоэ периферической нервной системы (ПНС), поставляя мыши задних конечностей с обоими двигательных и сенсорных путей волокна. В нашем протоколе, седалищного нервов остаются на месте и, следовательно, не должны быть извлечены или подвергается, позволяя измерения без каких-либо неблагоприятных нервных раздражений наряду с фактическими записями. С использованием соответствующих электродов иглы 3 мы выполнять как проксимального и дистального нервные стимуляции, регистрации переданные потенциалы с электродами зондирования в икроножных мышцах. После обработки данных, надежным и последовательные значения для скорости нервной проводимости (NCV) и соединение двигатель потенциала действия (СМАР), ключевые параметры для количественного определения общей функционирования периферических нервов, может быть достигнута.
Введение
Электрофизиологические измерения являются незаменимым инструментом для исследования функциональной целостности периферических нервов в клинических и лабораторных условиях. В организме человека большое количество нервно-мышечных нарушений и невропатии диагностически полагаться на электрофизиологических измерений. Измеряя нервные свойства, как скорость проводимости или потенциальных амплитуд сигнала, можно охарактеризовать грубую происхождение периферических нервных заболеваний.
Скорость нервной проводимости сильно зависит от быстрого распространения сигнала включен по миелинизации. Таким образом, демиелинизирующие процессы, как правило показывают снизилась скорости проводимости 4. Соединение двигателя потенциал действия (CMAP) - коррелирует с числом функциональных аксонов - является показателем повреждением аксонов, когда значительно снижается 5.
Таким образом, с помощью электрофизиологических методов этиология повреждения периферических нервовможно отличить, например, для наследственных невропатий 6,7, диабетической невропатии, 8,9 хронических воспалительных демиелинизирующих полиневропатии (ПРИК) 10, или метаболические невропатии 11.
Как правило, в человеческом применения предпочтительны неинвазивные записи на икроножной или локтевого нерва. У мышей, несложно проанализировать нервные свойства седалищного нервов, самый большой нерв периферической нервной системы (ПНС), содержащий как большая - и малокалиберных аксоны двигательного и сенсорной системы.
Процедура, как показано здесь быстрый, легкий и надежный способ измерить все стандартные значения имеют значение для электрофизиологии на периферических нервов в неповрежденной мыши. Принимая записи с сохранившейся организма, физиологические условия среды нерва гарантированы.
протокол
Настоящее исследование было проведено в соответствии с Закона о защите животных Федеративной Республики Германии (Tierschutzgesetz дер Bundesrepublik Deutschland) и был одобрен Государственным ведомством Тюрингии по безопасности пищевых продуктов и защите прав потребителей (Thüringer Landesamt für Lebensmittelsicherheit унд Verbraucherschutz).
1. Настройка системы измерения
- Обезболить мышей на изофлюран / O 2 ингаляции - для начала анестезии 3%, для обслуживания 2% изофлуран в 100% кислорода (рис. 1). Подтверждение достаточных анестезии путем тестирования простые рефлексы, такие как рефлексов движения и тестирования чувствительности для низкосортного боли. Использование мази на глазах, чтобы предотвратить сухость во время анестезии рекомендуется, но не является необходимым, так как процедура обычно занимает всего 30 мин / животное в общей сложности. В случае экспериментов выживания, управлять своевременным больше действующих анальгетиков для управления послеоперационной боли.
- Бритье мех, покрывающий задние конечности с электрической бритвой и выполнять депиляцию с коммерчески доступным крема удаления волос в то время как животные уже под обезболивания. В целях поддержания патогена статуса страны, свободной на протяжении всей процедуры, носить асептические перчатки и всегда использовать инструменты тщательно очищены с 70% этанола.
- Контроль тела температурная стабильность на обратной контролируется нагревательной пластины и прямой кишки термо зонда (рис. 2). Если необходимо, использовать стерильную драпировку, чтобы покрыть нагревательную пластину между животными, чтобы сохранить стерильное экспериментальную среду. Кроме того, рекомендуется использовать нагревательную пластину, которая электронным управлением через встроенным датчиком ограничить температуру нагрева до ≤ 40 ° C, чтобы избежать повреждения тканей.
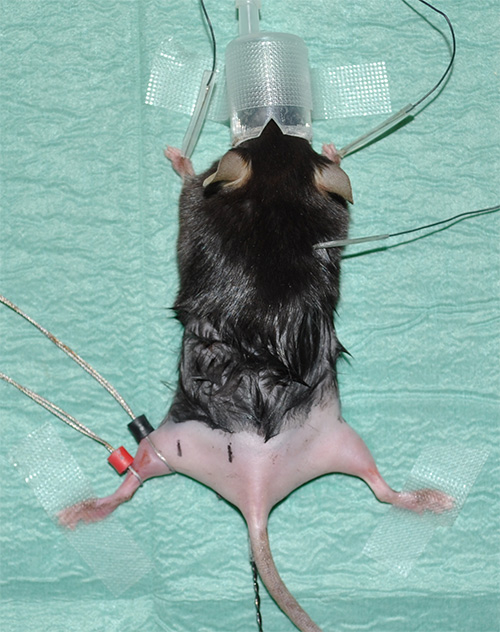
Рисунок 1. EXPerimental установки, показывающий наркозом мышь с бритыми задних конечностей. - Возьмите электрокардиографию (ЭКГ) записи для мониторинга сердечного ритма в качестве жизненно важного параметра. Установка три электрода для ЭКГ следующим образом: один электрод под кожу каждой передней конечности и одного электрода под кожу в области шеи.
- Место кольцевые электроды, использующие контактные гель для оптимального сопротивления теплопроводности / передачи. Чувствительный электрод (обозначены черным цветом) помещается в положение, в котором икроножной мышцы имеет свой максимальный диаметр. Электрод (обозначена красным) помещают непосредственно под чувствительным электродом.
Примечание: см. "Материал стол« Подробнее оборудования. - Отметить правильные позиции измерения с заданными но последовательных расстояний между ближним и дальним седалищного стимуляции нерва и ведущего электрода. Экспериментальная предложение: На расстоянии 4 мм от чувствительного электрода, дальний стимуляция состоится.На расстоянии 16 мм от чувствительного электрода, ближний стимуляция будет осуществляться (рис. 2).

Рисунок 2. Представитель картина показывает экспериментальную ситуацию непосредственно перед началом измерений. Белая стрелка указывает на положение зондирования (черный) и ссылки (красный) электрода в икроножной мышцы левой задней конечности. Стимуляция игольчатых электродов будет выполняться в определенных положениях по отношению к черным чувствительного электрода. Дело в дистальной стимуляции (черный знак с «ДС» в левой задней конечности) имеет расстояние 4 мм от чувствительного электрода; место ближайшего стимуляции (черной метки с "PS") составляет 16 мм от отеля. Красная линия на правой задней конечности показывает прибл Imate анатомическую ход седалищного нерва. Кроме того, грубые позиции соответствующих мышц задних конечностей показаны в качестве ориентиров. Звездочка указывает ректального теплового зонда.
2. Измерение
- Принцип: Выполните серию нервных раздражений с повторно генерируемых одиночных прямоугольных импульсов 0,1 мсек по монополярными одноразовых игл электродов 28 г (Рейтинг повторения 200 мс; см. рисунок 3А). Для анализа данных в автономном режиме, рекомендуется одновременно приобрести стимуляции сигналы вместе с нервно-мышечной кривой функция отклика (рис. 3В) из-за стимуляции нерва. Нормальное серию максимальных ответов ("представитель нервно-мышечной функции отклика") для последующего анализа данных. Для получения достоверных данных, запись и позже средних не менее 3 независимых, оптимальные кривые отклика на стимуляции сайте и животных.
p_upload/51181/51181fig3highres.jpg "Первоначально" / files/ftp_upload/51181/51181fig3.jpg "/>
Рисунок 3. Порядок сбора и анализа (Схематическое представление). Повторно генерируемых импульсов применяются к седалищного нерва с помощью игольчатых электродов (верхний ряд на фиг.3А). Одновременно несколько Соответствующие кривые реагирования нервно-мышечной записываются (нижний ряд в фигуре 3А). При среднем и вознес, нервно-мышечные, кривые счет стимуляции импульсами (верхний ряд на фигуре 3В) показать следующие характерные свойства (нижний ряд на рисунке 3b) латентность ответа сигнала, а также продолжительность и амплитуда сигнала обозначены и может быть получены для последующих расчетов и статистики. Нерегулярное проведение сигнала и / или неоптимальных записи обычно приводят в различных сигнальных деформаций с больше, чем просто один положительный и один отрицательный отклонения или деформации сигнала(Бимодальная форма) с пониженной амплитудой (рис. 3C). - Выполните ближний стимуляцию с игольчатым электродом в определенном положении ("PS" на рисунке 2).
- Для достижения наилучших условий записи с максимальными амплитудами, визуализировать фактические кривые отклика одновременно с процессом стимуляции. Таким образом, экспериментатор может немедленно оценить форму кривых отклика, а также размер амплитуды.
- Если необходимо, слегка и осторожно манипулировать положение и / или угол стимуляции иглы по отношению к седалищного нерва. Этот нежный оптимизация условий стимуляции позволяет достичь постоянные амплитуды с максимально возможным значением и кривой отклика типичного двухфазной форме (рис. 4).
- Выполните дистального стимуляцию с игольчатым электродом в определенном положении ("DS" на рисунке 2).
- После completioн измерения, передать тестирование мышь для отдельной клетке, пока он не пришел в достаточной сознание поддерживать грудины лежачее положение. Не оставляйте животное без присмотра и в компании других животных, пока он не полностью оправился от анестезии. Администрирование своевременное больше действующих анальгетиков для управления послеоперационной боли. Системное введение нестероидных противовоспалительных препаратов (НПВП) и опиоидов рекомендуется в течение 1-3 дней.
- Кроме того, пожертвовать еще под наркозом мышь быстро и гуманно без какой-либо дополнительной боли для животного, например, путем шеи дислокации.
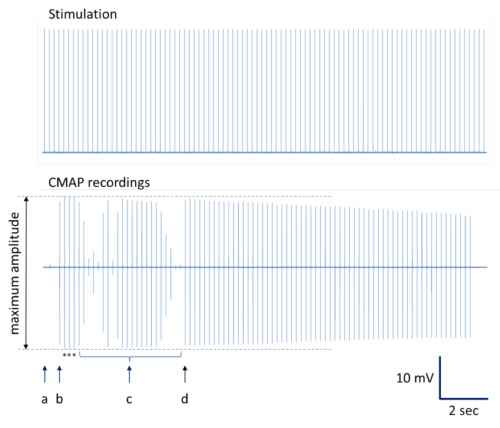
Рисунок 4. Иллюстрация для определения записи CMAP с наибольшими амплитудами. Полная серия регистрация представлен. ( ) Точка вставки с минимальными ответ СМАР. (Б) результаты движения Незначительные стимуляция иглы в CMAP записей с максимальными амплитудами. (С) Дополнительные изменения в размещения иглы производят CMAP записи с разными амплитудами в том числе рядом-максимум амплитуд. (Г) Стимуляция замена игла с серийными CMAP записи почти максимальных амплитуд. Примечание: Типичное уменьшение в CMAP амплитуд может произойти во время ритмической стимуляции при оптимальной стимуляции сайте 12, 13. Звездочки указывают CMAP записи с максимальными амплитудами изображенных для усреднения.
3. Анализ
- Выписка нервные параметры проводимости на основе репрезентативной нервно-мышечной набора данных функция реагирования с использованием соответствующего программного пакета (например AtisaPro).
Примечание: Пожалуйста, обращайтесь определение данных, связанных со временем с особой тщательностью, так как точка перегиба определение соединения двигателя действий горшокциальному (CMAP) начало и прекращение может быть затруднено. Процедура с проверенной воспроизводимости приведена на рисунке 3В, где используются касательные на сигнальных отклонений после начала и до завершения. - Рассчитать 'латентность сигнала "и значения" CMAP'.
- Задержка 'представляет собой временную задержку между стимуляции и СМАР начала, в то время как промежуток времени между CAMP наступления начальной отрицательное отклонение первоначального возвращения в базовый называется "CMAP продолжительность. Использование разницу между дистальным и проксимальным задержек для расчета скорость проводимости вместе с расстоянием между дистальным и проксимальным сайтов стимуляции.
скорость проведения = задержка / расстояние между стимуляции сайтов - CMAP '(соединение потенциал двигателя действие) амплитуда представляет величину между максимальной положительной и отрицательной точки оборота сигнала СМАР (приведенный в мВ).
CMAP = значение "положительным моментом поворот" - отрицательный поворот Ро значение 'внутр '
- Задержка 'представляет собой временную задержку между стимуляции и СМАР начала, в то время как промежуток времени между CAMP наступления начальной отрицательное отклонение первоначального возвращения в базовый называется "CMAP продолжительность. Использование разницу между дистальным и проксимальным задержек для расчета скорость проводимости вместе с расстоянием между дистальным и проксимальным сайтов стимуляции.
Результаты
Мы провели серию в естественных условиях электрофизиологических измерений на седалищного нервов 12 мышей в общей сложности для этого исследования: 6 животных каждого пола. Измерения проводились с представленной протокола и доставлены следующие результаты:
И му...
Обсуждение
Описанный протокол обеспечивает простой и надежный метод определения седалищного нерва свойства проводимости на наркозом мышей без необходимости подвергать нерв интерес. Тем не менее, это экспериментальная процедура вызывает повреждение тканей путем прокола. Поэтому разумным вари?...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Эта работа была поддержана SFB 604, DFG МО 1421/2-1 и Krebshilfe 107089 (к HM). AS является получателем премии для молодых исследователей из Детской опухоли Foundation (Нью-Йорк, США).
Материалы
| Name | Company | Catalog Number | Comments |
| Concentric Needle Electrodes (Stimulation) | Natus Medical Incorporated, San Carlos, CA, USA | 9013S0901 | |
| Digital Ring Electrodes (Recording) | Natus Medical Incorporated, San Carlos, CA, USA | 9013S0302 | |
| ToM - Tower of Measurement (A/D converter) | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| AtisaPro, data acquisition and analysis software | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| HSE-Stimulator T | Hugo Sachs Elektronik, Hugstetten, Germany |
Ссылки
- Kimura, J. 3rd ed. Electrodiagnosis in Diseases of Nerve and Muscle. , (2001).
- Rutkove, S. B. Effects of temperature on neuromuscular electrophysiology. Muscle Nerve. 24, 867-882 (2001).
- Xia, R. H., Yosef, N., Ubogu, E. E. Dorsal caudal tail and sciatic motor nerve conduction studies in adult mice: technical aspects and normative data. Muscle Nerve. 41, 850-856 (2010).
- Zielasek, J., Martini, R., Toyka, K. V. Functional abnormalities in P0-deficient mice resemble human hereditary neuropathies linked to P0 gene mutations. Muscle Nerve. 19, 946-952 (1996).
- Raynor, E. M., Ross, M. H., Shefner, J. M., Preston, D. C. Differentiation between axonal and demyelinating neuropathies: identical segments recorded from proximal and distal muscles. Muscle Nerve. 18, 402-408 (1995).
- Pareyson, D., Scaioli, V., Laura, M. Clinical and electrophysiological aspects of Charcot-Marie-Tooth disease. Neuromol. Med. 8, 3-22 (2006).
- Schulz, A., et al. Merlin isoform 2 in neurofibromatosis type 2-associated polyneuropathy. Nat. Neurosci. 16, 426-433 (2013).
- Lamontagne, A., Buchthal, F. Electrophysiological studies in diabetic neuropathy. J. Neurol. Neurosurg. Psychiatry. 33, 442-452 (1970).
- Andersen, H., Nielsen, J. F., Nielsen, V. K. Inability of insulin to maintain normal nerve function during high-frequency stimulation in diabetic rat tail nerves. Muscle Nerve. 17, 80-84 (1994).
- Magda, P., et al. Comparison of electrodiagnostic abnormalities and criteria in a cohort of patients with chronic inflammatory demyelinating polyneuropathy. Arch. Neurol. 60, 1755-1759 (2003).
- Lindberg, R. L., et al. Motor neuropathy in porphobilinogen deaminase-deficient mice imitates the peripheral neuropathy of human acute porphyria. J. Clin. Invest. 103, 1127-1134 (1999).
- Massey, J. M. Electromyography in disorders of neuromuscular transmission. Sem. Neurol. 10, 6-11 (1990).
- Stalberg, E., Falck, B. The role of electromyography in neurology. Electroencephalogr. Clin. Neurophysiol. 103, 579-598 (1997).
- Osuchowski, M. F., Teener, J., Remick, D. Noninvasive model of sciatic nerve conduction in healthy and septic mice: reliability and normative data. Muscle Nerve. 40, 610-616 (2009).
- Oh, S. S., Hayes, J. M., Sims-Robinson, C., Sullivan, K. A., Feldman, E. L. The effects of anesthesia on measures of nerve conduction velocity in male C57Bl6/J mice. Neurosci. Lett. 483, 127-131 (2010).
- Dilley, A., Lynn, B., Pang, S. J. Pressure and stretch mechanosensitivity of peripheral nerve fibres following local inflammation of the nerve trunk. Pain. 117, 462-472 (2005).
- Vleggeert-Lankamp, C. L., et al. Electrophysiology and morphometry of the alpha- and beta-fiber populations in the normal and regenerating rat sciatic nerve. Exp. Neurol. 187, 337-349 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены