É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Em Medidas Vivo eletrofisiológicos nos nervos ciático Rato
Neste Artigo
Resumo
Medições das propriedades de condução nervosa em vivo exemplificar uma ferramenta poderosa para caracterizar vários modelos animais de doenças neuromusculares. Aqui, apresentamos um protocolo de fácil e confiável pelo qual análise eletrofisiológica em nervo ciático de ratos anestesiados pode ser realizada.
Resumo
Estudos electrofisiológicos permitir uma classificação racional de várias doenças neuromusculares e são de ajuda, em conjunto com técnicas de neuropatológicos, na compreensão da patofisiologia subjacente 1. Aqui nós descrevemos um método para realizar estudos eletrofisiológicos no nervo ciático de rato in vivo.
Os animais são anestesiados com isoflurano, a fim de assegurar a analgesia para os ratinhos testados e não perturbada ambiente de trabalho durante as medições que levam cerca de 30 min / animal. A temperatura corporal constante de 37 ° C é mantida por uma placa de aquecimento e medida continuamente por uma sonda térmica rectal 2. Além disso, um eletrocardiograma (ECG) é rotineiramente registrada durante as medições, a fim de monitorar continuamente o estado fisiológico dos animais investigados.
Registros eletrofisiológicos são executadas no nervo ciático, o maior nervo do the sistema nervoso periférico (SNP), fornecendo o membro posterior do rato com feixes de fibras tanto motoras e sensoriais. No nosso protocolo, os nervos ciáticos permanecer in situ e, portanto, não têm de ser extraídos ou exposto, permitindo medições sem qualquer irritação nervosas adversas juntamente com gravações reais. Usando eletrodos de agulha apropriadas 3 realizamos tanto proximal e distal estímulos nervosos, registrar os potenciais de transmissão com eletrodos de sensoriamento no músculo gastrocnêmio. Após o processamento de dados, de confiança e valores altamente consistentes para a velocidade de condução nervosa (NCV) e do composto potencial de ação motor (CMAP), os principais parâmetros para a quantificação do funcionamento dos nervos periféricos bruto, pode ser alcançado.
Introdução
Medidas eletrofisiológicas são uma ferramenta indispensável para a investigação da integridade funcional dos nervos periféricos, tanto em ambientes clínicos e laboratoriais. Em seres humanos, um grande número de desordens neuromusculares e neuropatias diagnóstico dependem de medições electrofisiológicas. Ao medir as propriedades como velocidade de condução do nervo ou potenciais amplitudes do sinal, é possível caracterizar a origem áspero de doenças dos nervos periféricos.
A velocidade de condução nervosa é altamente dependente de propagação do sinal rápida ativada por mielinização. Portanto, os processos desmielinizantes geralmente apresentam diminuição velocidades de condução 4. O composto potencial de ação motor (CMAP) - correlacionando-se com o número de axônios funcionais - é um indicador de dano axonal quando reduziu significativamente 5.
Assim, por meio de métodos electrofisiológicos da etiologia da lesão do nervo periféricopode ser discriminado, tal como para as neuropatias hereditárias, neuropatia diabética 6,7 8,9, polineuropatias inflamatórias crónicas desmielinizantes (PDIC) 10, ou neuropatias metabólicas 11.
Normalmente, na aplicação humana são os preferidos gravações não-invasivos no nervo sural ou ulnar. Em camundongos, é muito simples para analisar propriedades nervosas do nervo ciático, o maior nervo do sistema nervoso periférico (SNP), contendo tanto grandes - e axônios de pequeno calibre do sistema motor e sensorial.
O procedimento como demonstrado aqui é um método rápido, fácil e confiável para medir todos os valores padrão relevantes para eletrofisiologia em nervos periféricos no rato intacto. Ao tomar gravações de um organismo preservados, são garantidas condições fisiológicas do ambiente do nervo.
Protocolo
O presente estudo foi realizado de acordo com a Lei de Proteção dos Animais da República Federal da Alemanha (Bundesrepublik Deutschland Tierschutzgesetz der) e foi aprovada pela Secretaria de Estado da Turíngia para a Segurança Alimentar e Defesa do Consumidor (Thüringer Landesamt für Lebensmittelsicherheit und Verbraucherschutz).
1. Definir as Medidas
- Anestesiar os ratos por isoflurano / O 2 inalação - para a iniciação de anestesia 3%, para a manutenção de 2% de isoflurano em 100% de oxigénio (Figura 1). Confirme anestesia suficientes, testando os reflexos simples, como reflexos de movimento e teste de sensibilidade para a dor de baixo grau. O uso de pomada para os olhos para evitar o ressecamento durante a anestesia é recomendada, mas não indispensável, pois o procedimento normalmente leva apenas 30 min / animal no total. Em caso de experimentos de sobrevivência, administrar mais oportuna analgésicos de acção para controlar a dor pós-operatória.
- Raspar a pele que cobre as patas traseiras com um barbeador elétrico e realizar depilação com um creme de depilação disponíveis no mercado enquanto que os animais já estão sob analgesia. A fim de manter o status de livre de patógenos durante todo o procedimento, use luvas de assepsia e sempre utilizar instrumentos cuidadosamente limpos com etanol 70%.
- Controle de estabilidade de temperatura do corpo por uma placa de aquecimento controlado de feedback e sonda térmica retal (Figura 2). Se necessário, utilize um campo estéril para cobrir a placa de aquecimento entre os animais, a fim de manter um ambiente estéril experimental. Além disso, recomenda-se usar uma placa de aquecimento, o qual é controlado electronicamente por meio de um sensor integrado para limitar a temperatura de aquecimento para ≤ 40 ° C, a fim de evitar danos no tecido.
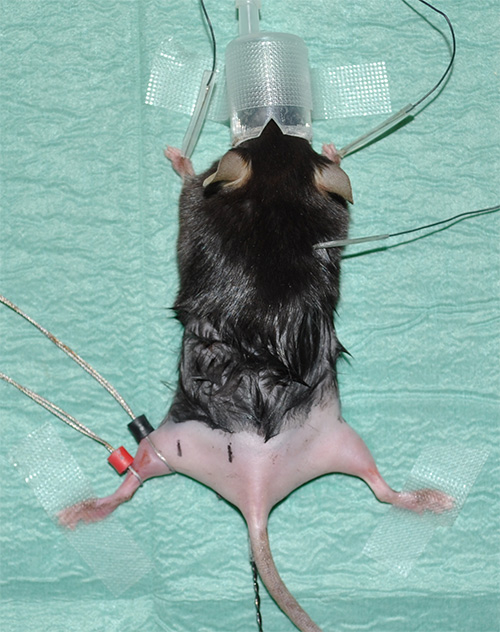
Figura 1. Expconfiguração erimental mostrando um rato anestesiado com membros posteriores raspadas. - Tome eletrocardiograma (ECG) para monitorar a freqüência cardíaca como um parâmetro vital. Instalar três eléctrodos para ECG, como segue: um eléctrodo sob a pele de cada um dos membros anteriores e um eléctrodo sob a pele na área do pescoço.
- Eletrodos coloque o anel usando contato gel para ótima resistência condutividade / transferência. O eléctrodo de detecção (rotulado de preto) é colocado na posição em que o músculo do gastrocnémio tem o seu diâmetro máximo. O eletrodo de referência (indicado em vermelho) é colocado logo abaixo do eletrodo de detecção.
Nota: Por favor, veja 'table material' para obter detalhes de equipamentos. - Marque as posições corretas de medição com pré-determinados, mas consistentes distâncias entre o proximal e distal a estimulação do nervo ciático eo eletrodo de chumbo. Proposta Experimental: A uma distância de 4 mm do eletrodo sensor, o estímulo distal ocorrerá.A uma distância de 16 mm e o eléctrodo de detecção, a estimulação proximal será realizado (Figura 2).

Figura 2. Imagem representativas mostrando a situação experimental apenas antes do inicio das medições. A seta branca indica a posição do meio de detecção (preto) e referência (vermelho) do eléctrodo no músculo gastrocnémio da pata posterior esquerda. A estimulação por eléctrodos de agulha vai ser realizada em posições definidas em relação ao eléctrodo de detecção preto. O ponto de estímulo distal (marca preta com "DS" no membro posterior esquerdo) tem uma distância de 4 mm do eletrodo sensor; o lugar da estimulação proximal (marca preta com "ps") é 16 milímetros de distância. A linha vermelha na pata traseira direita mostra a aproximadamente Imate curso anatômica do nervo ciático. Além disso, as posições aproximadas de músculos dos membros posteriores relevantes são mostrados como pontos de referência. O asterisco indica que a sonda térmica retal.
2. Medição
- Princípio: Realizar uma série de estímulos nervosos com repetitivamente gerados pulsos de 0,1 ms de duração por monopolar descartáveis eletrodos de agulha 28 g de onda quadrada simples (taxa de repetição de 200 ms; ver Figura 3A). Para a análise de dados fora de linha, é recomendado para adquirir simultaneamente sinais de estimulação, juntamente com a curva de resposta da função neuromuscular (Figura 3B), devido à estimulação do nervo. Média, uma série de respostas máximas ("representante resposta função neuromuscular") para posterior análise de dados. A fim de produzir dados confiáveis, ficha e posteriormente média pelo menos três curvas de resposta independentes, ótimo por local de estimulação e animal.
p_upload/51181/51181fig3highres.jpg "src =" / files/ftp_upload/51181/51181fig3.jpg "/>
Figura 3. Procedimento para a aquisição de dados e análise (representação esquemática). Impulsos repetitivos gerados são aplicados para o nervo isquiático através de eléctrodos em agulha (linha superior na Figura 3A). Simultaneamente, várias curvas de resposta neuromuscular correspondentes são registadas (linha inferior na Figura 3A). Quando a média e ampliada, as curvas de resposta neuromuscular devido a pulsos de estimulação (linha superior na Figura 3B) mostram as seguintes propriedades características de linha inferior (na Figura 3B): Latência da resposta do sinal, bem como a duração e a amplitude do sinal estão indicados e pode ser obtido para cálculos e estatísticas posteriores. Condução de sinal irregular e / ou gravações com qualidade inferior normalmente resulta em várias deformações de sinal com mais do que apenas um positivo e outro negativo deflexão ou deformação do sinal(Forma bimodal) com amplitude reduzida (Figura 3C). - Realizar estimulação proximal com um eléctrodo de agulha na posição determinada ("MA" na Figura 2).
- A fim de alcançar melhores condições de gravação com amplitudes máximas, visualizar as curvas de resposta reais em simultâneo com o processo de estimulação. Ao fazê-lo, o experimentador é capaz de avaliar imediatamente a forma das curvas de resposta, assim como o tamanho da amplitude.
- Se necessário, ligeiramente e cuidadosamente manipular a posição e / ou o ângulo da agulha em relação à estimulação do nervo ciático. Esta optimização suave condições de estimulação permite atingir amplitudes constantes com o maior valor possível, e uma curva de resposta de forma típica bifásica (Figura 4).
- Realizar estimulação distal com um eléctrodo de agulha na posição determinada ("DS" na Figura 2).
- Após completion da medição, transferir o mouse testado para uma gaiola separada até que ele recuperou a consciência suficiente para manter decúbito esternal. Não deixe um animal autônoma e na companhia de outros animais até que ele está totalmente recuperado da anestesia. Administrar oportuna mais analgésicos de acção para controlar a dor pós-operatória. A administração sistêmica de medicamentos anti-inflamatórios não esteróides (AINE) e opióides são recomendados para 1-3 dias.
- Alternativamente, sacrificar o mouse ainda anestesiados de forma rápida e mais humanos, sem dor para o animal, por exemplo, por deslocamento cervical.
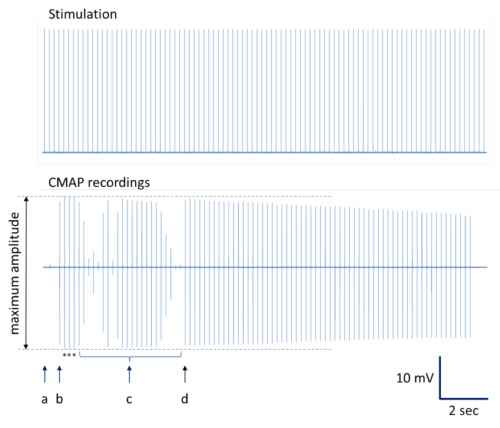
Figura 4. Ilustração para determinar as gravações CMAP com amplitudes máximas. Uma série de registo completo é apresentado. (Um ) Ponto de inserção com resposta mínima CMAP. (B) os resultados do movimento agulha estimulação leve em gravações CMAP com amplitudes máximas. (C) mudanças adicionais na colocação da agulha produzir gravações CMAP com diferentes amplitudes, incluindo quase máxima amplitudes. (D) Estimulação substituição da agulha com gravações CMAP série de amplitudes quase máximos. Nota: decremento típica em amplitudes CMAP pode ocorrer durante a estimulação repetitiva no local estimulação óptima 12, 13. Os asteriscos indicam gravações CMAP com amplitudes máximas representadas por média.
3. Análise
- Extraia parâmetros de condução nervosa com base no conjunto neuromuscular representante resposta função de dados usando um pacote de software adequado (por exemplo, AtisaPro).
Nota: lidar com a determinação de dados relacionados com o tempo, com um cuidado especial, pois a determinação do ponto de inflexão do composto pot ação motoracial (CMAP) início e término pode ser difícil. Um procedimento com reprodutibilidade verificado é dado na Figura 3B, onde são usados tangentes sobre desvios de sinal após o início e antes do término. - Calcular 'latência de sinal "e valores" CMAP'.
- Latência 'representa o intervalo de tempo entre estímulo e CMAP início, ao passo que o intervalo de tempo entre o início da CAMP deflexão negativa inicial para rubricar retorno à linha de base é chamado de' duração CMAP '. Utilizar a diferença entre latências distais e proximais para calcular a velocidade de condução junto com a distância entre sítios de estimulação proximal e distal.
A velocidade de condução = latência / distância entre sítios de estimulação - CMAP '(composto potencial de ação motor) amplitude representa a magnitude entre o ponto de viragem máximo positivo e negativo do sinal de CMAP (dada em mV).
CMAP = value 'positivo ponto de viragem "- valor" negativo po reviravoltaint '
- Latência 'representa o intervalo de tempo entre estímulo e CMAP início, ao passo que o intervalo de tempo entre o início da CAMP deflexão negativa inicial para rubricar retorno à linha de base é chamado de' duração CMAP '. Utilizar a diferença entre latências distais e proximais para calcular a velocidade de condução junto com a distância entre sítios de estimulação proximal e distal.
Resultados
Foi realizada uma série de medições in vivo eletrofisiológicos no nervo ciático de 12 ratos no total para este estudo: 6 animais de cada sexo. As medições foram realizadas com o protocolo apresentado e entregues os seguintes resultados:
Ambos os ratos machos e fêmeas exibir uma velocidade de condução do nervo ciático média de cerca de 20 m / s (Figura 5). Isto é consistente com outras medidas na literatura. Além disso, mostra que não há diferen...
Discussão
O protocolo descrito fornece um método fácil e confiável para determinar propriedades de condução do nervo ciático em ratos anestesiados, sem a necessidade de expor o nervo de interesse. No entanto, este procedimento experimental provoca lesão tecidual por punção da agulha. Por isso, é uma opção razoável para sacrificar os animais depois de terminar as gravações. No entanto, em comparação com outros procedimentos invasivos que exigem a exposição do nervo antes da gravação, o dano tecidual é compara...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo SFB 604, DFG MO 1421/2-1 e Krebshilfe 107089 (para HM). AS é destinatário de um Prêmio Jovem Investigador de Tumor das Crianças Foundation (Nova York, EUA).
Materiais
| Name | Company | Catalog Number | Comments |
| Concentric Needle Electrodes (Stimulation) | Natus Medical Incorporated, San Carlos, CA, USA | 9013S0901 | |
| Digital Ring Electrodes (Recording) | Natus Medical Incorporated, San Carlos, CA, USA | 9013S0302 | |
| ToM - Tower of Measurement (A/D converter) | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| AtisaPro, data acquisition and analysis software | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| HSE-Stimulator T | Hugo Sachs Elektronik, Hugstetten, Germany |
Referências
- Kimura, J. 3rd ed. Electrodiagnosis in Diseases of Nerve and Muscle. , (2001).
- Rutkove, S. B. Effects of temperature on neuromuscular electrophysiology. Muscle Nerve. 24, 867-882 (2001).
- Xia, R. H., Yosef, N., Ubogu, E. E. Dorsal caudal tail and sciatic motor nerve conduction studies in adult mice: technical aspects and normative data. Muscle Nerve. 41, 850-856 (2010).
- Zielasek, J., Martini, R., Toyka, K. V. Functional abnormalities in P0-deficient mice resemble human hereditary neuropathies linked to P0 gene mutations. Muscle Nerve. 19, 946-952 (1996).
- Raynor, E. M., Ross, M. H., Shefner, J. M., Preston, D. C. Differentiation between axonal and demyelinating neuropathies: identical segments recorded from proximal and distal muscles. Muscle Nerve. 18, 402-408 (1995).
- Pareyson, D., Scaioli, V., Laura, M. Clinical and electrophysiological aspects of Charcot-Marie-Tooth disease. Neuromol. Med. 8, 3-22 (2006).
- Schulz, A., et al. Merlin isoform 2 in neurofibromatosis type 2-associated polyneuropathy. Nat. Neurosci. 16, 426-433 (2013).
- Lamontagne, A., Buchthal, F. Electrophysiological studies in diabetic neuropathy. J. Neurol. Neurosurg. Psychiatry. 33, 442-452 (1970).
- Andersen, H., Nielsen, J. F., Nielsen, V. K. Inability of insulin to maintain normal nerve function during high-frequency stimulation in diabetic rat tail nerves. Muscle Nerve. 17, 80-84 (1994).
- Magda, P., et al. Comparison of electrodiagnostic abnormalities and criteria in a cohort of patients with chronic inflammatory demyelinating polyneuropathy. Arch. Neurol. 60, 1755-1759 (2003).
- Lindberg, R. L., et al. Motor neuropathy in porphobilinogen deaminase-deficient mice imitates the peripheral neuropathy of human acute porphyria. J. Clin. Invest. 103, 1127-1134 (1999).
- Massey, J. M. Electromyography in disorders of neuromuscular transmission. Sem. Neurol. 10, 6-11 (1990).
- Stalberg, E., Falck, B. The role of electromyography in neurology. Electroencephalogr. Clin. Neurophysiol. 103, 579-598 (1997).
- Osuchowski, M. F., Teener, J., Remick, D. Noninvasive model of sciatic nerve conduction in healthy and septic mice: reliability and normative data. Muscle Nerve. 40, 610-616 (2009).
- Oh, S. S., Hayes, J. M., Sims-Robinson, C., Sullivan, K. A., Feldman, E. L. The effects of anesthesia on measures of nerve conduction velocity in male C57Bl6/J mice. Neurosci. Lett. 483, 127-131 (2010).
- Dilley, A., Lynn, B., Pang, S. J. Pressure and stretch mechanosensitivity of peripheral nerve fibres following local inflammation of the nerve trunk. Pain. 117, 462-472 (2005).
- Vleggeert-Lankamp, C. L., et al. Electrophysiology and morphometry of the alpha- and beta-fiber populations in the normal and regenerating rat sciatic nerve. Exp. Neurol. 187, 337-349 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados