Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
En Vivo mesures électrophysiologiques sur les nerfs sciatiques souris
Dans cet article
Résumé
Les mesures de propriétés de conduction nerveuses in vivo illustrent un outil puissant pour caractériser différents modèles animaux de maladies neuromusculaires. Ici, nous présentons un protocole simple et fiable qui analyse électrophysiologique sur les nerfs sciatiques des souris anesthésiées peut être effectuée.
Résumé
Les études électrophysiologiques permettent une classification rationnelle des diverses maladies neuromusculaires et sont de l'aide, ainsi que des techniques neuropathologiques, dans la compréhension de la physiopathologie sous-jacente 1. Nous décrivons ici une méthode pour réaliser des études électrophysiologiques sur les nerfs sciatiques de souris in vivo.
Les animaux sont anesthésiés avec de l'isoflurane, afin d'assurer une analgésie pour les souris testées et perturbées environnement de travail au cours des mesures qui ont environ 30 min / animal. A température constante de 37 ° C est maintenue par une plaque de chauffage et de mesure en continu par une sonde thermo rectale 2. En outre, un électrocardiogramme (ECG) est régulièrement enregistré au cours des mesures afin de surveiller en permanence l'état physiologique des animaux étudiés.
Des enregistrements électrophysiologiques sont effectués sur le nerf sciatique, le plus grand nerf de ee système nerveux périphérique (SNP), en fournissant le membre postérieur de la souris avec des faisceaux de fibres à la fois motrices et sensorielles. Dans notre protocole, les nerfs sciatiques rester in situ et par conséquent n'ont pas besoin d'être extrait ou exposé, ce qui permet des mesures sans aucune irritation des nerfs indésirables avec des enregistrements réels. En utilisant des électrodes à aiguilles appropriées 3, nous effectuons tous les deux proximale et distale stimulations nerveuses, l'enregistrement des potentiels transmises avec des électrodes de détection à muscles jumeaux. Après traitement des données, fiable et valeurs très cohérentes pour la vitesse de conduction nerveuse (NCV) et le composé potentiel d'action du moteur (CMAP), les paramètres clés pour la quantification de fonctionnement brut de nerf périphérique, peuvent être atteints.
Introduction
Mesures électrophysiologiques sont un outil indispensable pour étudier l'intégrité fonctionnelle des nerfs périphériques dans des environnements cliniques et de laboratoire. Chez l'homme, un grand nombre de troubles neuromusculaires et des neuropathies diagnostic repose sur des mesures électrophysiologiques. En mesurant les propriétés nerveuses que la vitesse de conduction et l'amplitude possibles du signal, il est possible de caractériser l'origine grossière de maladies des nerfs périphériques.
La vitesse de conduction nerveuse est très dépendante de propagation de signal rapide est activée par la myélinisation. Par conséquent, les processus de démyélinisation montrent généralement diminué la vitesse de conduction 4. Le potentiel d'action composé de moteur (CMAP) - en corrélation avec le nombre d'axones fonctionnels - est un indicateur de lésions axonales quand considérablement réduit 5.
Ainsi, au moyen de procédés électrophysiologiques l'étiologie de la lésion des nerfs périphériquespeut être discriminé, comme par neuropathies héréditaires, la neuropathie diabétique 6,7 8,9, polyneuropathies inflammatoires chroniques démyélinisantes (CIDP), 10 ou des neuropathies métaboliques 11.
Normalement, dans l'application humaine des enregistrements non invasifs sur le nerf saphène ou ulnaire sont préférés. Chez la souris, il est facile d'analyser les propriétés nerveuses du nerf sciatique, le plus grand nerf du système nerveux périphérique (SNP) contenant à la fois grand - et les axones de petit calibre du système moteur et sensoriel.
La procédure comme l'a démontré ici est une méthode rapide, simple et fiable de mesurer toutes les valeurs standards pertinents pour électrophysiologie sur les nerfs périphériques chez la souris intacte. En prenant des enregistrements à partir d'un organisme préservé, les conditions physiologiques de l'environnement de nerf sont garantis.
Protocole
La présente étude a été réalisée selon la protection des animaux Loi de la République fédérale d'Allemagne (Tierschutzgesetz der Bundesrepublik Deutschland) et a été approuvé par l'Office d'Etat de Thuringe pour la sécurité alimentaire et la protection des consommateurs (Thüringer Landesamt für Lebensmittelsicherheit und Verbraucherschutz).
1. Configuration des mesures
- Anesthésier les souris par isoflurane / O 2 inhalation - pour l'initiation de l'anesthésie à 3%, pour l'entretien 2% d'isoflurane dans de l'oxygène à 100% (Figure 1). Confirmez l'anesthésie suffisamment en testant les réflexes simples comme des réflexes et des tests de sensibilité pour la douleur de bas grade mouvement. L'utilisation de la pommade sur les yeux pour prévenir la sécheresse pendant l'anesthésie est recommandé mais pas indispensable car la procédure prend généralement que 30 min / animaux au total. En cas d'expériences de survie, d'administrer en temps opportun plus analgésiques à action pour la gestion de la douleur postopératoire.
- Raser les poils qui recouvrent les pattes arrière avec un rasoir électrique et effectuer l'épilation avec une crème d'épilation disponibles dans le commerce alors que les animaux sont déjà sous analgésie. Afin de maintenir le statut exempt d'agents pathogènes tout au long de la procédure, porter des gants aseptiques et toujours utiliser des instruments soigneusement nettoyées à l'éthanol à 70%.
- Organe de contrôle de la stabilité de la température par une plaque de chauffage de retour et contrôlée sonde thermo rectale (figure 2). Si nécessaire, s'il vous plaît utiliser un champ stérile pour couvrir la plaque de chauffage entre les animaux afin de maintenir un environnement expérimental stérile. En outre, il est recommandé d'utiliser une plaque de chauffage, qui est commandé électroniquement par l'intermédiaire d'un capteur intégré pour limiter la température de chauffage à ≤ 40 ° C, afin d'éviter des dommages aux tissus.
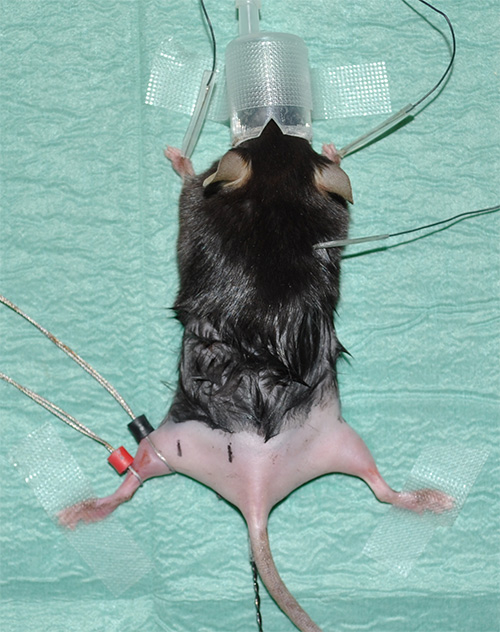
Figure 1. Expconfiguration erimental montrant une souris anesthésiée avec les membres postérieurs rasé. - Prenez l'électrocardiographie (ECG) pour surveiller le rythme cardiaque comme un paramètre essentiel. Installez trois électrodes pour les enregistrements ECG comme suit: une électrode sous la peau de chaque patte avant et une électrode sous la peau dans la région du cou.
- Électrodes Lieu d'anneau utilisant un gel de contact pour la résistance de conductivité / transfert optimal. L'électrode de détection (marqué en noir) est placé à la position où le muscle gastrocnémien a son diamètre maximal. L'électrode de référence (indiqué en rouge) est placé juste en dessous de l'électrode de détection.
Note: S'il vous plaît voir «Tableau des matériaux» pour les détails d'équipement. - Marquez les positions correctes de mesure des distances prédéterminées mais cohérentes entre la stimulation proximale et distale du nerf sciatique et l'électrode de plomb. Proposition expérimentale: À une distance de 4 mm de l'électrode de détection, la stimulation distale aura lieu.Dans une distance de 16 mm à l'électrode de détection, la stimulation proximale sera réalisée (figure 2).

Figure 2. D'image représentative montrant la situation expérimentale juste avant le début des mesures. La flèche blanche indique la position du palpeur (noir) et de référence (rouge) à l'électrode muscle jumeau de la patte arrière gauche. La stimulation par des électrodes à aiguille est réalisée à des positions définies par rapport à l'électrode de détection noir. Le point de stimulation distale (marque noire avec "ds" à la patte arrière gauche) a une distance de 4 mm de l'électrode de détection; le lieu de la stimulation proximale (marque noire "ps") est de 16 mm de distance. La ligne rouge sur la patte postérieure droite montre l'env iMate trajet anatomique du nerf sciatique. En outre, les positions approximatives des muscles des pattes postérieures pertinents sont présentés comme points de repère. L'astérisque indique la sonde thermique rectale.
2. Mesure
- Principe: Effectuez une série de stimulations nerveuses avec des impulsions carrés d'ondes simples générés de façon répétitive de 0,1 msec par jetables 28 G électrodes aiguilles monopolaires (taux de répétition de 200 ms, voir la figure 3A). Pour l'analyse des données hors de la ligne, il est recommandé d'acquérir simultanément des signaux de stimulation neuromusculaire avec la courbe de réponse en fonction (Figure 3B) du fait de la stimulation du nerf. Moyenne d'une série de réponses maximales («réponse de la fonction neuromusculaire représentant") pour une analyse ultérieure des données. Afin de produire des données fiables, fiche et au moins trois courbes plus tard moyennes indépendantes, optimales réponse par site de stimulation et animale.
p_upload/51181/51181fig3highres.jpg "src =" / files/ftp_upload/51181/51181fig3.jpg "/>
Figure 3. Procédure d'acquisition de données et d'analyse (présentation schématique). Impulsions générées sont appliquées répétitivement au nerf sciatique par l'intermédiaire d'électrodes à aiguille (rangée supérieure sur la figure 3A). Simultanément, plusieurs courbes de réponse neuromusculaire correspondantes sont enregistrées (rangée inférieure de la figure 3A). Lorsque la moyenne et agrandie, des courbes de réponse neuromusculaire due à des impulsions de stimulation (rangée supérieure sur la figure 3B) présentent les propriétés suivantes caractéristiques (rangée inférieure sur la figure 3B): Temps de latence de la réponse de signal ainsi que la durée et l'amplitude du signal sont indiquées et peuvent être obtenu pour les calculs et les statistiques suivantes. Conduction du signal irrégulière et / ou enregistrements sous-optimaux aboutissent généralement à diverses déformations de signaux avec plus que juste une positive et une déviation négative ou déformation du signal(Forme bimodale) avec une amplitude réduite (figure 3C). - Effectuer une stimulation avec une électrode proximale de l'aiguille à la position déterminée ("ps" sur la figure 2).
- Afin d'obtenir les meilleures conditions d'enregistrement avec des amplitudes maximales, de visualiser des courbes de réponse réels simultanés au processus de stimulation. En faisant cela, l'expérimentateur est en mesure d'évaluer immédiatement la forme de courbes de réponse ainsi que la taille de l'amplitude.
- Le cas échéant, un peu d'attention et de manipuler la position et / ou l'angle de l'aiguille de stimulation par rapport au nerf sciatique. Cette optimisation douceur de conditions de stimulation permet d'atteindre des amplitudes constantes avec la plus grande valeur possible, et une courbe de réponse typique de forme biphasique (figure 4).
- Effectuer une stimulation distale avec une électrode à aiguille en position déterminée ("ds" dans la figure 2).
- Après des achèvementsn de la mesure, de transférer la souris testée à une cage séparée jusqu'à ce qu'il ait repris conscience suffisante pour maintenir décubitus sternal. Ne pas laisser un animal sans surveillance, et en compagnie d'autres animaux jusqu'à ce qu'il ait totalement récupéré de l'anesthésie. Administrer en temps opportun plus analgésiques à action pour la gestion de la douleur postopératoire. L'administration systémique de médicaments anti-inflammatoires non stéroïdiens (AINS) et les opioïdes sont recommandés pour 1-3 jours.
- Sinon, sacrifier la souris encore anesthésiés de façon rapide et sans cruauté sans autre douleur pour l'animal, par exemple par dislocation cervicale.
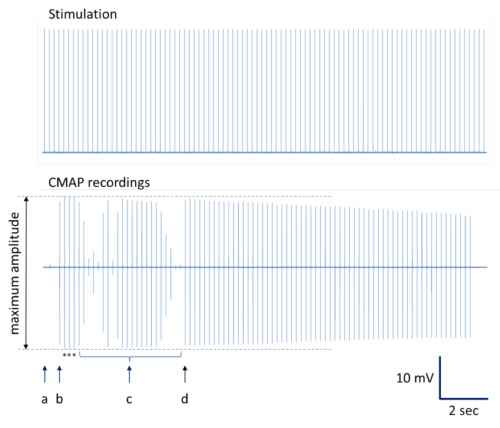
Figure 4. Illustration de déterminer les enregistrements CMAP avec des amplitudes maximales. Une série d'inscription complète est présentée. (A ) point d'insertion de la réponse de CMAP minime. (B) les résultats du mouvement de l'aiguille légère de stimulation dans les enregistrements CMAP avec amplitudes maximales. (C) D'autres changements dans le placement de l'aiguille produisent enregistrements CMAP avec des amplitudes différentes, y compris près du maximum des amplitudes. (D) la stimulation de remplacement de l'aiguille avec des enregistrements CMAP série d'amplitudes quasi-maximales. Remarque: décroissance typique des amplitudes CMAP peut se produire lors de la stimulation répétitive à optimale site de stimulation 12, 13. Les astérisques indiquent les enregistrements CMAP avec des amplitudes maximales représentées pour la moyenne.
3. Analyse
- Extraire des paramètres de conduction nerveuse sur la base de l'ensemble neuromusculaire représentant de réponse de la fonction de données en utilisant un logiciel approprié (par exemple AtisaPro).
Note: S'il vous plaît traiter détermination de données en fonction du temps avec un soin particulier car le point d'inflexion de détermination composé action motrice potrentiel (CMAP) début et la fin peut être difficile. Une procédure avec une reproductibilité garantie est donnée à la figure 3B, où les tangentes sur des détournements de signal après le début et avant la fin sont utilisés. - Calculez «signal latence» et les valeurs «CMAP.
- Latence »représente le délai entre la stimulation et CMAP apparition, tandis que le laps de temps entre CAMP début de déviation initiale négative à parapher retour à la ligne de base est appelé« durée CMAP. Utiliser la différence entre les latences distales et proximales pour calculer la vitesse de conduction en même temps que la distance entre les sites de stimulation distale et proximale.
= vitesse de conduction de latence / distance entre les sites de stimulation - CMAP '(composé potentiel d'action du moteur) amplitude représente l'amplitude entre le point positif et négatif maximum de redressement du signal CMAP (donnée en mV).
CMAP = valeur "point de retournement positif» - valeur «négative redressement point '
- Latence »représente le délai entre la stimulation et CMAP apparition, tandis que le laps de temps entre CAMP début de déviation initiale négative à parapher retour à la ligne de base est appelé« durée CMAP. Utiliser la différence entre les latences distales et proximales pour calculer la vitesse de conduction en même temps que la distance entre les sites de stimulation distale et proximale.
Résultats
Nous avons effectué une série de mesures électrophysiologiques in vivo sur les nerfs sciatiques de 12 souris au total pour cette étude: 6 animaux de chaque sexe. Les mesures ont été réalisées avec le protocole présenté et livrés aux résultats suivants:
Les deux souris mâles et femelles présentent une vitesse sciatique moyen de conduction nerveuse de l'ordre de 20 m / sec (figure 5). Ceci est cohérent avec d'autres mesures dans la littér...
Discussion
Le protocole décrit fournit une méthode simple et fiable pour déterminer nerf sciatique propriétés de conduction sur des souris anesthésiée sans la nécessité d'exposer le nerf d'intérêt. Néanmoins, cette procédure expérimentale provoque des lésions du tissu par ponction à l'aiguille. Il est donc raisonnable d'une option de sacrifier les animaux après la fin des enregistrements. Cependant, par rapport à d'autres procédures plus invasives, qui nécessitent l'exposition du nerf av...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été soutenu par SFB 604, DFG MO 1421/2-1 et Krebshilfe 107089 (HM). AS est récipiendaire du prix du jeune chercheur de la tumeur du Children Foundation (New York, États-Unis).
matériels
| Name | Company | Catalog Number | Comments |
| Concentric Needle Electrodes (Stimulation) | Natus Medical Incorporated, San Carlos, CA, USA | 9013S0901 | |
| Digital Ring Electrodes (Recording) | Natus Medical Incorporated, San Carlos, CA, USA | 9013S0302 | |
| ToM - Tower of Measurement (A/D converter) | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| AtisaPro, data acquisition and analysis software | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| HSE-Stimulator T | Hugo Sachs Elektronik, Hugstetten, Germany |
Références
- Kimura, J. 3rd ed. Electrodiagnosis in Diseases of Nerve and Muscle. , (2001).
- Rutkove, S. B. Effects of temperature on neuromuscular electrophysiology. Muscle Nerve. 24, 867-882 (2001).
- Xia, R. H., Yosef, N., Ubogu, E. E. Dorsal caudal tail and sciatic motor nerve conduction studies in adult mice: technical aspects and normative data. Muscle Nerve. 41, 850-856 (2010).
- Zielasek, J., Martini, R., Toyka, K. V. Functional abnormalities in P0-deficient mice resemble human hereditary neuropathies linked to P0 gene mutations. Muscle Nerve. 19, 946-952 (1996).
- Raynor, E. M., Ross, M. H., Shefner, J. M., Preston, D. C. Differentiation between axonal and demyelinating neuropathies: identical segments recorded from proximal and distal muscles. Muscle Nerve. 18, 402-408 (1995).
- Pareyson, D., Scaioli, V., Laura, M. Clinical and electrophysiological aspects of Charcot-Marie-Tooth disease. Neuromol. Med. 8, 3-22 (2006).
- Schulz, A., et al. Merlin isoform 2 in neurofibromatosis type 2-associated polyneuropathy. Nat. Neurosci. 16, 426-433 (2013).
- Lamontagne, A., Buchthal, F. Electrophysiological studies in diabetic neuropathy. J. Neurol. Neurosurg. Psychiatry. 33, 442-452 (1970).
- Andersen, H., Nielsen, J. F., Nielsen, V. K. Inability of insulin to maintain normal nerve function during high-frequency stimulation in diabetic rat tail nerves. Muscle Nerve. 17, 80-84 (1994).
- Magda, P., et al. Comparison of electrodiagnostic abnormalities and criteria in a cohort of patients with chronic inflammatory demyelinating polyneuropathy. Arch. Neurol. 60, 1755-1759 (2003).
- Lindberg, R. L., et al. Motor neuropathy in porphobilinogen deaminase-deficient mice imitates the peripheral neuropathy of human acute porphyria. J. Clin. Invest. 103, 1127-1134 (1999).
- Massey, J. M. Electromyography in disorders of neuromuscular transmission. Sem. Neurol. 10, 6-11 (1990).
- Stalberg, E., Falck, B. The role of electromyography in neurology. Electroencephalogr. Clin. Neurophysiol. 103, 579-598 (1997).
- Osuchowski, M. F., Teener, J., Remick, D. Noninvasive model of sciatic nerve conduction in healthy and septic mice: reliability and normative data. Muscle Nerve. 40, 610-616 (2009).
- Oh, S. S., Hayes, J. M., Sims-Robinson, C., Sullivan, K. A., Feldman, E. L. The effects of anesthesia on measures of nerve conduction velocity in male C57Bl6/J mice. Neurosci. Lett. 483, 127-131 (2010).
- Dilley, A., Lynn, B., Pang, S. J. Pressure and stretch mechanosensitivity of peripheral nerve fibres following local inflammation of the nerve trunk. Pain. 117, 462-472 (2005).
- Vleggeert-Lankamp, C. L., et al. Electrophysiology and morphometry of the alpha- and beta-fiber populations in the normal and regenerating rat sciatic nerve. Exp. Neurol. 187, 337-349 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon