JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스 좌골 신경에 생체 전기 생리 측정에서
요약
생체 내에서 신경의 전도 특성의 측정은 신경 근육 질환의 다양한 동물 모델을 특성화 할 수있는 강력한 도구를 예시. 여기서, 우리는 마취 된 쥐의 좌골 신경의 전기 생리 분석이 수행 될 수있는 간단하고 신뢰성있는 프로토콜을 제시한다.
초록
전기 생리학 연구는 기본 병태 생리 (1)의 이해, 함께 신경 병리학 기술과, 다양한 신경 근육 질환의 합리적인 분류를 허용하고 도움이됩니다. 여기에서 우리는 생체 내에서 마우스 좌골 신경에 전기 생리학 연구를 수행하는 방법을 설명합니다.
동물 실험군에 진통을 보장하기 위해 이소 플루 란으로 마취 약 30 분 / 동물을 측정하는 동안 작업 환경을 방해받지 않습니다. 37 ° C의 일정한 체온은 가열 플레이트에 의해 유지되고 지속적으로 직장 열 프로브 (2)에 의해 측정된다. 또한, 심전도 (ECG)를 정기적으로 계속해서 조사 동물의 생리 학적 상태를 모니터링하기 위해 측정 중에 기록된다.
전기 생리학 기록은 좌골 신경, 일의 가장 큰 신경에서 수행됩니다행등과 감각 모두 섬유 책자와 마우스의 뒷다리를 공급하는 전자 말초 신경계 (PNS). 우리의 프로토콜에서, 좌골 신경은 현장에 남아 있으므로 추출 또는 노출 할 필요가 없습니다, 실제 녹음과 함께 어떤 불리한 신경 자극없이 측정이 가능. 적절한 바늘 전극 3을 사용하여 우리는 비복근 근육에서 감지 전극과 함께 전송 된 잠재력을 등록, 근위 및 말초 신경 자극을 모두 수행합니다. 데이터 처리, 신뢰성과 신경 전도 속도 (NCV) 및 복합 모터 활동 전위 (CMAP) 고도로 일관된 값, 총 말초 신경 기능의 정량화를위한 주요 파라미터가 달성 될 수 후.
서문
전기 생리학 측정은 임상 및 실험실 환경 모두에서 말초 신경의 기능 무결성을 조사를위한 필수 도구입니다. 인간에서는, 신경근 장애 및 신경 병증의 다수 진단 학적 측정 전기 생리에 의존한다. 전도 속도 또는 신호의 전위 진폭 같이 신경 특성을 측정함으로써, 말초 신경 질환의 거친 원점을 특성화 할 수있다.
신경 전도 속도는 수초에 의해 활성화 빠른 신호 전달에 매우 의존적이다. 따라서 탈수 초성 프로세스는 일반적으로 전도 속도 4 감소합니다. 복합 운동 활동 전위 (CMAP) - 기능 축삭의 수와의 상관 관계는 - 크게 5 감소 축삭 손상에 대한 지표이다.
따라서, 전기 생리 방법에 의한 말초 신경 손상의 병인이러한 유전성 신경 병증 6,7, 당뇨병 성 신경 병증 8,9, 만성 염증성 탈수 초성 다발성 신경 병증 (CIDP) 10, 또는 신진 대사 신경 병증 11로 구별 할 수 있습니다.
일반적으로 인간의 응용 프로그램에서 수랄 또는 척골 신경에 비 침습적 녹음이 바람직하다. 및 행등 및 감각계의 소 구경 축삭 - 생쥐에서는, 좌골 신경의 신경 속성, 대용량을 모두 포함하는 말초 신경계 (PNS)의 규모 신경을 분석하기 쉽다.
여기에 설명 된대로 절차는 그대로 쥐의 말초 신경에 전기 생리학에 대한 관련 모든 표준 값을 측정 할 수있는, 쉽고 빠르고 안정적인 방법입니다. 보존 유기체에서 녹음을 복용함으로써, 신경 환경의 생리적 조건은 보장된다.
프로토콜
본 연구는 독일 연방 공화국 (Tierschutzgesetz 데르 Bundesrepublik Deutschland의)의 동물 보호법에 따라 수행하고, 식품 안전과 소비자 보호 (링거 Landesamt FÜR Lebensmittelsicherheit 싶게 Verbraucherschutz)의 튀 링겐 주 사무소에 의해 승인되었습니다.
1. 측정 설정
- 이소 플루 란 / O 2 흡입 쥐를 마취 - 마취 3 %의 개시를 위해, 100 % 산소의 유지 보수 2 % 이소 플루 란 (그림 1)를 참조하십시오. 이러한 운동 반사와 낮은 수준의 통증에 대한 민감도 테스트와 같은 간단한 반사 신경을 테스트하여 충분한 마취를 확인합니다. 절차는 일반적으로 총 약 30 분 / 동물 걸리기 때문에 마취 동안 건조를 방지하기 위해 눈에 연고의 사용을 권장하지만 필수되지 않습니다. 생존 실험의 경우, 수술 후 통증 관리를 위해 적시 이상 작용하는 진통제를 투여.
- 전기 면도기로 두 다리를 덮고있는 털을 면도하고 동물이 마취에서 이미 동안 시중에서 판매하는 제모 크림으로 제모를 수행합니다. 절차를 통해 무균 상태를 유지하기 위해, 무균 장갑을 착용하고 항상 조심스럽게 70 % 에탄올로 세척 장비를 사용합니다.
- 피드백 제어 가열 플레이트와 직장 열 프로브 (그림 2)에 의한 제어 체온 안정성. 필요한 경우, 멸균 실험 환경을 유지하기 위해 동물들 사이 가열판을 덮 멸균 드레이프 사용해주세요. 더욱이, 전자적으로 조직 손상을 방지하기 위해 40 ° C ≤를 위해 가열 온도를 제한하는 통합 된 센서를 통해 제어되는 가열판을 사용하는 것이 추천된다.
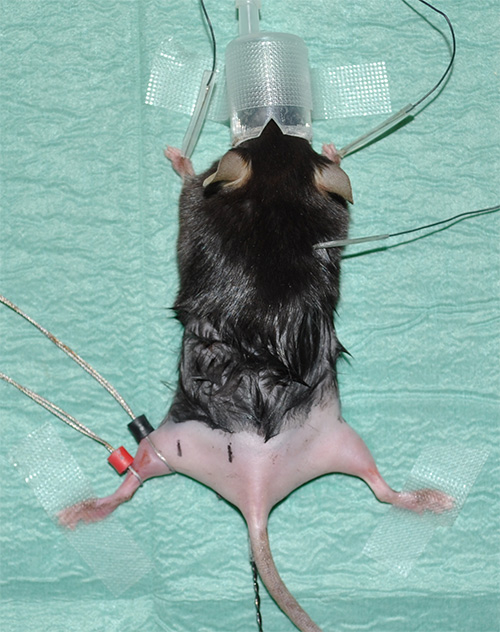
그림 1. 전문가에게면도 뒷다리로 마취 된 쥐를 보여주는 erimental 설치. - (ECG) 레코딩 중요한 매개 변수로 심장 박동을 모니터링하는 심전도를 가져 가라. 목 부분의 피부 아래의 각 앞다리와 하나의 전극의 피부 아래에 하나의 전극을 다음과 같이 ECG 녹음을 세 전극을 설치합니다.
- 최적의 전도도 / 전사 저항 접촉 겔을 사용하는 장소 링 전극. (블랙 표시)에 감지 전극은 비복근이 최대 직경을 갖는 위치에 배치된다. (빨간색으로 표시됨) 기준 전극은 단지 감지 전극 아래에 배치된다.
참고 : 장비에 대한 자세한 내용은 '자료 표'를 참조하십시오. - 근위 및 원위 좌골 신경의 자극과 리드 전극 사이에 미리 정해진하지만 일관된 거리와 측정의 정확한 위치를 표시합니다. 실험 계획안 : 감지 전극 내지 4 ㎜의 거리에서, 원위 자극이 열린다.감지 전극에 16mm의 거리에서, 인접한 자극 (도 2)을 실시한다.

도 2. 직전 측정의 시작 실험 상황을 도시 대표 화면. 흰색 화살표는 감지 (블랙) 및 참조 (레드) 왼쪽 뒷다리의 비복근에서 전극의 위치를 나타낸다. 니들 전극에 의해 자극 검정 감지 전극과 관련하여 정의 된 위치에서 수행 될 것이다. 말초 자극의 포인트는 (왼쪽 뒷다리에서 "DS"블랙 마크) 감지 전극에서 4mm의 거리가; 근위 자극 ( "PS"블랙 마크)의 장소는 거리 16mm입니다. 오른쪽 뒷다리에 빨간색 라인은 약을 보여줍니다 좌골 신경의 해부학 적 과정으로 iMate. 또한, 관련 뒷다리 근육의 거친 위치는 관광 명소로 표시됩니다. 별표는 직장 온도 프로브를 나타냅니다.
2. 측정
- 원리 : 모노 일회용 28 G 바늘 전극 0.1 밀리 기간 반복적으로 생성 된 하나의 구형파 펄스와 신경 자극의 일련의 수행 (반복 속도 200 밀리 초를, 그림 3A 참조). 오프라인 데이터 분석을 위해, 그것은 동시에 인한 신경 자극에 신경근 함수 응답 곡선 (도 3b)와 함께 자극 신호를 획득하도록 권장한다. 후속 데이터 분석을위한 최대 응답의 시리즈 ( "대표 신경근 함수 응답을") 보통. 신뢰할 수있는 데이터 기록 및 자극 사이트 및 동물 당 저장 보통 적어도 세 독립적 최적 반응 곡선을 생성하기 위해.
p_upload/51181/51181fig3highres.jpg "SRC ="/ files/ftp_upload/51181/51181fig3.jpg "/>
데이터 수집 및 분석 (개략적으로 표현) 그림 3. 절차는. 반복적으로 생성 된 펄스는 바늘 전극 (그림 3a에 상단 행)를 통해 좌골 신경에 적용됩니다. 동시에 여러 대응하는 신경 근육 학 반응 곡선은 (그림 3A 낮은 행)가 기록되어있다. 신호 응답의 지연뿐만 아니라, 재생 시간과 신호의 진폭을 표시 할 수있다 : 평균 및 확대하면 인해 자극 펄스 (도 3b에 위쪽 열)에 신경근 반응 곡선은 다음과 같은 특징적인 특성 (도 3b에 아래쪽 열)를 보여주는 이후의 계산 및 통계를 얻을 수. 불규칙한 신호 전도 및 / 또는 차선의 기록은 보통 하나의 긍정적와 음수 편향 또는 신호 변형보다 더 다양한 신호 변형을 초래할감소 된 진폭 (그림 3C)와 (바이 모달 모양). - 결정된 위치에 바늘 전극 (그림 2의 "PS")와 근위 자극을 수행합니다.
- 최대 진폭 최상의 촬영 조건을 달성하기 위해, 자극 프로세스 동시 실제 응답 곡선을 시각화. 이렇게함으로써, 실험자 즉시 반응 곡선의 형상뿐만 아니라 진폭의 크기를 평가할 수있다.
- 필요하다면, 약간 조심스럽게 위치 및 / 또는 좌골 신경에 대한 자극 바늘의 각도를 조작. 자극 조건이 부드러운 최적화는 최대 값과 전형적인 바이 페이 모양의 응답 곡선 (그림 4)와 일정한 진폭에 도달 할 수 있습니다.
- 결정된 위치 (그림 2에서 "DS")에서 바늘 전극과 말초 자극을 수행합니다.
- completio 후이 흉골 드러 누움을 유지하기 위해 충분한 의식을 회복 할 때까지 N 측정, 별도의 케이지에 테스트 마우스를 전송합니다. 완전히 마취에서 회복 될 때까지 무인과 다른 동물의 회사에서 동물을 방치하지 마십시오. 수술 후 통증 관리를위한 적절한 행동을 더 이상 진통제를 관리 할 수 있습니다. 비 스테로이드 성 항 염증성 약물 (NSAIDs)와 아편의 전신 투여는 1-3 일을 권장합니다.
- 또한, 목 탈구에 의해 예를 들어 동물에 대한 더 이상의 고통없이 신속하고 인도적인 방식으로 여전히 마취 마우스를 희생.
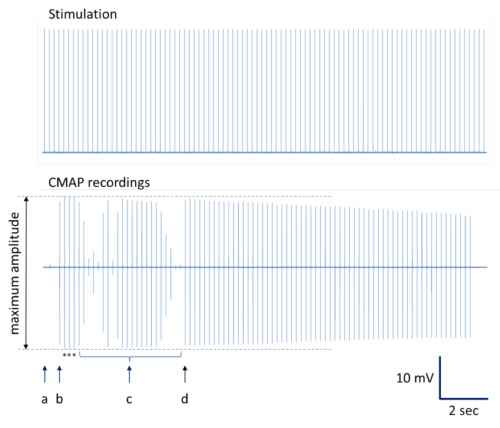
그림 4. 최대 진폭 CMAP 녹음을 결정하는 그림. 전체 등록 시리즈가 제공됩니다. ( ) 삽입 포인트. 최대 진폭 CMAP 녹화에서 (B) 약간의 자극 바늘 운동의 결과. (C) 바늘 위치의 추가 변경은 거의 최대 진폭 등 다양한 진폭 CMAP 녹음을 생산하고 있습니다. 가까운 최대 진폭의 시리얼 CMAP 녹화와 (d)에 자극 바늘 교체. 참고 : CMAP 진폭의 일반적인 감소는 최적의 자극 사이트 (12, 13)에 반복적 인 자극하는 동안 발생할 수 있습니다. 별표는 평균에 묘사 된 최대 진폭과 CMAP 녹음을 나타냅니다.
3. 분석
- 적절한 소프트웨어 패키지 (예 AtisaPro)를 사용하여 대표적인 신경 근육 기능 응답 데이터 세트에 기초하여 신경 전도 파라미터를 추출한다.
참고 : 특별한주의 시간 관련 데이터의 결정을 처리하십시오 때문에 화합물 모터 동작 냄비의 변곡점 결정ential (CMAP) 개시 및 종료가 어려울 수 있습니다. 확인 재현성 절차 개시 후 및 종료하기 전에 신호 편향에 접선을 사용하는 그림 (b)에서 제공됩니다. - '신호 대기'와 'CMAP'값을 계산합니다.
- CMAP 기간 '대기 시간'초기 부정적인 편향의 CAMP 발병 사이의 시간 간격이 기준이 호출로 돌아 최초 반면, 자극과 CMAP의 발병 사이의 시간 지연을 나타내는 '. 원위 및 근위 자극 위치 사이의 거리와 함께 전도 속도를 계산하는 근위 지연 사이의 차이를 사용한다.
자극 사이트 간의 전도 속도 = 지연 시간 / 거리 - CMAP '(복합 운동 활동 전위) 진폭 (MV에 주어진) CMAP 신호의 최대 양 및 음의 턴어라운드 시점 사이의 크기를 나타냅니다.
CMAP = 값 '긍정적 인 턴어라운드 시점'- 값 '부정적인 소요 포INT '
- CMAP 기간 '대기 시간'초기 부정적인 편향의 CAMP 발병 사이의 시간 간격이 기준이 호출로 돌아 최초 반면, 자극과 CMAP의 발병 사이의 시간 지연을 나타내는 '. 원위 및 근위 자극 위치 사이의 거리와 함께 전도 속도를 계산하는 근위 지연 사이의 차이를 사용한다.
결과
각 성별의 6 동물 : 우리는이 연구를 위해 총 12 쥐의 좌골 신경에 생체 전기 생리학 일련의 측정을 실시했다. 측정은 제시된 프로토콜을 수행하고 다음과 같은 결과를 제공 하였다 :
둘 다 남성과 여성 마우스는 약 20 M / sec의 평균 좌골 신경의 전도 속도 (그림 5)를 표시합니다. 이 문헌의 다른 측정과 일치한다. 또한, 남성과 여성 사이의 신경 전도 속도...
토론
설명 프로토콜은 관심의 신경을 노출 할 필요없이 마취 된 쥐의 좌골 신경의 전도 특성을 측정 할 수있는 쉽고 신뢰할 수있는 방법을 제공합니다. 그럼에도 불구하고,이 실험 과정은 바늘 구멍에 의해 조직 손상의 원인이됩니다. 따라서 녹음을 마친 후 동물을 희생 할 수있는 합리적인 선택이 될 것입니다. 그러나, 이전에 녹음 신경의 노출을 필요로하는 다른 추가 침습 절차에 비해 조직 손상은 <...
공개
저자가 공개하는 게 없다.
감사의 말
이 작품은 SFB (604), DFG MO 1421/2-1 및 Krebshilfe 107089 (HM까지)에 의해 지원되었다. 아이들의 종양 재단 (뉴욕, 미국)에서 젊은 연구자 상을받는 사람이 때문이다.
자료
| Name | Company | Catalog Number | Comments |
| Concentric Needle Electrodes (Stimulation) | Natus Medical Incorporated San Carlos, CA 94070, USA | 9013S0901 | |
| Digital Ring Electrodes (Recording) | Natus Medical Incorporated San Carlos, CA 94070, USA | 9013S0302 | |
| ToM - Tower of Measurement (A/D converter) | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| AtisaPro, Data acquisition & analysis software | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| HSE-Stimulator T | Hugo Sachs Elektronik, Hugstetten, Germany | ||
참고문헌
- Kimura, J. 3rd ed. Electrodiagnosis in Diseases of Nerve and Muscle. , (2001).
- Rutkove, S. B. Effects of temperature on neuromuscular electrophysiology. Muscle Nerve. 24, 867-882 (2001).
- Xia, R. H., Yosef, N., Ubogu, E. E. Dorsal caudal tail and sciatic motor nerve conduction studies in adult mice: technical aspects and normative data. Muscle Nerve. 41, 850-856 (2010).
- Zielasek, J., Martini, R., Toyka, K. V. Functional abnormalities in P0-deficient mice resemble human hereditary neuropathies linked to P0 gene mutations. Muscle Nerve. 19, 946-952 (1996).
- Raynor, E. M., Ross, M. H., Shefner, J. M., Preston, D. C. Differentiation between axonal and demyelinating neuropathies: identical segments recorded from proximal and distal muscles. Muscle Nerve. 18, 402-408 (1995).
- Pareyson, D., Scaioli, V., Laura, M. Clinical and electrophysiological aspects of Charcot-Marie-Tooth disease. Neuromol. Med. 8, 3-22 (2006).
- Schulz, A., et al. Merlin isoform 2 in neurofibromatosis type 2-associated polyneuropathy. Nat. Neurosci. 16, 426-433 (2013).
- Lamontagne, A., Buchthal, F. Electrophysiological studies in diabetic neuropathy. J. Neurol. Neurosurg. Psychiatry. 33, 442-452 (1970).
- Andersen, H., Nielsen, J. F., Nielsen, V. K. Inability of insulin to maintain normal nerve function during high-frequency stimulation in diabetic rat tail nerves. Muscle Nerve. 17, 80-84 (1994).
- Magda, P., et al. Comparison of electrodiagnostic abnormalities and criteria in a cohort of patients with chronic inflammatory demyelinating polyneuropathy. Arch. Neurol. 60, 1755-1759 (2003).
- Lindberg, R. L., et al. Motor neuropathy in porphobilinogen deaminase-deficient mice imitates the peripheral neuropathy of human acute porphyria. J. Clin. Invest. 103, 1127-1134 (1999).
- Massey, J. M. Electromyography in disorders of neuromuscular transmission. Sem. Neurol. 10, 6-11 (1990).
- Stalberg, E., Falck, B. The role of electromyography in neurology. Electroencephalogr. Clin. Neurophysiol. 103, 579-598 (1997).
- Osuchowski, M. F., Teener, J., Remick, D. Noninvasive model of sciatic nerve conduction in healthy and septic mice: reliability and normative data. Muscle Nerve. 40, 610-616 (2009).
- Oh, S. S., Hayes, J. M., Sims-Robinson, C., Sullivan, K. A., Feldman, E. L. The effects of anesthesia on measures of nerve conduction velocity in male C57Bl6/J mice. Neurosci. Lett. 483, 127-131 (2010).
- Dilley, A., Lynn, B., Pang, S. J. Pressure and stretch mechanosensitivity of peripheral nerve fibres following local inflammation of the nerve trunk. Pain. 117, 462-472 (2005).
- Vleggeert-Lankamp, C. L., et al. Electrophysiology and morphometry of the alpha- and beta-fiber populations in the normal and regenerating rat sciatic nerve. Exp. Neurol. 187, 337-349 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유