È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In Misure Vivo elettrofisiologici sui nervi mouse sciatico
In questo articolo
Riepilogo
Le misurazioni del nervo proprietà di conduzione in vivo esemplificano un potente strumento per caratterizzare i vari modelli animali di malattie neuromuscolari. Qui, presentiamo un protocollo semplice e affidabile con cui può essere eseguita l'analisi elettrofisiologica sul nervo sciatico di topi anestetizzati.
Abstract
Studi elettrofisiologici consentono una classificazione razionale delle varie malattie neuromuscolari e sono di aiuto, insieme alle tecniche neuropatologiche, nella comprensione della fisiopatologia 1. Qui si descrive un metodo per eseguire studi elettrofisiologici sul mouse del nervo sciatico in vivo.
Gli animali vengono anestetizzati con isoflurano per garantire analgesia per i topi testati e indisturbato ambiente di lavoro durante le misurazioni che prendono circa 30 min / animale. Una temperatura costante di 37 ° C corpo è mantenuto da una piastra riscaldante e continuamente misurata da una sonda rettale termo 2. Inoltre, un elettrocardiogramma (ECG) viene normalmente registrato durante le misurazioni al fine di monitorare costantemente lo stato fisiologico degli animali studiati.
Registrazioni elettrofisiologiche vengono eseguite sul nervo sciatico, il nervo più grande del secoloe del sistema nervoso periferico (PNS), fornendo il mouse arto posteriore con tratti di fibre sia motorie e sensoriali. Nel nostro protocollo, nervo sciatico rimanere in situ e, pertanto, non devono essere estratto o esposto, consentendo misurazioni senza alcuna irritazioni nervose avverse con registrazioni effettive. Utilizzando opportuni elettrodi ad ago 3 svolgiamo sia prossimale e stimolazioni nervose distali, registrando i potenziali trasmessi con elettrodi di rilevamento a muscoli gastrocnemio. Dopo l'elaborazione dei dati, i valori molto consistenti per la velocità di conduzione nervosa (NCV) e il composto potenziale d'azione del motore (CMAP) affidabile e, i parametri chiave per la quantificazione del funzionamento dei nervi periferici lordo, possono essere raggiunti.
Introduzione
Misure elettrofisiologiche sono uno strumento indispensabile per indagare l'integrità funzionale dei nervi periferici in ambienti clinici e di laboratorio. Negli esseri umani, un gran numero di disturbi neuromuscolari e neuropatie diagnostico si basa su misure elettrofisiologiche. Misurando proprietà nervose come velocità di conduzione o potenziali ampiezze del segnale, è possibile caratterizzare l'origine approssimativa delle malattie nervose periferiche.
La velocità di conduzione nervosa è altamente dipendente rapida propagazione del segnale attivata da mielinizzazione. Pertanto, i processi demielinizzanti in genere mostrano una diminuita velocità di conduzione 4. Il potenziale d'azione composto di motore (CMAP) - la correlazione con il numero di assoni funzionali - è un indicatore di danno assonale, quando ha ridotto significativamente 5.
Così, mediante metodi elettrofisiologici eziologia di danni ai nervi perifericipossono essere discriminati, come ad neuropatie ereditarie 6,7, 8,9, neuropatia diabetica cronica polineuropatia infiammatoria demielinizzante (CIDP) 10, o neuropatie metaboliche 11.
Normalmente, nella domanda umana sono preferiti registrazioni non invasive sul nervo surale o ulnare. Nei topi, è semplice da analizzare le proprietà nervosi del nervo sciatico, il nervo più grande del sistema nervoso periferico (PNS) contenente sia grande - e assoni di piccolo calibro del sistema motorio e sensoriale.
La procedura come dimostrato qui è un metodo rapido, semplice e affidabile per misurare tutti i valori forfettari rilevanti per elettrofisiologia sui nervi periferici nel topo intatto. Prendendo registrazioni da un organismo conservato, condizioni fisiologiche dell'ambiente nervo sono garantite.
Protocollo
Il presente studio è stato eseguito secondo la Protezione degli Animali legge della Repubblica Federale di Germania (Tierschutzgesetz der Bundesrepublik Deutschland) ed è stato approvato dall'Ufficio di Stato della Turingia per la sicurezza alimentare e la tutela dei consumatori (Thüringer Landesamt für Lebensmittelsicherheit und Verbraucherschutz).
1. Impostazione delle Misure
- Anestetizzare i topi da isoflurano / O 2 inalazione - per apertura di anestesia 3%, per manutenzione 2% isoflurano in ossigeno al 100% (Figura 1). Confermare anestesia sufficienti testando riflessi semplici come i riflessi e test di sensibilità per il dolore di basso grado del movimento. L'uso della pomata sugli occhi per prevenire la secchezza durante l'anestesia è consigliato ma non indispensabile in quanto la procedura richiede in genere solo 30 min / animale in totale. In caso di esperimenti di sopravvivenza, amministrare tempestiva più analgesici che agiscono per la gestione del dolore postoperatorio.
- Accorciare il pelo che copre gli arti posteriori con un rasoio elettrico ed eseguire depilazione con una crema depilazione disponibili in commercio mentre gli animali sono già in analgesia. Al fine di mantenere lo status di libero-patogeno durante tutta la procedura, indossare guanti asettici e utilizzare sempre strumenti accuratamente puliti con il 70% di etanolo.
- Corpo Controllo stabilità della temperatura da una piastra riscaldante controllato in retroazione e sonda termo rettale (Figura 2). Se necessario, si prega di utilizzare un telino sterile per coprire la piastra di riscaldamento tra gli animali al fine di mantenere un ambiente sperimentale sterile. Inoltre, si raccomanda di utilizzare una piastra di riscaldamento, che è controllata elettronicamente mediante un sensore integrato per limitare la temperatura di riscaldamento a ≤ 40 ° C per evitare danni ai tessuti.
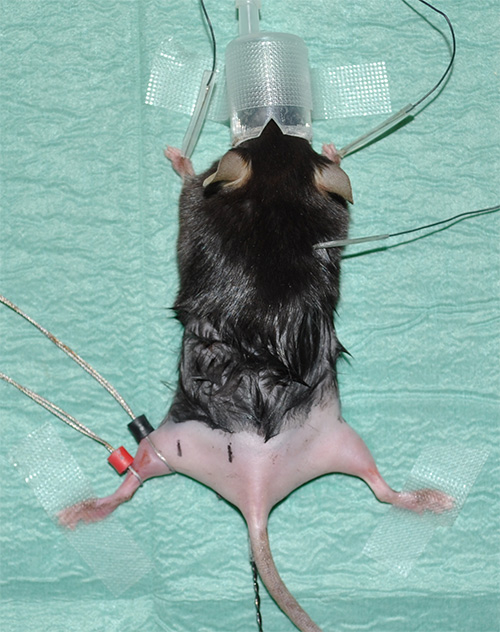
Figura 1. Expinstallazione erimental mostrando un mouse anestetizzato con gli arti posteriori rasati. - Prendere elettrocardiografia (ECG) registrazioni per monitorare la frequenza cardiaca come parametro vitale. Installare tre elettrodi per registrazioni ECG come segue: un elettrodo sotto la pelle di ogni zampa anteriore e un elettrodo sotto la pelle nella zona del collo.
- Elettrodi luogo ad anello con gel di contatto per ottimizzare la resistenza conducibilità / trasferimento. L'elettrodo di rivelazione (marcato in nero) è posto nella posizione in cui il muscolo gastrocnemio ha il suo diametro massimo. L'elettrodo di riferimento (indicata in rosso) è posto appena sotto l'elettrodo di rilevamento.
Nota: Si prega di vedere la 'tavola Materiale' per i dettagli apparecchiature. - Contrassegnare le posizioni corrette di misura con distanze predeterminate ma coerenti tra prossimale e distale stimolazione del nervo sciatico e l'elettrodo di piombo. Proposta sperimentale: Ad una distanza di 4 mm dal elettrodo di rilevamento, la stimolazione distale avrà luogo.In una distanza di 16 mm e l'elettrodo di rilevamento, la stimolazione prossimale sarà effettuata (Figura 2).

Figura 2. Immagine rappresentativa che mostra la situazione sperimentale appena prima dell'inizio delle misurazioni. La freccia bianca indica la posizione del sensore (nero) e di riferimento (rosso) elettrodo al muscolo gastrocnemio di arto posteriore sinistra. La stimolazione con elettrodi ad ago verrà effettuata in posizioni definite in relazione allo elettrodo di rilevamento nero. Il punto di stimolazione distale (segno nero con "ds" al posteriore arto sinistro) ha una distanza di 4 mm dal elettrodo di rilevamento; il luogo della stimolazione prossimale (segno nero con "ps") dista 16 mm. La linea rossa sulla destra dell'arto posteriore mostra la ca iMate corso anatomica del nervo sciatico. Inoltre, le posizioni di massima dei relativi muscoli degli arti posteriori sono indicati come punti di riferimento. L'asterisco indica la sonda termica rettale.
2. Misura
- Principio: Eseguire una serie di stimolazioni nervose con impulsi ad onda quadra singoli ripetutamente generati da 0,1 durata msec da monouso elettrodi ad ago 28 G monopolare (tasso di ripetizione di 200 msec; vedi Figura 3A). Per l'analisi dei dati off-line, si consiglia di acquisire simultaneamente segnali di stimolazione insieme con la curva di risposta funzione neuromuscolare (Figura 3B) a causa di stimolazione del nervo. Media, una serie di risposte massime ("rappresentante neuromuscolare risposta funzione") per la successiva analisi dei dati. Al fine di produrre dati affidabili, registrare e successivamente la media di almeno 3 indipendenti, curve di risposta ottimali per sito di stimolazione e animale.
p_upload/51181/51181fig3highres.jpg "src =" / files/ftp_upload/51181/51181fig3.jpg "/>
Figura 3. Procedura di acquisizione e analisi dei dati (presentazione schematica). Ripetutamente impulsi generati vengono applicati al nervo sciatico tramite elettrodi ad ago (riga superiore nella Figura 3A). Contemporaneamente, diversi corrispondenti curve di risposta neuromuscolare sono iscritte (riga inferiore in Figura 3A). Quando mediati e ingrandita, curve di risposta neuromuscolari dovute a impulsi di stimolazione (riga superiore nella Figura 3B) mostrano le seguenti proprietà caratteristiche (riga inferiore nella Figura 3B): latenza della risposta del segnale così come la durata e l'ampiezza del segnale sono indicati e possono essere ottenuto per i calcoli successivi e statistiche. Conduzione del segnale irregolare e / o registrazioni non ottimali solito risultato in varie deformazioni segnale con più di uno positivo e uno negativo deflessione o deformazione del segnale(Forma bimodale) con ampiezza ridotta (Figura 3C). - Eseguire stimolazione prossimale con un elettrodo ad ago in posizione determinata ("ps" in Figura 2).
- Per conseguire migliori condizioni di registrazione con ampiezze massime, visualizzare le curve di risposta reali simultanee al processo di stimolazione. In questo modo, lo sperimentatore è in grado di valutare immediatamente la forma delle curve di risposta e la dimensione dell'ampiezza.
- Se necessario, leggermente e con attenzione manipolare la posizione e / o l'angolo dell'ago stimolazione rispetto al nervo sciatico. Questo dolce ottimizzazione delle condizioni di stimolazione consente di raggiungere ampiezze costanti con il valore massimo possibile e una curva di risposta di tipica forma bifasico (Figura 4).
- Eseguire stimolazione distale con un elettrodo ad ago in posizione determinata ("ds" in Figura 2).
- Dopo completion di misura, di trasferire il mouse testato per una gabbia separata fino a quando non ha ripreso conoscenza sufficiente per mantenere decubito sternale. Non lasciare un animale incustodito e in compagnia di altri animali fino a quando non si è completamente ripreso dall'anestesia. Somministrare tempestivamente più analgesici che agiscono per la gestione del dolore postoperatorio. La somministrazione sistemica di farmaci anti-infiammatori non steroidei (FANS) e gli oppioidi sono raccomandati per 1-3 giorni.
- In alternativa, sacrificare il mouse ancora anestetizzato in modo rapido e umano senza alcun ulteriore dolore per l'animale, ad esempio dislocazione del collo.
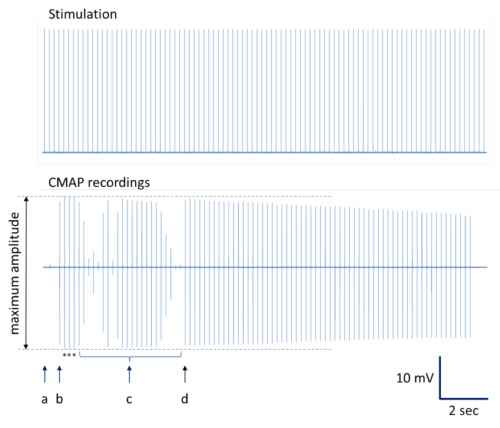
Figura 4. Illustrativa per determinare le registrazioni CMAP con ampiezze massime. Una serie completa di registrazione è presentata. (A ) Punto di inserimento con la minima risposta CMAP. (B) i risultati di circolazione stimolazione Lieve aghi nelle registrazioni CMAP con ampiezze massime. (C) Altre modifiche di posizionamento dell'ago producono registrazioni CMAP con diverse ampiezze comprese vicino-massimo ampiezze. (D) La stimolazione sostituzione dell'ago con le registrazioni di serie CMAP di ampiezze quasi massimo. Nota: decremento Tipica in ampiezze CMAP può verificarsi durante la stimolazione ripetitiva ottimale del sito di stimolazione 12, 13. Gli asterischi indicano le registrazioni CMAP con ampiezze massime rappresentati per la media.
3. Analisi
- Estrarre i parametri di conduzione nervosa basate sul rappresentante set di dati di risposta funzione neuromuscolare utilizzando un pacchetto software appropriato (ad es AtisaPro).
Nota: Si prega di gestire la determinazione dei dati in funzione del tempo con particolare attenzione perché la determinazione del punto di flesso del composto pentola azione motoriaziale (CMAP) insorgenza e la cessazione può essere difficile. Una procedura con la riproducibilità verificato è dato in figura 3B, in cui vengono utilizzati tangenti su deviazioni di segnale dopo l'esordio e prima di terminazione. - Calcola 'latenza del segnale' e di valori 'CMAP'.
- Latency 'rappresenta il ritardo di tempo tra stimolo e CMAP esordio, mentre l'intervallo di tempo tra la comparsa dei CAMP iniziale deflessione negativa per siglare il ritorno ai valori di base si chiama' durata CMAP '. Utilizzare la differenza tra latenze distali e prossimali di calcolare la velocità di conduzione insieme alla distanza tra i siti di stimolazione distale e prossimale.
velocità di conduzione = latenza / distanza tra i siti di stimolazione - CMAP '(composto potenziale d'azione del motore) ampiezza rappresenta la grandezza tra i punti positivi e negativi massimo turnaround del segnale CMAP (dato in mV).
CMAP = valore 'punto di svolta positivo' - valore 'negativo po turnaroundint '
- Latency 'rappresenta il ritardo di tempo tra stimolo e CMAP esordio, mentre l'intervallo di tempo tra la comparsa dei CAMP iniziale deflessione negativa per siglare il ritorno ai valori di base si chiama' durata CMAP '. Utilizzare la differenza tra latenze distali e prossimali di calcolare la velocità di conduzione insieme alla distanza tra i siti di stimolazione distale e prossimale.
Risultati
Abbiamo condotto una serie di misurazioni elettrofisiologiche in vivo sul nervo sciatico di 12 topi in totale per questo studio: 6 animali di ogni genere. Le misurazioni sono state effettuate con il protocollo presentato e consegnato i seguenti risultati:
Entrambi i topi maschi e femmine mostrano una velocità di conduzione del nervo sciatico medio di circa 20 m / sec (Figura 5). Questo è coerente con altre misurazioni in letteratura. Inoltre, dimostra che no...
Discussione
Il protocollo descritto fornisce un metodo semplice e affidabile per determinare nervo sciatico proprietà di conduzione su topi anestetizzati, senza la necessità di esporre il nervo di interesse. Tuttavia, questa procedura sperimentale provoca lesioni dei tessuti da puntura. E 'quindi una scelta ragionevole sacrificare gli animali dopo aver terminato le registrazioni. Tuttavia, rispetto ad altre procedure più invasive, che richiedono l'esposizione del nervo prima registrazioni, danno tissutale è relativament...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da SFB 604, DFG MO 1421/2-1 e Krebshilfe 107.089 (HM). AS è destinatario di un premio Young Investigator dalle Tumore dei Bambini Foundation (New York, USA).
Materiali
| Name | Company | Catalog Number | Comments |
| Concentric Needle Electrodes (Stimulation) | Natus Medical Incorporated San Carlos, CA 94070, USA | 9013S0901 | |
| Digital Ring Electrodes (Recording) | Natus Medical Incorporated San Carlos, CA 94070, USA | 9013S0302 | |
| ToM - Tower of Measurement (A/D converter) | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| AtisaPro, Data acquisition & analysis software | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| HSE-Stimulator T | Hugo Sachs Elektronik, Hugstetten, Germany | ||
Riferimenti
- Kimura, J. 3rd ed. Electrodiagnosis in Diseases of Nerve and Muscle. , (2001).
- Rutkove, S. B. Effects of temperature on neuromuscular electrophysiology. Muscle Nerve. 24, 867-882 (2001).
- Xia, R. H., Yosef, N., Ubogu, E. E. Dorsal caudal tail and sciatic motor nerve conduction studies in adult mice: technical aspects and normative data. Muscle Nerve. 41, 850-856 (2010).
- Zielasek, J., Martini, R., Toyka, K. V. Functional abnormalities in P0-deficient mice resemble human hereditary neuropathies linked to P0 gene mutations. Muscle Nerve. 19, 946-952 (1996).
- Raynor, E. M., Ross, M. H., Shefner, J. M., Preston, D. C. Differentiation between axonal and demyelinating neuropathies: identical segments recorded from proximal and distal muscles. Muscle Nerve. 18, 402-408 (1995).
- Pareyson, D., Scaioli, V., Laura, M. Clinical and electrophysiological aspects of Charcot-Marie-Tooth disease. Neuromol. Med. 8, 3-22 (2006).
- Schulz, A., et al. Merlin isoform 2 in neurofibromatosis type 2-associated polyneuropathy. Nat. Neurosci. 16, 426-433 (2013).
- Lamontagne, A., Buchthal, F. Electrophysiological studies in diabetic neuropathy. J. Neurol. Neurosurg. Psychiatry. 33, 442-452 (1970).
- Andersen, H., Nielsen, J. F., Nielsen, V. K. Inability of insulin to maintain normal nerve function during high-frequency stimulation in diabetic rat tail nerves. Muscle Nerve. 17, 80-84 (1994).
- Magda, P., et al. Comparison of electrodiagnostic abnormalities and criteria in a cohort of patients with chronic inflammatory demyelinating polyneuropathy. Arch. Neurol. 60, 1755-1759 (2003).
- Lindberg, R. L., et al. Motor neuropathy in porphobilinogen deaminase-deficient mice imitates the peripheral neuropathy of human acute porphyria. J. Clin. Invest. 103, 1127-1134 (1999).
- Massey, J. M. Electromyography in disorders of neuromuscular transmission. Sem. Neurol. 10, 6-11 (1990).
- Stalberg, E., Falck, B. The role of electromyography in neurology. Electroencephalogr. Clin. Neurophysiol. 103, 579-598 (1997).
- Osuchowski, M. F., Teener, J., Remick, D. Noninvasive model of sciatic nerve conduction in healthy and septic mice: reliability and normative data. Muscle Nerve. 40, 610-616 (2009).
- Oh, S. S., Hayes, J. M., Sims-Robinson, C., Sullivan, K. A., Feldman, E. L. The effects of anesthesia on measures of nerve conduction velocity in male C57Bl6/J mice. Neurosci. Lett. 483, 127-131 (2010).
- Dilley, A., Lynn, B., Pang, S. J. Pressure and stretch mechanosensitivity of peripheral nerve fibres following local inflammation of the nerve trunk. Pain. 117, 462-472 (2005).
- Vleggeert-Lankamp, C. L., et al. Electrophysiology and morphometry of the alpha- and beta-fiber populations in the normal and regenerating rat sciatic nerve. Exp. Neurol. 187, 337-349 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon