需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在对小鼠坐骨神经体内的电测量
摘要
体内神经传导特性的测量体现了强大的工具来表征神经肌肉疾病的多种动物模型。在这里,我们提出了一个简单而可靠的协议,其中对麻醉小鼠坐骨神经电生理分析可以执行。
摘要
电生理学研究允许各种神经肌肉疾病的合理的分类,并帮助连同神经病理学技术,在病理生理学1的理解。在这里,我们描述了在体内进行对小鼠坐骨神经的神经电生理研究的方法。
将动物用异氟烷麻醉,以确保镇痛试验小鼠并在此期间,约需30分钟/动物的测量不受干扰的工作环境。 37℃恒定的体温是由加热板维护和直肠温探头2连续测量。另外,心电图(ECG)中,以便测量被定期地记录连续监视所研究的动物的生理状态。
电生理记录均于坐骨神经,日最大神经进行ë外周神经系统(PNS),与两个肌肉运动和感觉纤维束供给鼠标后肢。在我们的协议,坐骨神经留在原位 ,并因而不具有要被提取或暴露,允许测量无任何不良神经刺激随着实际录音。使用适当的针电极3正进行近端和远端的神经刺激,登记所发送的电位与感测电极在腓肠肌。经过数据处理的,可靠的和对神经传导速度(NCV)和化合物肌肉动作电位(CMAP)高度一致的值,关键参数为外周神经机能总值的量化,可以实现的。
引言
电生理测量是必不可少的工具在临床和实验室环境调查周围神经功能的完整性。在人类中,有大量神经肌肉疾病和神经病变的诊断依赖于电生理学测量。通过测量神经性质传导速度或信号的电势的振幅,能够表征外周神经疾病的大致原点。
神经传导速度是高度依赖于由髓鞘启用快速信号传播。因此,脱髓鞘过程一般表现出下降传导速度4。复合肌肉动作电位(CMAP) -与功能性轴突的数量关联-是轴索损害时显著减少5的指标。
因此,通过电生理学方法手段的外周神经损伤的病因能够被辨别,如遗传性神经病6,7,糖尿病性神经病8,9,慢性炎症性脱髓鞘性多神经病(CIDP)10,或代谢性神经病11。
通常,在人类应用上的腓肠或尺神经的非侵入性的录音是优选的。在小鼠中,它是直接分析坐骨神经的神经性,同时含有较大的外周神经系统(PNS)中最大的神经 - 及肌肉运动和感觉系统的小口径轴突。
因为这里展示的过程是一个快速,简单和可靠的方法来测量相关的电生理学上的完整的小鼠外周神经的所有标准值。通过采取录音从保存生物,神经环境的生理条件有保证。
研究方案
本研究根据保护的德意志联邦共和国(Tierschutzgesetz DER德意志联邦共和国)的动物法进行,并批准了图林根州厅食品安全和消费者保护(图林根森Landesamt献给Lebensmittelsicherheit UND Verbraucherschutz)。
1,设置的测量
- 麻醉小鼠通过异氟烷/ O 2吸入-对麻醉3%的起始,在100%的氧气维持2%异氟醚( 图1)。通过测试简单的反射,如运动反射和低档疼痛的敏感性测试确认足够的麻醉。使用软膏对眼睛,以防止麻醉期间干涩建议,但没有必要的,因为该过程一般只需30分钟/动物的总和。如遇生存实验,及时管理长效止痛剂用于管理术后疼痛。
- 刮胡子的毛皮覆盖后肢用电动剃须刀,并与市售的脱毛霜脱毛执行,而动物已经在进行镇痛。为了在整个过程维持无病原状态,穿无菌手套,总是用70%乙醇仔细清洗工具。
- 通过反馈控制的加热板和热直肠探头( 图2)控制身体的温度稳定性。如果需要的话,给使用的无菌披盖以覆盖动物之间的加热板,以保持无菌的实验环境。此外,它是推荐使用的加热板,这是通过一个集成的传感器的电子控制,限制加热温度为≤40℃,以避免组织损伤。
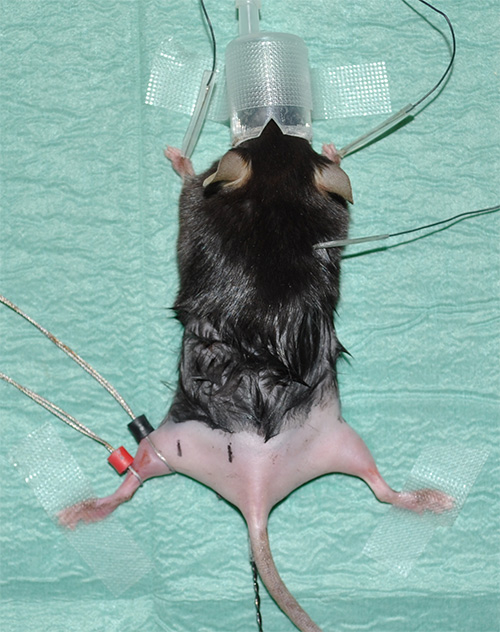
图1。地契erimental设置显示剃光后肢麻醉鼠标。 - 采取心电图(ECG)记录监视心脏率作为一个重要的参数。对于心电图记录安装三个电极如下:在颈部区域中的皮肤下的每个前肢和一个电极的皮肤下的一个电极。
- 采用接触凝胶的最佳电导率/电阻转移地方环形电极。所述感测电极(标示为黑色)被放置在那里的腓肠肌具有其最大直径位置。参比电极(以红色表示)置于正好在传感电极的下方。
注:请参阅“材料表”的设备的详细信息。 - 标记测量与近端和远端坐骨神经刺激和引线电极之间的预定但一致的距离上的正确位置上。实验方案:在从所述感测电极4毫米的距离,远端刺激就会发生。在16毫米到感测电极的距离,近端刺激将进行( 图2)。

图2代表图像显示之前,为了测量开始时的实验情况。的白色箭头表示传感(黑色)和参考(红色)在左后肢的腓肠肌电极的位置。通过针形电极的刺激,便会在定义的位置相对于黑色的感应电极来进行。远端刺激的点(黑线标记为“DS”在左后肢)具有从所述感测电极4 mm的距离;近端刺激(黑标有“PS”)的地方为16毫米远。在右后肢红线表示的约 iMate的坐骨神经的解剖过程。此外,相关的后肢肌肉的粗略位置显示为地标。星号表示直肠温度探头。
2,测量
- 原理:执行一系列的神经刺激与0.1毫秒的持续时间由单极支配28号针头电极重复生成的单个方波脉冲(重复频率200毫秒;参见图3A)。离线数据分析,建议以同时获得刺激信号连同神经肌肉功能的响应曲线( 图3B)由于神经刺激。平均一系列的最大反应(“代表神经肌肉功能反应”),为后续的数据分析。为了产生可靠的数据,记录和以后平均至少3个独立的,最佳响应每刺激位点和动物的曲线。
p_upload/51181/51181fig3highres.jpg“SRC =”/ files/ftp_upload/51181/51181fig3.jpg“/>
图3的程序进行数据采集和分析(概略表示)。重复地产生脉冲,通过针形电极(在图3A中上排)施加到坐骨神经。同时,若干个相应的神经肌肉反应曲线被记录(在图3A中下排)。当平均并放大,神经肌肉响应曲线由于刺激脉冲( 图3B中上排)显示如下的特性(在图3B中下排):信号响应的延时以及持续时间和信号的振幅的数目,而可以为后续计算和统计获得。不规则的信号传导和/或次优的记录通常会导致更多的各种信号的变形不是只有一个正极和一个负极偏转或变形的信号(双峰形状)具有降低的幅度( 图3C)。 - 与在确定的位置针电极( 图2“PS”)进行近端刺激。
- 为了达到最佳的拍摄条件,最大振幅,可视化的实际响应曲线,同时对刺激的过程。通过这样做,实验者能够立即评估的响应曲线的形状以及振幅的大小。
- 如果需要,轻微和仔细操作的位置和/或刺激针相对于坐骨神经的角度。刺激条件下,这种温和的优化使得达到恒定的幅度尽可能大的价值和典型的双相形状的响应曲线( 图4)。
- 用在确定的位置( 图2中“DS”)的针电极进行远端刺激。
- completio后n次测量,测试鼠标转移到一个单独的笼子里,直到它已经恢复了足够的意识,以保持胸骨斜卧。不要让动物无人值守和其他动物的公司,直到它完全从麻醉中恢复。及时管理长效止痛剂用于管理术后疼痛。的非甾体抗炎药(NSAID)和阿片类药物全身给药被推荐为1-3天。
- 或者,牺牲还是麻醉鼠标在一个快速和人性化的时尚没有任何进一步的疼痛的动物, 例如通过颈部脱位。
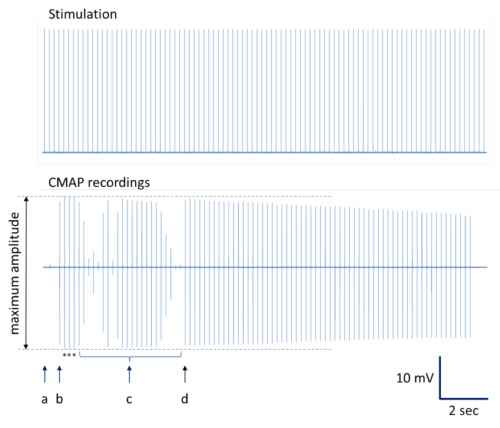
图4插图,以确定记录CMAP最大振幅。一个完整系列的注册提出。 ( 一 )插入点以最小的CMAP响应。 (二)轻微刺激针运动的结果CMAP录音与最大振幅。 ( 三)在针放置额外产生的变化记录CMAP振幅不同,包括接近最大振幅。 ( 四)刺激针替换为近最大振幅串行CMAP录音。注:典型的递减在CMAP振幅可以在最佳刺激位点12,13发生在重复刺激。星号表示CMAP记录与描绘的平均最大振幅。
3。分析
- 提取的基础上使用适当的软件( 如 AtisaPro)代表神经肌肉功能的响应数据集神经传导参数。
注:请处理与时间相关的数据测定,特别小心,因为复合运动动作锅拐点确定差分(CMAP)开始和终止是很困难的。与重复性验证的过程是在图3B,其中是用在发病后和结束前的信号偏差切线。 - 计算'的信号延时“和”CMAP的价值观。
- 延迟“表示刺激和CMAP发作之间的时间延迟,而CAMP发病的初始负偏转之间的时间跨度初始回归到基线被称为'CMAP持续时间'。使用远端和近端的延迟之间的差来计算传导速度与远侧和近侧的刺激部位之间的距离一起。
刺激部位之间传导速度=延迟/距离 - CMAP'(复合肌肉动作电位)的幅度代表了CMAP信号(毫伏给出)的最大正,负转机点之间的幅度。
CMAP =值“积极转变点” -价值“负婆转亏为盈INT'
- 延迟“表示刺激和CMAP发作之间的时间延迟,而CAMP发病的初始负偏转之间的时间跨度初始回归到基线被称为'CMAP持续时间'。使用远端和近端的延迟之间的差来计算传导速度与远侧和近侧的刺激部位之间的距离一起。
结果
我们进行了一系列体内对12只小鼠的坐骨神经电生理测量的总本研究:每组6只性别。的测量进行了与所提出的协议,并提供了以下的结果:
雄性和雌性小鼠显示约20米/秒,平均坐骨神经传导速度( 图5)。这与文献中的其他测量是一致的。此外,它表明,根据我们的数据是男性和女性之间没有相关的差异神经传导速度。
讨论
所描述的协议提供了一个简单而可靠的方法,而不需要暴露感兴趣的神经,以确定麻醉小鼠坐骨神经传导性能。然而,这一实验过程由穿刺针引起组织损伤。因此,这是一个合理的选择来完成录音后牺牲动物。然而,相对于其他更具侵入性的程序,这需要神经前录音曝光,组织损伤相对较小3,14。因此,重复的测量是可能的,并且取决于相应的研究设计。然而,某些点具有以保证一致的结?...
披露声明
作者什么都没有透露。
致谢
这项工作是由SFB 604,东风集团MO 1421/2-1和Krebshilfe 107089(陛下)的支持。 AS是从儿童肿瘤基金会(美国纽约)收件人的青年研究者奖。
材料
| Name | Company | Catalog Number | Comments |
| Concentric Needle Electrodes (Stimulation) | Natus Medical Incorporated, San Carlos, CA, USA | 9013S0901 | |
| Digital Ring Electrodes (Recording) | Natus Medical Incorporated, San Carlos, CA, USA | 9013S0302 | |
| ToM - Tower of Measurement (A/D converter) | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| AtisaPro, data acquisition and analysis software | GJB Datentechnik GmbH, Langewiesen, Germany | ||
| HSE-Stimulator T | Hugo Sachs Elektronik, Hugstetten, Germany |
参考文献
- Kimura, J. 3rd ed. Electrodiagnosis in Diseases of Nerve and Muscle. , (2001).
- Rutkove, S. B. Effects of temperature on neuromuscular electrophysiology. Muscle Nerve. 24, 867-882 (2001).
- Xia, R. H., Yosef, N., Ubogu, E. E. Dorsal caudal tail and sciatic motor nerve conduction studies in adult mice: technical aspects and normative data. Muscle Nerve. 41, 850-856 (2010).
- Zielasek, J., Martini, R., Toyka, K. V. Functional abnormalities in P0-deficient mice resemble human hereditary neuropathies linked to P0 gene mutations. Muscle Nerve. 19, 946-952 (1996).
- Raynor, E. M., Ross, M. H., Shefner, J. M., Preston, D. C. Differentiation between axonal and demyelinating neuropathies: identical segments recorded from proximal and distal muscles. Muscle Nerve. 18, 402-408 (1995).
- Pareyson, D., Scaioli, V., Laura, M. Clinical and electrophysiological aspects of Charcot-Marie-Tooth disease. Neuromol. Med. 8, 3-22 (2006).
- Schulz, A., et al. Merlin isoform 2 in neurofibromatosis type 2-associated polyneuropathy. Nat. Neurosci. 16, 426-433 (2013).
- Lamontagne, A., Buchthal, F. Electrophysiological studies in diabetic neuropathy. J. Neurol. Neurosurg. Psychiatry. 33, 442-452 (1970).
- Andersen, H., Nielsen, J. F., Nielsen, V. K. Inability of insulin to maintain normal nerve function during high-frequency stimulation in diabetic rat tail nerves. Muscle Nerve. 17, 80-84 (1994).
- Magda, P., et al. Comparison of electrodiagnostic abnormalities and criteria in a cohort of patients with chronic inflammatory demyelinating polyneuropathy. Arch. Neurol. 60, 1755-1759 (2003).
- Lindberg, R. L., et al. Motor neuropathy in porphobilinogen deaminase-deficient mice imitates the peripheral neuropathy of human acute porphyria. J. Clin. Invest. 103, 1127-1134 (1999).
- Massey, J. M. Electromyography in disorders of neuromuscular transmission. Sem. Neurol. 10, 6-11 (1990).
- Stalberg, E., Falck, B. The role of electromyography in neurology. Electroencephalogr. Clin. Neurophysiol. 103, 579-598 (1997).
- Osuchowski, M. F., Teener, J., Remick, D. Noninvasive model of sciatic nerve conduction in healthy and septic mice: reliability and normative data. Muscle Nerve. 40, 610-616 (2009).
- Oh, S. S., Hayes, J. M., Sims-Robinson, C., Sullivan, K. A., Feldman, E. L. The effects of anesthesia on measures of nerve conduction velocity in male C57Bl6/J mice. Neurosci. Lett. 483, 127-131 (2010).
- Dilley, A., Lynn, B., Pang, S. J. Pressure and stretch mechanosensitivity of peripheral nerve fibres following local inflammation of the nerve trunk. Pain. 117, 462-472 (2005).
- Vleggeert-Lankamp, C. L., et al. Electrophysiology and morphometry of the alpha- and beta-fiber populations in the normal and regenerating rat sciatic nerve. Exp. Neurol. 187, 337-349 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。