Method Article
وهناك طريقة لجعل حج القحف على بطني من الجمجمة الوليد القوارض
In This Article
Summary
ووصف الطريقة الجراحية لفضح الجمجمة البطني في الفئران حديثي الولادة. باستخدام هذا النهج فمن الممكن لفتح حج القحف لأداء الكهربية الحادة واثنين من الفوتون المجهري التجارب في الدماغ من الجراء تخدير.
Abstract
استخدام حج القحف لفي التجارب المجراة يوفر فرصة للتحقيق في ديناميات العمليات الخلوية المتنوعة في أدمغة الثدييات في مرحلة البلوغ وخلال التنمية. على الرغم من أن معظم المجراة نهج استخدام حج القحف لدراسة مناطق الدماغ التي تقع على الجانب الظهري والمناطق جذع الدماغ مثل الجسر، وتقع على الجانب البطني تبقى سلوكه نسبيا. الهدف الرئيسي من هذا البروتوكول هو لتسهيل الوصول إلى هياكل الدماغ البطني بحيث يمكن دراستها في الجسم الحي باستخدام الكهربية وأساليب التصوير. يسمح هذا النهج دراسة التغيرات الهيكلية في محاور عصبية طويلة المدى، وأنماط من النشاط الكهربائي في واحد ومجموعات من الخلايا، والتغيرات في نفاذية حاجز الدم في الدماغ في الحيوانات الوليد. على الرغم من أن هذا البروتوكول قد تستخدم في الغالب لدراسة الدماغ السمعية في الفئران حديثي الولادة، ويمكن بسهولة أن تتكيف للدراسات في أنواع القوارض الأخرى مثل الفئران حديثي الولادة، رودين الكبارالخبر ومناطق الدماغ الأخرى.
Introduction
استخدام حج القحف في تركيبة مع التصوير مضان والتقنيات الكهربية يسمح تدفق الدم الرصد، نفاذية حاجز الدم في الدماغ وقياس نشاط الخلايا العصبية والخلايا الدبقية في الحيوانات الحية 1-3. وقد استخدمت العديد من المختبرات هذا النهج إلى توفير نظرة ثاقبة فسيولوجيا الدماغ في ظروف صحية والمرض، ولكن لا تزال هناك فجوات في فهمنا للكيفية التي تنشأ هذه العمليات خلال التنمية. وعلاوة على ذلك، ركزت معظم الدراسات على مناطق الدماغ التي يسهل الوصول إليها من السطح الظهري من الجمجمة، بحيث هياكل الدماغ البطني مع الأدوار الفسيولوجية المختلفة وقد تم دراسة معظمها باستخدام فيفو السابقين النهج.
الهدف الرئيسي من هذا البروتوكول هو لتوفير وسيلة لفتح حج القحف على الجمجمة بطني من القوارض. وقد تم تكييف هذا النهج من الدراسات الكلاسيكية التي أجريت في الثدييات الكبيرة مثل الكلاب والقطط لريكو الفسيولوجيا العصبية الحسيةrdings من الدماغ السمعية 4-7. في هذا البروتوكول ومع ذلك، هناك التحدي الرواية من تنفيذ الإجراء في الحيوانات الوليد. باستخدام المعالم الأوعية الدموية، وقد استخدم هذا البروتوكول تكييفها سابقا لدراسة الدماغ السمعية من الفئران حديثي الولادة، والفئران الكبار ومناطق الدماغ الأخرى مثل الزيتون أدنى 8-11 (الشكل 1).
والميزة الرئيسية لحج القحف بطني على الطرق القائمة لدراسة نوى الدماغ البطني هو أنه يوفر الوصول المباشر إلى هياكل الفائدة في الحيوانات الحية. على سبيل المثال، يتم ترجمة الخلايا السمعية من مجمع الزيتوني متفوقة بضع عشرات من ميكرومتر من سطح الدماغ، وهو أمر مهم لوضع المستهدفة من تحقيقات واستخدام النهج التصوير ثنائي الفوتون في عمق التصوير التي يمكن أن تقتصر على 0.5 مم تشتت الضوء وامتصاص الأنسجة. يوفر حج القحف بطني أيضا إعداد مع الوصلات العصبية سليمة نسبيا، ذوي الخوذات البيضاءتتعطل معنوى في الاستعدادات شريحة الحادة وعضوي النمط 12. وعلى النقيض من البروتوكولات الأخرى لفي التجارب المجراة الفسيولوجيا العصبية 13، ويمكن الجمع بين نهج بطني مع تسجيل متعدد القطب وأساليب التصوير التي توفر معلومات حول الفرق الخلوية (أرقام 6 و 7). أخيرا، في تركيبة مع هذا البروتوكول المذاب fluorescently المسمى يمكن حقنها في الأوعية الدموية لقياس التغيرات في نفاذية حاجز الدم في الدماغ إلى المذاب (الشكل 8).
Protocol
بروتوكول التالية يتبع المبادئ التوجيهية رعاية الحيوان التي وضعتها اللجنة المؤسسية رعاية الحيوان واستخدام (IACUC) في كلية مدينة نيويورك.
1. التنبيب الحيوان (10-20 دقيقة)
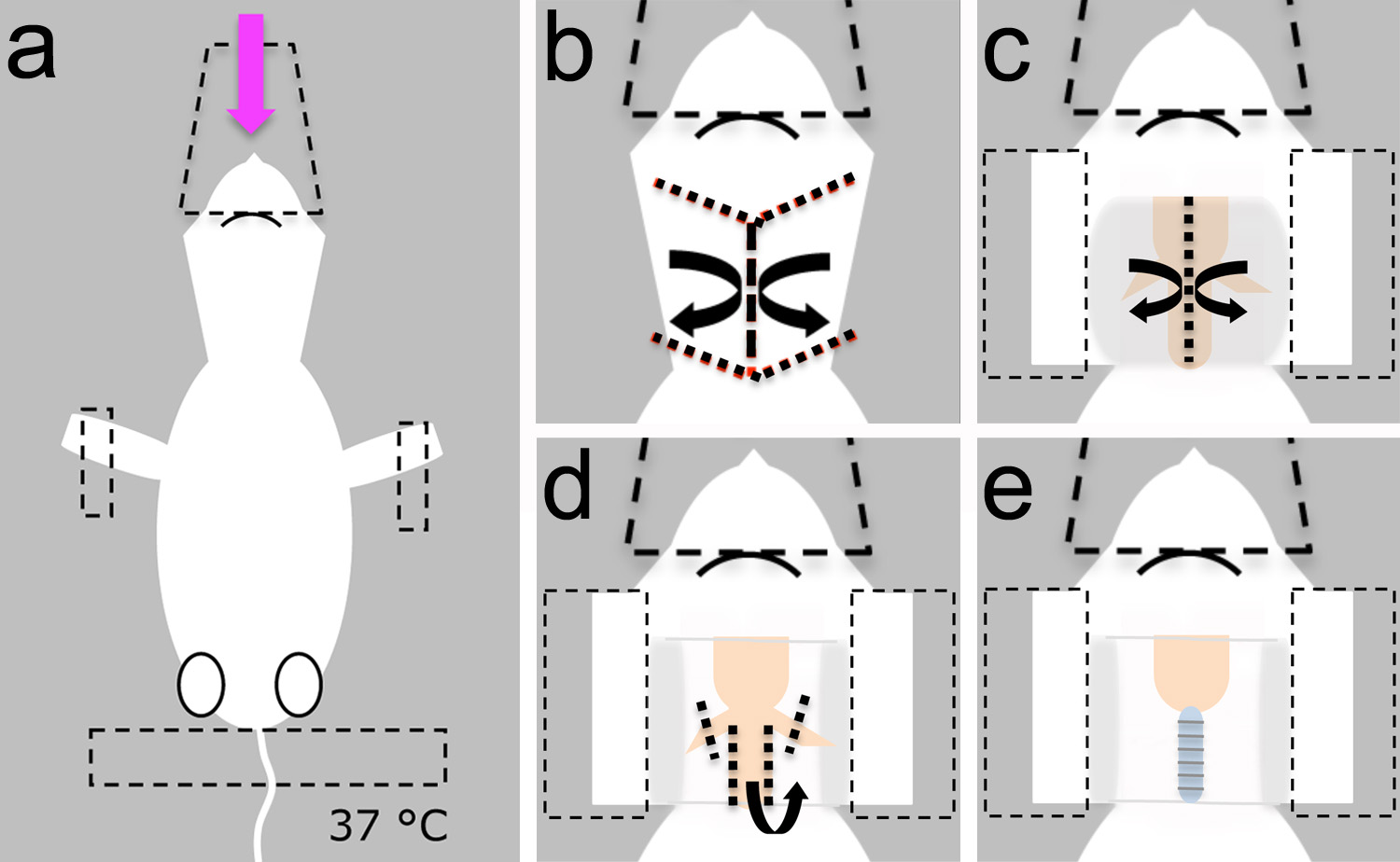
- قبل الجراحة، وإعداد حل قارع الأجراس الثدييات. تجميع الأدوات الجراحية، وسادة التدفئة، والتنفس الصناعي الحيوانات الصغيرة على مقاعد البدلاء (الشكل 2).
- لقياس نفاذية حاجز الدم في الدماغ جعل 10 مل من 1٪ مصل بقري الزلال (BSA) في حل قارع الأجراس وحل TRITC-ديكستران 155 دينار في 8 ملغ / مل في 1٪ BSA الحل، الحل فلتر مع 25 ملم حقنة مرشح (0.2 ميكرومتر حجم المسام) وتخزينها في حقنة المغطاة احباط في الظلام.
- تخدير الحيوان باستخدام isoflurane و. استخدام 5.0٪ لتحريض و1.5-3.0٪ للصيانة. بدلا من مزيج من الكيتامين (41.7 ملغ / كلغ) وزيلازين (2.5 ملغم / كغم من الجسم) يمكن استخدامها. عمق التخدير يمكن فحصها من قبل قرصة أخمص قدميه المنعكس منالأطراف العلوية والسفلية.
- وينبغي أن تدار جرعات لاحقة من الكيتامين (41.7 ملغ / كغ من وزن الجسم) وزيلازين (2.3 ملغم / كغم من وزن الجسم) في الزيادات من ⅓ من الحد الأقصى للجرعة لتجنب جرعة زائدة. فمن المستحسن استخدام جهاز التنفس الصناعي القوارض لمواجهة الناجم عن زيلازين الاكتئاب في الجهاز التنفسي.
- وضع الجرو تخدير ملقاة على الجانب الظهري وتأمين رئيسها مع مخروط البلاستيكية المستخدمة لتقديم مخدر (الشكل 3A).
- تأمين الحيوان مع شريط لاصق على أطرافه الصدارة والذيل (الشكل 3A).
- بديل لتأمين رأس الجرو هو استخدام لوحة الرأس تعلق على قضيب معدني.
ملاحظة: تأكد من تعيين سادة التدفئة إلى 37 درجة مئوية لتجنب انخفاض حرارة الجسم (الشكل 3A).
- استخدام مقص (الشكل 2B) لجعل واحدة طولية وأربعة شقوق جانبية على الجلد المغطي الرقبة (الشكل 3B). باستخدام تقنية حادة، تشريح الجلد ووضعه جانبا باستخدام ملقط (أرقام 2C و 3C).
- عقد الجلد أسفل باستخدام شريط لاصق. استقرار الرأس في وضع أفقي (الشكل 3C).
- باستخدام مقص الربيع (الشكل 2D) وتقنية حادة، الغدد دفعة وطبقات الدهون جانبا لفضح القصبة الهوائية (الشكل 3C). تحديد موقع الشرايين السباتية.
- الحفاظ على الشرايين السباتية بعيدا عن القصبة الهوائية.
ملاحظة: ثقب السباتية يمكن أن يؤدي إلى فقدان كميات هائلة من الدم والموت من الجرو.
- الحفاظ على الشرايين السباتية بعيدا عن القصبة الهوائية.
- باستخدام مقص الربيع (الشكل 2D) تشريح العضلات الطولية التي تغطي القصبة الهوائية. قطع العضلات الطولية الموجودة تحت (3D الشكل) القصبة الهوائية.
ملاحظة: يجب أن تكون واضحة للعيان حلقات القصبة الهوائية (الشكل 3E).- باستخدامملقط (الشكل 2C)، وتعادل قطعتين من الخيط حول القصبة الهوائية. وقطعة واحدة من خياطة تأمين أنبوب التهوية وسيتم استخدام موضوع الثاني لإغلاق منقاري القصبة الهوائية إلى نقطة الإدراج أنبوب التهوية (الشكل 4A).
ملاحظة: بلل تتعرض الأنسجة بانتظام مع حل قارع الأجراس لمنع الجفاف.
- باستخدامملقط (الشكل 2C)، وتعادل قطعتين من الخيط حول القصبة الهوائية. وقطعة واحدة من خياطة تأمين أنبوب التهوية وسيتم استخدام موضوع الثاني لإغلاق منقاري القصبة الهوائية إلى نقطة الإدراج أنبوب التهوية (الشكل 4A).
- باستخدام مقص الربيع (الشكل 2D) إجراء شق على واحدة من حلقات القصبة الهوائية التي تقع بين اثنين من المواضيع وضعت في الخطوة 1.6.1 (الشكل 4C).
ملاحظة: تأكد من أن أي سائل يدخل القصبة الهوائية مفتوحة. سوف السوائل في القصبة الهوائية يسبب الاختناق. - إدراج أنبوب التنبيب (الشكل 4B) في القصبة الهوائية وتشديد موضوع أقل لضمان الحصول عليها. باستخدام ملقط (الشكل 2C)، وتشديد موضوع العليا لإغلاق الخلفي القصبة الهوائية إلى نقطة الإدراج من أنبوب التنبيب.
- Tighteن وتقليم نهايات اثنين من المواضيع (الشكل 4D-F).
ملاحظة: بخار داخل أنبوب التنبيب هو علامة جيدة من السيطرة على تدفق الهواء.
- Tighteن وتقليم نهايات اثنين من المواضيع (الشكل 4D-F).
- على الفور تبديل العرض isoflurane وإلى التنفس الصناعي. ضبط حجم المخ ومعدل التهوية وفقا لوزن الحيوان.
- ختم الأنسجة المحيطة يتعرض مع المطاط الصناعي (الشكل 5A). الحفاظ على سطح مبلل ونظيفة.
2. القصبة الهوائية وإزالة العضلات لفضح الجمجمة (5-10 دقيقة)
- استخدام مقص الربيع (الشكل 2D) لقطع القصبة الهوائية المجاورة للأنبوب التهوية. أداء اثنين من التخفيضات على طول الجدار العضلي للالشدق لفضح نهاية الذيلية من الحنك (الشكل 5B).
ملاحظة: إذا لزم الأمر، واستخدام cauterizer لوقف النزيف. سوف يسبب النزيف غير المنضبط موت الحيوان. - تنظيفالمنطقة باستخدام كميات وفيرة من قارع الأجراس الحل (الشكل 5C). تحديد الفجوة بين الفقرات الماضي والعظام باسيل القذالي (الشكل 5D).
ملاحظة: إن الفجوة بين عظام الجمجمة معلما مفيدا لتحديد هياكل الدماغ. يقع الزيتون السفلي تحت هذه الفجوة. يقع مجمع الزيتوني متفوقة السمعية تحت العظم القذالي باسيل في الاتجاه منقاري من هذه الفجوة (انظر أيضا الشكل 1). - تنظيف المنطقة باستخدام ملقط (الشكل 2C) ومقص الربيع (الشكل 2D). لا ثقب الأوعية الدموية.
ملاحظة: إذا لزم الأمر، يكوي لوقف النزيف.- بعد منطقة معرضة نظيفة من الدهون والأنسجة العضلية، ينبغي أن الفضاء الفاصل بين عظم القذالي باسيل وفقرة مشاركة تكون مرئية (الشكل 5D).
3. القحف (15-30 دقيقة)
- استخدام microdrill أو متطرفالمطهر الصوتية. تحديد موقع الجدار الإنسي من الفقاعة.
- رقيقة الجمجمة بجعل شكل مقلوب D حتى الشرايين الكامنة مرئية (الشكل 5E).
ملاحظة: الشريان القاعدي (BAS) يعمل على رأس خط الوسط الدماغ. الشريان المخيخي السفلي الأمامي (الأيكا) فروع على المستوى الثنائي، ويمكن استخدامها بشكل موثوق كمعلم كما أن لديها موقف ثابت في الحيوانات المختلفة. - عندما ضعفت الجمجمة، وكسر برفق باستخدام إزميل تشريح (الشكل 2E). إزالة قطعة العظم مع ملقط (الشكل 2C). بدلا من ذلك، رفع وكسر الجمجمة باستخدام إبرة عازمة.
ملاحظة: كرر هذا الإجراء حتى حجم وشكل من حج القحف هو المناسب للتجربة كان مقررا. ينبغي أن وبا والأيكا تكون مرئية من خلال غشاء الجافية (الشكل 5F).
- رقيقة الجمجمة بجعل شكل مقلوب D حتى الشرايين الكامنة مرئية (الشكل 5E).
- تنظيف المنطقة عدة مرات مع حل قارع الأجراس الطازجة. باستخدام ماصة سنوياس يجف سطح غشاء الجافية.
- إذا لزم الأمر، واستخدام إبرة خياطة لإزالة غشاء الجافية دون تشريد أو كسر وبا الشرايين معلما والأيكا.
ملاحظة: عند ثقب الجافية السائل النخاعي سوف تتدفق. تنظيف المنطقة مع حل قارع الأجراس والحفاظ مبلل في كافة مراحل التجربة.
- إذا لزم الأمر، واستخدام إبرة خياطة لإزالة غشاء الجافية دون تشريد أو كسر وبا الشرايين معلما والأيكا.
4. الكهربية التجربة
- حدد polytrode وفقا لتصميم التجربة (الشكل 7A). استخدام الفرشاة الجميلة لمعطف polytrode مع الجاذبة. نقل الحل الجاذبة في أنبوب microcentrifuge 1 مل، وتراجع الفرشاة في الحل وضرب بلطف وpolytrode تحت التوجيه البصري (أي باستخدام المجسام). تبدأ في غيض من التحقيق ومواصلة بعناية حتى يتم المغلفة جميع أقطاب موحد.
- وضع القطب الأرض داخل تجويف الفم. تحميل polytrode في 7B حامل القطب (الشكل ).
- بدوره على مكبر للصوت وتحقق من أن كافة الاتصالات تعمل بشكل جيد.
- وضع القطب فوق بس في نقطة فرع الأيكا (موقف صفر). نقل الكهربائي إلى نقطة الهدف المطلوب باستخدام منقاري الأطراف تنسيق (الشكل 7C) المناسبة.
- وضع قطب كهربائي على سطح الدماغ ونقلها إلى العمق المطلوب في الخطوات من 5-10 ميكرون.
- أداء تسجيل وفقا لتصميم التجريبية. حفظ البيانات لمزيد من التحليل.
5. ثنائي الفوتون التصوير التجربة
- بدوره على المجهر. تعيين الطول الموجي الإثارة واستخدام عامل تصفية الانبعاثات المناسبة. الإثارة في 800 نانومتر و607 ± 45 نانومتر الفرقة تمرير تصفية الانبعاثات تعمل بشكل جيد لتصوير TRITC-ديكستران.
- تحديد اليمين أو اليسار الشريان السباتي. باستخدام تقنية كليلة تشريح الشريان السباتي من الأنسجة الضامة المجاورة أو الأعصاب.
- انتقاء وعقد السباتيالشريان مع مرقئ. التعادل ثلاث قطع من خياطة حول الشريان السباتي.
- تشديد موضوع أقرب إلى الجانب القلب لوقف تدفق الدم وترك الأخريين المواضيع فضفاضة.
- استخدام مقص غرامة لإجراء قطع صغير في زاوية 45 درجة على الشريان السباتي بين موضوع وموضوع ربط فضفاضة المقبل.
ملاحظة: تنظيف الدم مع ورقة ماصة.
- يقني؛ يدخل القنية الشريان السباتي. إدراج أنابيب تمتلئ حل TRITC-ديكستران في خفض على الشريان السباتي حوالي 5 ملم الموجهة نحو عميق رأس الجرو.
- تشديد الأخريين المواضيع حول الشريان لعقد أنابيب والشريان معا. تشديد المواضيع، وتقليم والمطاط الصناعي إضافة إلى مزيد من الاستقرار.
ملاحظة: يتم توصيل الطرف الآخر من الأنبوب مع حقنة تحتوي على محلول TRITC-ديكستران (المعد في الخطوة 1.1).
- تشديد الأخريين المواضيع حول الشريان لعقد أنابيب والشريان معا. تشديد المواضيع، وتقليم والمطاط الصناعي إضافة إلى مزيد من الاستقرار.
- إصلاح حقنة على ضخ حقنة.
- مجموعةسرعة في الشريان السباتي معدل تدفق الدم من الجرو. بدوره على ضخ حقنة لبضع ثوان وتحقق يدويا أن محلول الصبغة يمكن حقنه في الشريان السباتي. ملاحظة: على افتراض أن معدل تدفق الدم في الشريان السباتي من الفئران الكبار (240-280 ز) حوالي 3 مل / دقيقة 14، ومعدل تدفق الدم عن الجرو الفئران (على سبيل المثال P10 الجرو وزنها 15-25 غ) ويمكن حساب ل مجموعة ،16-،3 مل / دقيقة.
- وضع الحيوان تحت المجهر الهدف. حقن ديكستران فلوري في مجرى الدم.
- تحديد مجالات الاهتمام على الدماغ البطني مع الهدف الهواء 5X. التبديل إلى الهدف 20X 40X أو (الغمر بالماء، NA = 0.5 أو 0.8، على التوالي) لتركيز المنطقة ذات الاهتمام (ROI).
- بدء التصوير وضبط المعلمات الحصول على الصور (مثل التعرض الوقت، قوة الليزر، وزيادة كاشف) حتى كثافة مضان في الأوعية الدموية من العائد على الاستثمار هو الأمثل (أيليس منخفضا جدا ولكن ليس لالمشبعة).
- بدوره على ضخ حقنة لحقن محلول الصبغة في الشريان السباتي والحصول على سلسلة زمنية في المستوى البؤري ثابت.
6. رعاية الحيوان الإجراء التالي
- هذا هو إجراء المحطة. في نهاية التجربة على الحيوانات يجب أن يتم التخلص مع جرعة زائدة من بنتوباربيتال (100 ملغ / كغ، والحقن داخل الصفاق) أو أي وسيلة أخرى من القتل الرحيم التي وافقت عليها المبادئ التوجيهية القتل الرحيم الرابطة الأميركية للطب البيطري.
ملاحظة: الإرواء من خلال القلب مع حل قارع الأجراس يتبع مع حل تثبيتي ينصح لمزيد من التحليل النسيجي.
النتائج
التثقيب الكهربائي من استشفاف العصبية
نواة الإنسي من الجسم شبه منحرف (MNTB) هي مجموعة من الخلايا في مجمع الزيتوني المتفوقة التي تمت دراستها سابقا باستخدام هذا البروتوكول. على سبيل المثال، ماصات المشبك التصحيح يمكن استخدامها ل electroporate استشفاف العصبية (الشكل 6) 9. عندما توضع ماصات بالقرب من خط الوسط كما هو مبين في الشكل 6A، والنتيجة هي أن متصالبة محاور عصبية وارد وصفت. مجهر ثنائي الفوتون مجهزة الفتحة العددية عالية الهدف غمر المياه يمكن استخدامها لصورة ألياف الوصول إلى MNTB، بما في ذلك فروع ضمانات دقيقة جدا (السهام في الشكل 6B). ويمكن أيضا أن يتم تسليم استشفاف العصبية إلى MNTB مباشرة، كما هو مبين في الشكل 6C. والنتيجة هي وضع العلامات الخلايا MNTB ومحاور عصبية وارد، كما يمكن التقدير من قبل التصوير مع الفتحة العددية الهدف غمر المياه أقل (الشكل 6D). مميزة العين من استخدام الهدف التكبير أقل هو أن أوسع مجال الرؤية يمكن فحصها، وعلى الرغم من هذه النتائج إلى انخفاض في القرار المكانية ويرجع ذلك إلى انخفاض الفتحة العددية الهدف، وخلايا MNTB الفردية يمكن تمييزها جيدا (الأسهم في الشكل 6D) . متوسط مدة هذه التجارب للأعمار P1-P5 هو 3.1 ± 1.4 ساعة (ن = 22 الجراء).
التسجيلات الكهربية
عفوية اطلاق انفجر هو شكل من أشكال النشاط الكهربائي في الخلايا التنموية وحظ MNTB واحد قبل بداية سماع 11،13. باستخدام هذا البروتوكول الجراحية فمن الممكن أيضا لاستهداف صفائف multielectrode (polytrodes) إلى MNTB (الشكل 7A-ب). والنتيجة هي تسجيل النشاط العفوي في الفرقة الخلايا MNTB. ويبين الشكل 7E تسجيل polytrode ممثل من الفئران P6. في هذه التجربة، والمغلفة polytrode مع الجاذبة صبغ lipophylic باستخدامالفرشاة رقيقة (انظر الخطوة 4.1). بعد أداء وتسجيل ومعالجة المخ للتحليل النسيجي، وكان يستخدم موقع المسار polytrode الجاذبة المسمى لتأكيد السليم استهداف لMNTB (الشكل 7D). متوسط مدة التجارب للأعمار P1-P6 هو 2.0 ± 0.7 ساعة (ن = 33 الجراء).
قياس نفاذية microvessel
ويمكن أيضا أن تستخدم هذا البروتوكول لأداء تجارب التصوير ثنائي الفوتون من نفاذية الأوعية الدموية. A المذاب الفلورسنت (TRITC-ديكستران، MW 155 دينار كويتي، ستوكس دائرة نصف قطرها 8.5 نانومتر ~) تم حله في 1٪ BSA قارع الأجراس الحل وحقنها في الدورة الدموية الدماغية من خلال قنية إدراجها في الشريان السباتي 14. على عكس الذيل حقن الوريد، وهذا الإجراء يتجاوز القلب ويدخل المذاب الفلورسنت مباشرة في دوران الأوعية الدقيقة في الدماغ. ويوضح الشكل 8A نوعية وسم الأوعية الدموية الدم الذي ينتج من استخدام هذا الإجراء. بعد المستمرنضح من المواد المذابة وصفت في مجرى الدم فمن الممكن الحصول على تسلسل الوقت الفاصل بين المنطقة ذات الاهتمام، كما هو مبين في الشكل 8B. وقد تم قياس مجموع كثافة مضان في المنطقة ذات الاهتمام حاليا ونموذج رياضي يستخدم لتحديد نفاذية حاجز الدم في الدماغ لfluorescently المسمى المواد المذابة (الشكل 8C) 15. متوسط مدة التجارب للأعمار P9 P10-2.3 ± 0.8 ساعة (ن = 3 الجراء).
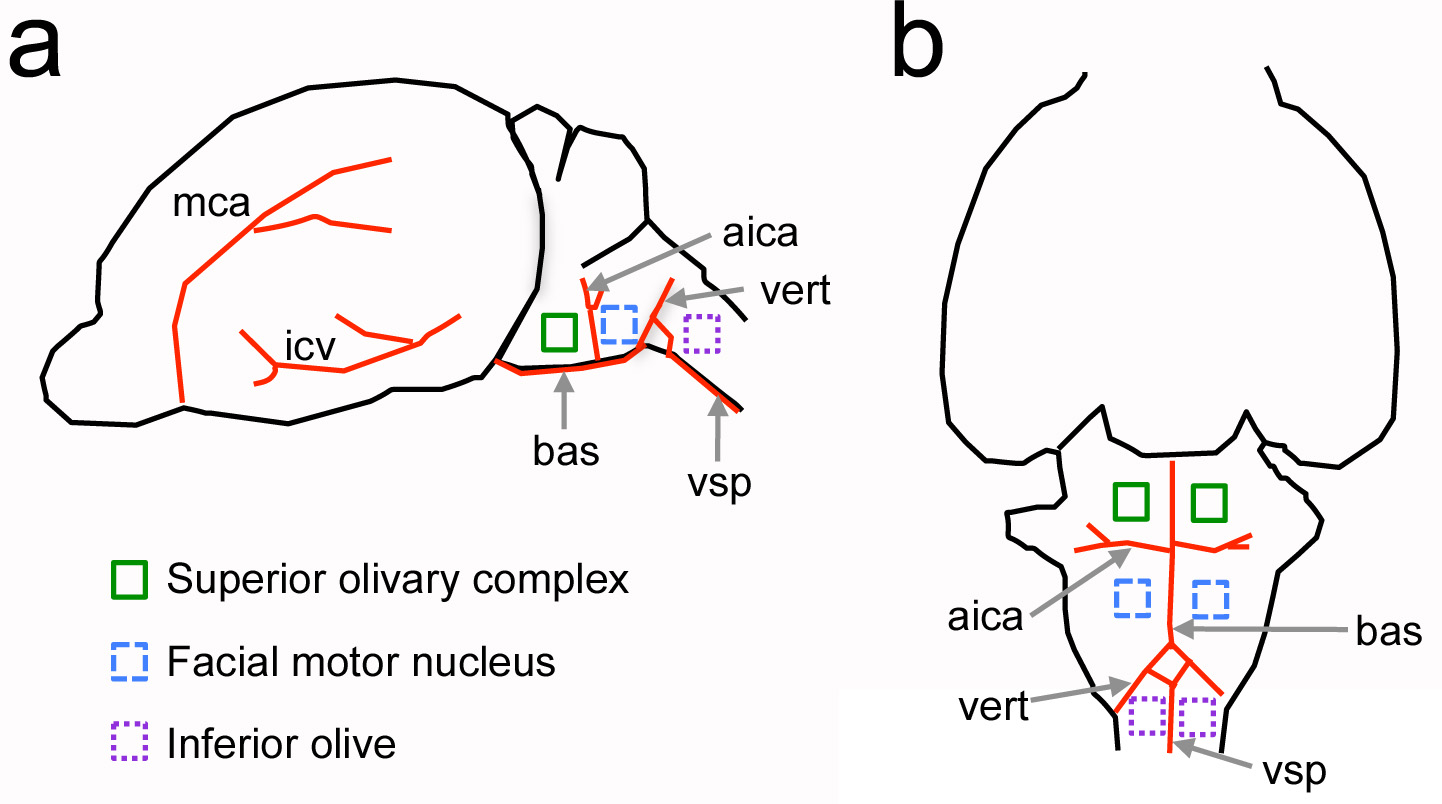
الشكل 1. الموقع النسبية من بطني الهياكل العصبية الدماغ فيما يتعلق معالم الأوعية الدموية في الفئران حديثي الولادة. لذلك، عرض جانب من الدماغ. ب، عرض البطنية من الدماغ. الأوعية الدموية الرئيسية وتظهر في الهياكل الحمراء والعصبية من الفائدة دائرة الهجرة والجنسيةicated بمربعات ملونة. لا يوجه إلى مقياس. الأيكا = الأمامي الشريان المخيخي السفلي؛ وبا = الشريان القاعدي؛ ICV = الوريد الدماغي السفلي؛ MCA = الشريان الدماغي الأوسط؛ فير = الشريان الفقري؛ VSP = الشريان الفقري بطني. اضغط هنا لمشاهدة صورة أكبر.

الشكل 2. الإعداد الجراحية. لذلك، ويمكن أن يتم جراحة على لوحة الخبز الصغيرة (1) ويستريح على قمة أعلى الجدول مستقرة. ويمكن للسادة التدفئة (2) وجهاز التنفس الصناعي الحيوانات الصغيرة (3) يتم تثبيتها على متن الخبز لتسهيل تحريك إعداد بأكمله عند الحاجة. التنفس الصناعي الحيوانات الصغيرة يمكن أن تعمل بالطاقة بواسطة بطارية (4). حامل المغناطيسي (5) يمكن استخدامها لتأمين مخروط الأنف تستخدم لتوصيل المخدر. مخروط الأنف يمكنأيضا مساعدة في تأمين الرأس في وضع مستقر. إذا لا يحتاج الحيوان الذين سيتم نقلهم، ومياداة مجهرية (6) يمكن استخدامها لتحقيقات المركز لالكهربية أو تتبع التجارب العصبية. هي مصدر الضوء (7) والمجسام (ليس في الصورة) اللازمة لتصور هياكل مهمة خلال المجهرية. ب، وتستخدم مقص صغير في الخطوة 1.4. ج، تستخدم الملقط في الخطوات 1.4، 1.6.1، 1.8 و 1.8.1 د، وتستخدم مقص الربيع في خطوات 1.5، 1.6 و 1.7. ه، ويستخدم تشريح إزميل في الخطوة 3.1.2. شريط النطاق في البريد = 1 مم، ينطبق على دينار بحريني. اضغط هنا لمشاهدة صورة أكبر.
الرقم 3. فضح القصبة الهوائية لالتنبيب.لذلك، يتم تخدير الحيوان، وضعت في وضعية الانبطاح والمضمون مع مخروط الأنف والشريط (الخطوط المتقطعة). ب، يتم قطع الجلد وتوضع جانبا لفضح الكامنة وراء طبقة الدهون. ج، والدهون والغدد المغطي (كما هو موضح في الرمادي يتم دفع) جانبا لفضح القصبة الهوائية. ويستخدم الشريط لتأمين الجلد المغطي (الخطوط المتقطعة). د، يتم تشريح القصبة الهوائية من عضلات. ه، والتصور من حلقات القصبة الهوائية يشير إلى إزالة ناجحة من العضلات الفوقية. اضغط هنا لمشاهدة صورة أكبر.
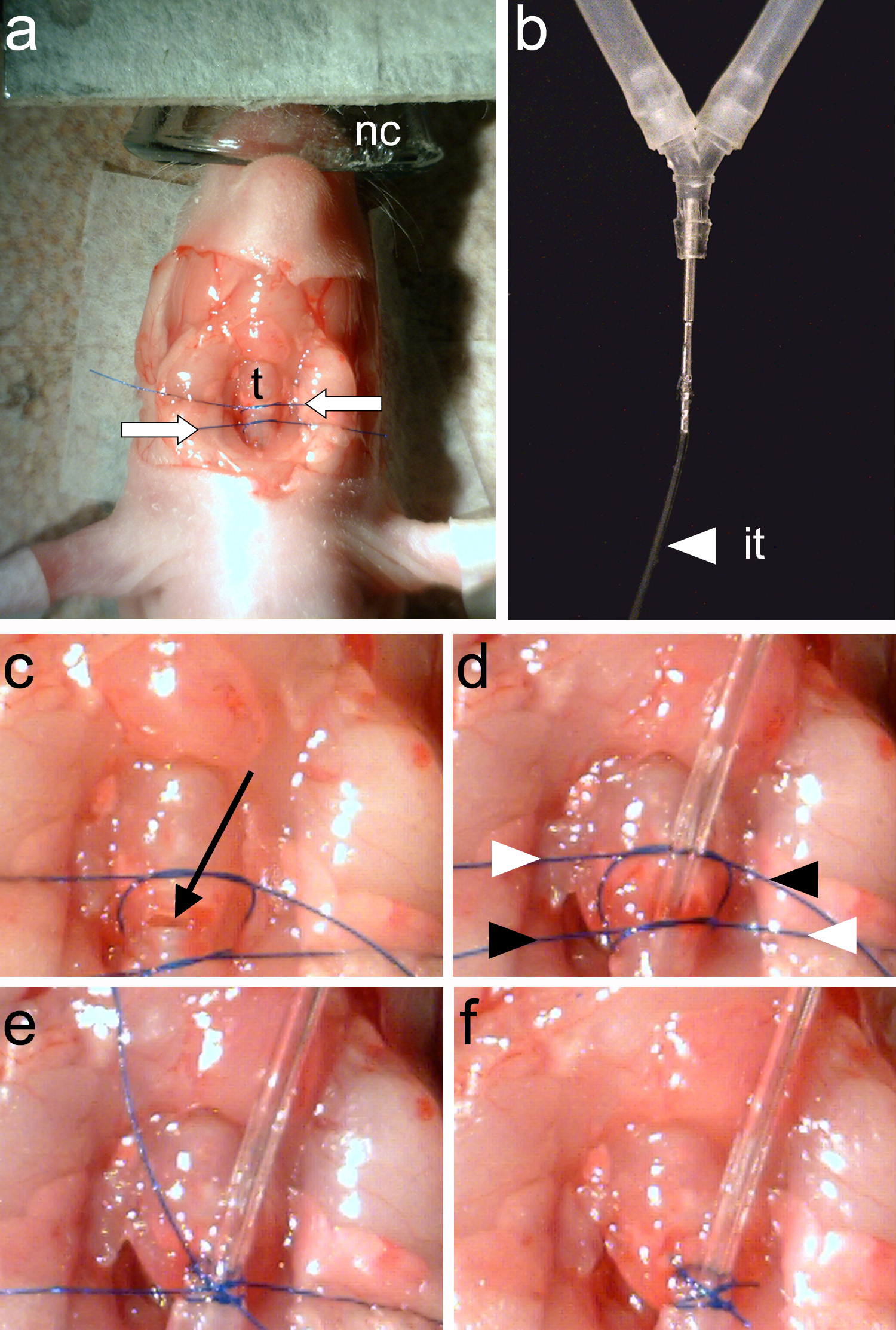
الشكل 4. تنبيب الحيوان. لذلك، وترتبط اثنين المواضيع خياطة (السهام البيضاء) حول القصبة الهوائية(ر). ب، وأنبوب التنبيب (عليه) يجب ان تكون مرتبطة بإحكام إلى أنبوب ذ الحيوان التنفس الصناعي. ج، ويرصد القصبة الهوائية بين المواضيع خياطة اثنين (السهم الأسود). د، يتم إدراج أنبوب التهوية و يتم شد الخيط اثنين من المواضيع. يتم شد نهايات الخيوط مرة أخرى بطريقة عبرت (المشار إليها السهام البيضاء والسوداء). ه، وترتبط النهايات خياطة. و، وقلص النهايات خياطة والتنبيب كاملة. اضغط هنا لمشاهدة صورة أكبر.
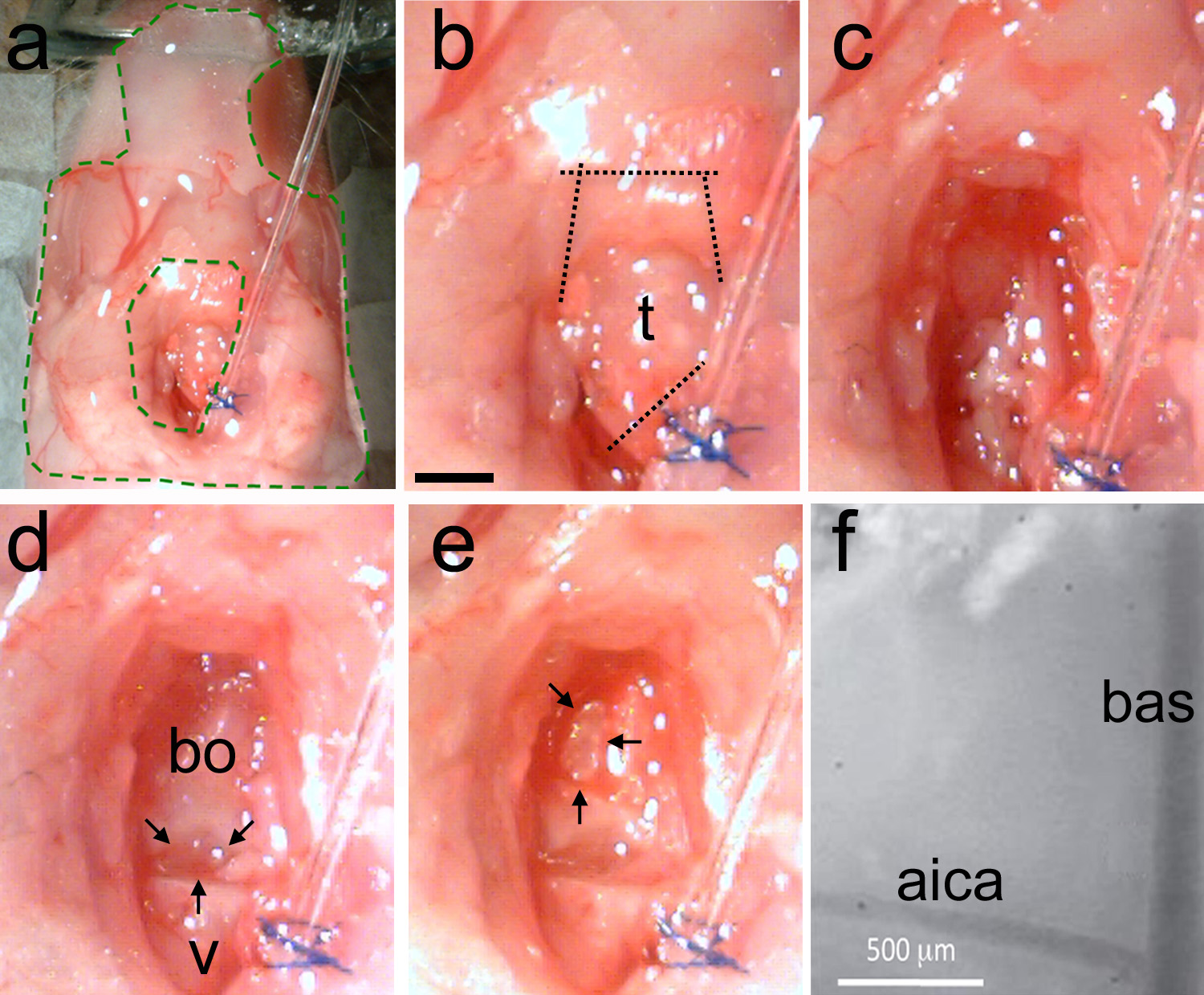
الرقم 5. إزالة القصبة الهوائية وجعل حج القحف. لذلك، يتم إعداد استقر مع الإعلاميين المطاط الصناعي (منطقة دي أخضر متقطع خطوط). ب، يتم التعرف على القصبة الهوائية ثم يتم إجراء تخفيضات الأولى لفصل القصبة الهوائية بعيدا عن أنبوب التنبيب، ثم إلى قطع عضلات الفك السفلي (الخطوط المنقطة). ج، تنظيف سطح الجمجمة باستخدام حادة تقنية لإزالة العضلات واستخدام ورقة ماصة لإزالة الدهون والدم. د، مثال لمنطقة نظيفة يبين فقرات الماضي (الخامس) وباسيل القذالي العظام (بو). هناك فجوة الطبيعية بين عظام اثنين (الأسهم السوداء). ه، وذلك باستخدام الموجات فوق الصوتية microdrill أو المطهر رقيقة الجمجمة في شكل مقلوب D (الأسهم السوداء). كسر بلطف الجمجمة ضعيفة وإزالة قطعة من العظام. وينبغي أن يكون معلما الأوعية الدموية مرئية. و، بترف، التكبير من معالم الأوعية الدموية على سطح الدماغ عرضة للخطر. وبا = الشريان القاعدي؛ الأيكا = الشريان المخيخي الأمامي السفلي. شريط النطاق في ب = 1 مم، ينطبق على م.highres.jpg "الهدف =" _blank "> اضغط هنا لمشاهدة صورة أكبر.
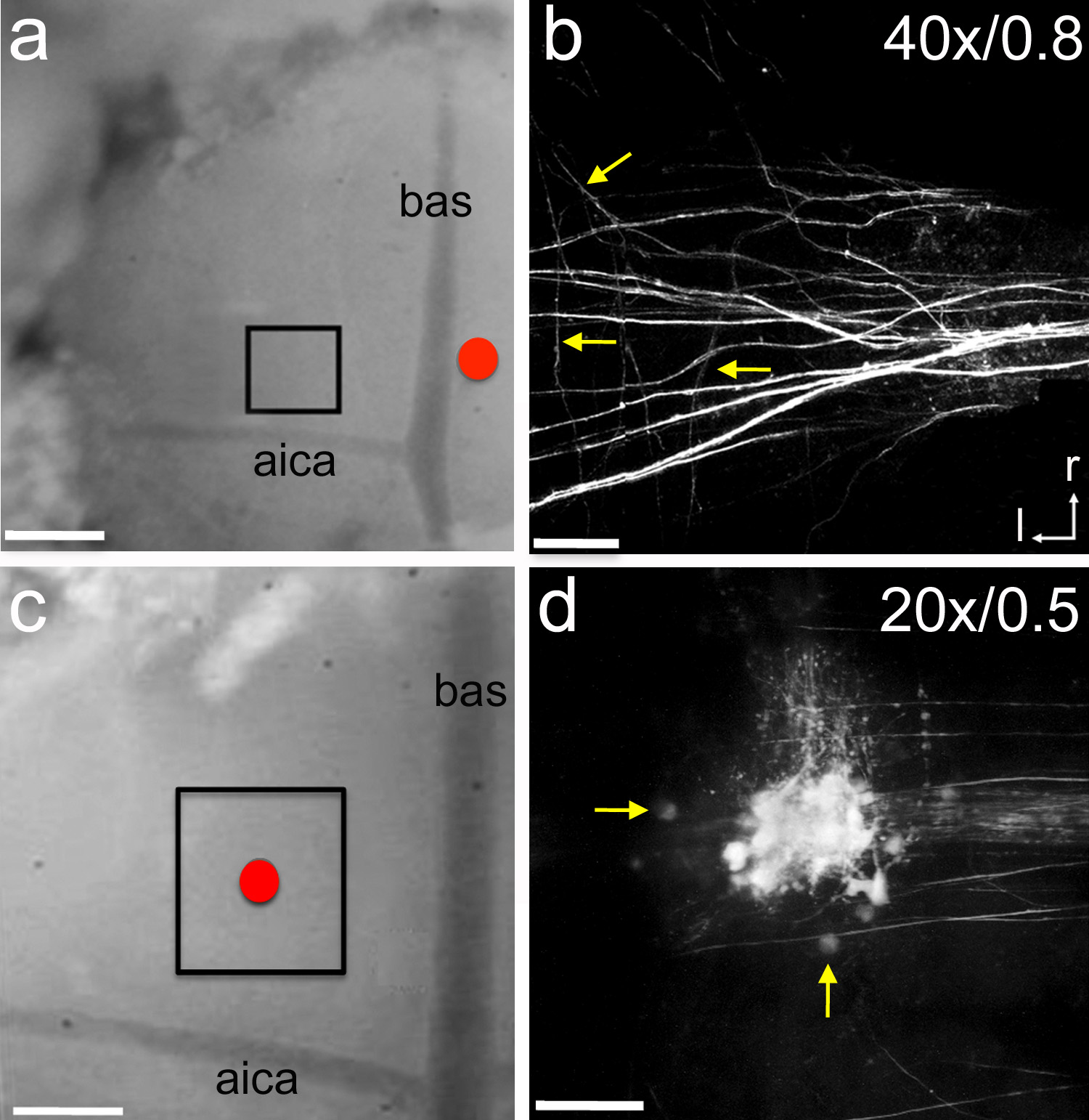
الرقم 6. التثقيب الكهربائي من استشفاف العصبية. لذلك، وضعت والزجاج الكهربائي التي تحتوي على العصبية التتبع الدقيقة روبي بالقرب من خط الوسط (دائرة حمراء). تم electroporated التتبع باستخدام تسليمها الثاني 7 نبضات طويلة -5 أمبير كل 14 ثانية لمدة 15 دقيقة. بعد 1 ساعة من وقت الشفاء كان تصوير المنطقة محاصر مع مجهر ثنائي الفوتون. الفئران P1 الجرو. ب، نموذج الصورة ض المكدس لوضع العلامات محوار وارد في MNTB. تشير الأسهم إلى فروع جانبية الفردية. ج، كان وضعه والزجاج الكهربائي مليئة روبي الصغرى على رأس MNTB (دائرة حمراء). تم electroporated التتبع باستخدام نفس الإعدادات الموضحة في. بعد 1 ساعة من وقت الشفاء كانت المنطقة محاصرتصوير مع مجهر ثنائي الفوتون. الجرو الفئران P5. د، نموذج الصورة ض المكدس من الخلايا والمحاور وصفت في MNTB. السهام تشير الخلايا MNTB واحد. التسميات في b و c تشير التكبير موضوعية والفتحة العددية، على التوالي. شريط النطاق في وج = 300 ميكرومتر؛ شريط النطاق في ب = 45 ميكرومتر؛ شريط النطاق في د = 90 ميكرون. الأيكا = الأمامي الشريان المخيخي السفلي؛ وبا = الشريان القاعدي؛ ص = منقاري؛ ل = الجانبي. اضغط هنا لمشاهدة صورة أكبر.
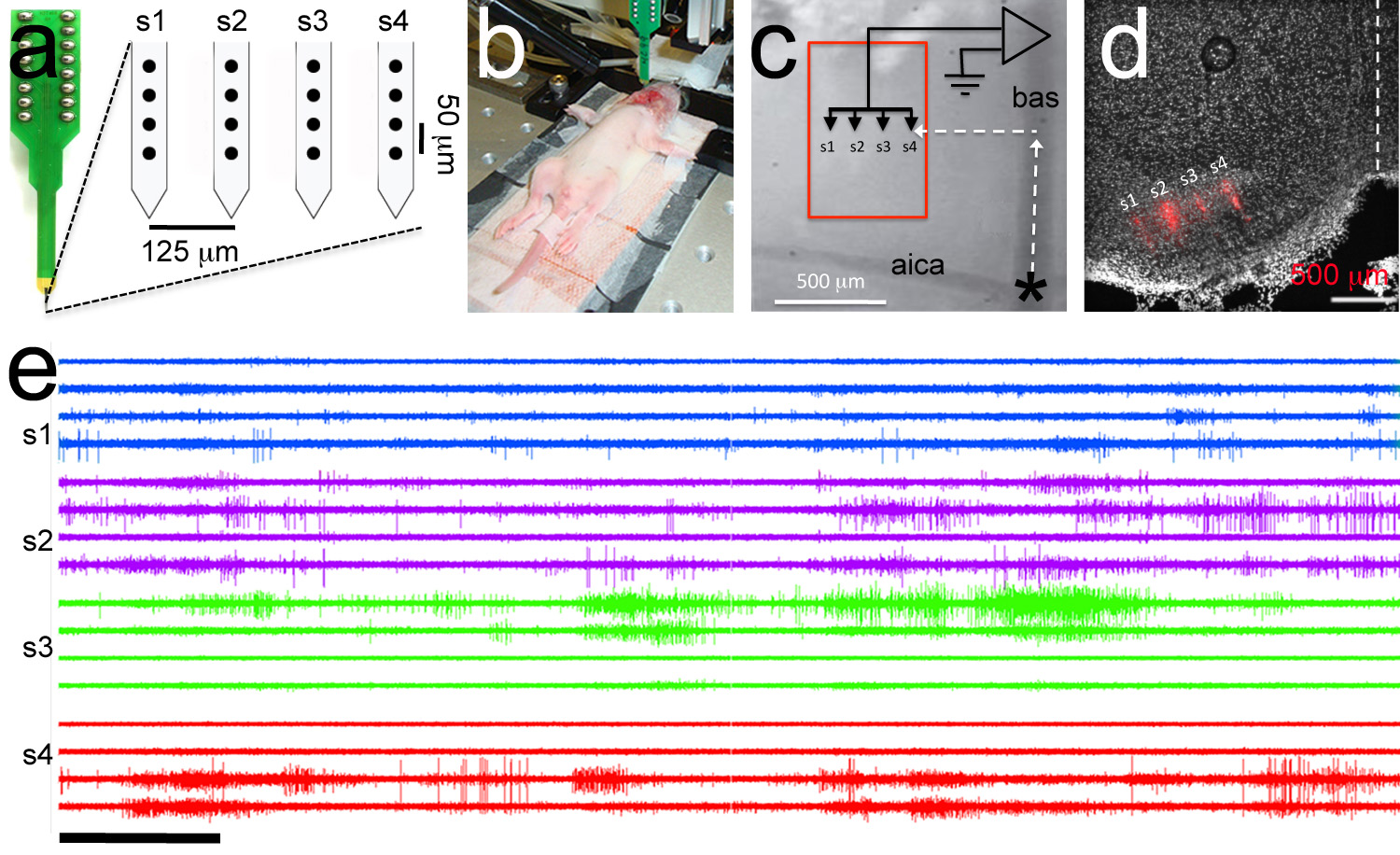
الرقم 7. المستهدفة تسجيل polytrode. لذلك، Polytrode يتكون من 4 السيقان مع 4 أقطاب في عرقوب (الدوائر السوداء). يشار إلى مسافات داخل وبين ساق بين الأقطاب. ب، صورة نموذج من التجربة الكهربية. يتم إدخال القطب المرجع في تجويف bucal وتوصيل ploytrode إلى headstage. الجرو الفئران P6. ج، عرض التكبير العالي من معالم الأوعية الدموية تستخدم لاستهداف polytrode. يتم وضع polytrode باستخدام الإحداثيات منقاري الأطراف لاستهداف نواة الإنسي من الجسم شبه منحرف (مربع أحمر). د، يوضح Posthoc التحليل النسيجي الاستهداف الصحيح للpolytrode الجاذبة المغلفة (يظهر polytrode المسار باللون الأحمر). الإلكترونية، نموذج متعدد وحدة التسجيل. أجل التتبع هو نفس النظام الكهربائي في لوحة أ. ضمن التسجيلات عرقوب لها نفس اللون. شريط النطاق في البريد = 5 ثوان. اضغط هنا لمشاهدة صورة أكبر.
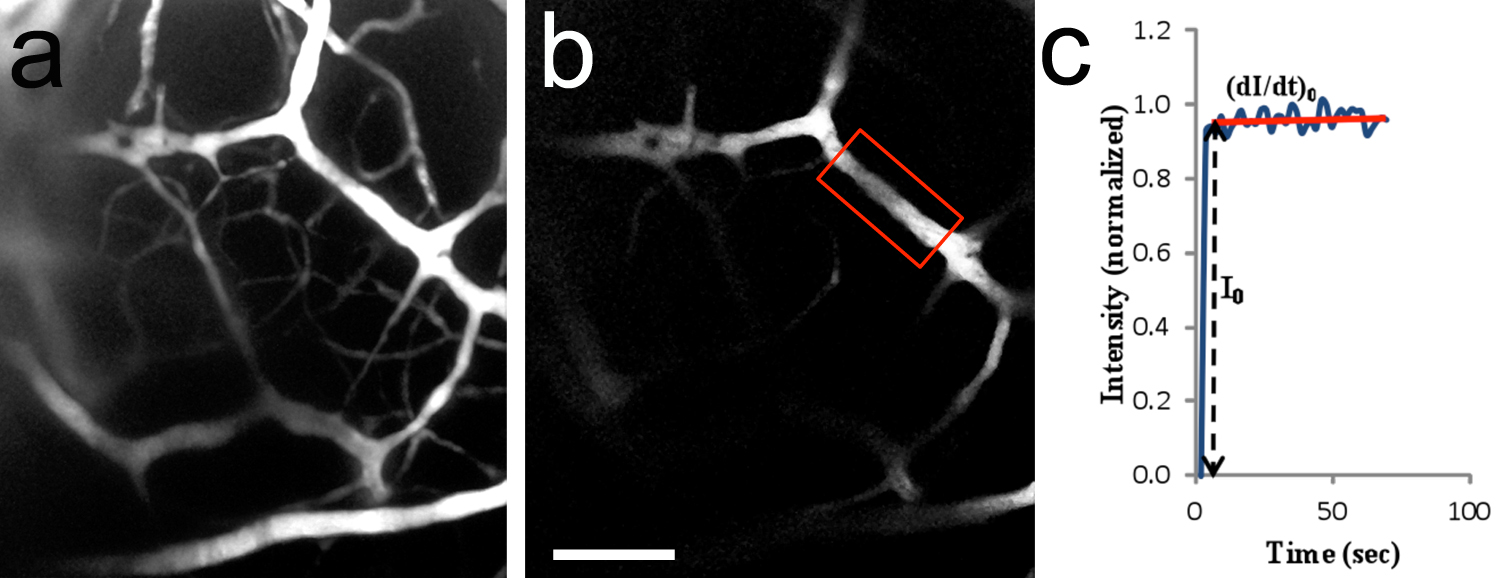
الرقم 8. في الجسم الحي اثنين الفوتون التصوير من microvessels الدماغ. لذلك، 2-D صورة (انهارت Z-كومة) من الأوعية الدموية في المخ بعد نضح من TRITC-ديكستران 155 دينار كويتي في الشريان السباتي. منطقة تصويرها هي مماثلة لتلك المبينة في الشكل 7C. 20x/0.5 الهدف الغمر بالماء. الجرو الفئران P10. ب، المنطقة ذات الاهتمام (ROI) تستخدم لقياس كثافة مضان (إطار أحمر المنطقة المغلقة). كان microvessel يبلغ قطرها 14.2 ميكرون ~ وكانت تقع 182 ميكرومتر تحت سطح الدماغ. ج، منحنى نموذجي من كثافة مضان (القيمة تطبيع) بوصفها وظيفة من الوقت. I 0 هي الزيادة خطوة في كثافة مضان في العائد على الاستثمار عندما حل fluoresence يملأ التجويف فقط حتى السفينة. (DI / ت) 0 وأنا تستخدم 0 لتحديد نفاذية microvessel إلى المذاب. تم حساب نفاذية لTRITC-ديكستران 155 دينار لتكون 1.5 × 10 -7 سم / ثانية.شريط النطاق في ب = 100 ميكرون، ينطبق على. اضغط هنا لمشاهدة صورة أكبر.
Discussion
الوقت أمر بالغ الأهمية. يجب أن يكون الباحث من ذوي الخبرة قادرة على استكمال هذا البروتوكول في 1 ساعة (الخطوات 1-3). في أوقات محددة لمختلف الخطوات تفترض المتوسط إلى مستوى عال من الخبرة. القصبة الهوائية المناسبة وفي الوقت المناسب والتنبيب حاسمة، لأن ضعف السيطرة التهوية يمكن أن يؤدي إلى الاختناق والموت للحيوان. إزالة حذرا من أنسجة العضلات والدهون هو أيضا مهم جدا لأن الأخطاء يمكن أن يؤدي إلى نزيف غير المنضبط وفاة الحيوان. وبالمثل، عند إعداد الشريان السباتي للقنية الإدراج، ويحتاج المرء لتشديد وقطع الشريان بعناية، وإذا كانت عقدة يصبح موضوع فضفاض النزيف غير المنضبط سوف تأخذ مكان. أخيرا، ينبغي بذل حج القحف بعناية، دون تعطيل المعالم الأوعية الدموية. إزالة الإهمال طبقة السحائي الخارجية (الجافية) يمكن أن يؤدي إلى نزيف حاد وتلف من إمدادات الشرياني.
ويتم اختيار إعدادات التهوية وفقا لعمر الحيوان.توفر معظم الموردين التجاريين معلومات مفيدة حول هذه الإعدادات. والتجارب في الفئران الأكبر سنا من P15 تتطلب استخدام جهاز التنفس الصناعي الحيوانات الكبيرة. الحيوانات البالغة قد لا تحتاج تهوية إذا تخدير مع الكيتامين / زيلازين، ولكن ينصح التنبيب لتجنب السوائل دخول القصبة الهوائية.
واحد القيد الرئيسي من هذا البروتوكول هو أن التجارب لا يمكن إلا أن يؤديها بشكل حاد. في المختبر لدينا قمنا بإجراء التجارب دائم بين سنتين وحتى عشر ساعات. والقيد الثاني هو أن التجارب يجب أن تتم تحت التخدير. لذا، فإن اختيار مخدر هو متغير المهم النظر في تخطيط وتصميم التجارب. وثمة مسألة ذات الصلة هو أن الحيوانات الوليد يمكن أن تكون حساسة بشكل خاص لجرعة زائدة. على سبيل المثال، اذا كان اختيار الكيتامين / زيلازين المزيج، وحساب الجرعة على أساس الوزن الجرو وإدارة المخدرات في ⅓ من الحد الأقصى للحجم. التحقق من حالة الحيوان كل 5-10 دقائق بواسطة إصبع قرصة صesponse. إذا باستخدام isoflurane و، وهناك حاجة أيضا الاحتياطات للحفاظ على بيئة آمنة للمحقق (التهوية المناسبة، والمرذاذ معايرتها).
وstereomicroscope يمكن تركيبه على حامل مرنة لضبط زاوية عرض وتسهل إزالة مساحة لوضع الأقطاب ونقل الحيوان إلى مجهر ثنائي الفوتون. استخدام بطارية لتشغيل جهاز التنفس الصناعي يمكن أن تسهل نقل الحيوانية والحد من القطع الأثرية الكهربائية خلال التجارب الكهربية. تحقيقا لهذه الغاية، اللوح الصغيرة (7.5 × 12 بوصة) يمكن استخدامها لتجميع معا التنفس الصناعي، وسادة التدفئة وتخدير الحيوانات (الشكل 2A). وهناك تعديل مفيدة ومهمة لهذا الإعداد هو إضافة جهاز لرصد المؤشرات الحيوية أثناء الجراحة. على مقياس التأكسج أو الأجهزة التناظرية أخرى يمكن استخدامها تبعا للميزانية المختبر.
وقد استخدم هذا البروتوكول مع الكهربية والتصوير التقىhods، بما في ذلك تسجيلات المشبك التصحيح 8،10،11 والتسجيلات polytrode (الشكل 7)، واثنين من الفوتون التصوير 9 (أرقام 6 و 8). واحد من شأنه تطبيق محتملة في المستقبل يكون الجمع بين هذه الأساليب لاستهداف الخلايا fluorescently المسمى لتسجيل الكهربية 16.
تطبيقات التصوير الجديدة يمكن أن تشمل أيضا 2-D أو 3-D السلسلة الزمنية باستخدام اثنين من الفوتون المجهري. على سبيل المثال، وذلك باستخدام بلعة تحميل مؤشرات الكالسيوم لدراسة نشاط الدماغ العصبية والسكان الخلية الدبقية. كما هو موضح في الشكل 8، حقن محلول الصبغة في الدورة الدموية من خلال الشريان السباتي يمكن استخدامها لتوليد الصور عالية التباين من الأوعية الدموية في الدماغ. كما يملأ صبغ مضان التجويف microvessel وينتشر في الأنسجة المحيطة بها، ويمكن استخدامه ليس فقط لحساب نفاذية المذاب واضح من حاجز الدم في الدماغ ولكن أيضا COEF المذاب نشرficient في أنسجة المخ 3. أحد الأسباب الرئيسية لحقن المواد المذابة fluorescently المسمى عبر الشريان السباتي هو أن محلول الصبغة يمكن أن تذهب مباشرة إلى microvessels في الدماغ من دون الذهاب الى قلبية للمرة الأولى كما هو الحال في حقن الوريد الذيل. هذا يجلب اثنين على الأقل من المزايا. واحد هو أن تركيز صبغ مضان في التجويف microvessel يمكن أن يكون ثابتا عمليا إذا تم إصلاح معدل نضح في موقع القسطرة. وهذا يضمن تحديد دقيق للنفاذية حاجز الدم في الدماغ. آخر هو أنه إذا كان يتم تضمين وكيل الاختبار في الإرواء، وسوف تذهب مباشرة إلى حاجز الدم في الدماغ دون أن تضعف أو جنبا إلى جنب مع عوامل أخرى من الدورة الدموية في الجسم.
التجارب الجديدة أيضا قد تستفيد من الحيوانات المعدلة وراثيا مع صحفيين الفلورسنت المشفرة وراثيا. وهذا من شأنه توفير ميزة أن تحقيقات الفلورسنت لن تحتاج إلى تحميل في الموقع (إلا إذا كان تصميم التجربةينص على خلاف ذلك)، وتوفير الوقت والسماح لمزيد من الاستعدادات سليمة (مثل النافذة في الجمجمة 17) ربما.
أخيرا، والتجارب ويمكن أن يتم في مناطق الدماغ الأخرى مثل الزيتون أو أدنى نواة المحرك الوجه. سوف المعرفة حول التشريح العصبي وتطوير السكان الخلوية محددة في نوع معين من المهم لتحقيق هذه الغاية، لا سيما المعالم التشريحية قد تتغير كما تنمو الحيوانات (الشكل 1). ونحن نأمل أن يكون هذا البروتوكول تشجع الآخرين لدراسة هياكل الدماغ البطني باستخدام الكهربية في الجسم الحي وأساليب التصوير.
Disclosures
والكتاب ليس لديهم ما يكشف.
Acknowledgements
وأيد هذا العمل عن طريق منحة G12-RR003060 من المعاهد الوطنية للصحة / NCRR / RCMI، منح SC1HD068129 من المعهد الوطني يونيس شرايفر الصحة والإنسان لتنمية الطفل، ومؤسسة العلوم الوطنية CBET 0754158 وPSC-62337-00 جامعة مدينة نيويورك 40 من جامعة مدينة نيو نيويورك.
Materials
| Name | Company | Catalog Number | Comments |
| Absorbant pads | Kettenbach | Sugi 31603 | Other options may be available from different companies |
| Cautery | Braintree Scientific, INC | GEM 5917 | Other options may be available from different companies |
| Tetramethyl rhodamine Isothiocyanate dextran | Sigma | T1287-500MG | Other options may be available from different companies |
| Dissecting Chisel | Fine Science Tools | 10095-12 | Other options may be available from different companies |
| DiI | Invitrogen | V-22885 | Other options may be available from different companies |
| Elastomer | World Precision Instruments | KWIK-SIL | Other options may be available from different companies |
| Fine Scissors | Fine Science Tools | 14060-09 | Other options may be available from different companies |
| Forceps | Fine Science Tools | 11027-12,11617-12, 11616-16 | Other options may be available from different companies |
| Spring Scissors | Fine Science Tools | 15009-08 | Other options may be available from different companies |
| Heating pad | FHC | 40-90-2 | Other options may be available from different companies |
| Intubation tubing | Braintree Scientific, INC | BIO CO-KIT | Choose age appropriate size |
| Light source | Spach Optics | Schott Ace illuminator | Other options may be available from different companies |
| Micro drill | Braintree Scientific, INC | MD-1200 120V | Other options may be available from different companies |
| Paper tape | Walgreens | Generic brand | Other options may be available from different companies |
| Syringe filter | VWR | 28145-483 | Other options may be available from different companies |
| Syringe pump | VWR | 52459-008 | Other options may be available from different companies |
| Stereomicroscope | Olympus | SZ61 | Other options may be available from different companies |
| Suture | Ethicon | Prolene 86979 | 6-0 size |
| Tubing | Braintree Scientific, INC | Micro-Renathane (MRE033); SUBL-120 | Other options depending on pup’s age |
| Vaporizer (isoflurane) | Vetequip Incorporated | 911103 | Other options may be available from different companies |
| Ventilator (minivent) | Harvard Apparatus | 730043 | Use for P0-P12 rats |
References
- Kerr, J. N. D., Denk, W. Imaging in vivo: watching the brain in action. Nat. Rev. Neurosci. 9 (3), 195-205 (2008).
- Sigler, A., Murphy, T. H. In vivo 2-photon imaging of fine structure in the rodent brain: before, during, and after stroke. Stroke. 41 (10), 117-123 (2010).
- Shi, L., Zeng, M., Sun, Y., Fu, B. M. Quantification of blood-brain barrier solute permeability and brain transport by multiphoton microscopy. ASME J. of Biomech. Eng. 136 (3), 031005-031005 (2014).
- Galambos, R., Schwartzkopff, J., Rupert, A. Microelectrode study of superior olivary nuclei. Am. J. Physiol. 197, 527-536 (1959).
- Goldberg, J., Brown, P. B. Response of binaural neurons of dog superior olivary complex to dichotic tonal stimuli: some physiological mechanisms of sound localization. J. Neurophysiol. 32 (4), 613-636 (1969).
- Guinan, J. J., Guinan, S. S., Norris, B. E. Single auditory units in the superior olivary complex I: responses to sounds and classifications based on physiological properties. Intern. J. Neurosci. 4, 101-120 (1972).
- Spirou, G. A., Brownell, W. E., Zidanic, M. Recordings from cat trapezoid body and HRP labeling of globular bushy cell axons. J. Neurophysiol. 63 (5), 1169-1190 (1990).
- Khosrovani, S., Der Giessen, R. S. V. a. n., De Zeeuw, C. I., De Jeu, M. T. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proc. Natl. Acad. Sci. U.S.A. 104 (40), 15911-15916 (2007).
- Rodríguez-Contreras, A., Van Hoeve, J. S., Habets, R. L., Locher, H., Borst, J. G. G. Dynamic development of the calyx of Held synapse. Proc. Natl. Acad. Sci. U.S.A. 105 (14), 5603-5608 (2008).
- Lorteije, J. A., Rusu, S. I., Kushmerick, C., Borst, J. G. G. Reliability and precision of the mouse calyx of Held synapse. J. Neurosci. 29 (44), 13770-13784 (2009).
- Tritsch, N. X., Rodríguez-Contreras, A., Crins, T. T., Wang, H. C., Borst, J. G. G., Bergles, D. E. Calcium action potentials in hair cells pattern auditory neuron activity before hearing onset. Nat. Neurosci. 13 (9), 1050-1052 (2010).
- Tong, H., Steinert, J. R., Robinson, S. W., Chernova, T., Read, D. J., Oliver, D. L., Forsythe, I. D. Regulation of Kv channel expression and neuronal excitability in rat medial nucleus of the trapezoid body maintained in organotypic culture. J. Physiol. 588 (9), 1451-1468 (2010).
- Sonntag, M., Englitz, B., Kopp-Scheinpflug, C., Rübsamen, R. Early postnatal development of spontaneous and acoustically evoked discharge activity of principal cells of the medial nucleus of the trapezoid body: an in vivo study in mice). J. Neurosci. 29 (30), 9510-9520 (2008).
- García-Villalón, A. L., Roda, J. M., Alvarez, F., Gómez, B., Diéguez, G. Carotid blood flow in anesthetized rats: effects of carotid ligation and anastomosis. Microsurgery. 13 (5), 258-261 (1992).
- Yuan, W., Lv, Y., Zeng, M., Fu, B. M. Non-invasive method for the measurement of solute permeability of rat pial microvessels. Microvasc. Res. 77 (2), 166-173 (2009).
- Kitamura, K., Judkewitz, B., Kano, M., Denk, W., Haüsser, M. Targeted patch-clamp recordings and single-cell electroporation of unlabeled neurons in vivo. Nat. Methods. 5 (1), 61-67 (2008).
- Mostany, R., Portera-Cailliau, C. A method for 2-photon imaging of blood flow in the neocortex through a cranial window. J. Vis. Exp. (12), (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved