Method Article
Un metodo per fare una craniotomia sul ventrale Cranio di neonato Roditori
In questo articolo
Riepilogo
Un metodo chirurgico è descritto per esporre il cranio ventrale nei ratti neonati. Usando questo approccio, è possibile aprire una craniotomia per eseguire elettrofisiologia acuta e esperimenti di microscopia a due fotoni nel tronco cerebrale dei cuccioli anestetizzati.
Abstract
L'uso di una craniotomia per esperimenti in vivo offre l'opportunità di studiare le dinamiche di diversi processi cellulari nel cervello dei mammiferi nell'età adulta e durante lo sviluppo. Sebbene la maggior parte degli approcci in vivo utilizzano una craniotomia per studiare le regioni del cervello poste sul lato dorsale, le regioni del tronco encefalico come il ponte, che si trova sul lato ventrale rimangono relativamente poco studiato. L'obiettivo principale di questo protocollo è quello di facilitare l'accesso alle strutture del tronco cerebrale ventrali in modo che possano essere studiate in vivo utilizzando elettrofisiologica e metodi di imaging. Questo approccio consente di studio dei cambiamenti strutturali assoni a lungo raggio, pattern di attività elettrica in single ei gruppi di cellule, e cambiamenti di sangue al cervello barriera di permeabilità negli animali neonati. Anche se questo protocollo è stato utilizzato soprattutto per studiare il tronco cerebrale uditivo nei ratti neonati, può essere facilmente adattato per studi in altre specie di roditori come topi neonati, roden adultits e di altre regioni del tronco encefalico.
Introduzione
L'uso di una craniotomia in combinazione con fluorescenza imaging e tecniche di elettrofisiologia consente monitoraggio del flusso sanguigno, barriera ematoencefalica permeabilità e misurando l'attività di neuroni e cellule gliali negli animali vivi 1-3. Numerosi laboratori hanno utilizzato questo approccio per fornire una conoscenza fisiologia del cervello in condizioni di salute e di malattia, ma le lacune restano nella nostra comprensione di come questi processi si presentano durante lo sviluppo. Inoltre, la maggior parte degli studi si sono concentrati sulle regioni cerebrali che sono facilmente accessibili dalla superficie dorsale del cranio, tale che le strutture del tronco cerebrale ventrali con diversi ruoli fisiologici sono stati studiati per lo più utilizzando approcci ex vivo.
L'obiettivo principale di questo protocollo è quello di fornire un metodo per aprire una craniotomia sul cranio ventrale di roditori. Questo approccio è stato adattato da studi classici eseguiti nei mammiferi più grandi come cani e gatti per reco neurofisiologia sensorialirdings del tronco encefalico uditivo 4-7. In questo protocollo tuttavia, vi è il romanzo sfida di eseguire la procedura in animali neonati. Utilizzando i luoghi di interesse vascolare, questo protocollo adattato è stato utilizzato in precedenza per studiare il tronco cerebrale uditivo di ratti neonati, topi adulti e in altre regioni del tronco cerebrale, come l'olivo inferiore 8-11 (Figura 1).
Un vantaggio principale di una craniotomia ventrale rispetto ai metodi esistenti per studiare nuclei del tronco encefalico ventrali è che fornisce un accesso diretto alle strutture di interesse in animali vivi. Per esempio, le cellule uditive del complesso olivare superiore sono localizzati a poche decine di micrometri dalla superficie cervello, che è importante per il posizionamento mirato di sonde e per utilizzare approcci di imaging a due fotoni in cui la profondità di imaging può essere limitato a 0,5 mm dal dispersione tessuto luce e di assorbimento. Una craniotomia ventrale fornisce anche una preparazione con connessioni neurali relativamente intatte, which vengono interrotto in fettine acute e organotipica 12. A differenza di altri protocolli per esperimenti in vivo neurofisiologia in 13, un approccio ventrale può essere combinato con registrazione multi-elettrodo e metodi di imaging che forniscono informazioni sulle formazioni cellulari (Figure 6 e 7). Infine, in combinazione con questo protocollo un soluto fluorescente può essere iniettato nel sistema vascolare a misurare le variazioni barriera ematoencefalica permeabilità al soluto (Figura 8).
Protocollo
Il seguente protocollo segue le linee guida per la cura degli animali stabiliti dalla cura degli animali ed uso Comitato Istituzionale (IACUC) presso il City College di New York.
Intubazione Animal 1. (10-20 min)
- Prima dell'intervento, preparare la soluzione Ringer mammiferi. Montare gli strumenti chirurgici, rilievo di riscaldamento, ventilazione e piccoli animali in panchina (Figura 2).
- Per misure di barriera ematoencefalica permeabilità fanno 10 ml di 1% di siero albumina bovina soluzione (BSA) in Ringer e dissolvono TRITC-destrano 155 kD a 8 mg / ml in soluzione BSA 1%, soluzione di filtro da 25 mm filtro a siringa (0,2 micron dimensione dei pori) e conservare in una siringa foglio coperto nel buio.
- Anestetizzare l'animale con isoflurano. Utilizzare 5,0% per l'induzione e il 1,5-3,0% per la manutenzione. In alternativa una miscela di ketamina (41,7 mg / kg) e xilazina (2,5 mg / kg di peso corporeo) può essere utilizzato. Profondità dell'anestesia può essere controllato da punta pizzico riflessoestremità superiori e inferiori.
- Dosi successive di ketamina (41,7 mg / kg di peso corporeo) e xilazina (2,3 mg / kg di peso corporeo) devono essere somministrati con incrementi di ⅓ della dose massima per evitare un sovradosaggio. L'uso di un ventilatore roditore è raccomandato per contrastare la depressione respiratoria xilazina indotta.
- Posizionare il cucciolo anestetizzato sdraiato su un fianco dorsale e fissare la testa con il cono di plastica utilizzato per fornire l'anestetico (Figura 3a).
- Fissare l'animale con nastro adesivo sugli arti anteriori e la coda (Figura 3a).
- Un'alternativa per fissare la testa del cucciolo è quello di utilizzare una piastra testa attaccata ad una barra di metallo.
Nota: Assicurarsi che il pad di riscaldamento è impostato a 37 ° C per evitare l'ipotermia (Figura 3a).
- Utilizzare forbici (Figura 2b) per fare uno longitudinale e quattro incisioni laterali sulla pelle sovrastante il collo (Figura 3b). Usando una tecnica smussato, sezionare la pelle e metterlo da parte con pinze (figure 2c e 3c).
- Tenere la pelle verso il basso con del nastro adesivo. Stabilizzare la testa in posizione orizzontale (figura 3c).
- Utilizzando le forbici a molla (Figura 2d) e la tecnica schietto, ghiandole spinta e strati di grasso da parte per esporre la trachea (Figura 3c). Identificare la posizione delle arterie carotidi.
- Mantenere le arterie carotidi dalla trachea.
Nota: Puntura carotidi può comportare la perdita massiccia di sangue e la morte del cucciolo.
- Mantenere le arterie carotidi dalla trachea.
- Utilizzando le forbici a molla (figura 2d) sezionare i muscoli longitudinali relativi alla trachea. Tagliare i muscoli longitudinali situati sotto la trachea (Figura 3d).
Nota: Gli anelli tracheali devono essere chiaramente visibili (Figura 3e).- Utilizzopinza (Figura 2c), legare due pezzi di sutura intorno alla trachea. Un pezzo di sutura sarà fissare il tubo di ventilazione ed il secondo thread viene utilizzato per chiudere il rostrale trachea al punto di inserimento tubo di ventilazione (Figura 4a).
Nota: Inumidire il tessuto esposto regolarmente con soluzione di Ringer per prevenire la disidratazione.
- Utilizzopinza (Figura 2c), legare due pezzi di sutura intorno alla trachea. Un pezzo di sutura sarà fissare il tubo di ventilazione ed il secondo thread viene utilizzato per chiudere il rostrale trachea al punto di inserimento tubo di ventilazione (Figura 4a).
- Utilizzando le forbici a molla (figura 2d) fanno un'incisione su uno degli anelli tracheali situate tra i due fili posti in fase 1.6.1 (Figura 4c).
Nota: Assicurarsi che nessun liquido entra nella trachea aperta. Liquido nella trachea provoca asfissia. - Inserire il tubo di intubazione (Figura 4b) nella trachea e serrare il filo inferiore per fissarlo. Utilizzando pinze (Figura 2c), serrare il filo superiore per chiudere posteriore trachea al punto di inserimento del tubo di intubazione.
- Serraren e tagliare le estremità dei due fili (Figura 4d-F).
Nota: vapore all'interno del tubo intubazione è un buon segno di controllo del flusso d'aria.
- Serraren e tagliare le estremità dei due fili (Figura 4d-F).
- Prontamente commutare l'alimentazione isoflurano al ventilatore. Regolare il volume della corsa e il tasso di aerazione secondo il peso dell'animale.
- Sigillare il tessuto circostante esposta con elastomero (figura 5a). Mantenere la superficie inumidito e pulito.
2. Trachea e rimozione Muscle per esporre il cranio (5-10 min)
- Utilizzare forbici a molla (figura 2d) per tagliare la trachea adiacente al tubo di ventilazione. Effettuare due tagli lungo la parete muscolare della cavità buccale per esporre la fine caudale del palato (Figura 5b).
Nota: Se necessario, utilizzare un cauterizer per fermare le emorragie. Sanguinamento incontrollato causerà la morte dell'animale. - Pulire ilzona con abbondanti quantità di soluzione di Ringer (Figura 5c). Identificare il divario tra l'ultima vertebra e l'osso basi-occipitale (Fig. 5d).
Nota: Il divario tra le ossa è un punto di riferimento teschio utile per individuare le strutture del tronco cerebrale. L'oliva inferiore si trova sotto questa lacuna. Il complesso olivary superiore uditivo si trova sotto l'osso basi-occipitale in direzione rostrale da questo gap (vedi anche figura 1). - Pulire l'area con pinze (Figura 2c) e forbici a molla (Figura 2d). Non forare i vasi sanguigni.
Nota: Se necessario, cauterizzare per fermare le emorragie.- Dopo l'area esposta è pulita di grasso e di tessuto muscolare, lo spazio che separa l'osso basi-occipitale e l'ultima vertebra deve essere visibile (figura 5d).
3. Craniotomy (15-30 min)
- Utilizzare un microdrill o di un ultradetergente sonic. Individuare la parete mediale della bulla.
- Sottile il cranio facendo una forma D invertita fino a quando le arterie sottostanti sono visibili (Figura 5e).
Nota: L'arteria basilare (bas) corre sulla parte superiore della linea mediana del tronco cerebrale. L'arteria cerebellare inferiore anteriore (AICA) le succursali a livello bilaterale e può essere utilizzato in modo affidabile come un punto di riferimento in quanto ha una posizione costante in diversi animali. - Quando il cranio è assottigliato, delicatamente rompere utilizzando uno scalpello dissezione (Figura 2e). Rimuovere il pezzo di osso con una pinza (Figura 2c). In alternativa, sollevare e rompere il cranio con un ago piegato.
Nota: Ripetere questa procedura fino a quando la dimensione e la forma del craniotomia è appropriato per l'esperimento previsto. Le bas e AICA dovrebbero essere visibili attraverso la membrana dura (Figura 5f).
- Sottile il cranio facendo una forma D invertita fino a quando le arterie sottostanti sono visibili (Figura 5e).
- Pulire l'area più volte con soluzione di Ringer fresca. Uso pa assorbenteds asciugare la superficie della membrana dura.
- Se necessario, utilizzare un ago di sutura per rimuovere la membrana dura senza spostare o rompere le arterie punto di riferimento bas e AICA.
Nota: Dopo dura pungere liquido cerebrospinale scorre fuori. Pulire la zona con soluzione di Ringer e mantenere inumidita tutto l'esperimento.
- Se necessario, utilizzare un ago di sutura per rimuovere la membrana dura senza spostare o rompere le arterie punto di riferimento bas e AICA.
4. Elettrofisiologia Experiment
- Selezionare il polytrode secondo il disegno esperimento (Figura 7a). Utilizzare un pennello fine per rivestire la polytrode con DII. Trasferire la soluzione DII in una provetta 1 ml, immergere il pennello nella soluzione e colpire delicatamente la polytrode sotto la guida visiva (vale a dire utilizzando uno stereoscopio). Inizia la punta della sonda e continuare con cura fino a quando tutti gli elettrodi sono rivestite in maniera uniforme.
- Posizionare l'elettrodo di terra all'interno della cavità orale. Caricare il polytrode nel 7b portaelettrodo (Figura ).
- Accendere l'amplificatore e verificare che tutti i collegamenti funzionano bene.
- Posizionare l'elettrodo sopra bas al punto di diramazione di AICA (posizione zero). Spostare l'elettrodo al punto di destinazione desiderato utilizzando l'apposito rostrale-laterale coordinate (Figura 7c).
- Posizionare l'elettrodo sulla superficie del cervello e spostarlo fino alla profondità desiderata in intervalli di 5-10 micron.
- Eseguire la registrazione secondo il disegno sperimentale. Salvare i dati per ulteriori analisi.
5. Due fotoni Imaging Experiment
- Accendere il microscopio. Impostare la lunghezza d'onda di eccitazione e di utilizzare un filtro per le emissioni appropriato. Eccitazione a 800 nm e ± 45 nm filtro per le emissioni passa-banda lavoro 607 bene per l'imaging TRITC-destrano.
- Identificare destra o sinistra carotide. Usando la tecnica smussato sezionare l'arteria carotide dai tessuti connettivi o nervi adiacenti.
- Scegli e tenere la carotidearteria con una pinza emostatica. Tie tre pezzi di sutura intorno alla carotide.
- Tendere il filo più vicino al lato del cuore per arrestare il flusso di sangue e lasciare gli altri due fili sciolti.
- Usare le forbici pregiati per fare un piccolo taglio ad un angolo di 45 ° sulla carotide tra il filo legato e la successiva filo allentato.
Nota: pulire il sangue con carta assorbente.
- Cannulate la carotide. Inserire il tubo riempito con soluzione TRITC-destrano nel taglio sulla carotide circa 5 mm di profondità orientate verso la testa del cucciolo.
- Serrare gli altri due fili intorno all'arteria per tenere il tubo e l'arteria insieme. Stringere i fili, tagliare e aggiungere elastomero per stabilizzare ulteriormente.
Nota: L'altro lato del tubo è collegato con la siringa contenente soluzione TRITC-destrano (preparato al punto 1.1).
- Serrare gli altri due fili intorno all'arteria per tenere il tubo e l'arteria insieme. Stringere i fili, tagliare e aggiungere elastomero per stabilizzare ulteriormente.
- Fissare la siringa sulla pompa a siringa.
- Setla velocità del flusso sanguigno carotide del cucciolo. Attiva la pompa a siringa per pochi secondi e controllare manualmente che la soluzione colorante può essere iniettato nella carotide. Nota: Supponendo che il tasso di flusso di sangue nella carotide di ratto adulto (240-280 g) è di circa 3 ml / min 14, il flusso sangue per un cucciolo di ratto (es. P10 cucciolo pesa 15-25 g) può essere calcolato per intervallo 0,16-0,3 ml / min.
- Mettere l'animale nell'ambito dell'obiettivo microscopio. Iniettare la destrano fluorescente nel flusso sanguigno.
- Identificare le aree di interesse sul tronco encefalico ventrale con un obiettivo di aria 5X. Passare a un obiettivo 20X o 40X (immersione in acqua, NA = 0.5 o 0.8, rispettivamente) per mettere a fuoco la regione di interesse (ROI).
- Inizia imaging e regolare i parametri di acquisizione di immagini (ad esempio tempo di esposizione, la potenza del laser, il guadagno del rivelatore) finché l'intensità di fluorescenza nel sistema vascolare del ROI viene ottimizzato (cioènon troppo basso ma non saturo).
- Accendere la pompa a siringa per iniettare la soluzione colorante nella carotide e acquisire una serie temporale in un piano focale fissa.
6. Animal Care Seguendo la procedura
- Questa è una procedura terminale. Alla fine di un esperimento animali devono essere sacrificati con una overdose di pentobarbital (100 mg / kg, iniezione intraperitoneale) o qualsiasi altro metodo di eutanasia approvato dalla American Veterinary Medical Association Linee guida eutanasia.
Nota: perfusione attraverso il cuore con la soluzione di Ringer seguito con una soluzione di fissativo è raccomandato per ulteriori analisi istologica.
Risultati
Elettroporazione di traccianti neuronali
Il nucleo mediale del corpo trapezoidale (MNTB) è un gruppo di cellule nel complesso olivare superiore che è stato studiato in precedenza utilizzando questo protocollo. Ad esempio, pipette patch clamp può essere utilizzato per l'elettroporazione di traccianti neuronali (Figura 6) 9. Quando pipette sono posizionati vicino alla linea mediana, come mostrato in Figura 6a, il risultato è che decussating assoni afferenti sono etichettati. Un microscopio a due fotoni dotati di elevata apertura numerica dell'obiettivo immersione in acqua può essere utilizzata per l'immagine fibre raggiungono la MNTB, compresi rami collaterali molto fini (frecce in Figura 6b). Traccianti neurali possono anche essere consegnati al MNTB direttamente, come mostrato in Figura 6c. Il risultato è l'etichettatura di cellule MNTB e assoni afferenti, come può essere apprezzato da imaging con un obiettivo ad immersione in acqua inferiore apertura numerica (figura 6d). Il main vantaggio di utilizzare l'obiettivo ingrandimento minore è che un più ampio campo di vista può essere esaminata, e anche se questo si traduce in una diminuzione della risoluzione spaziale a causa della apertura numerica obiettivo inferiore, cellule MNTB individuali possono essere individuate ben (frecce nella Figura 6d) . La durata media di questi esperimenti per tutte le età P1-P5 è di 3,1 ± 1,4 ore (n = 22 cuccioli).
Registrazioni Elettrofisiologia
Spontanea treno di impulsi è una forma di attività elettrica dello sviluppo osservata in cellule singole MNTB prima dell'inizio della dell'udito 11,13. Usando questo protocollo chirurgico è anche possibile indirizzare array multielettrodi (polytrodes) al MNTB (Figura 7a-b). Il risultato è una registrazione di attività spontanea in un insieme di celle MNTB. Figura 7e mostra una registrazione polytrode rappresentante di un ratto P6. In questo esperimento, il polytrode stato rivestito con DII colorante lipofile usandoun pennello sottile (vedi punto 4.1). Dopo aver eseguito la registrazione del cervello è stata processata per analisi istologica e la posizione della traccia polytrode DII marcato è stato usato per confermare il corretto rivolti al MNTB (Figura 7d). La durata media di esperimenti per tutte le età P1-P6 è di 2,0 ± 0,7 ore (n = 33 cuccioli).
Misurazione dei microvasi permeabilità
Questo protocollo può anche essere utilizzato per eseguire esperimenti di imaging a due fotoni di permeabilità vascolare. Un soluto fluorescente (TRITC-destrano, MW 155 kD, Stokes raggio ~ 8,5 nm) è stato disciolto in soluzione Ringer BSA 1% e iniettato nella circolazione cerebrale tramite una cannula inserita nella carotide 14. Diversamente iniezioni vena della coda, questa procedura bypassa il cuore e introduce il soluto fluorescente direttamente nel cervello microcircolazione. Figura 8a illustra la qualità di etichettatura dei vasi sangue risultante dall'utilizzo questa procedura. Dopo il continuaperfusione di soluti etichettati nel flusso sanguigno è possibile avere una sequenza al rallentatore di una regione di interesse, come mostrato in Figura 8b. L'intensità di fluorescenza totale della regione di interesse è stata misurata in linea e un modello matematico utilizzato per determinare la permeabilità barriera ematoencefalica per etichetta fluorescente soluti (Figura 8c) 15. La durata media di esperimenti per tutte le età P9-P10 è di 2,3 ± 0,8 ore (n = 3 cuccioli).
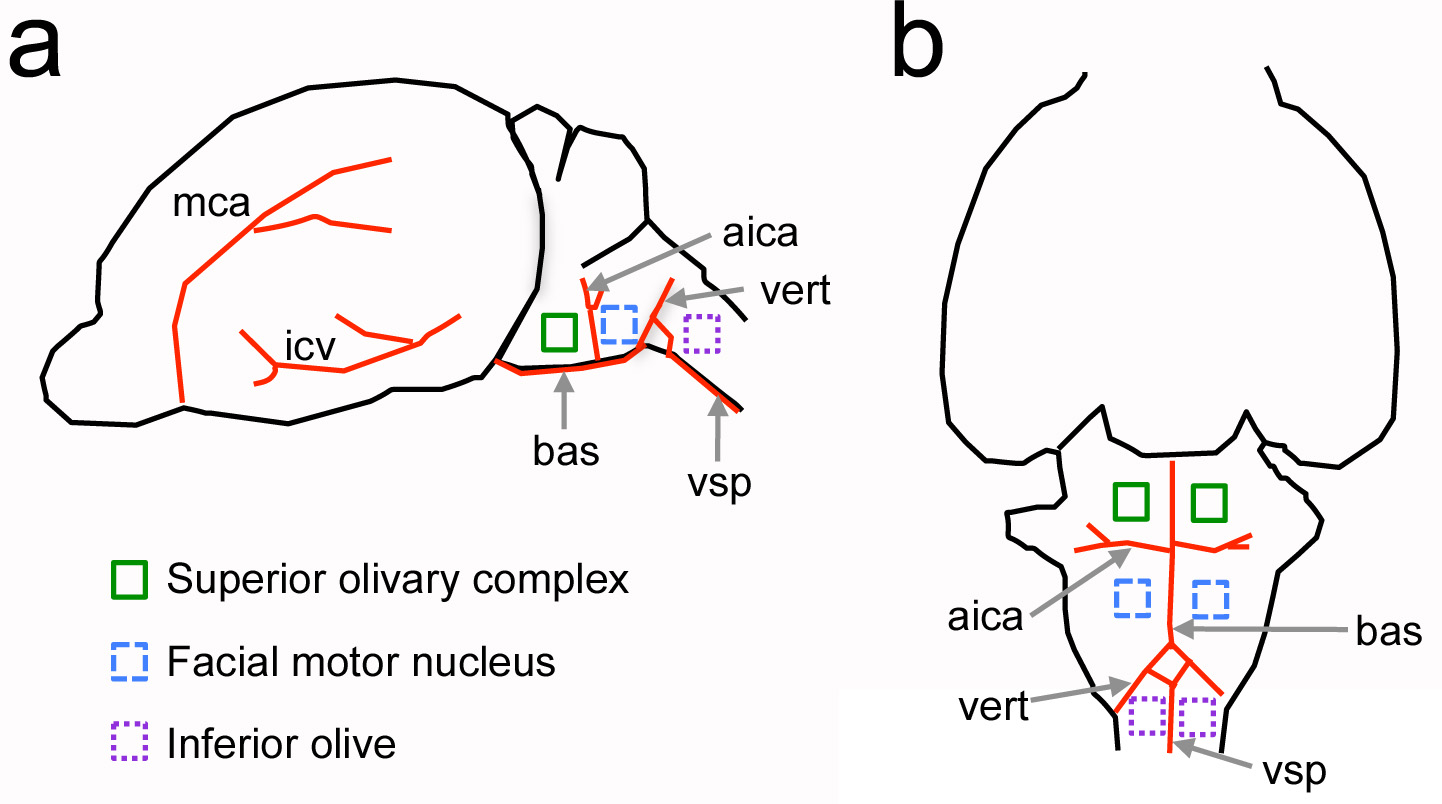
Figura 1. Posizione relativa del ventrali strutture neurali del tronco cerebrale rispetto a punti di riferimento vascolare nel ratto neonato. Una vista laterale del cervello. B, vista ventrale del cervello. Principali vasi sanguigni sono mostrati in rosso strutture e neurali di interesse inddicato dal colore piazze. Non sono in scala. AICA = antero-inferiore arteria cerebellare; bas = arteria basilare; ICV = inferiore vena cerebrale; mca = dell'arteria cerebrale media; vert = arteria vertebrale; vsp = ventrale arteria vertebrale. Clicca qui per vedere l'immagine ingrandita.

Figura 2. Installazione chirurgica. Una chirurgia può essere fatto su una piccola tavola di pane (1) di riposo sulla cima di un piano stabile tavolo. Un pad di riscaldamento (2) e un piccolo ventilatore animale (3) può essere fissato al bordo di pane per facilitare lo spostamento dell'intera preparazione quando necessario. Il piccolo ventilatore animale può essere alimentato da una batteria (4). Un supporto magnetico (5) può essere utilizzato per fissare il cono utilizzato per distribuire l'anestetico. Il cono puòanche proteggere la testa in una posizione stabile. Se l'animale non deve essere trasferito, un micromanipolatore (6) può essere utilizzato per sonde di posizione per elettrofisiologia o esperimenti tracciamento neurali. Una sorgente di luce (7) e uno stereoscopio (non nella foto) sono necessarie per visualizzare le strutture punto di riferimento durante la microchirurgia. B, piccole forbici vengono utilizzati nella fase 1.4. C, forcipe sono utilizzati in operazioni 1.4, 1.6.1, 1.8 e 1.8.1 . d, forbici a molla sono utilizzati in fasi 1.5, 1.6 e 1.7. elettroniche, sezionare scalpello viene utilizzato nella fase 3.1.2. Bar Scala in e = 1 mm, si applica a bd. Clicca qui per vedere l'immagine ingrandita.
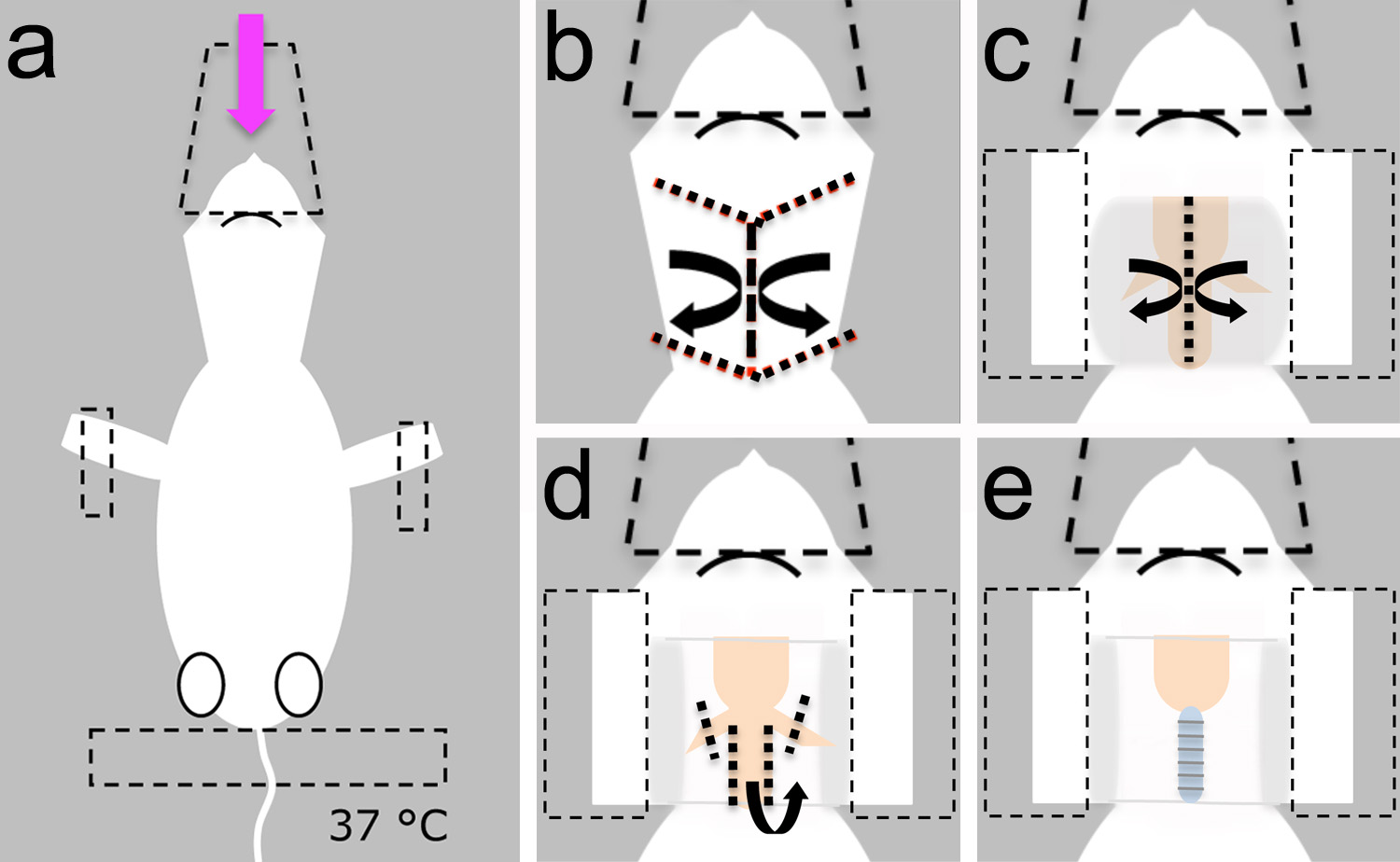
Figura 3. Esposizione della trachea per l'intubazione.una, L'animale è anestetizzato, posto in posizione prona e fissato con il cono e nastro (linee tratteggiate). b, la pelle è tagliata e posta da parte per esporre lo strato di grasso sottostante. c, Il grasso sovrastante e ghiandole (mostrato in grigio) sono messi da parte per esporre la trachea. Il nastro è utilizzato per proteggere la cute sovrastante (linee tratteggiate). D, La trachea è sezionato dalla muscolatura. Posta, visualizzazione di anelli tracheali indica l'eliminazione di muscolo sovrastante. Clicca qui per vedere l'immagine ingrandita.
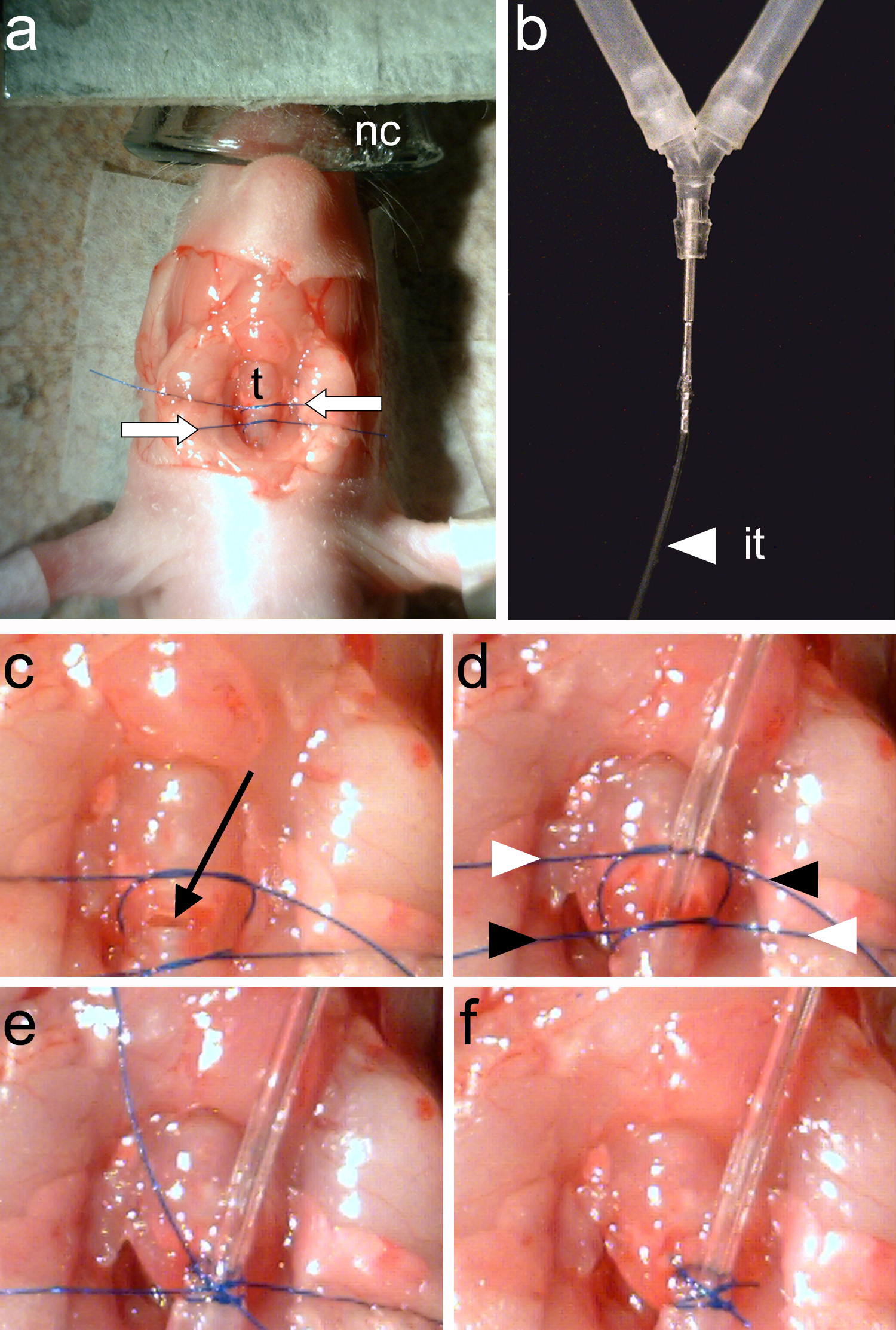
Figura 4. Intubare l'animale. Una, due fili di sutura (frecce bianche) sono legati intorno alla trachea(T). B, il tubo di intubazione (it) deve essere strettamente collegato al tubo y dell'animale ventilatore. C, A tracheotomia viene fatta tra i due fili di sutura (freccia nera). D, il tubo di ventilazione è inserita e la due fili di sutura sono serrati. Le estremità dei fili sono serrati nuovamente in modo incrociato (indicato da frecce bianche e nere). Posta, Le terminazioni sutura sono legati. F, Le terminazioni di sutura vengono tagliati e l'intubazione è completa. Clicca qui per vedere l'immagine ingrandita.
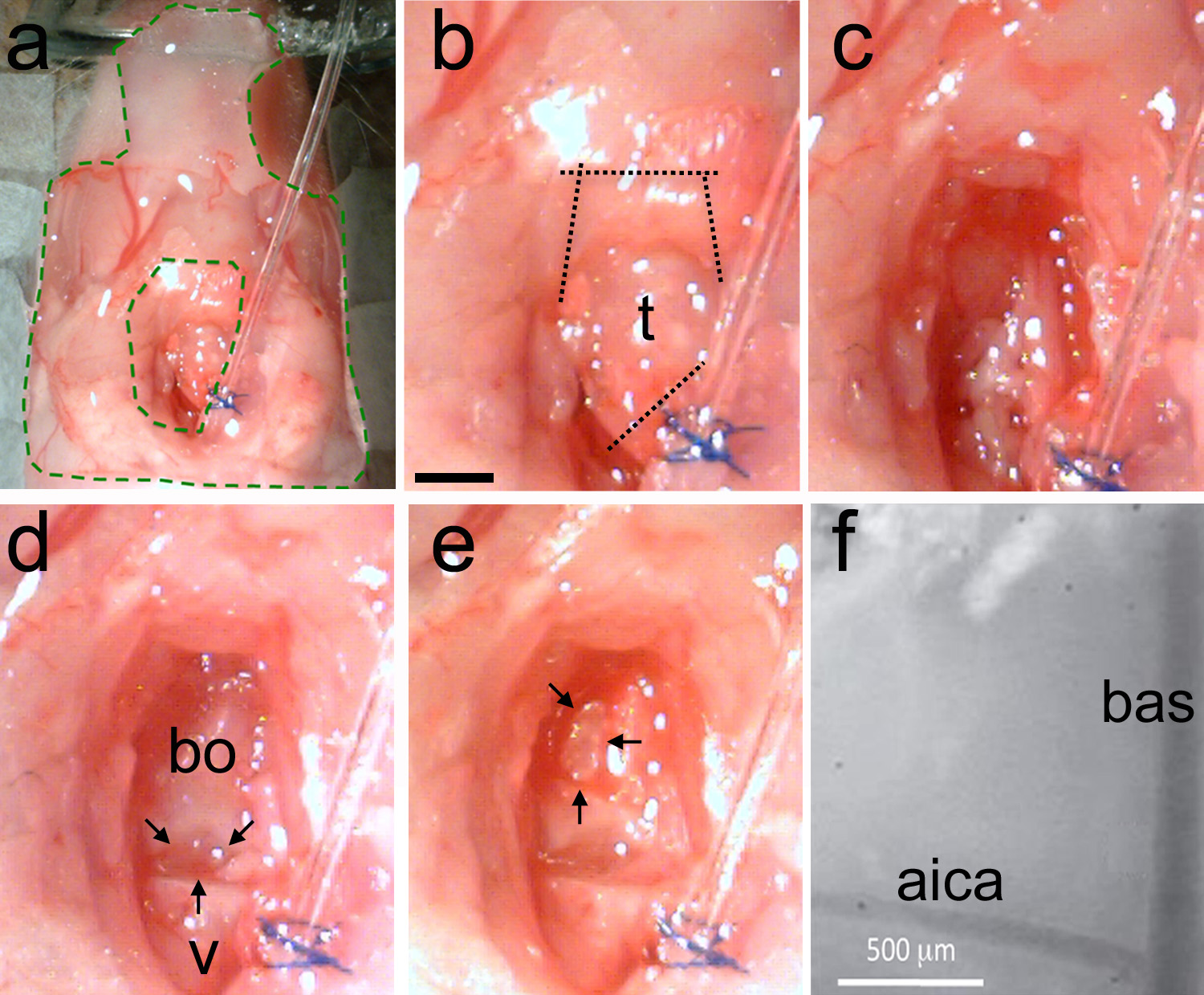
Figura 5. Rimozione della trachea e rendendo la craniotomia. Una, la preparazione è stabilizzato con elastomero (area all'inter de verde linee tratteggiate). b, la trachea è identificato e poi tagli sono fatti prima di separare la trachea lontano dal tubo di intubazione, e poi a tagliare i muscoli mandibolari (linee tratteggiate). c, pulire la superficie del cranio con smussato tecnica per rimuovere il muscolo e utilizzare la carta assorbente per rimuovere il grasso e il sangue. d, Esempio di una zona pulita mostra l'ultima vertebra (v) e la basi-occipitale osso (bo). C'è un divario naturale tra le due ossa (frecce nere). Posta, Utilizzo di un microdrill o detergente ad ultrasuoni sottile il cranio a forma di D rovesciata (frecce nere). Rompere delicatamente il cranio assottigliata e togliere il pezzo di osso. Vascolarizzazione punto di riferimento dovrebbe essere visibile. F, view-Alto ingrandimento dei punti di riferimento vascolari sulla superficie tronco encefalico esposta. Bas = arteria basilare; AICA = arteria cerebellare antero-inferiore. Bar Scala in b = 1 mm, vale a ce.highres.jpg "target =" _blank "> Clicca qui per vedere l'immagine ingrandita.
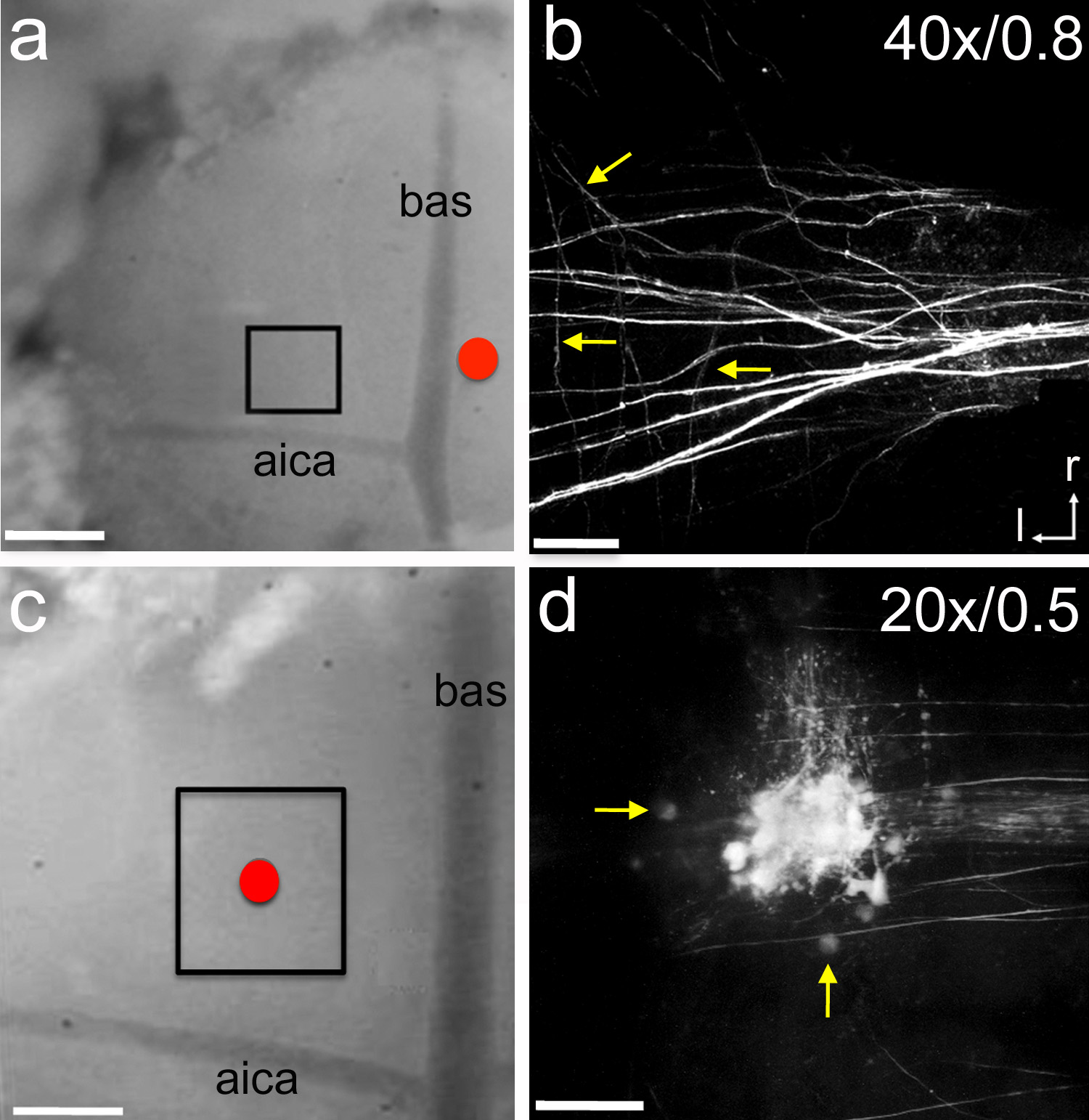
Figura 6. Elettroporazione di traccianti neurali. Uno, un elettrodo di vetro contenente il tracciante neurale micro-ruby è stato collocato vicino alla linea mediana (cerchio rosso). Il tracciante è stata elettroporata con 7 secondi di impulsi -5 lungo μA consegnati ogni 14 secondi per 15 minuti. Dopo 1 ora di tempo di recupero della zona in scatola è stato ripreso con un microscopio a due fotoni. P1 ratto cucciolo. B, Exemplar immagine z-stack di etichettatura degli assoni afferenti al MNTB. Frecce indicano i singoli rami collaterali. C, un elettrodo di vetro riempito di micro-rubino è stato posizionato sulla parte superiore del MNTB (cerchio rosso). Il tracciante è stata elettroporazione utilizzando le stesse impostazioni descritte in un. Dopo 1 ora di tempo di recupero della zona in scatola eraripreso con un microscopio a due fotoni. P5 ratto cucciolo. D, Exemplar immagine z-pila di cellule marcate e degli assoni nel MNTB. Le frecce indicano le cellule MNTB singoli. Etichette in B e C indicano ingrandimento dell'obiettivo e apertura numerica, rispettivamente. Bar Scala in una e c = 300 micron; bar scala b = 45 micron; barra della scala in d = 90 micron. AICA = antero-inferiore arteria cerebellare; bas = arteria basilare; r = rostrale; l = laterale. Clicca qui per vedere l'immagine ingrandita.
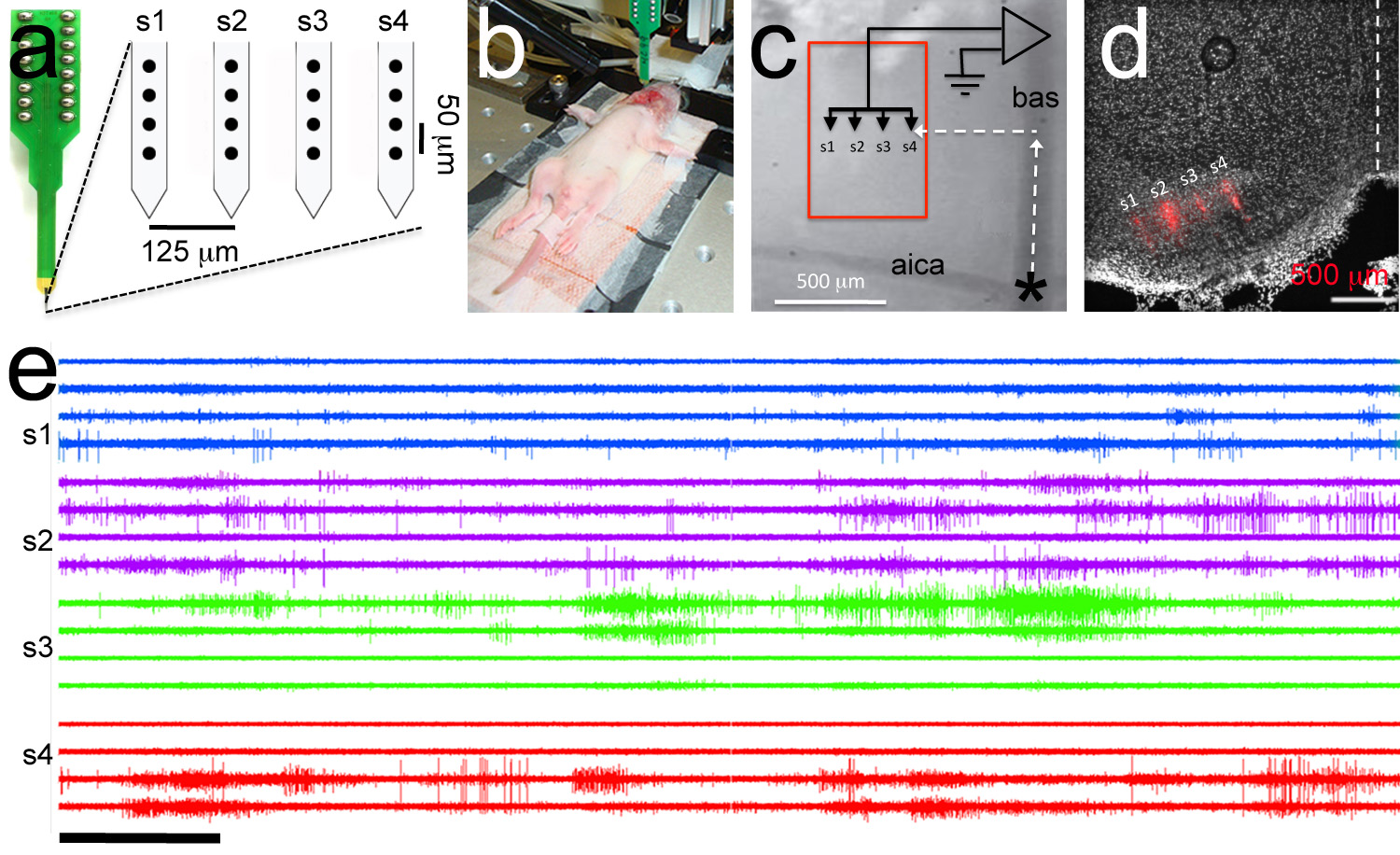
Figura 7. Mirata registrazione polytrode a., Polytrode composta da 4 gambi con 4 elettrodi per gambo (cerchi neri). Sono indicate le distanze intra-e inter-gambo tra gli elettrodi. B, Immagine Esemplare di esperimenti di elettrofisiologia. Un elettrodo di riferimento viene inserito nella cavità bucal e un ploytrode è collegato al headstage. P6 ratto cucciolo. C, maggiore ingrandimento dei punti di riferimento vascolare utilizzati per polytrode targeting. Il polytrode è posizionato in coordinate rostrale-laterali di indirizzare il nucleo mediale del corpo trapezoidale (riquadro rosso). D, POSTHOC analisi istologica dimostra corretta destinazione della polytrode DII rivestite (traccia polytrode è mostrato in rosso). Posta, Exemplar più -unità di registrazione. Ordine Trace è lo stesso ordine di elettrodi in un pannello. All'interno di registrazioni gambo avere lo stesso colore. Bar Scala in e = 5 secondi. Clicca qui per vedere l'immagine ingrandita.
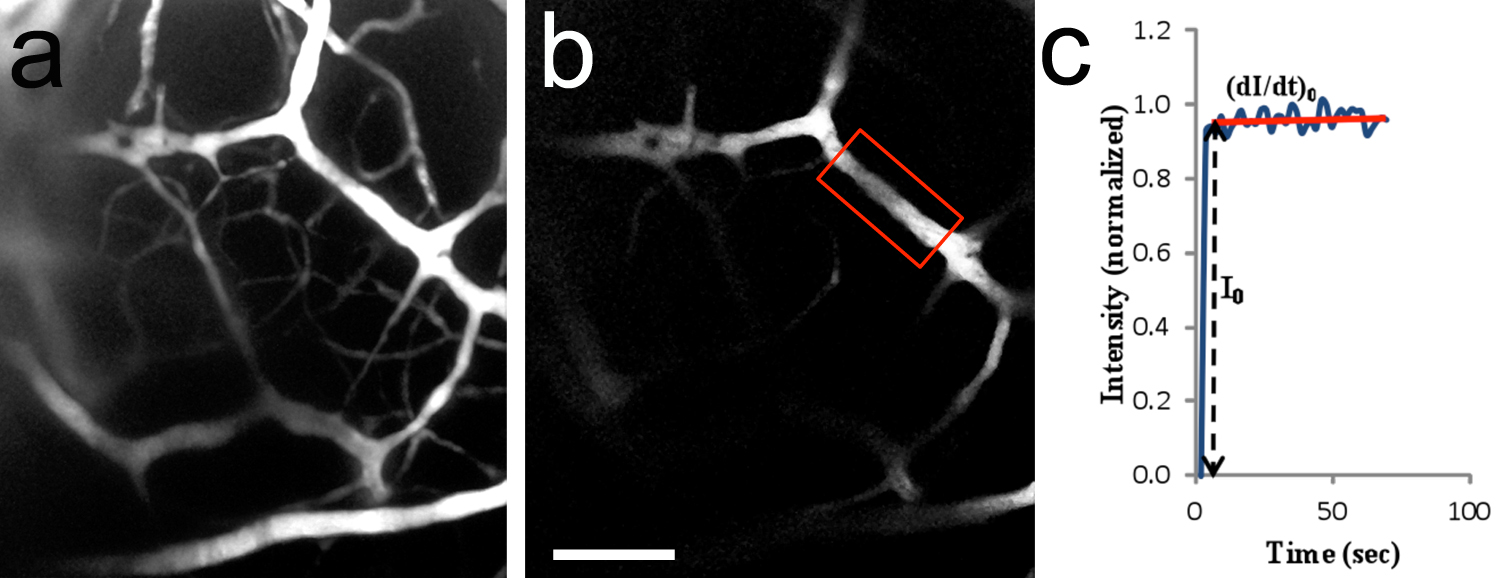
Figura 8. In vivo due fotoni di imaging di microvasi cerebrali. un, immagine 2-D (compresso Z-stack) di vascolare cerebrale dopo perfusione di TRITC-destrano 155 kD nella carotide. La zona ripreso è simile a quello mostrato in figura 7c. 20x/0.5 obiettivo di immersione in acqua. P10 ratto cucciolo. B, regione di interesse (ROI) usati per misurare l'intensità di fluorescenza (riquadro rosso regione chiusa). Il microvasi aveva un diametro di circa 14,2 micron e 182 micron era situato sotto la superficie tronco cerebrale. C, tipica curva di intensità di fluorescenza (valore normalizzato) in funzione del tempo. I 0 è l'aumento graduale di intensità di fluorescenza del ROI quando la soluzione fluoresence appena riempie il lume del vaso. (DI / dt) 0 e 0 vengono utilizzati per determinare la permeabilità dei microvasi per il soluto. La permeabilità al TRITC-destrano 155 kD era pari al 1,5 x 10 -7 cm / sec.Bar Scala in b = 100 micron, si applica a una. Clicca qui per vedere l'immagine ingrandita.
Discussione
Il tempo è un fattore critico. Un ricercatore esperto dovrebbe essere in grado di completare questo protocollo in 1 ora (passi 1-3). I tempi indicati per le diverse fasi assumono un medio-alto livello di competenza. Tracheotomia e intubazione corretta e tempestiva sono fondamentali, in quanto scarso controllo ventilazione può portare ad asfissia e la morte dell'animale. Liquidazione attenta dei tessuti muscolari e adipose è molto importante anche perché gli errori possono portare a sanguinamento incontrollato e la morte dell'animale. Allo stesso modo, quando si prepara l'arteria carotide per l'inserimento cannula, bisogna stringere e tagliare l'arteria con attenzione, se il nodo del filo si allenta sanguinamento incontrollato avrà luogo. Infine, la craniotomia deve essere fatta con attenzione, senza interrompere i punti di riferimento vascolare. Rimozione incurante dello strato meningea esterna (dura) può portare a gravi emorragie e danni della fornitura arteriosa.
Impostazioni di ventilazione sono scelti secondo l'età dell'animale.La maggior parte dei fornitori commerciali forniscono utili informazioni su tali impostazioni. Esperimenti sui ratti di età superiore a P15 richiedono l'uso di un grande ventilatore animale. Animali adulti non possono avere bisogno di ventilazione se anestetizzati con ketamina / xylazina, ma l'intubazione è consigliato per evitare fluido entrare nella trachea.
Una limitazione principale di questo protocollo è che gli esperimenti possono essere eseguiti soltanto acutamente. Nel nostro laboratorio abbiamo effettuato esperimenti di durata compresa tra due e fino a dieci ore. Una seconda limitazione è che gli esperimenti devono essere effettuati sotto anestesia. Pertanto, la scelta di anestesia è una variabile importante da considerare nella pianificazione e progettazione di esperimenti. Un problema correlato è che gli animali neonati possono essere particolarmente sensibili al sovradosaggio. Ad esempio, se si sceglie di ketamina / xilazina mix, calcolare la dose in base al peso del cucciolo e somministrare farmaci a ⅓ del volume massimo. Controllare lo stato dell'animale ogni 5-10 minuti da toe pinch response. Se si utilizza isoflurano, sono necessarie anche le precauzioni per mantenere un ambiente sicuro per l'investigatore (corretta ventilazione, e un vaporizzatore calibrato correttamente).
Lo stereomicroscopio può essere montato su un supporto flessibile per regolare l'angolo di visione e facilitare la gestione spazio per posizionare elettrodi e trasferimento dell'animale al microscopio a due fotoni. L'uso di una batteria per alimentare il ventilatore può facilitare lo spostamento dell'animale e ridurre gli artefatti elettrici durante gli esperimenti di elettrofisiologia. A tal fine, una piccola basetta (7,5 x 12 pollici) può essere utilizzato per assemblare insieme al ventilatore, rilievo di riscaldamento e la anestetizzato animale (Figura 2a). Una modifica utile ed importante per questa configurazione è l'aggiunta di un dispositivo per il monitoraggio dei parametri vitali durante l'intervento chirurgico. Un ossimetro o altri dispositivi analogici possono essere utilizzati a seconda del budget laboratorio.
Questo protocollo è stato usato con elettrofisiologia e di imaging incontratohods, incluse registrazioni di patch clamp 8,10,11, registrazioni polytrode (Figura 7), e due fotoni di imaging 9 (figure 6 e 8). Una possibile applicazione futura sarebbe di combinare questi metodi per colpire le cellule fluorescente per la registrazione elettrofisiologica 16.
Le nuove applicazioni di imaging possono anche includere 2-D o serie temporali 3-D usando la microscopia a due fotoni. Ad esempio, utilizzando bolo loading di indicatori calcio per studiare l'attività del tronco cerebrale neuronale e popolazioni di cellule gliali. Come mostrato in figura 8, una soluzione colorante iniettato nella circolazione sanguigna attraverso l'arteria carotide può essere utilizzato per generare immagini ad alto contrasto del cervello del sistema vascolare. Poiché il colorante fluorescente riempie il lume microvasali e si diffonde nel tessuto circostante, esso può essere utilizzato non solo per la determinazione del soluto permeabilità apparente della barriera ematoencefalica ma anche il coefficiente di diffusione del solutoficiente nel tessuto cerebrale 3. Una ragione principale per iniettare i soluti fluorescente attraverso l'arteria carotidea è che la soluzione colorante può andare direttamente ai microvasi nel cervello senza andare al cuore prima come in una iniezione coda vena. Questo porta almeno due vantaggi. Uno è che la concentrazione di fluorescenza colorante nel lume microvasali può essere praticamente costante se il tasso di perfusione è fissata sul sito incannulamento. Questo assicura determinazione accurata della permeabilità barriera emato-encefalica. Un altro è che se un agente di test è incluso nel perfusato, si passerà direttamente alla barriera emato-encefalica senza essere diluito o in combinazione con altri fattori della circolazione del corpo.
Nuovi esperimenti possono inoltre usufruire di animali transgenici con i giornalisti fluorescenti geneticamente codificati. Ciò fornirebbe il vantaggio che le sonde fluorescenti non avrebbero bisogno di essere caricato in situ (a meno che il progetto dell'esperimentodisponga diversamente), risparmio di tempo e forse consentendo preparati intatte altre (ad esempio, finestre cranica 17).
Infine, esperimenti possono essere condotti in altre regioni del tronco cerebrale come l'oliva inferiore o il nucleo motore facciale. Le conoscenze su neuroanatomia e lo sviluppo delle popolazioni cellulari specifiche in una determinata specie sarà importante a questo fine, in particolare per quanto punti di riferimento anatomici possono cambiare come animali crescono (Figura 1). Ci auguriamo che questo protocollo incoraggia gli altri a studiare le strutture del tronco cerebrale ventrali utilizzo in elettrofisiologica vivo e metodi di imaging.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla concessione G12-RR003060 da NIH / NCRR / RCMI, concedere SC1HD068129 dall'Istituto Nazionale di Eunice Shriver del Child Health & Human Development, National Science Foundation CBET 0.754.158 e PSC-CUNY 62337-00 40 presso la City University di New York.
Materiali
| Name | Company | Catalog Number | Comments |
| Absorbant pads | Kettenbach | Sugi 31603 | Other options may be available from different companies |
| Cautery | Braintree Scientific, INC | GEM 5917 | Other options may be available from different companies |
| Tetramethyl rhodamine Isothiocyanate dextran | Sigma | T1287-500MG | Other options may be available from different companies |
| Dissecting Chisel | Fine Science Tools | 10095-12 | Other options may be available from different companies |
| DiI | Invitrogen | V-22885 | Other options may be available from different companies |
| Elastomer | World Precision Instruments | KWIK-SIL | Other options may be available from different companies |
| Fine Scissors | Fine Science Tools | 14060-09 | Other options may be available from different companies |
| Forceps | Fine Science Tools | 11027-12,11617-12, 11616-16 | Other options may be available from different companies |
| Spring Scissors | Fine Science Tools | 15009-08 | Other options may be available from different companies |
| Heating pad | FHC | 40-90-2 | Other options may be available from different companies |
| Intubation tubing | Braintree Scientific, INC | BIO CO-KIT | Choose age appropriate size |
| Light source | Spach Optics | Schott Ace illuminator | Other options may be available from different companies |
| Micro drill | Braintree Scientific, INC | MD-1200 120V | Other options may be available from different companies |
| Paper tape | Walgreens | Generic brand | Other options may be available from different companies |
| Syringe filter | VWR | 28145-483 | Other options may be available from different companies |
| Syringe pump | VWR | 52459-008 | Other options may be available from different companies |
| Stereomicroscope | Olympus | SZ61 | Other options may be available from different companies |
| Suture | Ethicon | Prolene 86979 | 6-0 size |
| Tubing | Braintree Scientific, INC | Micro-Renathane (MRE033); SUBL-120 | Other options depending on pup’s age |
| Vaporizer (isoflurane) | Vetequip Incorporated | 911103 | Other options may be available from different companies |
| Ventilator (minivent) | Harvard Apparatus | 730043 | Use for P0-P12 rats |
Riferimenti
- Kerr, J. N. D., Denk, W. Imaging in vivo: watching the brain in action. Nat. Rev. Neurosci. 9 (3), 195-205 (2008).
- Sigler, A., Murphy, T. H. In vivo 2-photon imaging of fine structure in the rodent brain: before, during, and after stroke. Stroke. 41 (10), 117-123 (2010).
- Shi, L., Zeng, M., Sun, Y., Fu, B. M. Quantification of blood-brain barrier solute permeability and brain transport by multiphoton microscopy. ASME J. of Biomech. Eng. 136 (3), 031005-031005 (2014).
- Galambos, R., Schwartzkopff, J., Rupert, A. Microelectrode study of superior olivary nuclei. Am. J. Physiol. 197, 527-536 (1959).
- Goldberg, J., Brown, P. B. Response of binaural neurons of dog superior olivary complex to dichotic tonal stimuli: some physiological mechanisms of sound localization. J. Neurophysiol. 32 (4), 613-636 (1969).
- Guinan, J. J., Guinan, S. S., Norris, B. E. Single auditory units in the superior olivary complex I: responses to sounds and classifications based on physiological properties. Intern. J. Neurosci. 4, 101-120 (1972).
- Spirou, G. A., Brownell, W. E., Zidanic, M. Recordings from cat trapezoid body and HRP labeling of globular bushy cell axons. J. Neurophysiol. 63 (5), 1169-1190 (1990).
- Khosrovani, S., Der Giessen, R. S. V. a. n., De Zeeuw, C. I., De Jeu, M. T. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proc. Natl. Acad. Sci. U.S.A. 104 (40), 15911-15916 (2007).
- Rodríguez-Contreras, A., Van Hoeve, J. S., Habets, R. L., Locher, H., Borst, J. G. G. Dynamic development of the calyx of Held synapse. Proc. Natl. Acad. Sci. U.S.A. 105 (14), 5603-5608 (2008).
- Lorteije, J. A., Rusu, S. I., Kushmerick, C., Borst, J. G. G. Reliability and precision of the mouse calyx of Held synapse. J. Neurosci. 29 (44), 13770-13784 (2009).
- Tritsch, N. X., Rodríguez-Contreras, A., Crins, T. T., Wang, H. C., Borst, J. G. G., Bergles, D. E. Calcium action potentials in hair cells pattern auditory neuron activity before hearing onset. Nat. Neurosci. 13 (9), 1050-1052 (2010).
- Tong, H., Steinert, J. R., Robinson, S. W., Chernova, T., Read, D. J., Oliver, D. L., Forsythe, I. D. Regulation of Kv channel expression and neuronal excitability in rat medial nucleus of the trapezoid body maintained in organotypic culture. J. Physiol. 588 (9), 1451-1468 (2010).
- Sonntag, M., Englitz, B., Kopp-Scheinpflug, C., Rübsamen, R. Early postnatal development of spontaneous and acoustically evoked discharge activity of principal cells of the medial nucleus of the trapezoid body: an in vivo study in mice). J. Neurosci. 29 (30), 9510-9520 (2008).
- García-Villalón, A. L., Roda, J. M., Alvarez, F., Gómez, B., Diéguez, G. Carotid blood flow in anesthetized rats: effects of carotid ligation and anastomosis. Microsurgery. 13 (5), 258-261 (1992).
- Yuan, W., Lv, Y., Zeng, M., Fu, B. M. Non-invasive method for the measurement of solute permeability of rat pial microvessels. Microvasc. Res. 77 (2), 166-173 (2009).
- Kitamura, K., Judkewitz, B., Kano, M., Denk, W., Haüsser, M. Targeted patch-clamp recordings and single-cell electroporation of unlabeled neurons in vivo. Nat. Methods. 5 (1), 61-67 (2008).
- Mostany, R., Portera-Cailliau, C. A method for 2-photon imaging of blood flow in the neocortex through a cranial window. J. Vis. Exp. (12), (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon