Method Article
Yenidoğan Kemirgenlerin Ventral Kafatası kranyotomi olun Bir Yöntem
Bu Makalede
Özet
Bir cerrahi yöntem, yeni doğmuş sıçanlarda ventral kafatasını açığa çıkarmak için tarif edilmektedir. Bu yaklaşımı kullanarak bu anestezi yavruların beyin sapı akut elektrofizyoloji ve iki-foton mikroskopi deneylerini gerçekleştirmek için bir kraniotomi açmak mümkündür.
Özet
In vivo deneyler için bir kranyotomi kullanılması erişkin memeli beyninde ve gelişme sırasında çeşitli hücresel süreçlerin dinamiklerini araştırmak için bir fırsat sağlar. Çoğu in vivo yaklaşımlar sırt tarafında bulunan beyin bölgelerini incelemek için kranyotomi kullanmalarına rağmen, bu tür ventral tarafında bulunan pons, gibi beyin bölgeleri nispeten ilgili yeterli kalır. Bu protokolün ana amacı, elektrofizyolojik ve görüntüleme yöntemleri kullanılarak in vivo okudu böylece ventral beyinsapı yapılarının erişimi kolaylaştırmaktır. Bu yaklaşım sağlar yapısal uzun menzilli akson değişiklikler, tek bir elektriksel aktivite desen ve hücrelerin topluluklar ve yenidoğan hayvanlarda kan beyin bariyeri geçirgenliğinin değişikliklerin çalışma. Bu protokol, yeni doğmuş sıçanlarda beyin sapı işitsel çalışma için en çok kullanılmış olmasına rağmen, bu tür kolay yeni doğmuş farelerde, yetişkin Roden gibi diğer kemirgen türlerde çalışmalar için uyarlanabilirts ve diğer beyin bölgeleri.
Giriş
Flüoresan görüntüleme ve elektrofizyoloji teknikleri ile kombinasyon halinde bir kranyotomi kullanılması izleme sağlar: kan akımı, kan-beyin bariyeri geçirgenliğinin ve canlı hayvan 1-3 nöron ve glial hücrelerin aktivitesinin ölçülmesi. Çeşitli laboratuarlar sağlıklı ve hastalık durumlarında beyin fizyolojisi içgörü sağlamak için bu yaklaşımı kullanmış, ancak boşluklar bu süreçlerin gelişimi sırasında ortaya nasıl anlayışımıza kalır. Ayrıca, çalışmaların çoğu çeşitli fizyolojik rolleri ile ventral beyin sapı yapıları ex vivo yaklaşımlar kullanılarak çoğunlukla çalışılmıştır şekilde, kolayca kafatasının dorsal yüzeyinden erişilebilir beyin bölgelerinde odaklanmıştır.
Bu protokol ana amacı kemirgen ventral kafatası kranyotomi açılması için bir yöntem sağlamaktır. Bu yaklaşım, duyusal neurophysiology reco için köpek ve kedi gibi daha büyük memelilerde gerçekleştirilen klasik çalışmalar uyarlanmıştırişitsel beyin sapı 4-7 rdings. Bu protokolde Ancak, yenidoğan hayvanlarda prosedürü yerine yeni bir meydan okuma vardır. Damar işaretlerini kullanarak, bu adapte protokol yenidoğan sıçanlar, yetişkin farelerin ve alt zeytin 8-11 (Şekil 1) gibi diğer beyin sapı bölgelerin işitsel beyin sapı incelemek için önceden kullanılan olmuştur.
Ventral beyin sapı çekirdekleri çalışma mevcut yöntemlere göre bir ventral kranyotomi bir ana avantajı yaşayan hayvanlar ilgi yapılarına doğrudan erişim sağlamasıdır. Örneğin, üstün olivary kompleksinin işitsel hücreleri probları hedef yerleştirilmesi için ve görüntüleme derinliği 0,5 mm ile sınırlı hangi iki foton görüntüleme yaklaşımlar kullanılarak için önemli olan beyin yüzeyinden mikrometre arasında birkaç on lokalizedir Hafif doku saçılma ve soğurma. Bir ventral kraniotomi de wh, nispeten bozulmamış sinirsel bağlantıları ile bir hazırlık sağlar,ich akut ve organotipik dilim hazırlıkları 12 bozulur. In vivo deneyler neurophysiology 13 için diğer protokollere aksine, ventral bir yaklaşım, çok elektrot kayıt ve hücre toplulukları hakkında bilgi görüntüleme yöntemleri ile kombine edilebilir (Şekil 6 ve 7). Son olarak, bu protokol ile kombinasyon halinde bir floresan işaretli çözünen çözünen için, kan-beyin bariyeri geçirgenliğinin değişiklikleri (Şekil 8) ölçmek için damar enjekte edilebilir.
Protokol
Aşağıdaki protokol New York City College Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından kurulan hayvan bakım yönergeleri takip eder.
1.. Hayvan Entübasyon (10-20 dakika)
- Ameliyat öncesinde, memeli Ringer çözeltisi hazırlar. Cerrahi aletler, ısıtma pedi, ve bankta küçük hayvan vantilatör (Şekil 2) birleştirin.
- Kan-beyin bariyeri geçirgenliğinin ölçümleri için Ringer içinde% 1 sığır serum albümini (BSA) çözeltisi 10 ml yapmak ve% 1 BSA çözeltisi, 25 mm şırınga filtresinden (0.2 um filtre ile çözelti içinde 8 mg / ml 'de TRITC-dekstran 155 kD çözülür gözenek boyutu) ve karanlıkta bir folyo kaplı şırınga saklayın.
- Izofluran kullanarak hayvan anestezisi. Idamesi ve 1.5-3.0% için 5.0% kullanın. Alternatif olarak, ketamin (41.7 mg / kg) ve ksilazin (2.5 mg / kg vücut) bir karışımı kullanılabilir. Anestezi derinliği ayak tutam refleksi ile kontrol edilebilirüst ve alt ekstremite.
- Ketamin sonraki doz (41.7 mg / kg vücut ağırlığı) ve ksilazin (2.3 mg / kg vücut ağırlığı) doz aşımı önlemek için en yüksek dozun ⅓ artışlarla tatbik edilmelidir. Bir kemirgen vantilatör kullanılması ksilazin ile indüklenen solunum depresyonu ortadan kaldırmak için tavsiye edilir.
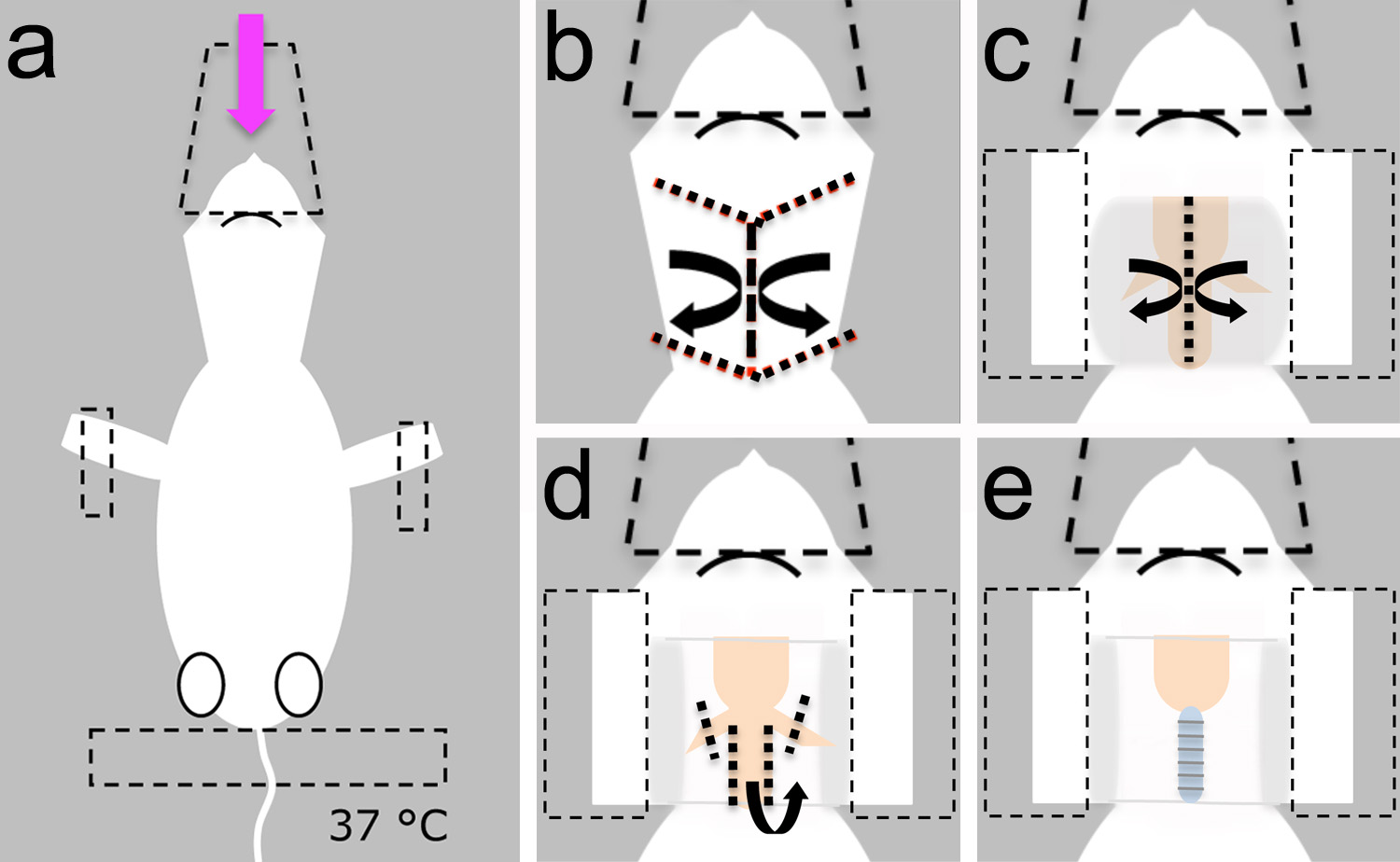
- Dorsal yan yatarken anestezi yavru yerleştirin ve anestetik (Şekil 3a) teslim etmek için kullanılan plastik koni ile başını sağlamlaştırmak.
- Ön bacaklarda ve kuyruk (Şekil 3a) üzerinde yapışkan bant ile hayvan sabitleyin.
- Yavru kafasını sağlamak için alternatif bir metal çubuk bağlanmış bir kafa plakası kullanmaktır.
Not: ısıtma pedi hipotermi (Şekil 3a) önlemek için 37 ° C'ye ayarlanmış olduğundan emin olun.
- Bir boyuna yapmak için makas (Şekil 2b) kullanın ve cilt üzerinde dört yan insizyon (boyun örtenŞekil 3b). Künt tekniği kullanarak, cildi incelemek ve forseps kullanarak bir kenara koyun (Şekil 2c ve 3c).
- Yapışkan bant kullanılarak cilt basılı tutun. Yatay konumda (Şekil 3c) 'de baş stabilize.
- Trakea (Şekil 3c) maruz kenara yaylı makas (Şekil 2d) ve künt tekniği, itme bezleri ve yağ katmanları kullanma. Karotid arter konumunu belirlemek.
- Uzak trakea karotis arterler tutun.
Not: karotis delme yavru masif kan kaybı ve ölüme neden olabilir.
- Uzak trakea karotis arterler tutun.
- Yaylı makas kullanılarak (Şekil 2d) trakea kapsayan boyuna kasları teşrih. Trakea (Şekil 3d) altında bulunan uzunlamasına kaslar kesin.
Not: trakeal halkalar (Şekil 3e) açıkça görünür olmalıdır.- Kullanmaforseps (Şekil 2c), trakea etrafında dikiş iki adet kravat. Sütür tek parça havalandırma tüp güvenli ve ikinci iplik havalandırma tüpü yerleştirilmesi noktasında (Şekil 4a) trakea rostral kapatmak için kullanılır.
Not: nemlendirir, su kaybını önlemek için Ringer solüsyonu ile düzenli doku maruz.
- Kullanmaforseps (Şekil 2c), trakea etrafında dikiş iki adet kravat. Sütür tek parça havalandırma tüp güvenli ve ikinci iplik havalandırma tüpü yerleştirilmesi noktasında (Şekil 4a) trakea rostral kapatmak için kullanılır.
- Yaylı makas kullanılarak (Şekil 2d) aşama 1.6.1 (Şekil 4c) yerleştirilen iki dişin arasında bulunan trakeal halkalardan birinde bir kesi yapmak.
Not: herhangi bir sıvı açık trakea girer emin olun. Trakea sıvı boğulmaya neden olur. - Trakea içine entübasyon tüpü (Şekil 4b) takın ve sabitlemek için alt iplik sıkın. Forseps (Şekil 2c), entübasyon tüpünün ekleme noktasına trakea posterior kapatmak için üst iplik sıkın.
- Tighten ve iki ipliği (Şekil 4d-f) uçlarını kesin.
Not: entübasyon tüpünün içine Buhar üfleme kontrolü iyi bir işaretidir.
- Tighten ve iki ipliği (Şekil 4d-f) uçlarını kesin.
- Derhal ventilatöre izofluran kaynağını açın. Hayvanın ağırlığına göre vuruş hacmi ve havalandırma hızını ayarlayın.
- Elastomer ile maruz çevreleyen doku (Şekil 5a) sıkıca kapatın. Yüzeyi nemli ve temiz tutun.
2.. Trakea ve Kas Kaldırma Kraniyumun Expose (5-10 dk)
- Havalandırma borusuna yakın trakea kesmek için yaylı makas (Şekil 2d) kullanın. Damak kaudal ucunu açığa çıkarmak için ağız boşluğuna kas duvarı boyunca iki kesim yapın (Şekil 5b).
Not: Gerekirse, kanamayı durdurmak için bir cauterizer kullanın. Kontrolsüz kanama hayvanın ölümüne neden olacaktır. - Temizleyinalan Ringer solüsyonu (Şekil 5c) bol miktarda kullanarak. Son vertebra ve Basi-oksipital kemik (Şekil 5d) arasındaki boşluğu belirleyin.
Not: kemikler arasındaki boşluk beyin sapı yapıları bulmak için yararlı bir kafatası bir dönüm noktası olduğunu. Aşağı zeytin bu boşluğun altında yer almaktadır. Işitsel superior oliver kompleks (Şekil 1 de bakınız), bu boşluğu gelen rostral yönde Basi-oksipital kemiğin altında bulunur. - Forseps (Şekil 2c) ve yaylı makas (Şekil 2d) kullanarak bölgeyi temizleyin. Kan damarlarını delmeyin.
Not: Gerekirse, kanamayı durdurmak için dağlamak.- Açık alan, yağ ve kas dokusu, temiz sonra, Basi-oksipital kemik ve son omur ayıran boşluk görebilir (Şekil 5d) olmalıdır.
3.. Kranyotomi (15-30 dakika)
- Bir mikrotur veya ultra kullanınsonik temizleyici. Bullasının medial duvar bulun.
- Yatan arterler (Şekil 5e) görünene kadar bir ters D şekli yaparak ince kafatası.
Not: baziler arter (bas) beyin sapı orta hat üstünde çalışır. Anterior inferior serebellar arter (AICA) dalları bilateral ve farklı hayvanlarda sabit bir konuma sahip olduğu bir dönüm noktası olarak güvenilir kullanılabilir. - Kafatası inceltilmiş olduğunda, yavaşça bir kesme keski (Şekil 2e) kullanarak bölünürler. Forseps ile kemik parçası (Şekil 2c) sökün. Alternatif olarak, asansör ve bükülmüş bir iğne kullanılarak kafatası kırmak.
Not: kraniotomi boyutu ve şekli planlanan deney için uygun olana kadar bu işlemi tekrarlayın. Bas ve aica dura zarı (Şekil 5f) aracılığıyla görünür olmalıdır.
- Yatan arterler (Şekil 5e) görünene kadar bir ters D şekli yaparak ince kafatası.
- Alanı taze Ringer çözeltisi ile birkaç kez temizleyin. Emici pa kullanmads dura zarın yüzeyini kurutun.
- Gerekirse, dönüm arterler bas ve AICA yerinden veya bozmadan dura zar kaldırmak için bir dikiş iğnesi kullanın.
Not: beyin omurilik sıvısı delinmesiyle dura dışarı akacaktır üzerine. Ringer çözeltisi ile bölgeyi temizleyin ve deney boyunca nemlendirilmiş tutmak.
- Gerekirse, dönüm arterler bas ve AICA yerinden veya bozmadan dura zar kaldırmak için bir dikiş iğnesi kullanın.
4. Elektrofizyoloji Deney
- Deney tasarımı ile (Şekil 7) göre polytrode seçin. Kat DII ile polytrode ince bir fırça kullanın. , 1 ml mikrosantrifüj tüpü içine DII çözüm aktarın çözelti içindeki daldırma fırça ve yavaşça (örneğin bir Stereoskop kullanılarak) görsel gözetiminde polytrode çarpar. Prob ucu başlayın ve elektrotlar muntazam biçimde kaplanmış kadar dikkatli bir şekilde devam eder.
- Ağız boşluğu içindeki toprak elektrotu yerleştirin. Elektrot tutucu (Şekil 7b içine yerleştirin polytrode
- Üzerinde amplifikatörü açmak ve tüm bağlantıların iyi çalıştığını kontrol edin.
- AICA (pozisyon sıfır) şube noktada bas yukarıda elektrot yerleştirin. Uygun rostral-yanal koordinat (Şekil 7c) kullanılarak istenilen hedef noktasına elektrot taşıyın.
- Beyin yüzeyinde elektrot yerleştirin ve 5-10 mikron adımlarla istenilen derinliğe taşıyın.
- Deneme desenine göre kayıt yapın. Daha fazla analiz için verileri kaydetmek.
5. İki foton Görüntüleme Deneyi
- Mikroskop açın. Dalgaboyu ayarlayın ve uygun bir emisyon filtresi kullanın. 800 nm uyarma ve TRITC-dekstran görüntüleme için de bir 607 ± 45 nm band geçiren emisyon filtresi çalışma.
- Sağ veya sol karotis arter tespit. Künt tekniği kullanarak komşu bağ dokuları ya da sinirlerden karotis arter teşrih.
- Karotis almak ve tutunhemostatla arter. Karotid arter çevresinde dikiş üç adet kravat.
- Kan akışını durdurmak ve gevşek diğer iki Konuları bırakmak yakın kalp tarafına iplik sıkın.
- Bağlı iplik ve sonraki gevşek parçacığı arasında karotis arter üzerinde bir 45 ° 'lik açıyla küçük bir kesim yapmak için ince makas kullanın.
Not: emici kağıt ile kanı temizleyin.
- Karotid arter Cannulate. Yaklaşık 5 mm derinliğinde yavrunun kafası yönelik karotis arter üzerinde kesim içine TRITC-dekstran solüsyonu ile dolu tüp yerleştirin.
- Birlikte, tüp ve arter tutmak için arter çevresindeki diğer iki konuları sıkın. , Konuları sıkın Döşeme ve daha fazla stabilize etmek için elastomer ekleyin.
Not: borunun diğer tarafında (aşama 1.1 'de elde edilmiş) TRITC-dekstran çözeltisi ihtiva eden bir şırınga ile bağlanır.
- Birlikte, tüp ve arter tutmak için arter çevresindeki diğer iki konuları sıkın. , Konuları sıkın Döşeme ve daha fazla stabilize etmek için elastomer ekleyin.
- Şırınga pompası şırınga Fix.
- Setyavru karotid arter kan akış hızında hızı. Birkaç saniye için bir şırınga pompası açın ve boya çözeltisi karotid arter içine enjekte edilebilir elle kontrol edin. Not: Yetişkin farelerin karotid arter kan akış hızı (240-280 g) varsayılarak, yaklaşık 3 ml / dakika, 14, bir yavru fare için kan akış hızı (örneğin, P10 yavru 15-25 g ağırlığında) için hesaplanan edilebilir 0.16-0.3 ml / dak aralığı.
- Mikroskop objektif altında hayvan yerleştirin. Kana floresan dekstran enjekte edilir.
- 5X hava amacı ile ventral beyin sapı üzerinde ilgi alanları belirlemek. 20X veya 40X amacı geçmek ilgi (ROI) bölgesini odak (suya daldırma, NA sırasıyla 0.5 ve 0.8, =).
- Görüntüleme başlatın ve ROI damar içinde floresan yoğunluğu kadar görüntü elde etme parametreleri (örneğin, maruz kalma süresi, lazer gücü, dedektör kazanç) ayarlamak optimize edilir (yani) çok düşük değil ama doymuş değil.
- Karotid artere boya çözeltisinin enjekte ve sabit bir odak düzlemi bir zaman serisi elde etmek için bir şırınga pompası açın.
6.. Hayvan Bakımı ardından Prosedürü
- Bu, bir terminal işlemdir. Bir deney hayvan sonunda yüksek dozda pentobarbital (100 mg / kg, karın içinden enjeksiyon) veya American Medical Association Veteriner Ötenazi Rehberi tarafından onaylanmış ötenazi herhangi bir başka yöntem ile ötenazi gerekir.
Not: Perfüzyon Ringer çözeltisi ile kalbinden bir tespit çözeltisi ile ve ardından fazla histolojik analiz için tavsiye edilir.
Sonuçlar
Nöral izleyiciler eîektroporasyonu
Trapezoid gövdenin (MNTB) medial çekirdeği Bu protokol kullanılarak, daha önce araştırılmıştır üstün olivary karmaşık bir hücre grubudur. Örneğin, yama kelepçe pipetler (Şekil 6) 9 sinir izleyiciler elektroporasyonu için kullanılabilir. Şekil 6A'da gösterildiği gibi, pipetler orta hatta yakın yerleştirilir, sonuç çaprazlaşma afferent aksonlar etiketlenir olmasıdır. Yüksek sayısal açıklık suya daldırma objektif ile donatılmış bir iki-fotonlu mikroskop çok ince tamamlayıcı dallar dahil olmak üzere MNTB ulaşan elyaflar, görüntü için kullanılabilir (Şekil 6b oklar). Şekil 6c'de gösterildiği gibi sinir izleyiciler aynı zamanda, doğrudan MNTB teslim edilebilir. Düşük bir sayısal açıklık suya daldırma hedefi (Şekil 6d) ile görüntüleme tarafından takdir edilebilir gibi sonuç MNTB hücreleri ve afferent aksonların etiketleme. Malt büyütme objektif kullanarak bir ain fayda açısından daha geniş bir alanı kontrol edilebilir olduğunu ve bu durum, daha düşük amacı sayısal açıklık için uzamsal çözünürlük bir azalma ile sonuçlanır, ancak tek tek MNTB hücreleri de (Şekil 6d de oklar) ayırt edilebilir . Yaşları P1-P5 için bu deneylerin süresi ortalama 3.1 ± 1.4 saat (n = 22 yavru) 'dir.
Elektrofizyoloji kayıtları
Spontan patlama ateşleme 11,13 işitme başlangıcından önce tek MNTB hücrelerinde gözlenen gelişimsel elektriksel aktivitenin bir şeklidir. Bu cerrahi protokolü kullanarak bu MNTB (Şekil 7a-b) için multielectrode diziler (polytrodes) hedeflemek de mümkündür. Sonuç MNTB hücrelerin bir topluluk spontan aktivitede bir kayıttır. Şekil 7e bir P6 sıçan bir temsilci polytrode kaydını gösterir. Bu deneyde, polytrode kullanılarak lipofilik DII boya ile kaplanmıştırince bir fırça (adım 4.1). Kayıt yaptıktan sonra beyin histolojik analiz için işlenmiştir ve DII etiketli polytrode parçanın konumu MNTB (Şekil 7d) hedefleyen uygun teyit etmek için kullanıldı. Yaşları P1-P6 için deneylerin süresi ortalama 2.0 ± 0.7 saat (n = 33 yavru) 'dir.
Mikrovasküler geçirgenliği Ölçme
Bu protokol, aynı zamanda, vasküler geçirgenliğin, iki foton görüntüleme deneyler gerçekleştirmek için kullanılabilir. Bir floresan çözünen (TRITC-dekstran, MW 155 kD, Stokes yarıçapı ~ 8.5 nm)% 1 BSA Ringer çözeltisi içerisinde çözündürüldü ve karotid arteri 14 takılı bir kanül yoluyla serebral dolaşıma enjekte edilmiştir. Kuyruk ven enjeksiyonları farklı olarak, bu prosedür, kalp atlar ve doğrudan beyin mikro içine floresan çözünmüş madde sunar. Şekil 8a, bu prosedür kullanılarak sonuçları, kan damar etiketleme kalitesini göstermektedir. Sürekli sonraŞekil 8b'de gösterildiği gibi, kan akımı içine etiketli solutların perfüzyon bu, ilgi konusu bir bölge bir zaman atlamalı dizisi elde etmek mümkündür. Ilgi bölgesi içindeki toplam flüoresan yoğunluğu offline ölçülür ve bir matematiksel model flüoresan (Şekil 8c) 15 eriyiklerin etiketli için kan-beyin bariyeri geçirgenliğinin saptanması için kullanılmıştır. Yaşları P9-P10 için deneylerin süresi ortalama 2.3 ± 0.8 saat (n = 3 yavru) 'dir.
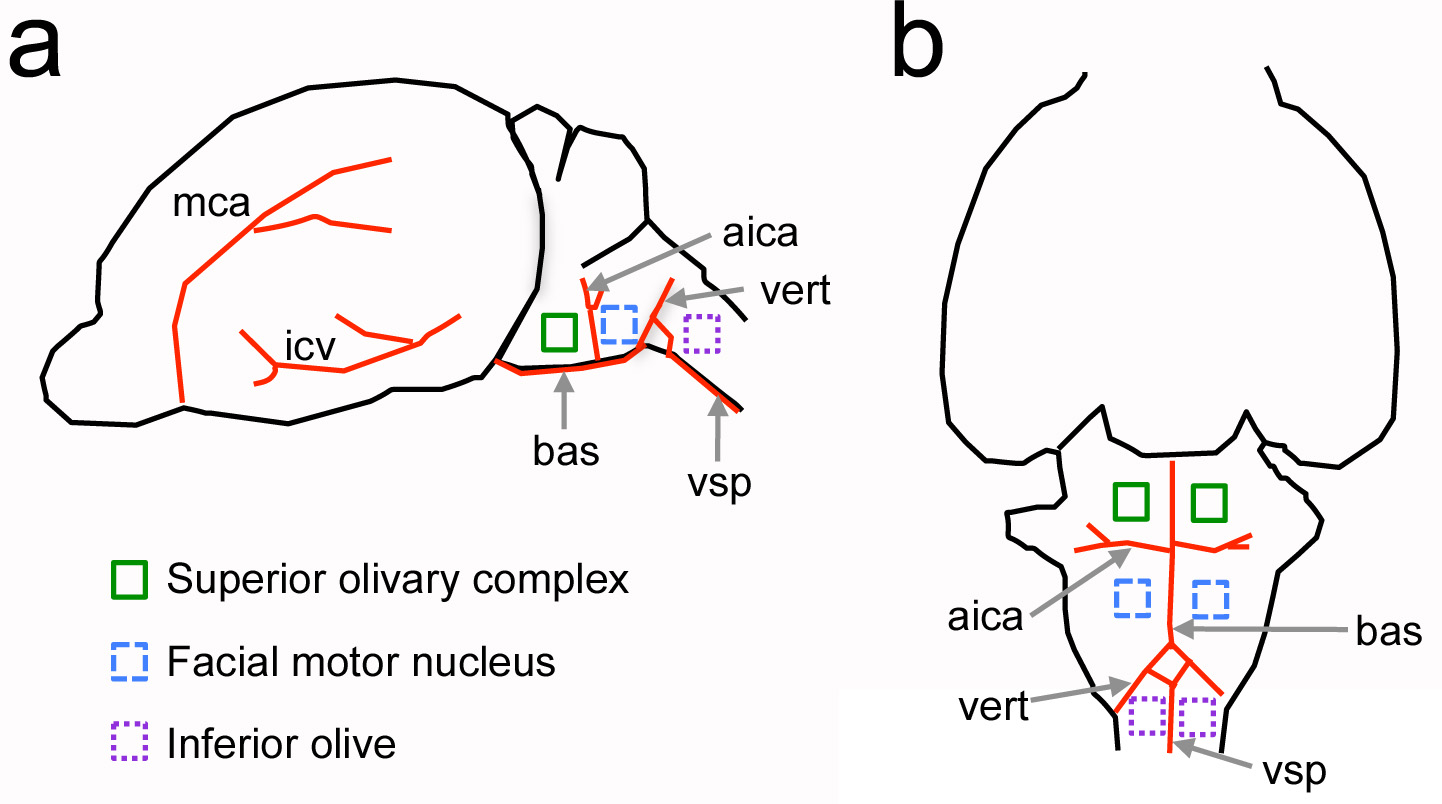
Şekil 1. Yenidoğan sıçanlarda damar noktalara göre ventral beyin sapı sinir yapıları Göreli konumu. Bir, beynin yan görünümü. B, beynin ventral görünümü. Büyük kan damarları ilgilendiren kırmızı ve sinir yapıları gösterilmiştir indrenkli kareler ile gili bölümü. Ölçekli çizilmemiştir. AICA = anterior inferior serebellar arter; bas = baziler arter; icv = alt serebral ven; mca = orta serebral arter; = vertebral arter vert; vsp = ventral spinal arter. resmi büyütmek için buraya tıklayın.

Şekil 2. Cerrahi kurulum. A, Cerrahi (1) istikrarlı bir tablo üstüne üstüne oturan bir küçük ekmek gemide yapılabilir. Bir ısıtma pedi (2) ve küçük bir hayvan ventilatör (3) gerektiğinde tüm hazırlanmasını kolaylaştırmak için hareket ekmek kartına tespit edilebilir. Küçük hayvan ventilatör bir batarya olabilir (4). Manyetik bir tutucu (5), anestezi sağlamak için kullanılan burun konisi güvence altına almak için de kullanılabilir. Burun konisi yapabilirsinizAyrıca sabit bir pozisyonda kafa güvenli yardımcı olur. Hayvan konumlandırılarak gerek yoksa, bir mikromanipülatör (6) elektrofizyoloji veya nöral izleme deneyler için konum problar için kullanılabilir. Bir ışık kaynağı (7) ve (resimde) bir steroskop mikrocerrahi. B sırasında dönüm yapıları görselleştirmek için gerekli olan, küçük makas 1.4 adım kullanılır. C, Forseps adımlarla 1.4, 1.6.1, 1.8 ve 1.8.1 kullanılmaktadır . d, yaylı makas adımlarla 1.5, 1.6 ve 1.7. e kullanılan, kesme keski adım 3.1.2 kullanılmaktadır. E = 1 mm Ölçek çubuğu, BD için geçerlidir. resmi büyütmek için buraya tıklayın.
Şekil 3. Entübasyon trakea merceğin.Bir, hayvan, anestezi yüzükoyun pozisyonda yerleştirilir ve burun konisi ve bant (kesik çizgiler). b ile sabitlenir, deri kesilir ve temel yağ tabakası. c örten yağ ve bezleri (gösterilen maruz kenara konur gri) trakea ortaya çıkarmak için bir kenara itilir. Bant örten deri (kesik çizgiler). D sabitlemek için kullanılan, nefes borusu kas disseke. E, trakea halkaları Görselleştirme örten kas başarılı kaldırma gösterir. resmi büyütmek için buraya tıklayın.
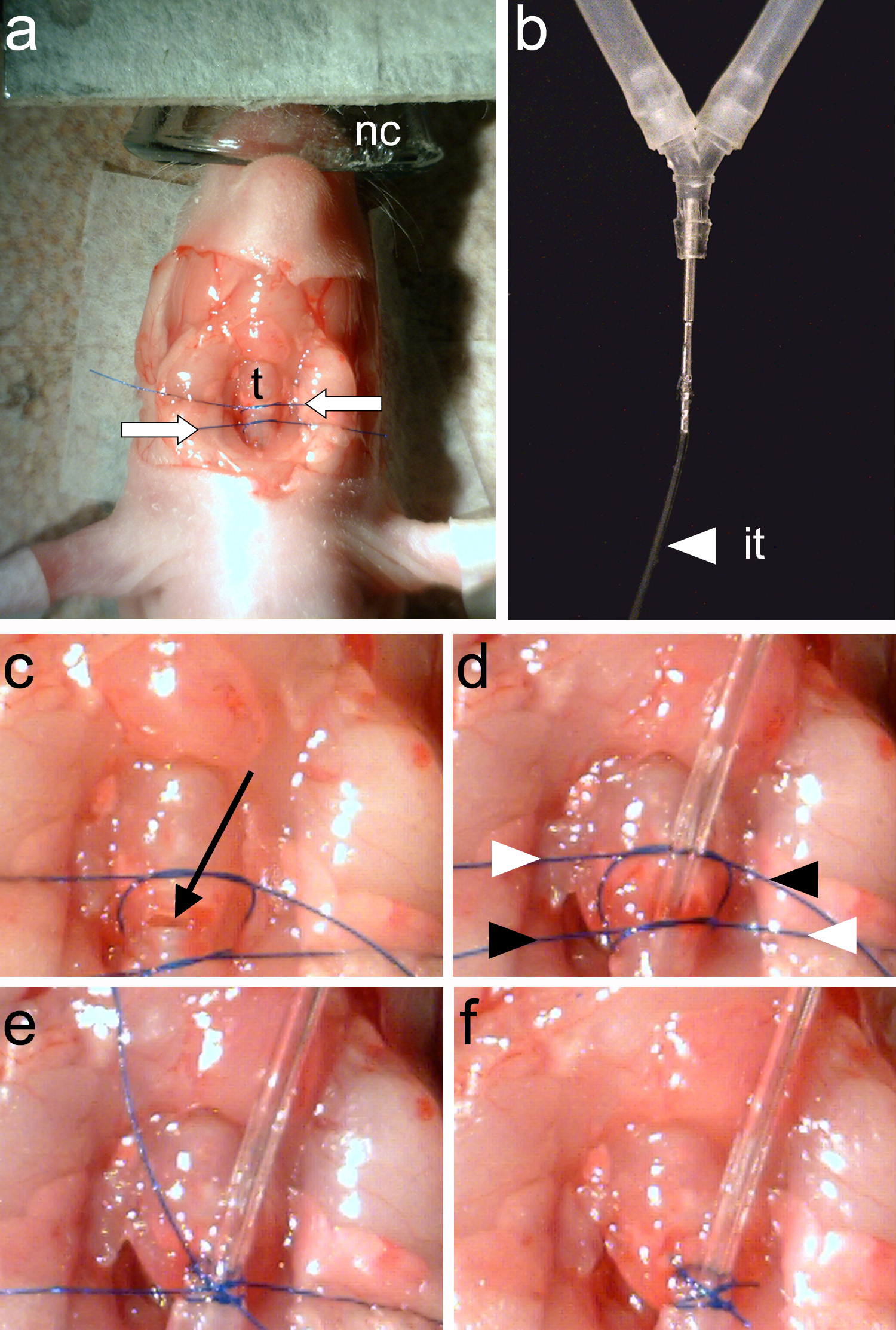
Şekil 4. Hayvan Entübasyon., Bir, iki dikiş ipler (beyaz oklar) trakea etrafında bağlanır(T). B, entübasyon boru (it) sıkıca hayvan vantilatör. C y tüpüne bağlı olması, bir trakeostomi iki dikiş iplikleri (siyah ok). D, havalandırma tüpü yerleştirildiğinde ve arasında yapılır iki dikiş iplikleri sıkılır. Ipliklerin uçları (beyaz ve siyah ok uçları ile gösterilen) bir çapraz şekilde tekrar sıkılır. E, sütür uçları bağlıdır. F, sütür uçları kesilmiş ve entübasyon tamam olmaktadır. resmi büyütmek için buraya tıklayın.
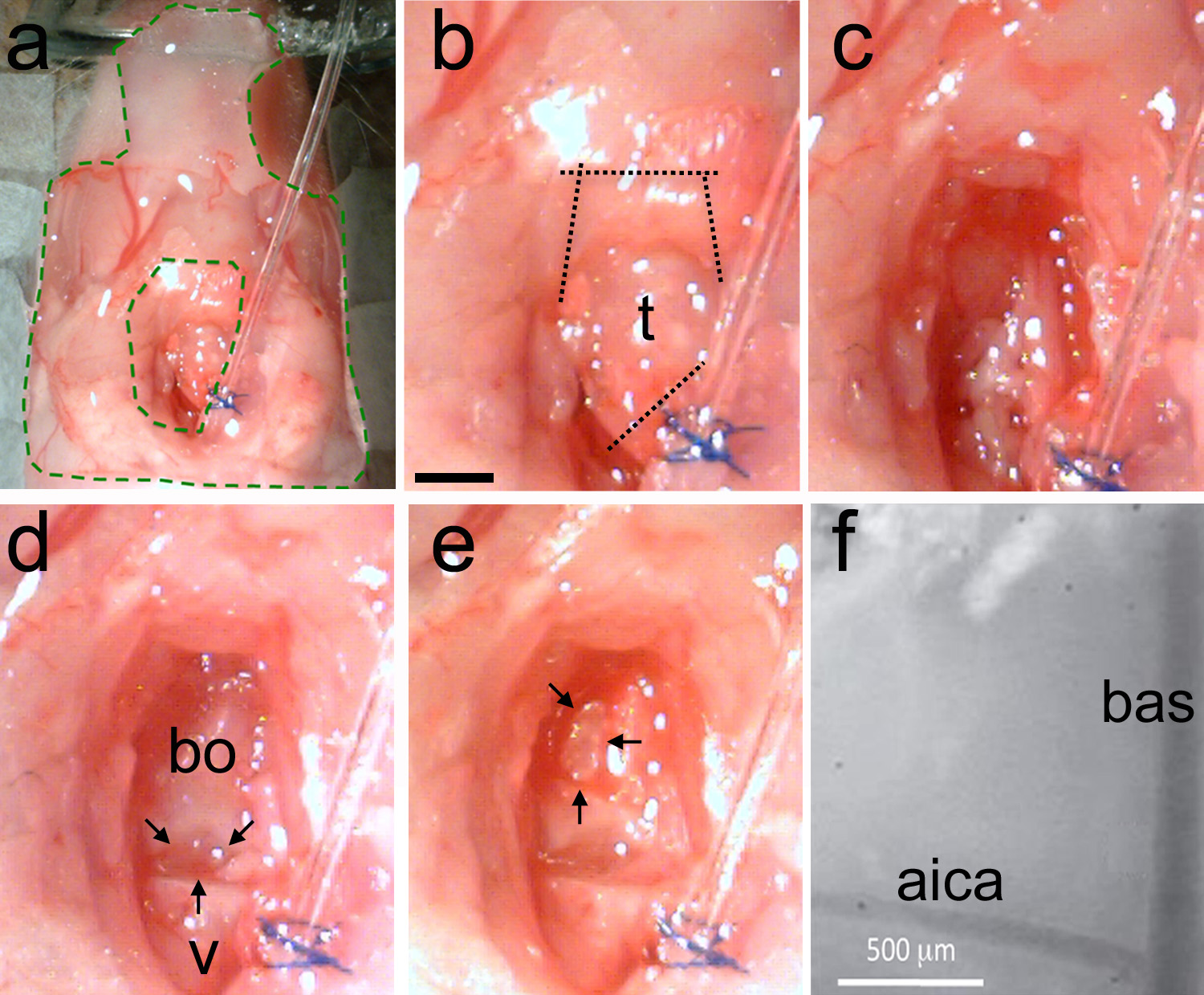
Şekil 5. Trakea Çıkarma ve kraniotomi yapım. A, hazırlık elastomer (bölge Insi ile stabilize edilir de yeşil) kesikli çizgiler. b, trakea tanımlanır ve daha sonra keser ilk deplasman entübasyon tüpü trakea ayırmak için, ve sonra mandibular kasları (noktalı çizgiler). c kesmek için, künt kullanarak kafatasının yüzeyini temizleyin yapılır teknik kas kaldırmak ve yağ ve kan. d kaldırmak için emici kağıt kullanmak için, temiz bir alanda örneği son omurları (v) ve Basi-oksipital kemik (bo) gösterir. Iki kemik (siyah oklar) arasında doğal bir uçurum var. E, ters D şeklinde (siyah oklar) bir microdrill veya ultrasonik temizleyici ince kafatası kullanma. Yavaşça inceltilmiş kafatası kırmak ve kemik parçasını çıkartın. Landmark damarsal görünür. F, maruz kalan beyin sapı yüzeyinde damar yerlerinden Yüksek büyütmeli görünüm olmalıdır. Bas = baziler arter; AICA = anterior inferior serebellar arter. B = 1 mm Ölçek çubuğu, ce için de geçerlidir.highres.jpg "target =" _blank "> büyük resmi görebilmek için buraya tıklayın.
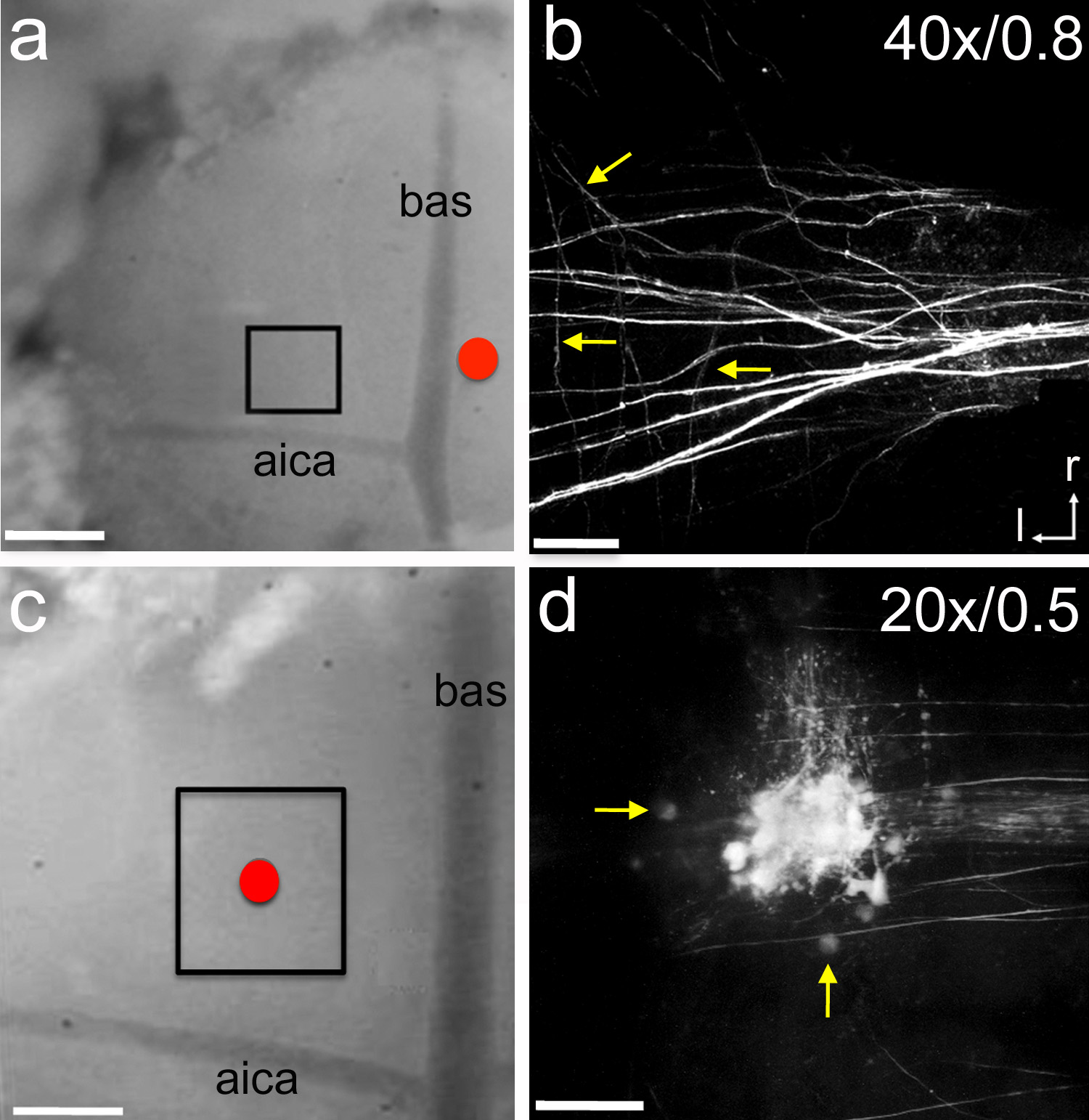
Şekil 6. Sinir izleyiciler eîektroporasyonu. Bir, nöral izleyici mikro-yakut içeren bir cam elektrot orta hat (kırmızı daire) yanına konulmuştur. İzleyici 7 ikinci uzun -5 uA bakliyat 15 dakika boyunca her 14 saniyede teslim kullanılarak elektroporatlanmıştır. Iyileşme süresi 1 saat sonra, kutu alanı ile bir iki-fotonlu mikroskop ile görüntülendi. P1 sıçan yavru. B MNTB içeri götüren akson etiketleme Exemplar z-yığını görüntüsü. Oklar bireysel teminat dalları işaret. C mikro-yakut ile dolu bir cam elektrot MNTB (kırmızı daire) üstüne yerleştirildi. Izleyici, bir de açıklanan aynı ayarları kullanarak elektroporasyona tabi tutulmuştur. Iyileşme süresi 1 saat sonra, kutulu alan olduİki foton mikroskop ile görüntülendi. P5 sıçan yavru. D MNTB etiketli hücreleri ve akson Exemplar z-yığını görüntüsü. Oklar bir MNTB hücreleri göstermektedir. B ve c Etiketler objektif büyütme ve sayısal açıklığı göstermektedir sırasıyla. , Bir ve c = 300 mikron ölçek çubuğu = 45 mikron b ölçek bar; d = 90 mikron ölçekli bar. AICA = anterior inferior serebellar arter; bas = baziler arter; r = rostral; l = yanal. resmi büyütmek için buraya tıklayın.
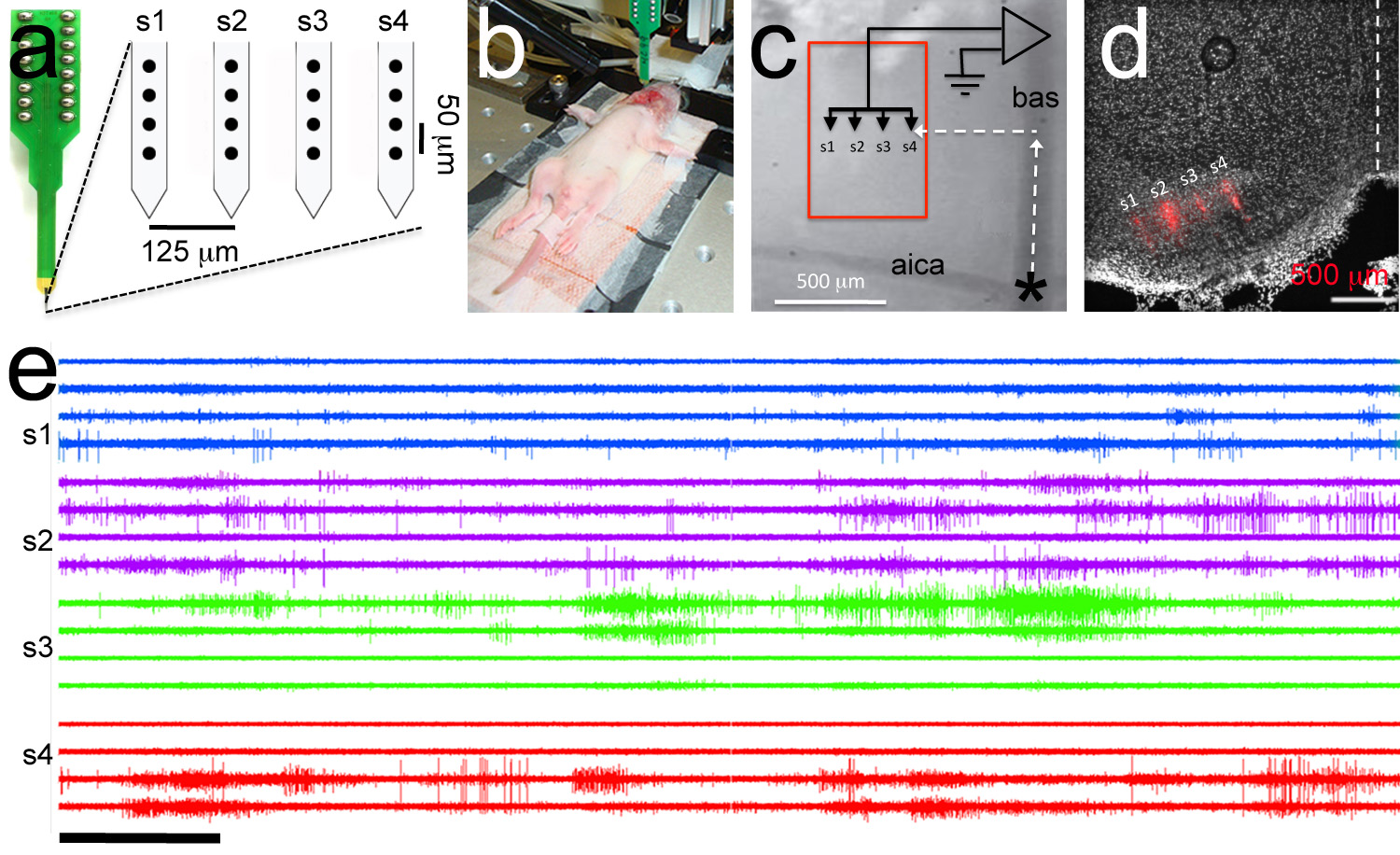
Şekil 7. Polytrode Kaydı Hedeflenen. Bir, Polytrode incik başına 4 elektrotlar (siyah daireler) ile 4 saplar oluşur. Elektrodlar arasında intra-ve inter-sap mesafeleri gösterilir. B, elektrofizyoloji deney Exemplar görüntüsü. Bir referans elektrot bukkal boşlukta sokulur ve ploytrode headstage bağlanır. P6 sıçan yavru. C polytrode hedefleme için kullanılan damar yerlerinden yüksek büyütme görünümü. Polytrode (polytrode parça kırmızı gösterilir) yamuk vücudun (kırmızı kutu). D, Posthoc histolojik analiz DiI kaplı polytrode doğru hedefleme gösteren medial çekirdeğini hedef rostral-yanal koordinatlarını kullanarak konumlandırılmış. E, Exemplar multi -birimi kaydı. Trace sipariş Panel A elektrot için aynıdır. Incik kayıtların içinde aynı renge sahiptir. E Ölçek çubuğu = 5 saniye. resmi büyütmek için buraya tıklayın.
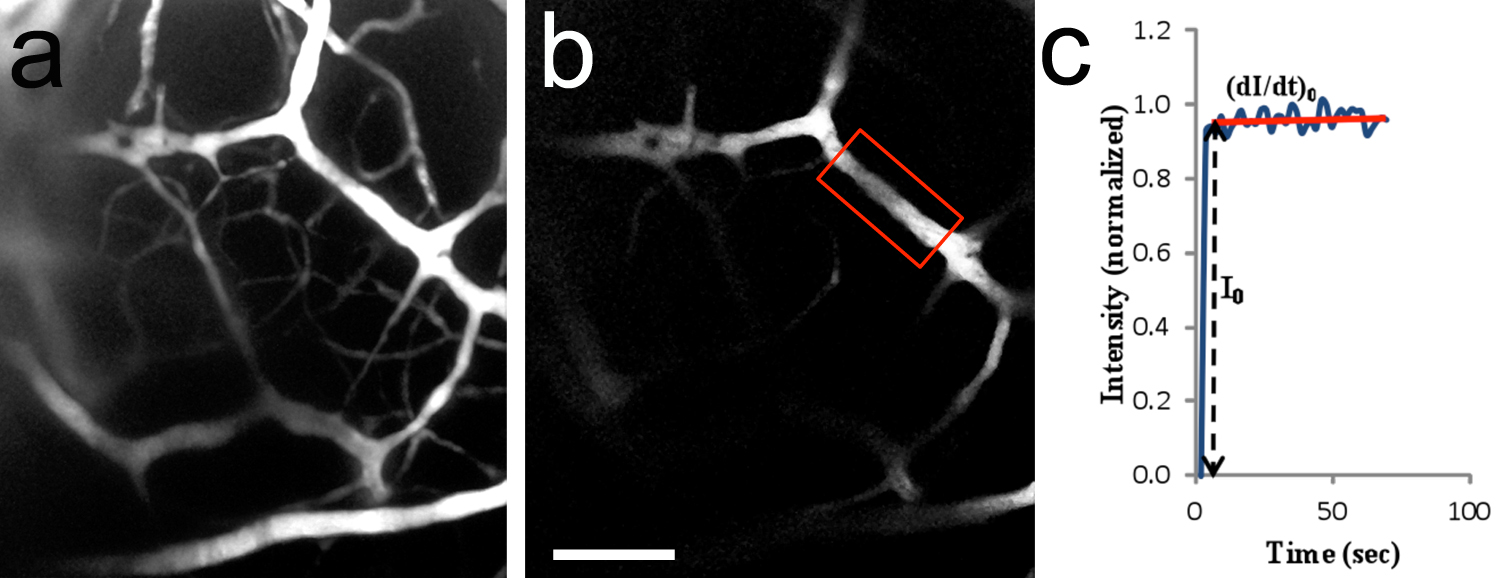
Beyin mikrodamarlar Şekil 8.. In vivo iki foton görüntüleme. karotid artere TRITC-dekstran 155 kD perfüzyon sonrası beyin damar sisteminde bir, 2-boyutlu bir görüntü (daraltılmış Z-yığın). Görüntülenmiş alan Şekil 7c gösterilene benzer. 20x/0.5 suya daldırma hedefi. P10 sıçan yavru. B, faiz (ROI) Bölge floresan yoğunluğu (kırmızı çerçeve kapalı bölge) ölçmek için kullanılır. Mikrodamar ~ 14.2 um'lik bir çapa sahip olan ve. C, floresan yoğunluğu (normalize değeri) tipik eğri zamanın bir fonksiyonu olarak 182 um beyin yüzeyinin altında bulunan oldu. Flöresans çözüm sadece damar lümeni doldurur zaman 0 ROI floresan yoğunluğunda adım artıştır. (DI / dt) 0 ve 0 çözünen için mikro damar geçirgenliğinin saptanması için kullanılır. TRITC-dekstran 155 kD geçirgenliği 1.5 x 10 -7 cm / sn olduğu hesaplandı.B = 100 mikron ölçekli bar, için de geçerlidir. resmi büyütmek için buraya tıklayın.
Tartışmalar
Zaman kritiktir. Deneyimli bir araştırmacı (1-3 adım) 1 saat içinde bu protokol tamamlamak gerekir. Farklı adımları için belirtilen süreleri uzmanlık düzeyi yüksek bir orta varsayalım. Yoksul havalandırma kontrol hayvanın boğulma ve ölüme yol açabilir beri doğru ve zamanında trakeostomi ve entübasyon, önemlidir. Hatalar hayvanın kontrolsüz kanama ve ölüme yol açabilir, çünkü kas ve yağ dokularının dikkatli açıklık da çok önemlidir. Kanül yerleştirilmesi için karotis arter hazırlarken Benzer şekilde, bir iplik düğüm gevşek olursa kontrolsüz kanama gerçekleşecek, dikkatle arter sıkın ve kesmek gerekir. Son olarak, kraniotomi damarsal işaretlerini aksatmadan, dikkatle yapılmalıdır. Dış meningeal tabakası (dura) dikkatsiz çıkarılması şiddetli kanama ve arteriyel arz hasara yol açabilir.
Havalandırma ayarları hayvanın yaşına göre seçilir.Çoğu ticari tedarikçiler gibi ayarları hakkında yararlı bilgiler sağlar. P15 daha yaşlı farelerde deneyler büyük bir hayvan vantilatörü kullanımını gerektirecektir. Ergin hayvanlar ketamin / ksilazin ile anestezi eğer havalandırma ihtiyacı olmayabilir, ancak entübasyon trakea giren sıvıyı önlemek için tavsiye edilir.
Bu protokolün bir ana sınırlama deneyleri sadece akut gerçekleştirilebilir olmasıdır. Laboratuarımızda iki ve on kadar saat arasında süren deneyler var. İkinci bir sınırlama deneyleri anestezi altında yapılabilir zorunda olmasıdır. Bu nedenle, anestezik seçimi deneylerin planlanması ve tasarımında dikkate almak önemli bir değişkendir. Bununla ilgili bir konu yenidoğan hayvanlar doz aşımı özellikle hassas olmasıdır. Örneğin, ketamin / ksilazin karışımı seçimi ise, yavru ağırlığına göre dozu hesaplamak ve maksimum hacim ⅓ da ilaçlar yönetmek. Ayak tutam r tarafından her 5-10 dakikada hayvanın durumunu kontrol edinesponse. Izofluran kullanıyorsanız, önlemler aynı zamanda araştırmacı (uygun havalandırma ve düzgün kalibre buharlaştırıcı) için güvenli bir ortam sağlamak için gereklidir.
Stereomikroskop iki foton mikroskop için elektrotlar ve hayvanın taşınması yer görüş açısını ayarlamak ve alan açıklık kolaylaştırmak için esnek bir tutucu üzerine monte edilebilir. Ventilatöre güç bir pil kullanın hayvan hareket kolaylaştırmak ve elektrofizyoloji deneyleri sırasında elektrik eserler azaltabilir. Bu amaçla, bir küçük breadboard (7.5 x 12 inç) ventilatör, ısıtma yastığı ile anestezi uygulanmış hayvan (Şekil 2a) birlikte monte etmek için kullanılabilir. Bu kurulum için yararlı ve önemli bir değişiklik ameliyat sırasında vital işaretler izlenmesi için bir cihaz eklenmesidir. Bir oksimetre veya diğer analog cihazların laboratuvar bütçesine bağlı olarak kullanılabilir.
Bu protokol elektrofizyoloji ve araya görüntüleme ile kullanılır olmuşturpatch clamp kayıtları 8,10,11, polytrode kayıtları (Şekil 7) ve iki foton görüntüleme de dahil olmak üzere 9 hods, (Şekil 6 ve 8). Bir gelecekteki olası uygulama elektrofizyolojik kayıt 16 için floresan etiketli hücreleri hedef için bu yöntemleri birleştirmek olacaktır.
Yeni görüntüleme uygulamalar da 2-D veya iki-foton mikroskopi kullanılarak 3-D zaman serisi içerebilir. Örneğin, beyin nöronal ve glial hücre popülasyonlarının aktivitesini incelemek için kalsiyum göstergelerin bolus yükleme kullanılarak. Şekil 8'de gösterildiği gibi, bir boya çözeltisi karotid arteri yoluyla kan dolaşımı içine enjekte edilen beyin damar yüksek kontrast görüntüleri üretmek için kullanılabilir. Floresan boya mikro damar lümeni doldurur ve çevredeki dokuya yayılır, bu eriyik difüzyon katsayısı, kan-beyin bariyerinin geçirgenliğinin belirgin çözünen hesaplamak için değil, aynı zamanda kullanılabilirbeyin dokusunda 3 ficient. Karotid arter yoluyla floresan etiketli çözünmüş enjekte edilmesi için bir ana nedeni, boya çözeltisi doğrudan bir kuyruk damarından enjeksiyon ilk olarak kalp gitmeden beyindeki kılcal gitmek olabilir. Bu, en azından iki avantajı getirir. Bir perfüzyon oranı kanülasyon yerinde sabit ise mikrodamar lümeninde floresan boya konsantrasyonu, hemen hemen sabit olmasıdır. Bu, kan-beyin bariyeri geçirgenliğinin doğru belirlenmesini sağlar. Başka bir test maddesi Perfüzat dahil olması durumunda, doğrudan vücut dolaşımdan diğer faktörler ile seyreltildi ve kombine edilmeden, kan-beyin bariyeri gidecek olmasıdır.
Yeni deneyler de genetik olarak kodlanmış floresan gazetecilere transgenik hayvanların yararlanabilir. Bu (floresan probları yerinde yüklenmesine gerek olmaz olanaklar sağlayacak sürece Deneyin tasarımızaman tasarrufu ve muhtemelen daha sağlam hazırlıkları (örn. kafa penceresi 17) için izin) olarak belirtiyor.
Son olarak, deneyler bu tür alt zeytin ya da yüz motor çekirdeği gibi diğer beyin bölgelerinde yapılabilir. Belirli bir türün belirli hücresel popülasyonların Nöroanatomisinin ve gelişimi hakkında bilgiler anatomik oluşumlar hayvanlar (Şekil 1) büyüdükçe değişebilir özellikle de, bu amaca yönelik önemli olacaktır. Biz bu protokol vivo elektrofizyolojik ve görüntüleme yöntemleri kullanılarak ventral beyin sapı yapıları incelemek için başkalarını teşvik umuyoruz.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Bu çalışma NIH / NCRR / RCMI hibe G12-RR003060 tarafından desteklenen, Yeni Şehir Üniversitesi Çocuk Sağlığı ve İnsan Gelişimi, Ulusal Bilim Vakfı CBET 0754158 ve PSC-CUNY 62337-00 40 Eunice Shriver Ulusal Enstitüsü SC1HD068129 hibe York.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Absorbant pads | Kettenbach | Sugi 31603 | Other options may be available from different companies |
| Cautery | Braintree Scientific, INC | GEM 5917 | Other options may be available from different companies |
| Tetramethyl rhodamine Isothiocyanate dextran | Sigma | T1287-500MG | Other options may be available from different companies |
| Dissecting Chisel | Fine Science Tools | 10095-12 | Other options may be available from different companies |
| DiI | Invitrogen | V-22885 | Other options may be available from different companies |
| Elastomer | World Precision Instruments | KWIK-SIL | Other options may be available from different companies |
| Fine Scissors | Fine Science Tools | 14060-09 | Other options may be available from different companies |
| Forceps | Fine Science Tools | 11027-12,11617-12, 11616-16 | Other options may be available from different companies |
| Spring Scissors | Fine Science Tools | 15009-08 | Other options may be available from different companies |
| Heating pad | FHC | 40-90-2 | Other options may be available from different companies |
| Intubation tubing | Braintree Scientific, INC | BIO CO-KIT | Choose age appropriate size |
| Light source | Spach Optics | Schott Ace illuminator | Other options may be available from different companies |
| Micro drill | Braintree Scientific, INC | MD-1200 120V | Other options may be available from different companies |
| Paper tape | Walgreens | Generic brand | Other options may be available from different companies |
| Syringe filter | VWR | 28145-483 | Other options may be available from different companies |
| Syringe pump | VWR | 52459-008 | Other options may be available from different companies |
| Stereomicroscope | Olympus | SZ61 | Other options may be available from different companies |
| Suture | Ethicon | Prolene 86979 | 6-0 size |
| Tubing | Braintree Scientific, INC | Micro-Renathane (MRE033); SUBL-120 | Other options depending on pup’s age |
| Vaporizer (isoflurane) | Vetequip Incorporated | 911103 | Other options may be available from different companies |
| Ventilator (minivent) | Harvard Apparatus | 730043 | Use for P0-P12 rats |
Referanslar
- Kerr, J. N. D., Denk, W. Imaging in vivo: watching the brain in action. Nat. Rev. Neurosci. 9 (3), 195-205 (2008).
- Sigler, A., Murphy, T. H. In vivo 2-photon imaging of fine structure in the rodent brain: before, during, and after stroke. Stroke. 41 (10), 117-123 (2010).
- Shi, L., Zeng, M., Sun, Y., Fu, B. M. Quantification of blood-brain barrier solute permeability and brain transport by multiphoton microscopy. ASME J. of Biomech. Eng. 136 (3), 031005-031005 (2014).
- Galambos, R., Schwartzkopff, J., Rupert, A. Microelectrode study of superior olivary nuclei. Am. J. Physiol. 197, 527-536 (1959).
- Goldberg, J., Brown, P. B. Response of binaural neurons of dog superior olivary complex to dichotic tonal stimuli: some physiological mechanisms of sound localization. J. Neurophysiol. 32 (4), 613-636 (1969).
- Guinan, J. J., Guinan, S. S., Norris, B. E. Single auditory units in the superior olivary complex I: responses to sounds and classifications based on physiological properties. Intern. J. Neurosci. 4, 101-120 (1972).
- Spirou, G. A., Brownell, W. E., Zidanic, M. Recordings from cat trapezoid body and HRP labeling of globular bushy cell axons. J. Neurophysiol. 63 (5), 1169-1190 (1990).
- Khosrovani, S., Der Giessen, R. S. V. a. n., De Zeeuw, C. I., De Jeu, M. T. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proc. Natl. Acad. Sci. U.S.A. 104 (40), 15911-15916 (2007).
- Rodríguez-Contreras, A., Van Hoeve, J. S., Habets, R. L., Locher, H., Borst, J. G. G. Dynamic development of the calyx of Held synapse. Proc. Natl. Acad. Sci. U.S.A. 105 (14), 5603-5608 (2008).
- Lorteije, J. A., Rusu, S. I., Kushmerick, C., Borst, J. G. G. Reliability and precision of the mouse calyx of Held synapse. J. Neurosci. 29 (44), 13770-13784 (2009).
- Tritsch, N. X., Rodríguez-Contreras, A., Crins, T. T., Wang, H. C., Borst, J. G. G., Bergles, D. E. Calcium action potentials in hair cells pattern auditory neuron activity before hearing onset. Nat. Neurosci. 13 (9), 1050-1052 (2010).
- Tong, H., Steinert, J. R., Robinson, S. W., Chernova, T., Read, D. J., Oliver, D. L., Forsythe, I. D. Regulation of Kv channel expression and neuronal excitability in rat medial nucleus of the trapezoid body maintained in organotypic culture. J. Physiol. 588 (9), 1451-1468 (2010).
- Sonntag, M., Englitz, B., Kopp-Scheinpflug, C., Rübsamen, R. Early postnatal development of spontaneous and acoustically evoked discharge activity of principal cells of the medial nucleus of the trapezoid body: an in vivo study in mice). J. Neurosci. 29 (30), 9510-9520 (2008).
- García-Villalón, A. L., Roda, J. M., Alvarez, F., Gómez, B., Diéguez, G. Carotid blood flow in anesthetized rats: effects of carotid ligation and anastomosis. Microsurgery. 13 (5), 258-261 (1992).
- Yuan, W., Lv, Y., Zeng, M., Fu, B. M. Non-invasive method for the measurement of solute permeability of rat pial microvessels. Microvasc. Res. 77 (2), 166-173 (2009).
- Kitamura, K., Judkewitz, B., Kano, M., Denk, W., Haüsser, M. Targeted patch-clamp recordings and single-cell electroporation of unlabeled neurons in vivo. Nat. Methods. 5 (1), 61-67 (2008).
- Mostany, R., Portera-Cailliau, C. A method for 2-photon imaging of blood flow in the neocortex through a cranial window. J. Vis. Exp. (12), (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır