Method Article
Une méthode pour faire un Craniotomie sur le crâne ventrale de nouveaux-nés Rongeurs
Dans cet article
Résumé
Une méthode chirurgicale est décrite à exposer le crâne ventrale chez des rats nouveau-nés. En utilisant cette approche, il est possible d'ouvrir une craniotomie pour effectuer électrophysiologie aiguë et des expériences de microscopie à deux photons dans le tronc cérébral des bébés anesthésiés.
Résumé
L'utilisation d'une craniotomie pour des expériences in vivo offre la possibilité d'étudier la dynamique de divers processus cellulaires dans le cerveau d'un mammifère à l'âge adulte et pendant le développement. Bien que la plupart des approches in vivo utilisent une craniotomie pour étudier les régions du cerveau qui se trouvent sur le côté dorsal, les régions du tronc cérébral telles que la protubérance, située sur le côté ventral restent relativement peu étudié. L'objectif principal de ce protocole est de faciliter l'accès aux structures du tronc cérébral ventrales afin qu'ils puissent être étudiés in vivo en utilisant électrophysiologique et méthodes d'imagerie. Cette approche permet d'étudier les changements structurels dans les axones à longue portée, les modèles de l'activité électrique en simple et ensembles de cellules, et les changements de barrière hémato-encéphalique chez les animaux nouveau-nés perméabilité. Bien que ce protocole a été utilisé principalement pour étudier le tronc cérébral chez les rats nouveau-nés, il peut facilement être adapté pour des études dans d'autres espèces de rongeurs tels que les souris de nouveau-nés, roden adultets et d'autres régions du tronc cérébral.
Introduction
L'utilisation d'une craniotomie en combinaison avec l'imagerie par fluorescence et des techniques d'électrophysiologie permet l'écoulement de sang de la surveillance, la barrière hématoencéphalique et de perméabilité en mesurant l'activité des neurones et des cellules gliales dans les animaux vivants 3.1. Plusieurs laboratoires ont utilisé cette méthode pour donner un aperçu de la physiologie du cerveau dans des conditions saines et maladie, mais il reste des lacunes dans notre compréhension de la façon dont ces processus se produisent au cours du développement. En outre, la plupart des études se sont concentrées sur les régions du cerveau qui sont facilement accessibles à partir de la surface dorsale du crâne, de sorte que les structures du tronc cérébral ventrales avec divers rôles physiologiques ont été étudiés en utilisant la plupart des approches ex vivo.
L'objectif principal de ce protocole est de fournir une méthode pour ouvrir une craniotomie sur le crâne ventrale de rongeurs. Cette approche a été adaptée à partir d'études classiques réalisées dans les grands mammifères tels que les chiens et les chats pour reco de neurophysiologie sensoriellerdings du tronc cérébral 4-7. Dans ce protocole, cependant, il est le nouveau défi de réaliser la procédure chez les animaux nouveau-nés. Utilisation de points de repère de la vascularisation, ce protocole adapté a déjà été utilisé pour étudier le tronc cérébral de rats nouveaux-nés, les souris adultes et d'autres régions du tronc cérébral comme l'olive inférieure 8-11 (figure 1).
Le principal avantage d'une craniotomie ventrale par rapport aux méthodes existantes pour étudier noyaux du tronc cérébral ventrale est qu'il offre un accès direct aux structures d'intérêt chez les animaux vivants. Par exemple, les cellules auditives du complexe olivaire supérieur sont localisées à quelques dizaines de micromètres de la surface du cerveau, ce qui est important pour la mise en place ciblée des sondes et pour l'utilisation d'approches d'imagerie à deux photons dans laquelle la profondeur d'imagerie peut être limitée à 0,5 mm par diffusion de la lumière et de l'absorption des tissus. Une craniotomie ventrale fournit également une préparation avec des connexions neuronales relativement intacts, which sont perturbés dans des préparations de tranches aiguës et organotypiques 12. Contrairement à d'autres protocoles pour des expériences in vivo de neurophysiologie 13, une approche ventrale peut être combiné avec l'enregistrement multi-électrodes et des méthodes d'imagerie qui fournissent des informations sur les ensembles cellulaires (figures 6 et 7). Enfin, en combinaison avec ce protocole un soluté marqué par fluorescence peut être injecté dans le système vasculaire à mesurer les changements dans le cerveau de la perméabilité de la barrière sang vers le soluté (figure 8).
Protocole
Le protocole suivant suit les directives de protection des animaux établies par le soin et l'utilisation des animaux Commission institutionnelle (IACUC) au City College de New York.
Intubation animale 1. (10-20 min)
- Avant la chirurgie, préparer une solution de Ringer mammifères. Assembler les outils chirurgicaux, coussin chauffant, et petit ventilateur animal sur le banc (figure 2).
- Pour les mesures de barrière hémato-encéphalique perméabilité font 10 ml de 1% d'albumine de sérum bovin (BSA) en solution dans de sonnerie et se dissolvent TRITC-dextran 155 kD à 8 mg / ml dans une solution de BSA à 1%, solution de filtration avec 25 mm filtre de seringue (0,2 pm la taille des pores) et entreposer dans une seringue de papier d'aluminium dans l'obscurité.
- Anesthésier l'animal à l'isoflurane. Utiliser 5,0% pour l'induction et 1,5-3,0% pour l'entretien. En variante, un mélange de kétamine (41,7 mg / kg) et de xylazine (2,5 mg / kg de poids corporel) peut être utilisé. Profondeur de l'anesthésie peut être contrôlé par pincement de l'orteil réflexe deles extrémités supérieures et inférieures.
- Les doses suivantes de kétamine (41,7 mg / kg de poids corporel) et de xylazine (2,3 mg / kg de poids corporel) doivent être administrés en unité de ⅓ de la dose maximale pour éviter un surdosage. Utilisation d'un ventilateur de rongeur est recommandée pour contrecarrer la dépression respiratoire induite par la xylazine.
- Placez le chiot anesthésié couché sur le côté dorsal et assurer sa tête avec le cône en plastique utilisée pour fournir l'anesthésique (Figure 3a).
- Fixez l'animal avec du ruban adhésif sur les membres antérieurs et la queue (Figure 3a).
- Une alternative à obtenir la tête du chiot est d'utiliser une plaque de tête attachée à une barre de métal.
Remarque: Assurez-vous que le coussin chauffant est fixé à 37 ° C pour éviter l'hypothermie (Figure 3a).
- Utilisez des ciseaux (figure 2b) pour faire une longitudinale et quatre incisions latérales sur la peau recouvrant le cou (Figure 3b). En utilisant une technique émoussé, disséquer la peau et le mettre de côté en utilisant une pince (figures 2c et 3c).
- Maintenez la peau vers le bas avec du ruban adhésif. Stabiliser la tête dans une position horizontale (figure 3c).
- Avec des ciseaux à ressort (figure 2d) et technique émoussé, les glandes de poussoirs et des couches de graisse de côté pour exposer la trachée (figure 3c). Identifier l'emplacement des artères carotides.
- Conserver les artères carotides loin de la trachée.
Remarque: ponction des carotides peut entraîner une perte de sang massive et la mort du chiot.
- Conserver les artères carotides loin de la trachée.
- Avec des ciseaux à ressort (figure 2d) disséquer les muscles longitudinaux couvrant la trachée. Couper les muscles longitudinaux situés sous la trachée (figure 3d).
Remarque: Les anneaux de la trachée doit être clairement visible (figure 3e).- Utilisationforceps (figure 2c), attacher deux morceaux de fil de suture autour de la trachée. Un morceau de fil de suture fixer le tube de ventilation et le deuxième fil sera utilisé pour fermer le rostre de la trachée au point d'insertion de tube de ventilation (figure 4a).
Remarque: Mouiller le tissu exposé régulièrement avec une solution de Ringer pour prévenir la déshydratation.
- Utilisationforceps (figure 2c), attacher deux morceaux de fil de suture autour de la trachée. Un morceau de fil de suture fixer le tube de ventilation et le deuxième fil sera utilisé pour fermer le rostre de la trachée au point d'insertion de tube de ventilation (figure 4a).
- Utilisation de ciseaux à ressort (Figure 2d) faire une incision sur l'un des anneaux de trachée qui se trouvent entre les deux fils placés dans l'étape 1.6.1 (Figure 4c).
Remarque: Assurez-vous qu'aucun fluide pénètre dans la trachée ouverte. Fluide dans la trachée provoque l'asphyxie. - Insérez le tube d'intubation (figure 4b) dans la trachée et serrer le fil inférieur pour le fixer. En utilisant des pinces (figure 2c), serrer le fil supérieur pour fermer le postérieur de la trachée à la pointe de la sonde d'intubation d'insertion.
- Tighten et couper les extrémités des deux fils (figure 4d-f).
Remarque: La vapeur à l'intérieur du tube d'intubation est un bon signe de contrôle du flux d'air.
- Tighten et couper les extrémités des deux fils (figure 4d-f).
- Passer rapidement la fourniture de l'isoflurane au ventilateur. Ajuster le volume de course et la vitesse de ventilation en fonction du poids de l'animal.
- Sceller le tissu environnant exposée avec élastomère (figure 5a). Maintenir la surface humide et propre.
2. Trachée et Muscle enlèvement pour exposer le crâne (5-10 min)
- Utiliser des ciseaux à ressort (Figure 2d) pour couper la trachée adjacent au tube de ventilation. Effectuer deux coupes le long de la paroi musculaire de la cavité buccale pour exposer l'extrémité caudale de la bouche (figure 5b).
Remarque: Si nécessaire, utiliser un cauterizer pour arrêter le saignement. Saignement incontrôlé peut entraîner la mort de l'animal. - Nettoyez lezone à l'aide de grandes quantités de solution de Ringer (figure 5c). Identifier l'écart entre la dernière vertèbre et l'os basi-occipital (figure 5d).
Remarque: L'écart entre les os est un repère utile crâne pour localiser des structures du tronc cérébral. L'olive inférieure se trouve sous cette lacune. Le complexe olivaire supérieur auditif est situé sous l'os de basi-occipital dans le sens rostral de cet écart (voir aussi la figure 1). - Nettoyer la zone en utilisant une pince (figure 2c) et des ciseaux à ressort (figure 2d). Ne pas perforer les vaisseaux sanguins.
Remarque: Si nécessaire, cautériser pour arrêter le saignement.- Après la zone exposée est propre de la graisse et le tissu musculaire, l'espace séparant l'os basi-occipitale et la dernière vertèbre doit être visible (Figure 5d).
3. Craniotomie (15-30 min)
- Utilisez un micro-foret ou un ultranettoyant sonique. Localisez la paroi interne de la bulle.
- Thin le crâne en faisant une forme de D inversé jusqu'à ce que les artères sous-jacentes sont visibles (figure 5e).
Remarque: L'artère basilaire (de bas) tourne au-dessus de la ligne médiane du tronc cérébral. L'artère cérébelleuse inférieure antérieure (AICA) branches bilatérale et peut être utilisé de façon fiable comme un point de repère car il a une position constante dans différents animaux. - Lorsque le crâne est amincie, casser délicatement à l'aide d'un ciseau à dissection (figure 2e). Retirez le morceau de l'os avec une pince (figure 2c). Sinon, soulever et briser le crâne à l'aide d'une aiguille tordue.
Remarque: Répétez cette procédure jusqu'à ce que la taille et la forme de la craniotomie est approprié pour l'expérience prévue. Les bas et aica doivent être visibles à travers la membrane dure (figure 5f).
- Thin le crâne en faisant une forme de D inversé jusqu'à ce que les artères sous-jacentes sont visibles (figure 5e).
- Nettoyer la zone plusieurs fois avec une solution de Ringer frais. Utilisation pa absorbantds sécher la surface de la membrane dure.
- Si nécessaire, utilisez une aiguille de suture à retirer la membrane dure sans déplacer ou casser les artères emblématiques bas et aica.
Remarque: Lors de la dure-perforation liquide céphalo-rachidien s'écoule. Nettoyer la zone avec une solution de Ringer et garder humide pendant toute l'expérience.
- Si nécessaire, utilisez une aiguille de suture à retirer la membrane dure sans déplacer ou casser les artères emblématiques bas et aica.
4. Électrophysiologie Expérience
- Sélectionnez le polytrode selon la conception de l'expérience (figure 7a). Utilisez un pinceau fin pour enrober le polytrode avec Dil. Transférer la solution Dil dans un tube à centrifuger de 1 ml, tremper le pinceau dans la solution et frapper doucement le polytrode sous guidage visuel (c'est à dire en utilisant un stéréoscope). Commencez à l'extrémité de la sonde et soigneusement continuer jusqu'à ce que toutes les électrodes sont recouvertes uniformément.
- Placer l'électrode de masse à l'intérieur de la cavité buccale. Charger le polytrode dans le porte-électrode (figure 7b ).
- Allumez l'amplificateur et vérifier que toutes les connexions fonctionnent bien.
- Placez l'électrode ci-dessus au point bas de l'AICA (position zéro) de la branche. Déplacer l'électrode au point cible souhaitée en utilisant le cas échéant rostrale-coordonnée latérale (figure 7c).
- Placer l'électrode sur la surface du cerveau et de la déplacer à la profondeur souhaitée par pas de 5 à 10 um.
- Effectuer l'enregistrement en fonction de la conception expérimentale. Enregistrer des données pour une analyse ultérieure.
5. Deux photons Imaging Experiment
- Allumez le microscope. Réglez la longueur d'onde d'excitation et d'utiliser un filtre d'émission approprié. Excitation à 800 nm et un travail de 607 ± 45 nm de filtre d'émission passe-bande et pour l'imagerie de TRITC-dextran.
- Identifier la droite ou la gauche artère carotide. En utilisant une technique émoussé disséquer l'artère carotide dans les tissus conjonctifs ou des nerfs adjacents.
- Choisissez et maintenez la carotideartère avec une pince hémostatique. Attachez trois morceaux de suture autour de l'artère carotide.
- Serrez le fil près du côté du cœur pour arrêter l'écoulement de sang et laisser les deux autres fils lâche.
- Utilisez des ciseaux fins de faire une petite coupure à un angle de 45 ° sur l'artère carotide entre le fil attaché et le prochain fil lâche.
Remarque: Nettoyer le sang avec du papier absorbant.
- Cathétériser l'artère carotide. Insérer le tube rempli de solution TRITC-dextran dans la coupe sur l'artère carotide environ 5 mm de profondeur orientés vers la tête du chiot.
- Serrez les deux autres fils autour de l'artère pour maintenir le tube et l'artère ensemble. Serrer les fils, couper et ajouter élastomère à stabiliser davantage.
Remarque: L'autre côté de la tubulure est reliée à la seringue contenant la solution de dextrane-TRITC (préparé à l'étape 1.1).
- Serrez les deux autres fils autour de l'artère pour maintenir le tube et l'artère ensemble. Serrer les fils, couper et ajouter élastomère à stabiliser davantage.
- Fixer la seringue sur le pousse-seringue.
- Setla vitesse à la vitesse de la pup du flux sanguin de l'artère carotide. Allumer la pompe à seringue pendant quelques secondes et vérifier manuellement que la solution de colorant peut être injecté dans l'artère carotide. Remarque: En supposant que la vitesse d'écoulement du sang dans l'artère carotide de rats adultes (240-280 g) est d'environ 3 ml / min 14, la vitesse d'écoulement du sang pour un chiot de rat (par exemple, P10 chiot pesant 15 à 25 g) peut être calculé à gamme de 0,16 à 0,3 ml / min.
- Placez l'animal sous l'objectif du microscope. Injecter le dextran fluorescent dans la circulation sanguine.
- Identifier les domaines d'intérêt sur le tronc cérébral ventrale avec un objectif de l'air 5X. Passer à un objectif 20X ou 40X (immersion dans l'eau, NA = 0,5 ou 0,8, respectivement) pour concentrer la région d'intérêt (ROI).
- Lancer imagerie et d'ajuster les paramètres d'acquisition d'image (par exemple, le temps d'exposition, la puissance du laser, le gain de détecteur) jusqu'à ce que l'intensité de la fluorescence dans la vascularisation de la région d'intérêt est optimisée (à savoirmais pas trop faible pour ne pas saturé).
- Mettre en marche la pompe à seringue pour injecter la solution de colorant dans l'artère carotide et acquérir une série chronologique dans un plan focal fixe.
6. Protection des animaux en suivant la procédure
- Il s'agit d'une procédure de terminal. A la fin d'une animaux de laboratoire doivent être euthanasiés avec une overdose de pentobarbital (100 mg / kg, injection intrapéritonéale) ou toute autre méthode d'euthanasie approuvé par American Veterinary Medical Association Directives pour l'euthanasie.
Remarque: Perfusion par le coeur avec une solution de Ringer a suivi avec une solution de fixation est recommandé pour une analyse plus approfondie histologique.
Résultats
L'électroporation de traceurs neuronaux
Le noyau interne du corps de trapèze (MNTB) est un groupe de cellules dans le complexe olivaire supérieur qui a été étudié précédemment en utilisant ce protocole. Par exemple, des pipettes de patch-clamp peuvent être utilisées pour l'électroporation des traceurs neuronaux (figure 6) 9. Lorsque les pipettes sont placées près de la ligne médiane, comme représenté sur la figure 6a, le résultat est que decussating axones afférents sont étiquetés. Un microscope à deux photons équipé d'une ouverture de l'objectif de l'immersion en eau numérique élevée peut être utilisé pour l'image des fibres atteignant le MNTB, y compris les branches collatérales très fines (flèches dans la figure 6b). Traceurs de neurones peuvent également être délivrés à la MNTB directement, comme représenté sur la figure 6c. Le résultat est MNTB marquage des cellules et axones afférents, comme cela peut être apprécié par imagerie avec un objectif à immersion dans l'eau de faible ouverture numérique (figure 6d). Le main avantage de l'utilisation de l'objectif à grossissement plus faible, c'est un champ de vision plus large peut être examiné, et bien que cela se traduit par une diminution de la résolution spatiale du fait de l'ouverture numérique objectif plus faible, les cellules MNTB individuels peut être ainsi discernée (flèches sur la figure 6d) . La durée moyenne de ces expériences pour les âges P1-P5 est de 3,1 ± 1,4 heures (n = 22 chiots).
enregistrements électrophysiologiques
Spontanée tir d'éclatement est une forme de l'activité électrique du développement observé dans les cellules de MNTB simples avant le début de l'audition 11,13. En utilisant ce protocole opératoire, il est également possible de cibler des matrices de multiélectrodes (les) polytrodes au MNTB (Figure 7a-b). Le résultat est un enregistrement de l'activité spontanée dans un ensemble de cellules MNTB. Figure 7e montre un enregistrement de polytrode représentatif d'un rat P6. Dans cette expérience, la polytrode a été revêtue avec le DiI de colorants lipophiles en utilisantun pinceau mince (voir l'étape 4.1). Après avoir effectué l'enregistrement, le cerveau a été générée pour l'analyse histologique et l'emplacement de la piste de polytrode Dil-marqué a été utilisé pour confirmer le ciblage approprié pour la MNTB (figure 7d). La durée moyenne d'expériences pour les âges P1-P6 est de 2,0 ± 0,7 heures (n = 33 chiots).
Mesure microvaisseaux perméabilité
Ce protocole peut également être utilisé pour réaliser deux photons expériences d'imagerie de la perméabilité vasculaire. Un soluté fluorescent (TRITC-dextran, PM 155 kD, le rayon de Stokes ~ 8,5 nm) a été dissous dans une solution Ringer BSA à 1% et injecté dans la circulation cérébrale via une canule insérée dans l'artère carotide 14. Contrairement injections veine de la queue, cette procédure contourne le cœur et introduit le soluté fluorescent directement dans la microcirculation cérébrale. La Figure 8a illustre la qualité de l'étiquetage de la vascularisation sanguine qui résulte de l'utilisation de ce mode opératoire. Après continueperfusion de solutés marquées dans la circulation sanguine, il est possible d'obtenir une séquence time-lapse d'une région d'intérêt, comme le montre la Figure 8b. L'intensité de fluorescence totale dans la région d'intérêt a été mesurée hors ligne et un modèle mathématique utilisée pour déterminer la perméabilité hémato-encéphalique barrière aux solutés marqué par fluorescence (Figure 8c) 15. La durée moyenne d'expériences pour les âges P9-P10 est de 2,3 ± 0,8 heures (n = 3 chiots).
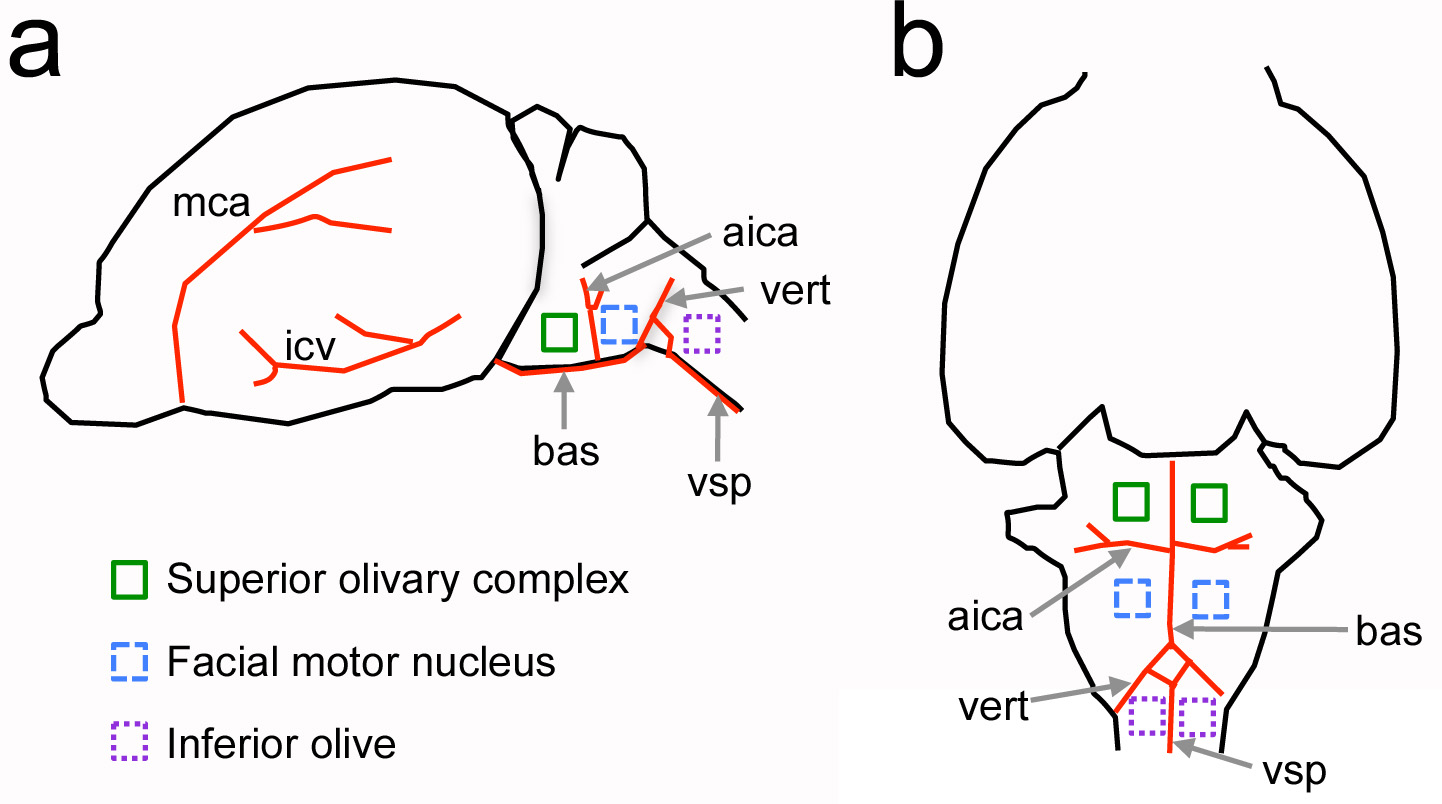
Figure 1. L'emplacement relatif de tronc cérébral ventrales structures neurales par rapport à des repères du système vasculaire chez le rat nouveau-né de. Une, Vue latérale du cerveau. B, vue ventrale du cerveau. Vaisseaux sanguins majeurs sont représentés dans les structures rouges et de neurones d'intérêt sont indicated par des carrés de couleur. Pas dessinés à l'échelle. aica = antérieure de l'artère cérébelleuse inférieure; bas = artère basilaire; ICV = veine cérébrale inférieure; mca = artère cérébrale moyenne; vert = de l'artère vertébrale; vsp = artère spinale ventrale. Cliquez ici pour agrandir l'image.

Figure 2. D'installation chirurgicale. Une, la chirurgie peut être fait sur une petite planche à pain (1) reposant sur une table stable. Un coussin chauffant (2) et un petit ventilateur pour animaux (3) peut être fixée à la planche à pain pour faciliter le déplacement toute la préparation en cas de besoin. Le petit ventilateur animal peut être alimenté par une batterie (4). Un support magnétique (5) peut être utilisé pour fixer le cône de nez utilisés pour délivrer l'anesthésique. Le cône de nez peutaussi aider à sécuriser la tête dans une position stable. Si l'animal n'a pas besoin d'être déplacé, un micromanipulateur (6) peut être utilisé pour les sondes de position pour l'électrophysiologie ou des expériences de traçage de neurones. Une source de lumière (7) et un stéréoscope (pas sur la photo) sont nécessaires pour visualiser les structures historiques au cours de la microchirurgie. B, petits ciseaux sont utilisés dans l'étape 1.4. C, forceps sont utilisés dans les étapes 1.4, 1.6.1, 1.8 et 1.8.1 . d, ciseaux à ressort sont utilisés dans les étapes 1.5, 1.6 et 1.7. e, ciseau dissection est utilisé à l'étape 3.1.2. La barre d'échelle en e = 1 mm, s'applique à bd. Cliquez ici pour agrandir l'image.
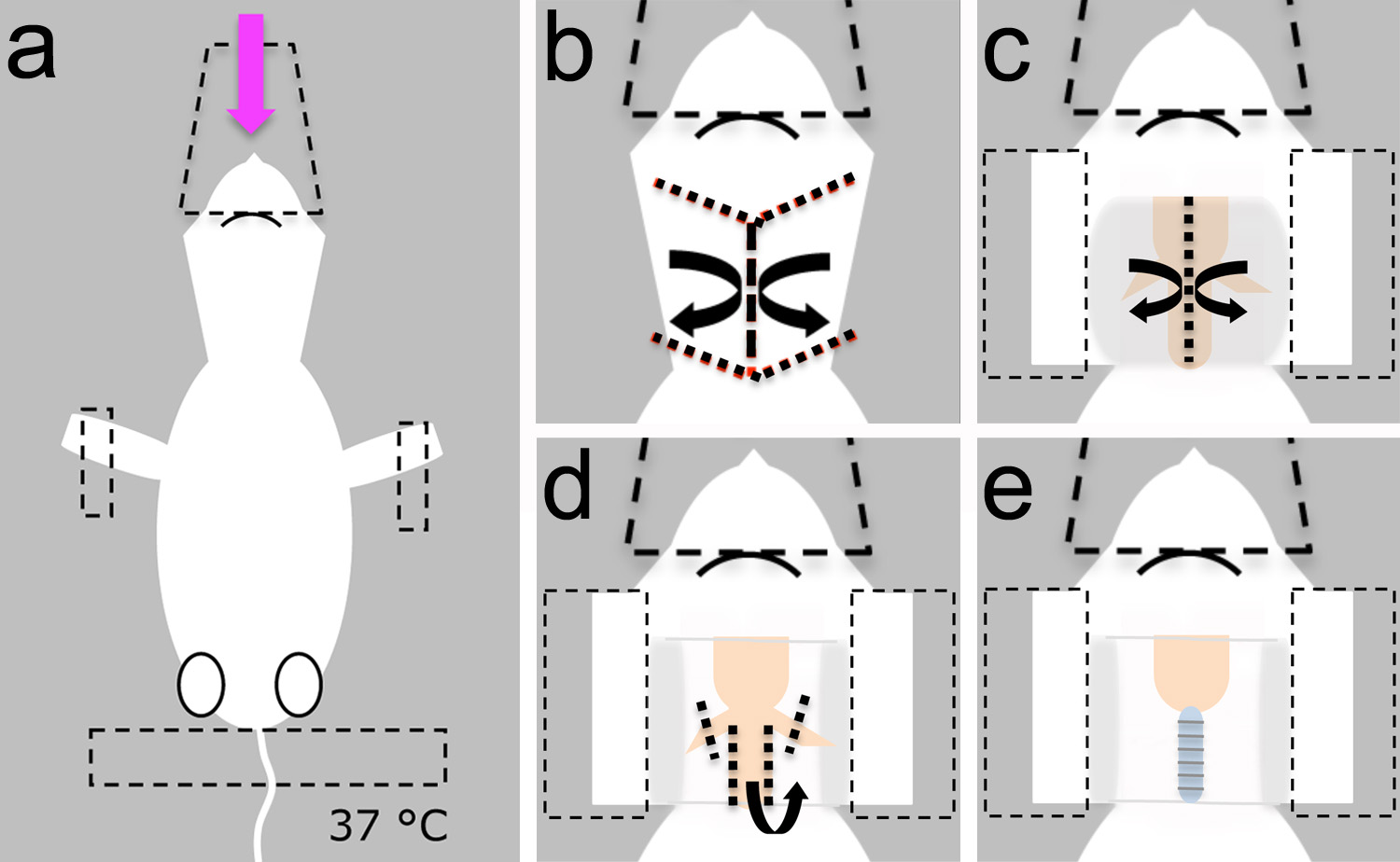
Figure 3. Exposer la trachée pour l'intubation.une, L'animal est anesthésié, placé en position couchée et fixée avec le cône de nez et bande (lignes pointillées). b, La peau est découpée et placée de côté pour exposer la couche sous-jacente de la graisse. c, La graisse sus-jacente et les glandes (représenté en gris) sont mis de côté pour exposer la trachée. La bande est utilisé pour sécuriser la peau sus-jacente (lignes en pointillés). D, La trachée est disséqué de la musculature. E, Visualisation des anneaux de la trachée indique suppression réussie du muscle sus-jacente. Cliquez ici pour agrandir l'image.
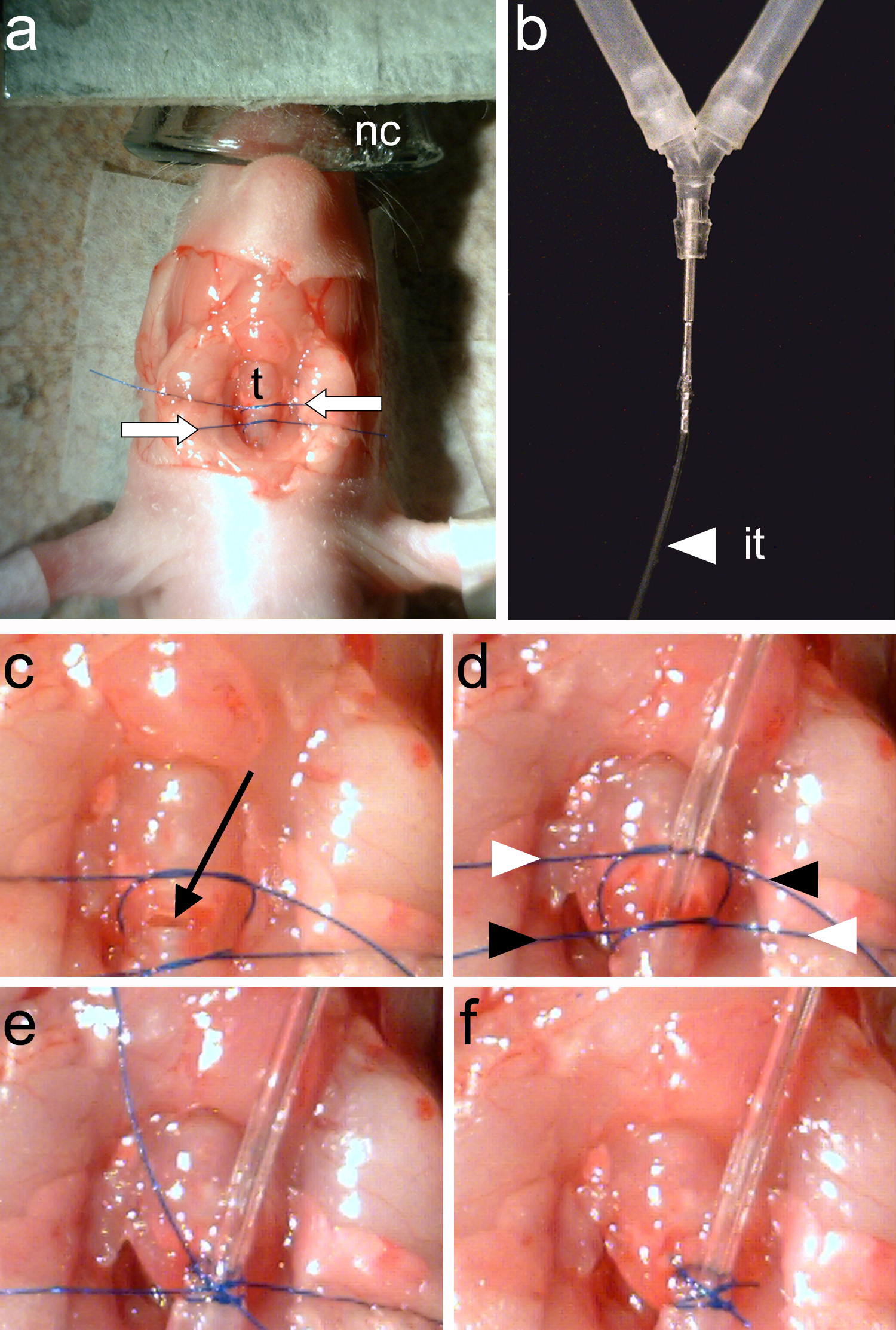
Figure 4. Intubating l'animal. Une, deux fils de suture (flèches blanches) sont liés autour de la trachée(T). B, Le tube d'intubation (elle) doit être raccordé de façon étanche au tube de y de l'animal ventilateur. C, A trachéotomie est réalisée entre les deux fils de suture (flèche noire). D, le tube de ventilation est insérée et l' deux fils de suture sont serrés. Les extrémités des fils sont resserrés de façon croisée (indiqué par des flèches blanches et noires). E, Les terminaisons de suture sont liés. F, Les terminaisons de suture sont coupés et l'intubation est terminée. Cliquez ici pour agrandir l'image.
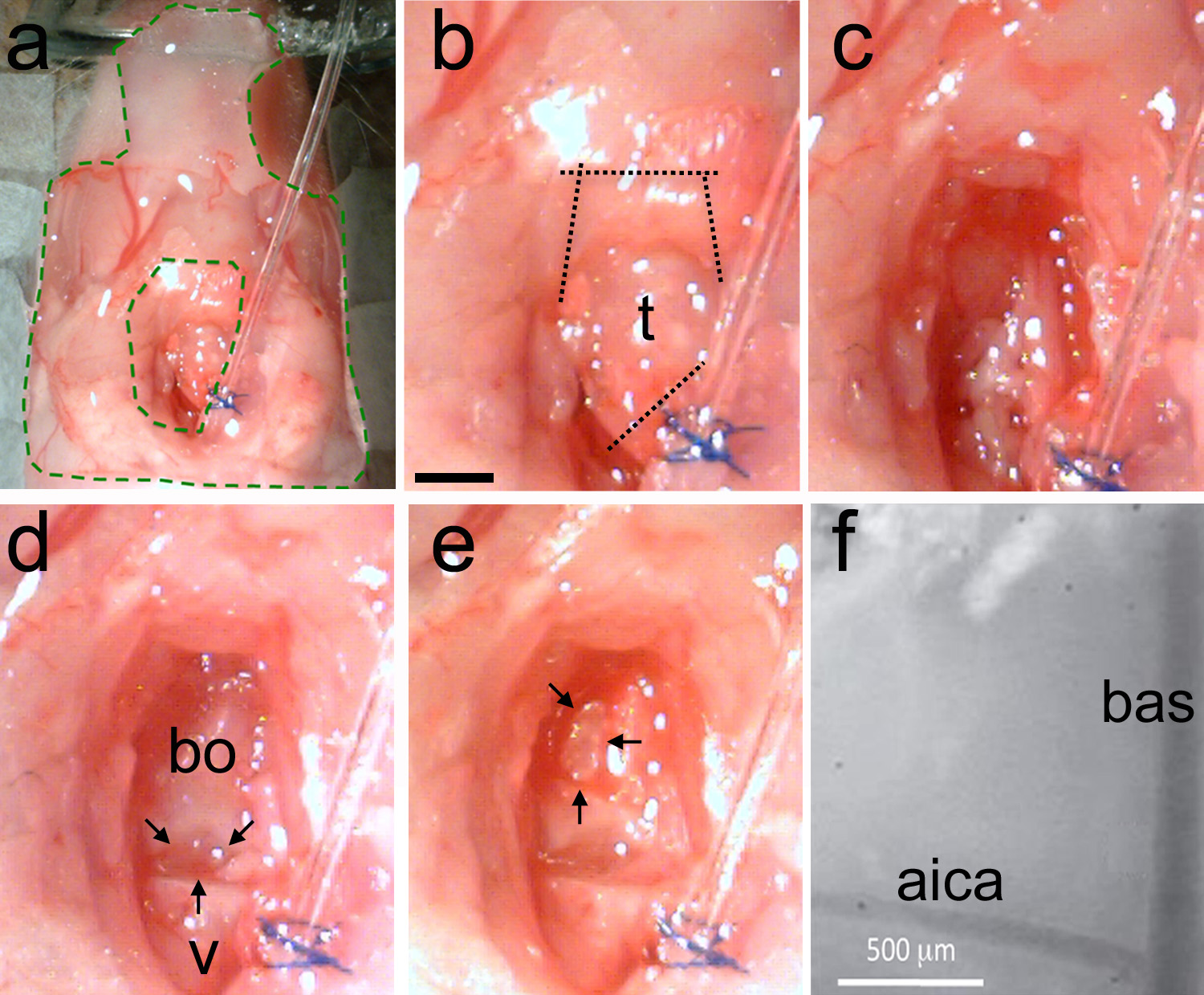
Figure 5. Retrait de la trachée et de faire la craniotomie. Une, La préparation est stabilisée avec un élastomère (zone insi de vert pointillés). b, La trachée est identifié, puis les coupes sont faites d'abord séparer la trachée loin de la sonde d'intubation, puis de couper les muscles mandibulaires (lignes pointillées). c, Nettoyer la surface du crâne à l'aide émoussé technique pour enlever muscle et utiliser du papier absorbant pour enlever la graisse et le sang. d, exemple d'une zone propre montre la dernière vertèbre (v) et le basi-occipital (bo). Il existe un fossé naturel entre les deux os (flèches noires). E, l'aide d'un micro-foret ou un nettoyant à ultrasons mince du crâne en forme de D inversé (flèches noires). Casser doucement le crâne amincie et enlever le morceau d'os. Vasculaire repère doit être visible. F, vue à fort grossissement des points de repère vasculaires sur la surface du tronc exposée. Bas = artère basilaire; aica = antérieure et inférieure artère cérébelleuse. La barre d'échelle en b = 1 mm, s'applique à ce.highres.jpg "target =" _blank "> Cliquez ici pour agrandir l'image.
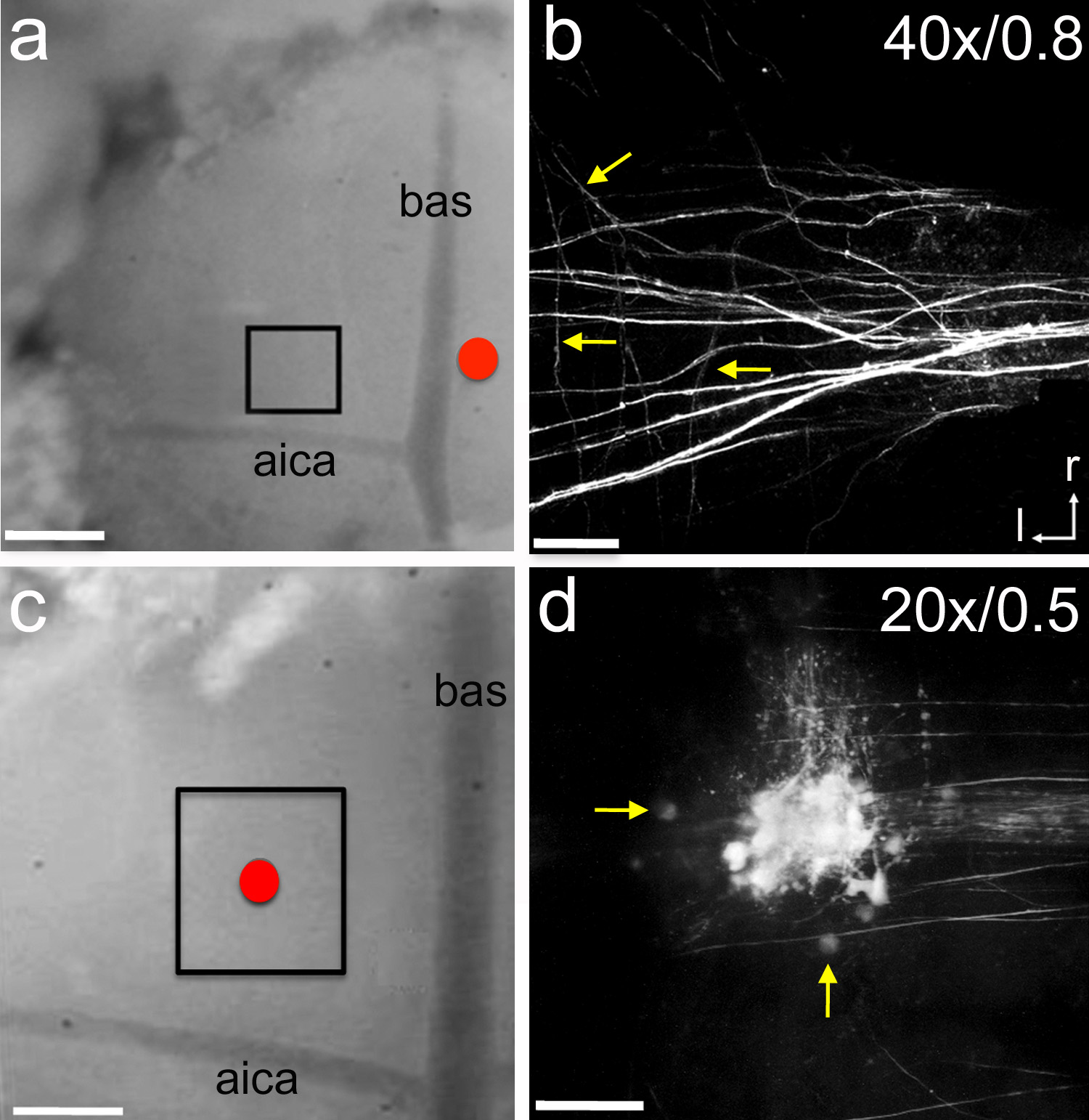
Figure 6. Électroporation de traceurs neuronaux. Une, une électrode de verre contenant le traceur micro-ruby neural a été placé près de la ligne médiane (cercle rouge). Le traceur a été soumis à une électroporation en utilisant sept secondes impulsions de temps délivrées -5 pA toutes les 14 secondes pendant 15 minutes. Après 1 heure de temps de récupération de la zone boîte a été imagé avec un microscope à deux photons. P1 rat chiot. B, l'image Copie z-pile de afférente étiquetage des axones dans le MNTB. Les flèches indiquent les branches collatérales individuels. C, une électrode de verre rempli de micro-rubis a été placé sur le dessus de la MNTB (cercle rouge). Le traceur a été électroporation en utilisant les mêmes paramètres décrits dans un. Après 1 heure de temps de récupération de la zone encadrée étaitimagé avec un microscope à deux photons. Chiot P5 de rat. D image Copie z-empilement de cellules et les axones marqués dans la MNTB. Les flèches indiquent les cellules MNTB simples. Étiquettes en b et c indiquent grossissement de l'objectif et l'ouverture numérique, respectivement. La barre d'échelle en a et c = 300 pm; barre d'échelle en b = 45 pm; barre d'échelle dans d = 90 pm. aica = antérieure de l'artère cérébelleuse inférieure; bas = artère basilaire; r = rostrale; l = latéral. Cliquez ici pour agrandir l'image.
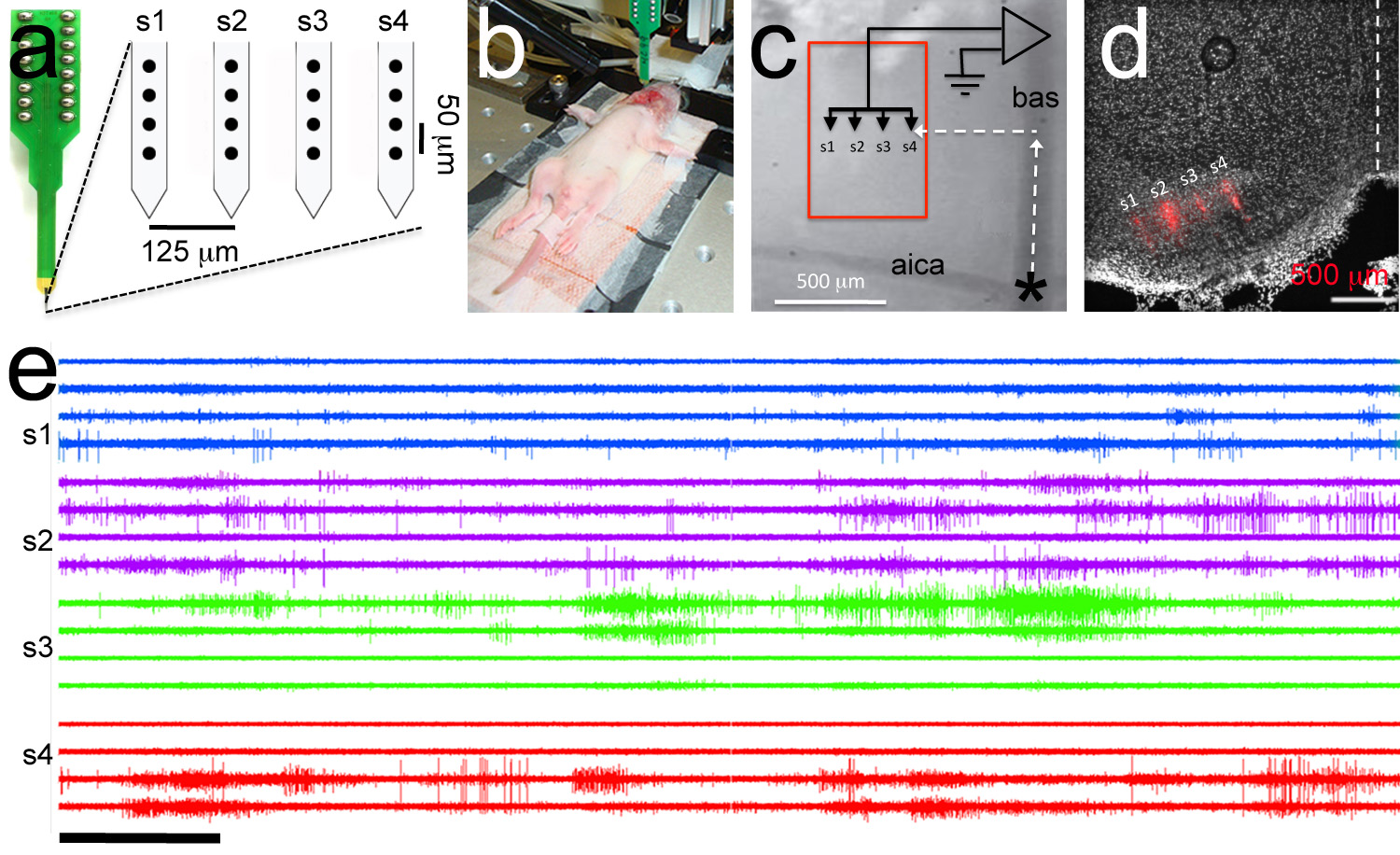
Figure 7. Ciblée enregistrement polytrode. Une, Polytrode se compose de 4 tiges avec 4 électrodes par tige (cercles noirs). Distances intra-et inter-jambe entre électrodes sont indiqués. B, Copie l'image de l'expérience d'électrophysiologie. Une électrode de référence est inséré dans la cavité buccale et une ploytrode est reliée à la headstage. Chiot P6 de rat. C, vue de grossissement supérieur des monuments de la vascularisation utilisés pour polytrode ciblage. Le polytrode est positionné en utilisant les coordonnées rostrale-latéraux pour cibler le noyau interne du corps de trapèze (zone rouge). D, analyse histologique POSTHOC démontre ciblage correct de la polytrode Dil enduit (piste polytrode est indiquée en rouge). E, multi Exemplar -unité d'enregistrement. Afin de Trace est le même que l'ordre de l'électrode dans le panneau a. Dans les enregistrements de tige de la même couleur. La barre d'échelle en e = 5 secondes. Cliquez ici pour agrandir l'image.
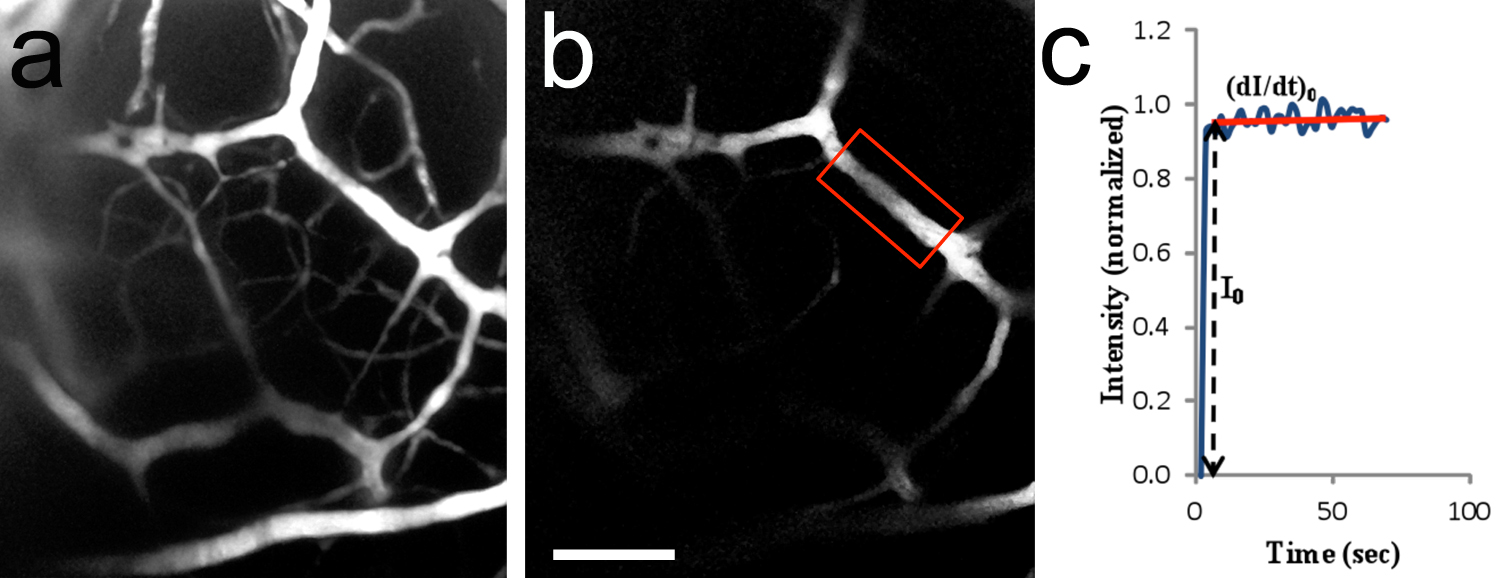
Figure 8. In vivo à deux photons imagerie des microvaisseaux du cerveau. une, image 2-D (effondré Z-pile) du système vasculaire du cerveau après une perfusion de TRITC-dextran 155 kD dans l'artère carotide. La zone imagée est similaire à celui représenté sur la figure 7c. 20x/0.5 objectif à immersion d'eau. Chiot P10 rat. B, région d'intérêt (ROI) utilisés pour mesurer l'intensité de fluorescence (cadre rouge de la région ci-joint). Le microvaisseaux avait un diamètre de ~ 14,2 um et 182 um était situé en dessous de la surface du tronc cérébral. C, la courbe typique de l'intensité de fluorescence (valeur normalisée) en fonction du temps. I 0 est l'augmentation progressive de l'intensité de la fluorescence dans la région d'intérêt quand la solution de fluorescence remplit juste au bout de la lumière du vaisseau. (Di / dt) 0 et I 0 sont utilisés pour déterminer la perméabilité microvasculaire au soluté. La perméabilité à la TRITC-dextran 155 kD a été calculée comme étant de 1,5 x 10 -7 cm / sec.La barre d'échelle en b = 100 pm, s'applique à un. Cliquez ici pour agrandir l'image.
Discussion
Le temps est critique. Un chercheur expérimenté devrait être en mesure de compléter ce protocole en 1 heure (étapes 1-3). Les temps indiqués pour les différentes étapes supposent un milieu à haut niveau d'expertise. Trachéotomie et l'intubation appropriée et en temps opportun sont essentielles, car un mauvais contrôle de la ventilation peut conduire à l'asphyxie et la mort de l'animal. Examiner minutieusement les tissus musculaires et adipeuses est également très important parce que les erreurs peuvent conduire à un saignement incontrôlé et la mort de l'animal. De même, lors de la préparation de l'artère carotide pour l'insertion de la canule, il faut serrer et couper l'artère soigneusement, si le nœud de fil devient lâche saignement incontrôlé aura lieu. Enfin, la craniotomie doit être faite soigneusement, sans perturber les repères de la vascularisation. Élimination négligente de la couche méningée externe (durée) peut conduire à des saignements et des dommages sévères de la vascularisation artérielle.
les paramètres de ventilation sont choisis en fonction de l'âge de l'animal.La plupart des fournisseurs commerciaux fournissent des informations utiles sur ces paramètres. Des expériences sur des rats âgés de plus de P15 nécessiteront l'utilisation d'un grand ventilateur des animaux. Les animaux adultes ne peuvent pas besoin de ventilation si anesthésiés avec de la kétamine / xylazine, mais l'intubation est recommandé d'éviter fluide entrant dans la trachée.
Une limitation principale de ce protocole est que les expériences ne peuvent être effectuées aiguë. Dans notre laboratoire, nous avons réalisé des expériences durables entre deux et jusqu'à dix heures. Une deuxième limite est que les expériences doivent être effectuées sous anesthésie. Par conséquent, le choix de l'anesthésique est une variable importante à prendre en compte dans la planification et la conception d'expériences. Une question connexe est que les animaux nouveau-nés peuvent être particulièrement sensibles à une overdose. Par exemple, si le choix de la kétamine / xylazine mélange, calculer la dose en fonction du poids de chiot et d'administrer des médicaments à ⅓ du volume maximal. Vérifier l'état de l'animal toutes les 5-10 minutes par pincement de l'orteil ré ponse. Si vous utilisez l'isoflurane, des précautions sont également nécessaires pour maintenir un environnement sûr pour l'enquêteur (d'une bonne ventilation, et un vaporisateur bien calibré).
Le microscope stéréoscopique peut être monté sur un support flexible pour ajuster l'angle de vision et de faciliter le dégagement de l'espace pour placer les électrodes et la relocalisation de l'animal au microscope à deux photons. Utilisation d'une batterie pour alimenter le ventilateur peut faciliter le déplacement de l'animal et de réduire les artefacts électriques au cours d'expériences d'électrophysiologie. A cette fin, une petite plaque d'essais (7,5 x 12 cm) peut être utilisé pour assembler le ventilateur, un coussin chauffant et le anesthésié l'animal (Figure 2a). Une modification utile et important de cette configuration est l'ajout d'un dispositif de surveillance des signes vitaux pendant la chirurgie. Un oxymètre ou autres appareils analogiques peuvent être utilisées en fonction du budget de laboratoire.
Ce protocole a été utilisé avec l'électrophysiologie et d'imagerie rencontréauges, y compris les correctifs enregistrements de serrage 8,10,11, enregistrements polytrode (figure 7), et à deux photons imagerie 9 (figures 6 et 8). Une possible application future serait de combiner ces méthodes pour cibler des cellules marquées par fluorescence pour l'enregistrement électrophysiologique 16.
Les nouvelles applications d'imagerie peuvent également inclure 2-D ou 3-D série temporelle en utilisant un microscope à deux photons. Par exemple, en utilisant des indicateurs de bolus chargement de calcium pour étudier l'activité neuronale du tronc cérébral et des populations de cellules gliales. Comme le montre la figure 8, une solution de colorant injecté dans la circulation du sang à travers l'artère carotide peut être utilisé pour générer des images de contraste élevé de la vascularisation cérébrale. Comme le colorant fluorescent remplit le lumen de microvaisseaux et se propage dans le tissu environnant, elle peut être utilisée non seulement pour le calcul du soluté perméabilité apparente de la barrière sang-cerveau, mais aussi du coefficient de diffusion de solutéFicient dans le tissu cérébral 3. Une des raisons principales pour l'injection des solutés marquées par fluorescence via l'artère carotide est que la solution de colorant peut aller directement aux microvaisseaux du cerveau sans passer par le coeur d'abord comme une injection dans la veine caudale. Cela porte au moins deux avantages. La première est que la concentration de colorant de fluorescence dans la lumière de microvaisseaux peut être pratiquement constante, si le taux de perfusion est fixé au niveau du site de canulation. Cela garantit une détermination précise de la perméabilité de la barrière hématoencéphalique. Une autre est que, si un agent de test est inclus dans le liquide de perfusion, il ira directement à la barrière hémato-encéphalique sans être dilué ou en combinaison avec d'autres facteurs de la circulation du corps.
De nouvelles expériences pourront également profiter des animaux transgéniques avec les journalistes fluorescentes codées génétiquement. Cela offrirait l'avantage que des sondes fluorescentes n'auraient pas besoin d'être chargées in situ (à moins que la conception de l'expériencestipule autrement), un gain de temps et permettant éventuellement pour les préparations intactes plus (par exemple de la fenêtre crânienne 17).
Enfin, les expériences peuvent être faites dans d'autres régions du tronc cérébral comme l'olive inférieure ou le noyau moteur facial. La connaissance de la neuroanatomie et le développement des populations cellulaires spécifiques à une espèce donnée sera important à cette fin, d'autant plus que des repères anatomiques peuvent changer en animaux grandissent (Figure 1). Nous espérons que ce protocole encourage les autres à étudier les structures du tronc cérébral ventrales aide dans électrophysiologique in vivo et des méthodes d'imagerie.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été soutenu par subvention G12-RR003060 du NIH / NCRR / RCMI, accorder SC1HD068129 de l'Institut national de la santé et du développement humain des enfants, la National Science Foundation ÉFAC 0754158 et CFP-CUNY 62337-00 40 de la City University de New Eunice Shriver York.
matériels
| Name | Company | Catalog Number | Comments |
| Absorbant pads | Kettenbach | Sugi 31603 | Other options may be available from different companies |
| Cautery | Braintree Scientific, INC | GEM 5917 | Other options may be available from different companies |
| Tetramethyl rhodamine Isothiocyanate dextran | Sigma | T1287-500MG | Other options may be available from different companies |
| Dissecting Chisel | Fine Science Tools | 10095-12 | Other options may be available from different companies |
| DiI | Invitrogen | V-22885 | Other options may be available from different companies |
| Elastomer | World Precision Instruments | KWIK-SIL | Other options may be available from different companies |
| Fine Scissors | Fine Science Tools | 14060-09 | Other options may be available from different companies |
| Forceps | Fine Science Tools | 11027-12,11617-12, 11616-16 | Other options may be available from different companies |
| Spring Scissors | Fine Science Tools | 15009-08 | Other options may be available from different companies |
| Heating pad | FHC | 40-90-2 | Other options may be available from different companies |
| Intubation tubing | Braintree Scientific, INC | BIO CO-KIT | Choose age appropriate size |
| Light source | Spach Optics | Schott Ace illuminator | Other options may be available from different companies |
| Micro drill | Braintree Scientific, INC | MD-1200 120V | Other options may be available from different companies |
| Paper tape | Walgreens | Generic brand | Other options may be available from different companies |
| Syringe filter | VWR | 28145-483 | Other options may be available from different companies |
| Syringe pump | VWR | 52459-008 | Other options may be available from different companies |
| Stereomicroscope | Olympus | SZ61 | Other options may be available from different companies |
| Suture | Ethicon | Prolene 86979 | 6-0 size |
| Tubing | Braintree Scientific, INC | Micro-Renathane (MRE033); SUBL-120 | Other options depending on pup’s age |
| Vaporizer (isoflurane) | Vetequip Incorporated | 911103 | Other options may be available from different companies |
| Ventilator (minivent) | Harvard Apparatus | 730043 | Use for P0-P12 rats |
Références
- Kerr, J. N. D., Denk, W. Imaging in vivo: watching the brain in action. Nat. Rev. Neurosci. 9 (3), 195-205 (2008).
- Sigler, A., Murphy, T. H. In vivo 2-photon imaging of fine structure in the rodent brain: before, during, and after stroke. Stroke. 41 (10), 117-123 (2010).
- Shi, L., Zeng, M., Sun, Y., Fu, B. M. Quantification of blood-brain barrier solute permeability and brain transport by multiphoton microscopy. ASME J. of Biomech. Eng. 136 (3), 031005-031005 (2014).
- Galambos, R., Schwartzkopff, J., Rupert, A. Microelectrode study of superior olivary nuclei. Am. J. Physiol. 197, 527-536 (1959).
- Goldberg, J., Brown, P. B. Response of binaural neurons of dog superior olivary complex to dichotic tonal stimuli: some physiological mechanisms of sound localization. J. Neurophysiol. 32 (4), 613-636 (1969).
- Guinan, J. J., Guinan, S. S., Norris, B. E. Single auditory units in the superior olivary complex I: responses to sounds and classifications based on physiological properties. Intern. J. Neurosci. 4, 101-120 (1972).
- Spirou, G. A., Brownell, W. E., Zidanic, M. Recordings from cat trapezoid body and HRP labeling of globular bushy cell axons. J. Neurophysiol. 63 (5), 1169-1190 (1990).
- Khosrovani, S., Der Giessen, R. S. V. a. n., De Zeeuw, C. I., De Jeu, M. T. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proc. Natl. Acad. Sci. U.S.A. 104 (40), 15911-15916 (2007).
- Rodríguez-Contreras, A., Van Hoeve, J. S., Habets, R. L., Locher, H., Borst, J. G. G. Dynamic development of the calyx of Held synapse. Proc. Natl. Acad. Sci. U.S.A. 105 (14), 5603-5608 (2008).
- Lorteije, J. A., Rusu, S. I., Kushmerick, C., Borst, J. G. G. Reliability and precision of the mouse calyx of Held synapse. J. Neurosci. 29 (44), 13770-13784 (2009).
- Tritsch, N. X., Rodríguez-Contreras, A., Crins, T. T., Wang, H. C., Borst, J. G. G., Bergles, D. E. Calcium action potentials in hair cells pattern auditory neuron activity before hearing onset. Nat. Neurosci. 13 (9), 1050-1052 (2010).
- Tong, H., Steinert, J. R., Robinson, S. W., Chernova, T., Read, D. J., Oliver, D. L., Forsythe, I. D. Regulation of Kv channel expression and neuronal excitability in rat medial nucleus of the trapezoid body maintained in organotypic culture. J. Physiol. 588 (9), 1451-1468 (2010).
- Sonntag, M., Englitz, B., Kopp-Scheinpflug, C., Rübsamen, R. Early postnatal development of spontaneous and acoustically evoked discharge activity of principal cells of the medial nucleus of the trapezoid body: an in vivo study in mice). J. Neurosci. 29 (30), 9510-9520 (2008).
- García-Villalón, A. L., Roda, J. M., Alvarez, F., Gómez, B., Diéguez, G. Carotid blood flow in anesthetized rats: effects of carotid ligation and anastomosis. Microsurgery. 13 (5), 258-261 (1992).
- Yuan, W., Lv, Y., Zeng, M., Fu, B. M. Non-invasive method for the measurement of solute permeability of rat pial microvessels. Microvasc. Res. 77 (2), 166-173 (2009).
- Kitamura, K., Judkewitz, B., Kano, M., Denk, W., Haüsser, M. Targeted patch-clamp recordings and single-cell electroporation of unlabeled neurons in vivo. Nat. Methods. 5 (1), 61-67 (2008).
- Mostany, R., Portera-Cailliau, C. A method for 2-photon imaging of blood flow in the neocortex through a cranial window. J. Vis. Exp. (12), (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon