Method Article
Um método para fazer uma craniotomia no crânio ventral de neonatos Roedores
Neste Artigo
Resumo
Um método cirúrgico é descrito para expor o crânio ventral em ratos recém-nascidos. Usando essa abordagem, é possível abrir uma craniotomia para realizar eletrofisiologia aguda e experimentos de microscopia de dois fótons no tronco encefálico de filhotes anestesiados.
Resumo
O uso de uma craniotomia para experiências in vivo, oferece a oportunidade de investigar a dinâmica de diversos processos celulares do cérebro de mamíferos em idade adulta e durante o desenvolvimento. Embora a maioria das abordagens in vivo utilizar uma craniotomia para estudar as regiões do cérebro situadas no lado dorsal, as regiões do tronco cerebral, tais como a ponte, localizadas no lado ventral permanecem relativamente pouco estudado. O principal objetivo deste protocolo é facilitar o acesso às estruturas do tronco cerebral ventral, para que possam ser estudados in vivo utilizando eletrofisiológico e métodos de imagem. Esta abordagem permite o estudo de mudanças estruturais no axônios de longo alcance, os padrões de atividade elétrica em único e conjuntos de células, e as alterações na permeabilidade da barreira sanguínea do cérebro em animais recém-nascidos. Embora este protocolo tem sido usado principalmente para estudar o tronco encefálico em ratos recém-nascidos, ele pode facilmente ser adaptado para estudos em outras espécies de roedores, como ratos neonatos, adultos rodents e de outras regiões do tronco cerebral.
Introdução
O uso de uma craniotomia em combinação com imagens de fluorescência e técnicas de monitorização de electrofisiologia permite o fluxo sanguíneo, permeabilidade da barreira hemato-encefálica e medição da actividade de neurónios e células da glia em animais vivos 1-3. Vários laboratórios têm usado essa abordagem para fornecer informações sobre a fisiologia do cérebro em condições saudáveis e de doença, mas subsistem lacunas em nossa compreensão de como esses processos surgem durante o desenvolvimento. Além disso, a maioria dos estudos têm-se centrado em regiões do cérebro que são facilmente acessíveis a partir da superfície dorsal do crânio, de tal forma que as estruturas do tronco cerebral ventrais com diversas funções fisiológicas têm sido estudados principalmente utilizando abordagens ex vivo.
O principal objetivo deste protocolo é fornecer um método para abrir uma craniotomia no crânio ventral de roedores. Esta abordagem foi adaptada a partir de estudos clássicos realizados em mamíferos de grande porte, tais como cães e gatos para reco neurofisiologia sensoriaisrdings do tronco encefálico 4-7. Neste protocolo no entanto, não é o novo desafio de realizar o procedimento em animais recém-nascidos. Usando marcos vasculatura, este protocolo adaptado tem sido usado anteriormente para estudar o tronco encefálico de ratos neonatos, camundongos adultos e de outras regiões do tronco cerebral, como o verde-oliva inferior 8-11 (Figura 1).
A principal vantagem de uma craniotomia ventral sobre os métodos existentes para estudar núcleos do tronco cerebral ventral é que ele fornece acesso direto às estruturas de interesse em animais vivos. Por exemplo, as células auditivas do complexo olivar superior estão localizadas a algumas dezenas de micrómetros a partir da superfície do cérebro, o que é importante para a colocação de sondas alvo e para a utilização de métodos de imagiologia de dois fotões, em que a profundidade da imagem pode ser limitada a 0,5 mm x espalhamento de tecido leve e absorção. A craniotomia ventral também proporciona uma preparação com conexões neurais relativamente intactas, which são interrompidos em preparações fatia organotípicas agudas e 12. Em contraste com outros protocolos para experimentos in vivo neurofisiologia 13, uma abordagem ventral pode ser combinada com a gravação multi-eletrodo e métodos de imagem que fornecem informações sobre conjuntos celulares (figuras 6 e 7). Por último, em combinação com este protocolo um soluto marcado por fluorescência pode ser injectado no sistema vascular para medir alterações na permeabilidade da barreira hematoencefálica para o soluto (Figura 8).
Protocolo
O protocolo a seguir segue as diretrizes estabelecidas pelo cuidado dos animais Animal Care e Use Comitê Institucional (IACUC) no The City College de Nova York.
1. Intubação Animal (10-20 min)
- Antes da cirurgia, preparar solução de Ringer mamíferos. Reúna as ferramentas cirúrgicas, almofada de aquecimento e ventilador para pequenos animais no banco (Figura 2).
- Para as medições de permeabilidade da barreira hematoencefálica fazer 10 ml de solução a 1% (BSA) a albumina do soro bovino em Ringer e dissolver TRITC-dextrano 155 kDa a 8 mg / ml em solução de BSA a 1%, solução de filtro com 25 milímetros filtro de seringa (0,2 mM tamanho dos poros) e armazenar em uma seringa cobertas de papel alumínio no escuro.
- Anestesiar o animal utilizando isoflurano. Use 5,0% para indução e 1,5-3,0% para manutenção. Alternativamente, uma mistura de cetamina (41,7 mg / kg) e xilazina (2,5 mg / kg de peso corporal) pode ser utilizado. Profundidade da anestesia pode ser verificado toe pitada reflexo daextremidades superiores e inferiores.
- As doses subsequentes de cetamina (41,7 mg / kg de peso corporal) e xilazina (2,3 mg / kg de peso corporal) deve ser administrado em intervalos de ⅓ da dose máxima, para evitar a sobredosagem. A utilização de um ventilador de roedor é recomendado para neutralizar a depressão respiratória induzida por xilazina.
- Coloque o filhote anestesiado deitado de lado dorsal e garantir a sua cabeça com o cone de plástico usado para entregar o anestésico (Figura 3A).
- Fixe o animal com fita adesiva nos membros dianteiros e cauda (Figura 3A).
- Uma alternativa para fixar a cabeça do cão é a utilização de uma placa de cabeça ligado a uma barra de metal.
Nota: Certifique-se de que a almofada de aquecimento está definido para 37 ° C para evitar a hipotermia (Figura 3A).
- Use tesouras (Figura 2b) para fazer uma longitudinal e quatro incisões laterais sobre a pele que recobre o colo (Figura 3b). Utilizando uma técnica sem corte, dissecar a pele e coloque-o de lado com a pinça (Figuras 2c e 3c).
- Segure a pele para baixo, usando fita adesiva. Estabilize a cabeça em uma posição horizontal (Figura 3c).
- Com uma tesoura de mola (Figura 2D) e técnica contundente, empurrar glândulas e camadas de gordura de lado para expor a traquéia (Figura 3c). Identificar a localização das artérias carótidas.
- Mantenha as artérias carótidas de distância da traquéia.
Nota: a perfuração da carótidas pode resultar em perda maciça de sangue e morte do filhote.
- Mantenha as artérias carótidas de distância da traquéia.
- Com uma tesoura de mola (Figura 2d) dissecar os músculos longitudinais que cobrem a traqueia. Corte os músculos longitudinais localizados sob a traquéia (Figura 3d).
Nota: Os anéis traqueais deve ser claramente visível (Figura 3e).- Utilizaçãouma pinça (Figura 2c), amarrar duas partes de fio de sutura em torno da traqueia. Um pedaço de sutura vai fixar o tubo de ventilação e o segundo segmento será usado para fechar a rostral traquéia para o ponto de inserção do tubo de ventilação (Figura 4a).
Nota: Umedeça exposto tecido regularmente com solução de Ringer para evitar a desidratação.
- Utilizaçãouma pinça (Figura 2c), amarrar duas partes de fio de sutura em torno da traqueia. Um pedaço de sutura vai fixar o tubo de ventilação e o segundo segmento será usado para fechar a rostral traquéia para o ponto de inserção do tubo de ventilação (Figura 4a).
- Com uma tesoura de mola (Figura 2d) fazer uma incisão em um dos anéis de traqueia localizados entre os dois fios colocados no passo 1.6.1 (Figura 4c).
Nota: Certifique-se de que nenhum fluido entra na traqueia aberta. Fluid na traquéia vai causar asfixia. - Insira o tubo de intubação (Figura 4-B) na traquéia e apertar a linha de baixo para prendê-lo. Utilizando uma pinça (Figura 2-C), aperte a linha superior para fechar a posterior traquéia para o ponto de inserção do tubo de intubação.
- Rosn e aparar as extremidades das duas linhas (Figura 4d-F).
Nota: Vapor dentro do tubo de intubação é um bom sinal de controle de fluxo de ar.
- Rosn e aparar as extremidades das duas linhas (Figura 4d-F).
- Mudar imediatamente o fornecimento de isoflurano ao ventilador. Ajustar o volume da pulsação e a taxa de ventilação de acordo com o peso do animal.
- Selar o tecido circundante exposto com elastômero (Figura 5a). Mantenha a superfície umedecida e limpo.
2. Traquéia e Remoção muscular para expor o crânio (5-10 min)
- Use uma tesoura de mola (Figura 2d) para cortar a traqueia adjacente ao tubo de ventilação. Realizar dois cortes ao longo da parede do músculo da cavidade bucal para expor a extremidade caudal do palato (Figura 5b).
Nota: Se necessário, utilize um cauterizador para parar o sangramento. Hemorragia descontrolada irá causar a morte do animal. - Limpe oárea, utilizando grandes quantidades de solução de Ringer (Figura 5c). Identificar a distância entre o último vértebras e o osso basi-occipital (Figura 5d).
Nota: A diferença entre os ossos é um marco crânio útil para localizar estruturas do tronco cerebral. A oliveira inferior está localizado sob esta lacuna. O complexo olivar superior auditivo está localizado abaixo do osso basi-occipital na direção rostral dessa lacuna (ver também Figura 1). - Limpe a área com a pinça (Figura 2c) e tesoura primavera (Figura 2d). Não fure vasos sanguíneos.
Nota: Se necessário, cauterizar para parar o sangramento.- Depois da área exposta é limpa de gordura e de tecido muscular, o espaço que separa o osso basi-occipital e da última vértebra deve ser visível (Figura 5d).
3. Craneotomia (15-30 min)
- Use um microdrill ou um ultralimpador sônico. Localize a parede medial da bolha.
- Fina crânio, fazendo uma forma D invertido até as artérias subjacentes são visíveis (Figura 5e).
Nota: A artéria basilar (BAS) é executado em cima da linha média do tronco cerebral. A artéria cerebelar inferior anterior (AICA) ramos bilateral e pode ser usado de forma confiável como um marco, pois tem uma posição constante em diferentes animais. - Quando o crânio é diluído, quebrá-lo suavemente com um cinzel de dissecação (Figura 2e). Remover o pedaço de osso com uma pinça (Figura 2c). Alternativamente, levantar e quebrar o crânio usando uma agulha torta.
Nota: Repetir este procedimento até que o tamanho e forma da craniotomia é apropriado para a experiência planeada. Os bas e aica deve ser visível através da membrana dura (Figura 5-F).
- Fina crânio, fazendo uma forma D invertido até as artérias subjacentes são visíveis (Figura 5e).
- Limpe a área várias vezes com solução de Ringer fresco. Usando pa absorventeds secar a superfície da membrana da dura-máter.
- Se necessário, use uma agulha de sutura para remover a membrana dura sem deslocar ou quebrar o bas artérias marco e aica.
Nota: Após a dura punção do líquido cefalorraquidiano fluirá. Limpe a área com a solução de Ringer e manter úmido durante todo o experimento.
- Se necessário, use uma agulha de sutura para remover a membrana dura sem deslocar ou quebrar o bas artérias marco e aica.
4. Eletrofisiologia Experiment
- Selecione o polytrode acordo com o projeto experimental (Figura 7a). Use um pincel fino para revestir o polytrode com DII. Transferir a solução de DII em um tubo de microcentrífuga de 1 ml, mergulhar o pincel na solução e atingir suavemente a polytrode sob orientação visual (por exemplo, usando um estereoscópio). Comece a ponta da sonda e com cuidado continuar até que todos os eléctrodos são revestidas uniformemente.
- Coloque o eléctrodo de terra dentro da cavidade oral. Carregue o polytrode no suporte do eletrodo (Figura 7b ).
- Ligue o amplificador e verifique se todas as conexões funcionam bem.
- Posicione o eletrodo acima bas no ponto ramo da AICA (posição zero). Mova o eletrodo para o ponto de destino desejado usando o rostral-lateral coordenadas (Figura 7c) apropriado.
- Colocar o eléctrodo sobre a superfície do cérebro e movê-lo para a profundidade desejada, em passos de 5-10 mM.
- Realizar gravação de acordo com projeto experimental. Salve os dados para análise posterior.
5. Dois fótons de imagem Experiment
- Ligue o microscópio. Defina o comprimento de onda de excitação e usar um filtro de emissão apropriado. Excitação em 800 nm e um trabalho de 607 ± 45 nm filtro de emissão passa-banda bem para a imagem TRITC-dextrano.
- Identificar a artéria carótida direita ou esquerda. Utilizando uma técnica franco dissecção da artéria carótida dos tecidos conjuntivos adjacentes ou nervos.
- Escolha e mantenha a carótidaartéria com uma pinça hemostática. Amarrar três pedaços de fio de sutura em torno da artéria carótida.
- Aperte o fio mais perto do lado do coração para parar o fluxo de sangue e deixar os outros dois fios soltos.
- Use uma tesoura fina para fazer um pequeno corte em um ângulo de 45 ° sobre a artéria carótida entre o fio amarrado eo próximo fio solto.
Nota: Limpe o sangue com papel absorvente.
- Canular a artéria carótida. Insira o tubo preenchido com solução TRITC-dextrano para o corte na artéria carótida cerca de 5 mm de profundidade orientada para a cabeça do filhote.
- Apertar os outros dois segmentos em torno da artéria para segurar o tubo e a artéria juntos. Aperte os fios, cortar e adicionar elastômero para estabilizar ainda mais.
Nota: O outro lado do tubo está ligado à seringa contendo a solução de TRITC-dextrano (preparado no passo 1.1.)
- Apertar os outros dois segmentos em torno da artéria para segurar o tubo e a artéria juntos. Aperte os fios, cortar e adicionar elastômero para estabilizar ainda mais.
- Fixar a seringa sobre a bomba de seringa.
- Conjuntoa velocidade com a taxa de fluxo sanguíneo da artéria carótida do filhote. Ligar a bomba de seringa, durante alguns segundos e verificar manualmente que a solução corante pode ser injectado para dentro da artéria carótida. Nota: Supondo que a taxa de fluxo de sangue na artéria carótida de ratos adultos (240-280 g) é de cerca de 3 ml / min 14, a taxa de fluxo de sangue para um filhote de rato (por exemplo, P10 filhote pesando 15-25 g) pode ser calculado a Faixa de 0,16-0,3 ml / min.
- Colocar o animal sob a objetiva do microscópio. Injectar a dextrano fluorescente na corrente sanguínea.
- Identificar áreas de interesse no tronco cerebral ventral com um objetivo ar 5X. Mudar para um objetivo 20X ou 40X (imersão em água, NA = 0,5 ou 0,8, respectivamente) para focar a região de interesse (ROI).
- Comece a imagem e ajustar os parâmetros de aquisição de imagem (por exemplo, tempo de exposição, a potência do laser, ganho de detector) até a intensidade de fluorescência na vasculatura do ROI é otimizado (ou seja,não é muito baixo, mas não saturado).
- Ligue a bomba de seringa para injetar a solução de corante na artéria carótida e adquirir uma série de tempo em um plano focal fixa.
6. Animal Care Seguindo o Procedimento
- Este é um procedimento terminal. No final de um experimento os animais devem ser sacrificados com uma overdose de pentobarbital (100 mg / kg, via intraperitoneal) ou qualquer outro método de eutanásia aprovada pelo Diretrizes Eutanásia American Veterinary Medical Association.
Nota: A perfusão através do coração com solução de Ringer seguiu com uma solução fixadora é recomendado para posterior análise histológica.
Resultados
Eletroporação de traçadores neurais
O núcleo central do corpo trapezoidal (MNTB) é um grupo de células no complexo olivar superior que foi estudado anteriormente utilizando este protocolo. Por exemplo, as pipetas de fixação de membranas pode ser utilizado para electroporar marcadores neuronais (Figura 6) 9. Quando pipetas são colocadas perto da linha central, como mostrado na Figura 6a, o resultado é que decussating axônios são rotulados. Um microscópio de dois fotões equipado com uma objectiva de imersão em água de abertura numérica elevada pode ser utilizado para a imagem das fibras que atingem a MNTB, incluindo ramos colaterais muito fina (setas na Figura 6b). Marcadores neurais podem também ser entregues a MNTB directamente, como mostrado na Figura 6c. O resultado é a marcação de células MNTB e axónios aferentes, como pode ser apreciado por imagem com uma objectiva de imersão em água inferior a abertura numérica (Figura 6d). A main vantagem de utilizar o objectivo de ampliação é menor que um campo de visão mais amplo pode ser examinado, e embora isso resulta numa diminuição da resolução espacial devido à abertura numérica objectivo inferior, células MNTB individuais podem ser discernidos bem (setas na Figura 6d) . A duração média desses experimentos para idades P1-P5 é de 3,1 ± 1,4 horas (n = 22 filhotes).
Gravações de Eletrofisiologia
Disparo explosão espontânea é uma forma de atividade elétrica de desenvolvimento observado em células MNTB único antes do início da audição 11,13. Usando este protocolo cirúrgico também é possível atingir matrizes multieletrodo (polytrodes) para MNTB (Figura 7a-b). O resultado é um registro da atividade espontânea em um conjunto de células MNTB. Figura 7e mostra uma gravação polytrode representante de um rato P6. Neste experimento, o polytrode foi revestido com as DII corante lipofílicas usandoum pincel fino (veja o passo 4.1). Depois de realizar a gravação do cérebro foi processado para análise histológica e a localização da pista polytrode Dil-marcado foi utilizado para confirmar o bom alvo para MNTB (Figura 7d). A duração média de experimentos para idades P1-P6 é de 2,0 ± 0,7 horas (n = 33 filhotes).
Medição da permeabilidade microvascular
Este protocolo pode também ser usada para efectuar experiências com dois fótons de permeabilidade vascular. Um soluto fluorescente (TRITC-dextrano, MW 155 kD, o raio de Stokes ~ 8,5 nm) foi dissolvido em solução de BSA a 1% da campainha e injectado na circulação cerebral por meio de uma cânula inserida na artéria carótida 14. Ao contrário de injecções na veia da cauda, este procedimento evita o coração e apresenta o soluto fluorescente directamente para a microcirculação do cérebro. A Figura 8a ilustra a qualidade da marcação da vasculatura arterial que resulta da utilização deste processo. Após contínuoperfusão de solutos marcadas na corrente sanguínea, é possível obter uma sequência de lapso de tempo de uma região de interesse, tal como mostrado na Figura 8b. A intensidade de fluorescência na região de interesse foi medida fora de linha e um modelo matemático utilizado para determinar a permeabilidade da barreira hematoencefálica aos solutos marcado por fluorescência (Figura 8c) 15. A duração média de experimentos para idades P9-P10 é de 2,3 ± 0,8 horas (n = 3 filhotes).
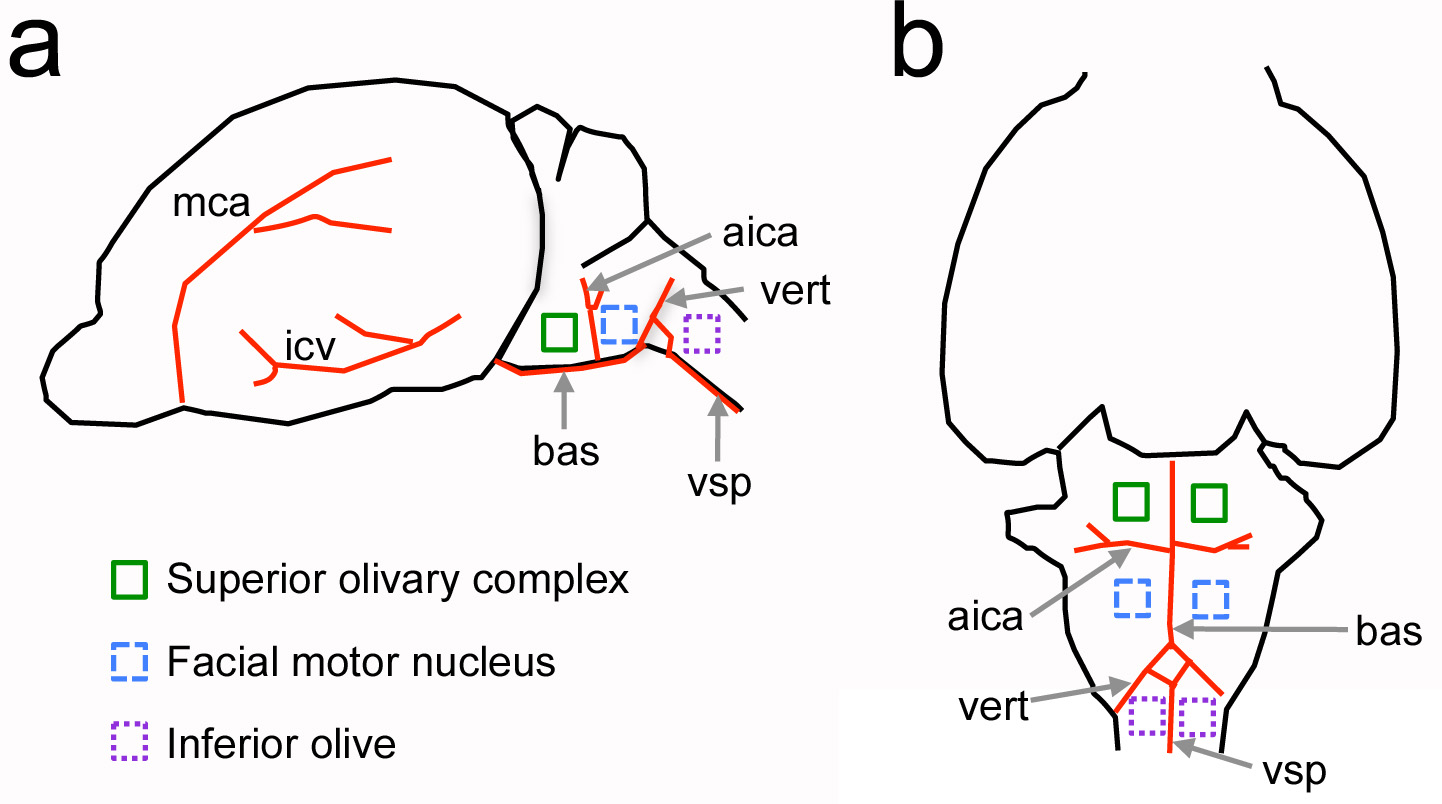
Figura 1. Localização relativa de estruturas neurais do tronco cerebral ventral com relação a marcos vasculatura no rato recém-nascido. Uma, Vista lateral do cérebro. B, vista ventral do cérebro. Grandes vasos sanguíneos são mostradas em estruturas vermelhas e neural de interesse são indicated por quadrados de cor. Não em escala. aica = anterior artéria cerebelar inferior; bas = artéria basilar; ICV = veia cerebral inferior; mca = artéria cerebral média; vert = artéria vertebral; VSP = artéria espinhal ventral. Clique aqui para ver imagem ampliada.

Figura 2. Instalação cirúrgica. Uma, a cirurgia pode ser feito em uma placa de pão pequeno (1) descansando em cima de uma mesa estável. A almofada de aquecimento (2) e um pequeno ventilador para animais (3) pode ser fixado à placa de pão para facilitar a movimentação de toda a preparação, quando necessário. O pequeno ventilador animal pode ser alimentado por uma bateria (4). Um suporte magnético (5) pode ser usado para proteger o cone de nariz usada para entregar o anestésico. O nariz do avião podetambém ajudar a proteger a cabeça em uma posição estável. Se o animal não precisa ser realocados, um micromanipulador (6) pode ser usado para sondas de posição para eletrofisiologia ou experimentos de rastreamento neural. Uma fonte de luz (7) e um estereoscópio (não ilustrado) são necessários para a visualização das estruturas marco durante microcirurgia. B, pequenas tesouras são utilizados no passo 1.4. C, fórceps são utilizados nos passos 1.4, 1.6.1, 1.8 e 1.8.1 . d, tesoura de mola são utilizadas nos passos 1.5, 1.6 e 1.7. electrónicos, dissecando cinzel é utilizado no passo 3.1.2. Barra de escala em e = 1 mm, aplica-se a bd. Clique aqui para ver imagem ampliada.
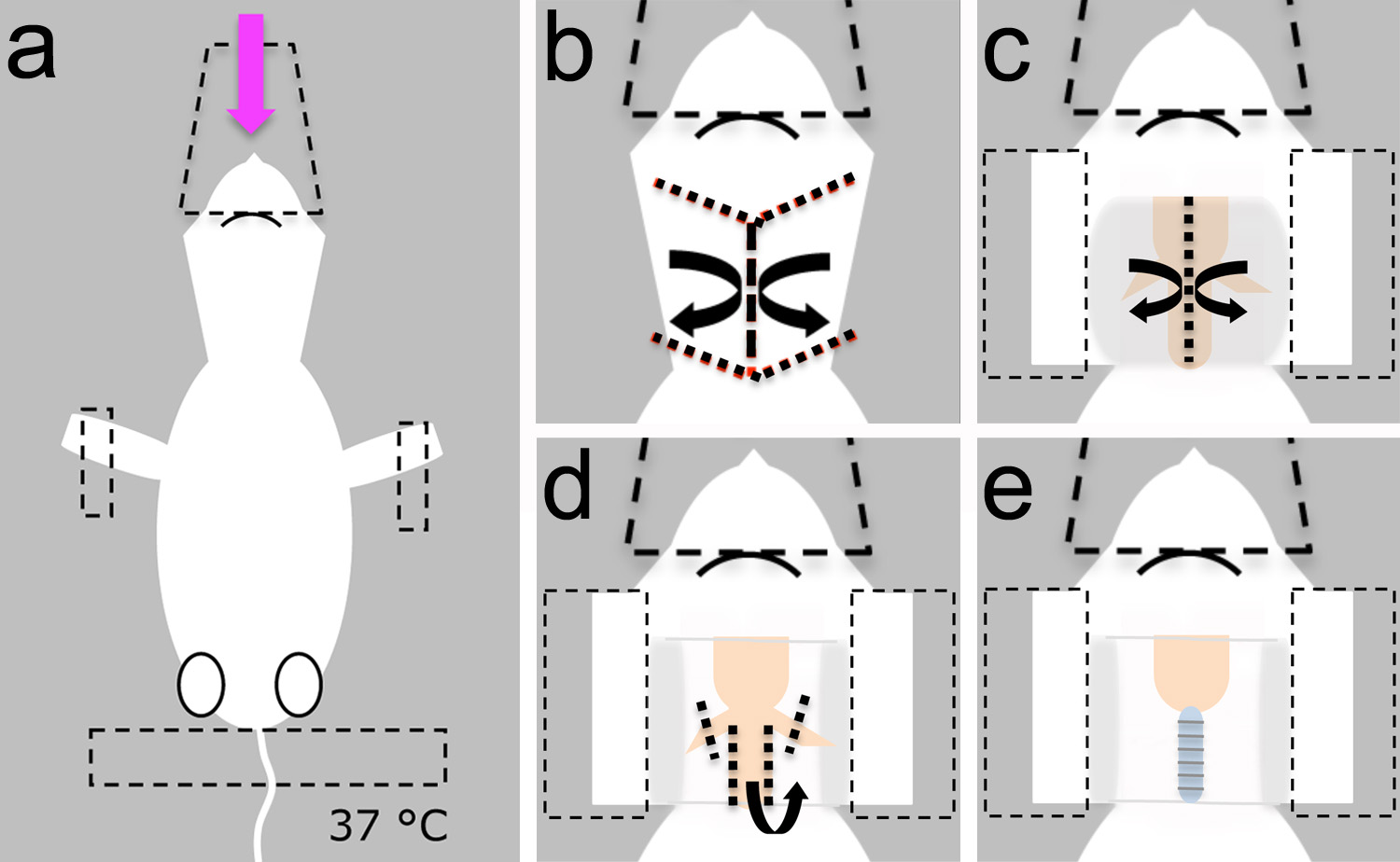
Figura 3. Expor a traquéia para intubação.uma, o animal é anestesiado, colocado na posição de bruços e fixado com o (linhas tracejadas). b cone do nariz e da fita, a pele é cortada e colocada de lado para expor a camada de gordura subjacente. c, A gordura e glândulas sobrejacente (mostrado em cinza) são deixados de lado para expor a traquéia. A fita é usada para proteger a pele sobrejacente (linhas tracejadas). D, A traquéia é dissecada da musculatura. E, Visualização de anéis traqueais indica a remoção bem sucedida do músculo sobrejacente. Clique aqui para ver imagem ampliada.
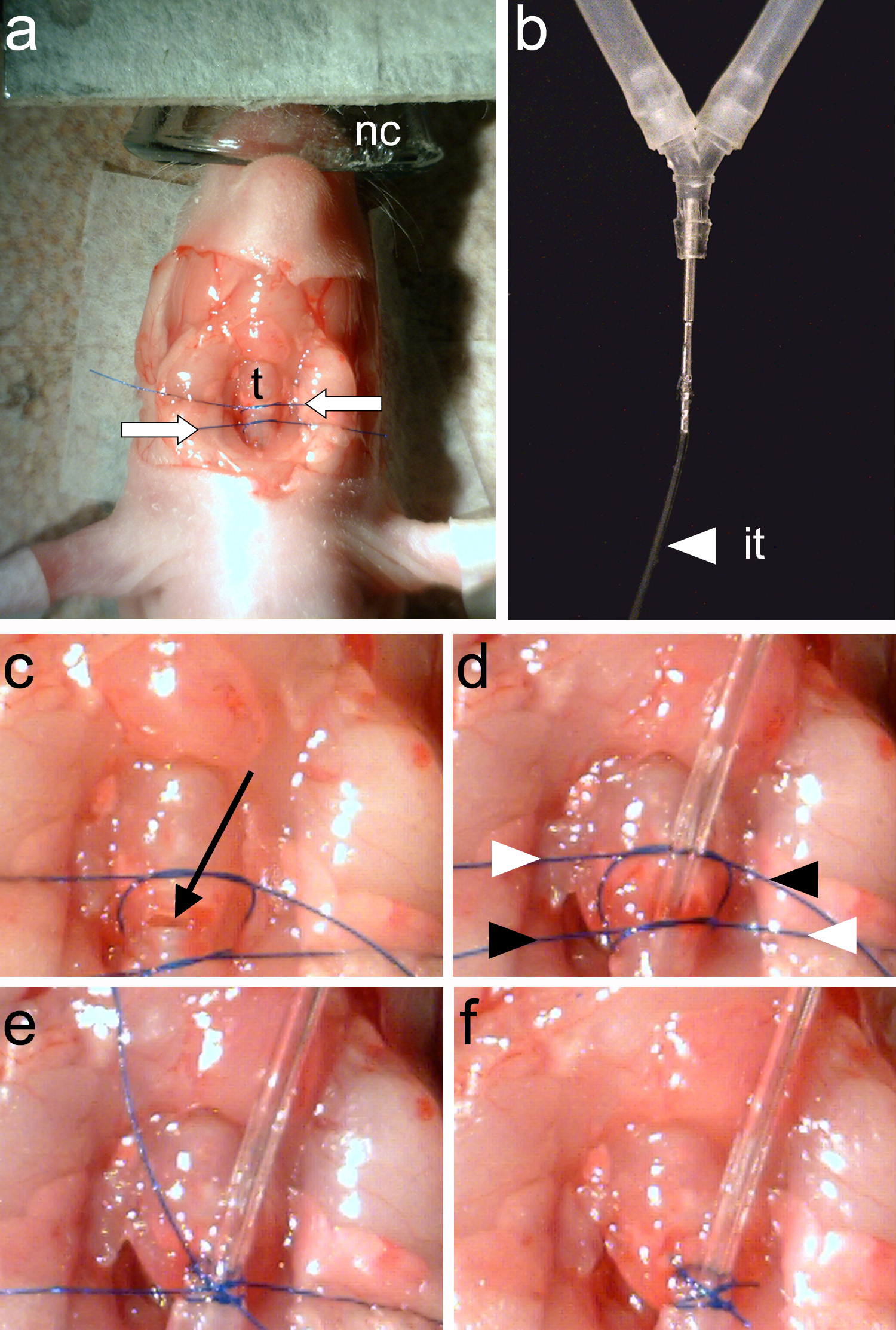
Figura 4. Intubating o animal. Um, dois fios de sutura (setas brancas) são amarrados em torno da traquéia(T). B, O tubo de intubação (it) deve ser firmemente ligado ao tubo y do animal ventilador. C, A traqueostomia é feita entre os dois fios de sutura (seta preta). D, está inserido o tubo de ventilação e dois fios de sutura são apertados. As extremidades dos fios são apertados novamente de forma cruzada (indicado por setas brancas e pretas). E, As terminações de sutura estão atadas. F, As terminações de sutura são aparados e intubação está completa. Clique aqui para ver imagem ampliada.
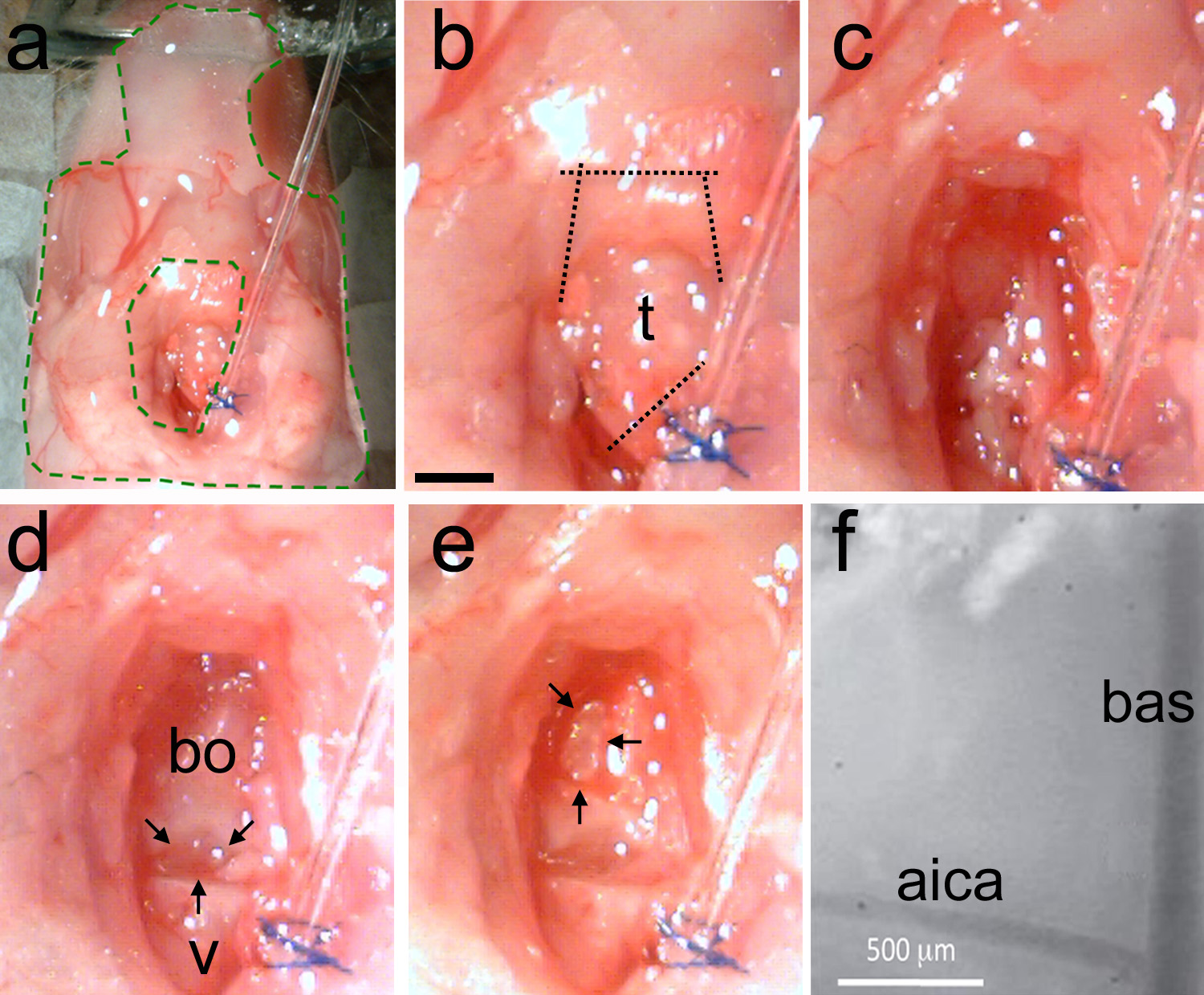
Figura 5. Removendo a traqueia e fazendo a craniotomia. Uma, A preparação é estabilizado com insi elastómero (área verde de linhas tracejadas). b, A traqueia é identificado e, em seguida, os cortes são feitos em primeiro lugar para separar a traqueia de distância a partir do tubo de intubação, e, em seguida, para cortar os músculos mandibulares (linhas pontilhadas). c, limpar a superfície do crânio utilizando romba técnica para remover o músculo e usar papel absorvente para remover a gordura e o sangue. d, Exemplo de uma área limpa mostra a última vértebras (V) e o osso occipital basi-(BO). Há uma lacuna natural entre os dois ossos (setas pretas). E, Usando um limpador ultra-sônico microdrill ou diluir o crânio em forma de D invertido (setas pretas). Gentilmente quebrar o crânio diluído e remover o pedaço de osso. Vasculatura Landmark deve estar visível. F, vista de alta ampliação dos marcos vasculares na superfície do tronco cerebral exposto. Bas = artéria basilar; aica = anterior artéria cerebelar inferior. Barra de escala em b = 1 mm, aplica-se a ce.highres.jpg "target =" _blank "> Clique aqui para ver imagem ampliada.
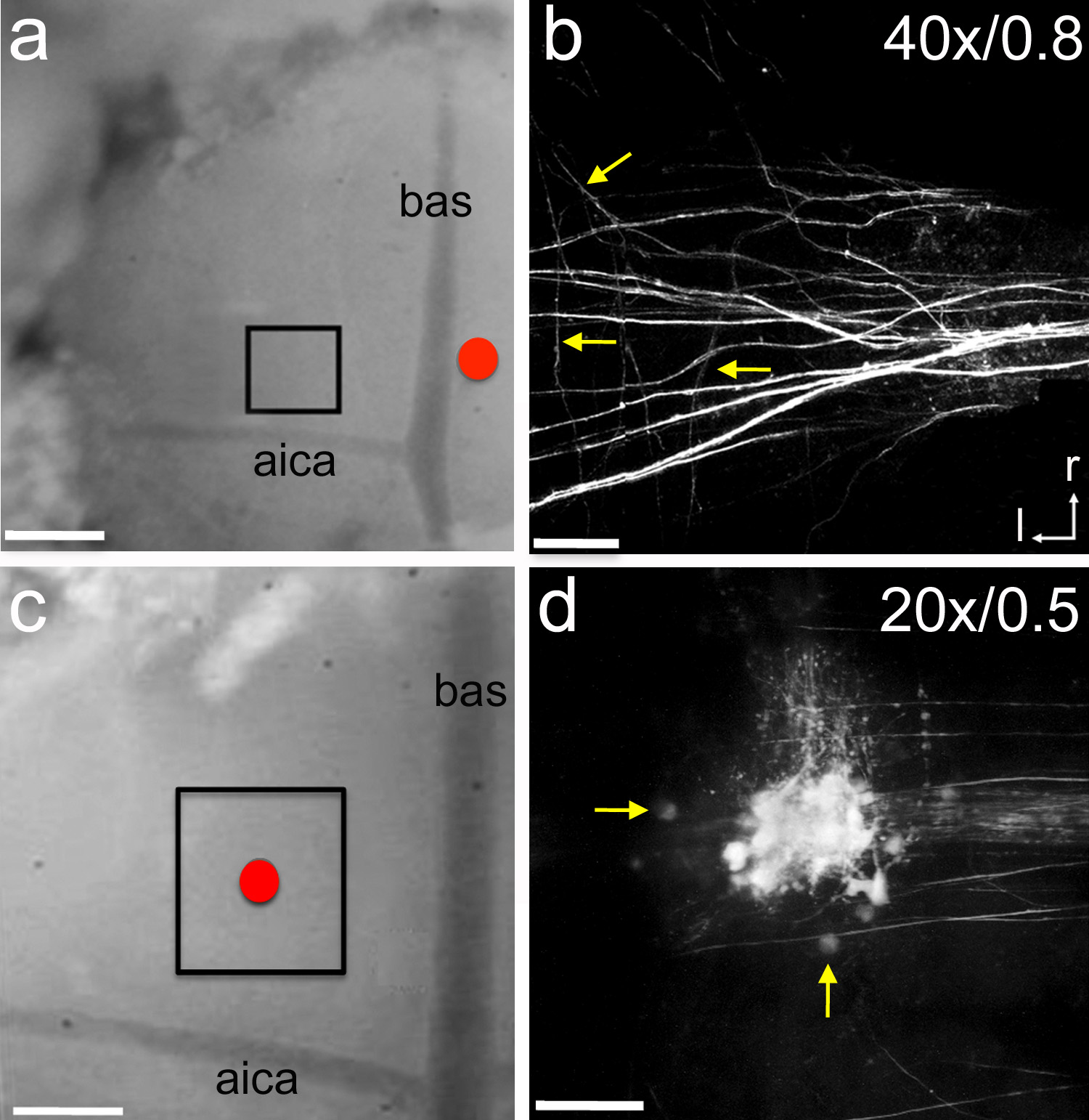
Figura 6. Eletroporação de traçadores neurais. Uma, um eletrodo de vidro contendo o traçador neural micro-rubi foi colocado perto da linha média (círculo vermelho). O marcador foi electroporados usando sete segundo pulsos longo -5 mA entregue cada 14 segundos por 15 minutos. Após 1 hora de tempo de recuperação da área encaixotado foi fotografada com um microscópio de dois fotões. Imagem z-stack Exemplar de aferentes axônio rotulagem no MNTB P1 rato filhote. B,. As setas apontam para ramos colaterais individuais. C, um eletrodo de vidro cheia de micro-rubi foi posicionado no topo da MNTB (círculo vermelho). O marcador foi electroporados usando as mesmas definições descritas em um arquivo. Após 1 hora de tempo de recuperação da área de box erafotografada com um microscópio de dois fotões. Imagem z-stack Exemplar de células marcadas e axônios no MNTB filhote P5 rato. D,. As setas indicam células MNTB individuais. Rótulos em b e c indicam ampliação da objetiva e abertura numérica, respectivamente. A barra de escala em a e c = 300 mm; barra de escala em b = 45 m; barra de escala em d = 90 m. aica = anterior artéria cerebelar inferior; bas = artéria basilar; r = rostral; l = lateral. Clique aqui para ver imagem ampliada.
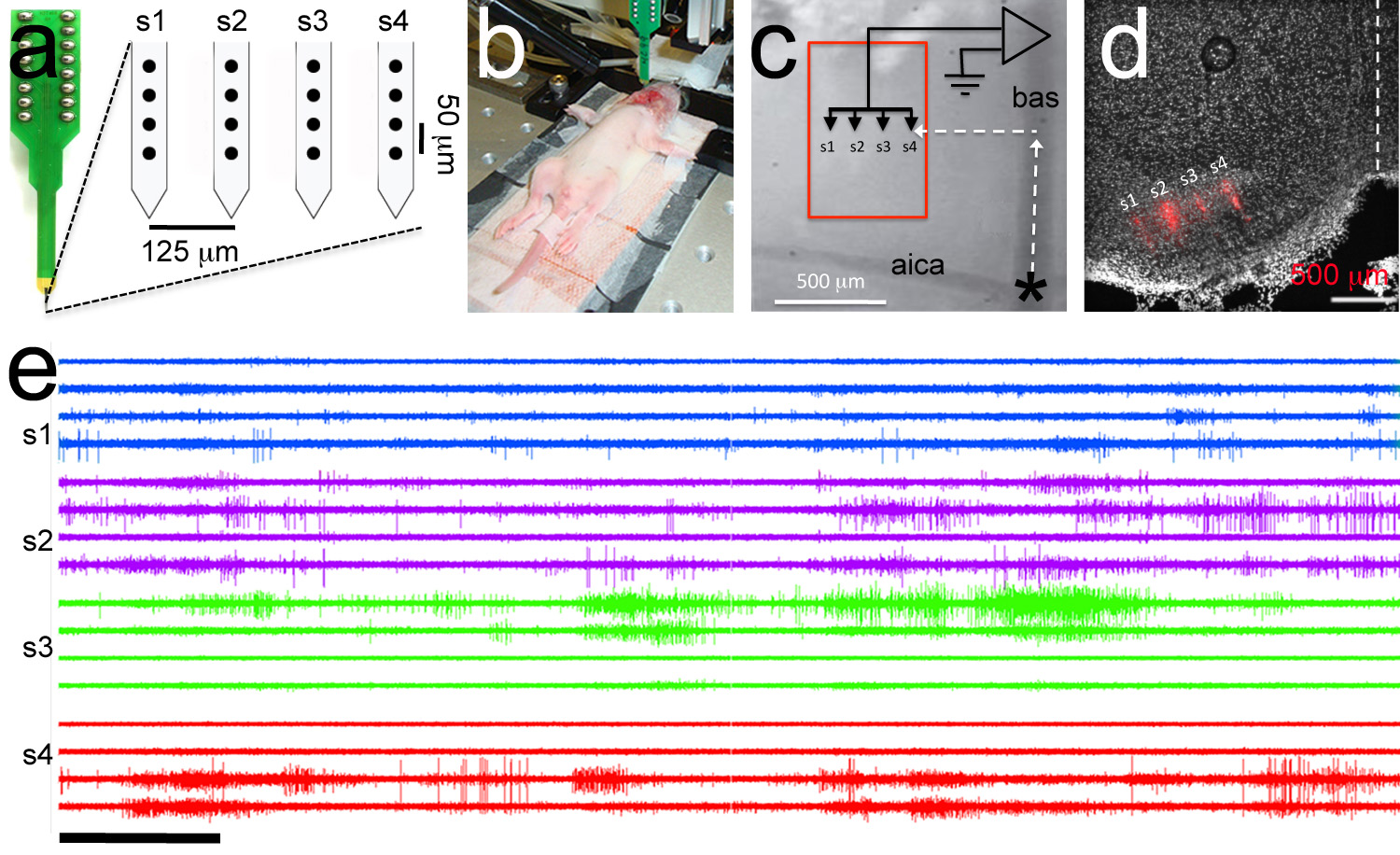
Figura 7. Alvejado gravação polytrode. Uma, Polytrode consiste de 4 hastes com 4 eléctrodos por haste (círculos pretos). São indicados. B distâncias intra-e inter-haste entre os eletrodos, imagem Exemplar de experimento de eletrofisiologia. Um eléctrodo de referência é introduzido na cavidade bucal e uma ploytrode está ligado ao andar de entrada. P6 filhote de rato. C, vista ampliação Superior de marcos vasculatura utilizados para polytrode segmentação. O polytrode é posicionado usando coordenadas rostral-laterais para atingir o núcleo medial do corpo trapezóide (caixa vermelha). D, análise histológica Posthoc demonstra correto direcionamento do polytrode DiI revestido (faixa polytrode é mostrado em vermelho). E, Exemplar múltiplas -unidade de gravação. Ordem de rastreio é a mesma ordem eletrodo em um painel. Dentro de gravações de haste têm a mesma cor. Barra de escala em e = 5 segundos. Clique aqui para ver imagem ampliada.
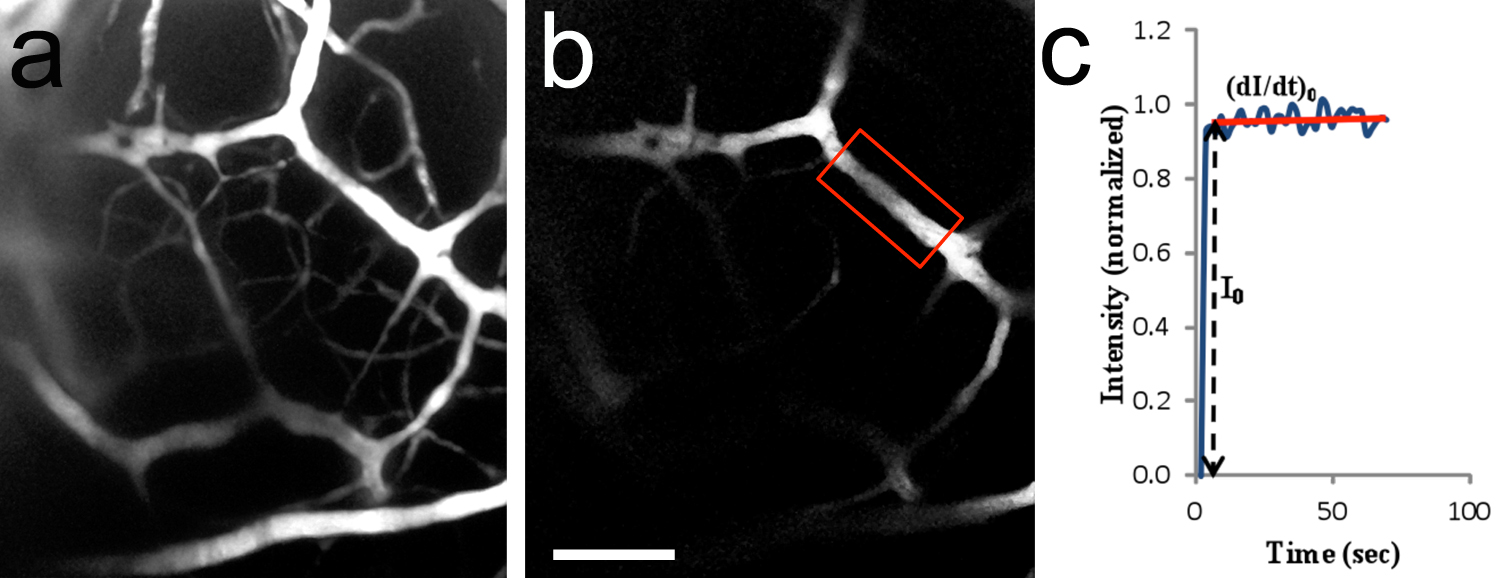
Figura 8. In vivo de dois fotões imagiologia de microvasos cerebrais. um, imagem 2-D (desabou Z-stack) da vasculatura cerebral, após a perfusão de TRITC-dextrano 155 kD na artéria carótida. A área trabalhada é semelhante ao que é mostrado na Figura 7c. 20x/0.5 objetivo de imersão em água. P10 filhote de rato. B, região de interesse (ROI) usado para medir a intensidade de fluorescência (moldura vermelha região em anexo). O microvasos tinha um diâmetro de ~ 14,2 mM e 182 mM foi localizada abaixo da superfície do tronco cerebral. C, a curva típica de intensidade de fluorescência (valor normalizado) como uma função do tempo. I 0 é o passo de aumento da intensidade da fluorescência na ROI quando a solução de fluorescência só enche o lúmen do vaso. (Di / dt) e I 0 0 são usadas para determinar a permeabilidade microvascular ao soluto. A permeabilidade para TRITC-dextrano 155 kDa foi calculada como sendo de 1,5 x 10 -7 cm / seg.Barra de escala em b = 100 mm, aplica-se a. Clique aqui para ver imagem ampliada.
Discussão
O tempo é crítico. Um pesquisador experiente deve ser capaz de completar este protocolo em 1 hora (passos 1-3). Os tempos indicados para as diferentes etapas pressupõem um médio a alto nível de especialização. Traqueostomia e intubação adequada e atempada são fundamentais, uma vez pobre controle de ventilação pode levar à asfixia e morte do animal. Folga cuidadosa dos tecidos musculares e de gordura também é muito importante porque os erros podem levar a hemorragia descontrolada e morte do animal. Da mesma forma, quando se prepara a artéria carótida para a inserção da cânula, é preciso apertar e cortar a artéria com cuidado, se o nó fio fica solto hemorragia descontrolada ocorrerá. Por fim, a craniotomia deve ser feita com cuidado, sem interromper os marcos vasculatura. Remoção Careless da camada meníngea externo (dura) pode levar a hemorragia grave e danos do suprimento arterial.
Configurações de ventilação são escolhidos de acordo com a idade do animal.A maioria dos fornecedores comerciais fornecer informações úteis sobre essas definições. Experimentos em ratos mais velhos do que P15 vai exigir o uso de um grande ventilador animal. Os animais adultos podem não precisar de ventilação se anestesiados com cetamina / xilazina, mas intubação é recomendado para evitar fluido entrar na traquéia.
Uma das principais limitações deste protocolo é que as experiências só podem ser realizadas de forma aguda. Em nosso laboratório temos realizado experimentos com duração entre dois e até dez horas. Uma segunda limitação é que as experiências devem ser realizadas sob anestesia. Portanto, a escolha do anestésico é uma variável importante a ser considerado no planejamento e projeto de experimentos. Uma questão relacionada é que os animais recém-nascidos podem ser particularmente sensíveis a uma overdose. Por exemplo, se a escolha de cetamina / xilazina mix, calcular a dose com base no peso do filhote e administrar medicamentos a ⅓ do volume máximo. Verifique o estado do animal a cada 5-10 minutos por toe pitada resposta. Se estiver usando o isoflurano, as precauções também são necessárias para manter um ambiente seguro para o investigador (ventilação adequada e um vaporizador calibrado corretamente).
A lupa pode ser montado em um suporte flexível para ajustar o ângulo de visualização e facilitar o desembaraço de espaço para colocar eletrodos e deslocalização do animal ao microscópio de dois fotões. A utilização de uma bateria para alimentar o ventilador pode facilitar a movimentação do animal e reduzir artefatos elétricos durante experimentos de eletrofisiologia. Para este fim, uma pequena placa de ensaio (7,5 x 12 polegadas) pode ser utilizado para montar o conjunto do ventilador, a almofada de aquecimento e animais anestesiados (Figura 2a). Uma modificação útil e importante para esta configuração é a adição de um dispositivo para a monitorização de sinais vitais durante a cirurgia. Um oxímetro ou outros dispositivos analógicos podem ser usados, dependendo do orçamento de laboratório.
Este protocolo tem sido utilizado com eletrofisiologia e imagem conhecicochos, incluindo gravações de patch braçadeira 8,10,11, gravações polytrode (Figura 7), e de dois fótons de imagem 9 (Figuras 6 e 8). Uma possível aplicação futura seria combinar esses métodos para direcionar células marcadas com fluorescência para a gravação eletrofisiológico 16.
Novas aplicações de imagem também pode incluir 2-D ou 3-D de séries temporais usando microscopia de dois fótons. Por exemplo, utilizando-se em bolus de indicadores de cálcio para estudar a actividade neuronal do tronco cerebral e populações de células da glia. Como mostrado na Figura 8, uma solução corante injectados na circulação de sangue através da artéria carótida interna pode ser utilizada para gerar imagens de alto contraste da vasculatura cerebral. Como o corante de fluorescência enche o lúmen dos microvasos e espalha-se para dentro do tecido circundante, pode ser usado não só para o cálculo da permeabilidade soluto aparente da barreira hemato-encefálica, mas também o coeficiente de difusão de solutoficiente no tecido cerebral 3. Uma das principais razões para injetar os solutos fluorescente etiquetado através da artéria carótida é que a solução corante pode ir diretamente para os microvasos no cérebro sem ir ao coração pela primeira vez como em uma injeção na veia da cauda. Isto leva, pelo menos, duas vantagens. Uma delas é que a concentração do corante fluorescente no lúmen dos microvasos pode ser praticamente constante, se a taxa de perfusão é fixado no local da punção. Isto garante a determinação precisa da permeabilidade da barreira sangue-cérebro. Outra é que, se um agente de teste é incluído no perfusato, que vai directamente para passar a barreira sangue-cérebro, sem ser diluída ou combinado com outros factores da circulação do corpo.
Novos experimentos poderão usufruir de animais transgênicos com repórteres fluorescentes geneticamente codificados. Isto proporciona a vantagem de que as sondas fluorescentes não devem ser carregado in situ (a menos que a concepção da experiênciaafirma o contrário), economizando tempo e possivelmente permitindo mais preparações intactas (por exemplo, janelas craniano 17).
Finalmente, as experiências podem ser feitas em outras regiões do tronco cerebral, tais como o azeite ou inferior do núcleo motor facial. O conhecimento sobre neuroanatomia e desenvolvimento de populações celulares específicas em uma dada espécie será importante nesse sentido, particularmente como marcos anatômicos podem mudar à medida que os animais crescem (Figura 1). Esperamos que este protocolo incentiva os outros a estudar estruturas do tronco cerebral ventral utilizando em eletrofisiológico vivo e métodos de imagem.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi financiado pela concessão G12-RR003060 do NIH / NCRR / RCMI, conceder SC1HD068129 do Instituto Nacional de Saúde Infantil e Desenvolvimento Humano, National Science Foundation CBET 0.754.158 e PSC-CUNY 62337-00 40 da Universidade da Cidade de Nova Eunice Shriver Iorque.
Materiais
| Name | Company | Catalog Number | Comments |
| Absorbant pads | Kettenbach | Sugi 31603 | Other options may be available from different companies |
| Cautery | Braintree Scientific, INC | GEM 5917 | Other options may be available from different companies |
| Tetramethyl rhodamine Isothiocyanate dextran | Sigma | T1287-500MG | Other options may be available from different companies |
| Dissecting Chisel | Fine Science Tools | 10095-12 | Other options may be available from different companies |
| DiI | Invitrogen | V-22885 | Other options may be available from different companies |
| Elastomer | World Precision Instruments | KWIK-SIL | Other options may be available from different companies |
| Fine Scissors | Fine Science Tools | 14060-09 | Other options may be available from different companies |
| Forceps | Fine Science Tools | 11027-12,11617-12, 11616-16 | Other options may be available from different companies |
| Spring Scissors | Fine Science Tools | 15009-08 | Other options may be available from different companies |
| Heating pad | FHC | 40-90-2 | Other options may be available from different companies |
| Intubation tubing | Braintree Scientific, INC | BIO CO-KIT | Choose age appropriate size |
| Light source | Spach Optics | Schott Ace illuminator | Other options may be available from different companies |
| Micro drill | Braintree Scientific, INC | MD-1200 120V | Other options may be available from different companies |
| Paper tape | Walgreens | Generic brand | Other options may be available from different companies |
| Syringe filter | VWR | 28145-483 | Other options may be available from different companies |
| Syringe pump | VWR | 52459-008 | Other options may be available from different companies |
| Stereomicroscope | Olympus | SZ61 | Other options may be available from different companies |
| Suture | Ethicon | Prolene 86979 | 6-0 size |
| Tubing | Braintree Scientific, INC | Micro-Renathane (MRE033); SUBL-120 | Other options depending on pup’s age |
| Vaporizer (isoflurane) | Vetequip Incorporated | 911103 | Other options may be available from different companies |
| Ventilator (minivent) | Harvard Apparatus | 730043 | Use for P0-P12 rats |
Referências
- Kerr, J. N. D., Denk, W. Imaging in vivo: watching the brain in action. Nat. Rev. Neurosci. 9 (3), 195-205 (2008).
- Sigler, A., Murphy, T. H. In vivo 2-photon imaging of fine structure in the rodent brain: before, during, and after stroke. Stroke. 41 (10), 117-123 (2010).
- Shi, L., Zeng, M., Sun, Y., Fu, B. M. Quantification of blood-brain barrier solute permeability and brain transport by multiphoton microscopy. ASME J. of Biomech. Eng. 136 (3), 031005-031005 (2014).
- Galambos, R., Schwartzkopff, J., Rupert, A. Microelectrode study of superior olivary nuclei. Am. J. Physiol. 197, 527-536 (1959).
- Goldberg, J., Brown, P. B. Response of binaural neurons of dog superior olivary complex to dichotic tonal stimuli: some physiological mechanisms of sound localization. J. Neurophysiol. 32 (4), 613-636 (1969).
- Guinan, J. J., Guinan, S. S., Norris, B. E. Single auditory units in the superior olivary complex I: responses to sounds and classifications based on physiological properties. Intern. J. Neurosci. 4, 101-120 (1972).
- Spirou, G. A., Brownell, W. E., Zidanic, M. Recordings from cat trapezoid body and HRP labeling of globular bushy cell axons. J. Neurophysiol. 63 (5), 1169-1190 (1990).
- Khosrovani, S., Der Giessen, R. S. V. a. n., De Zeeuw, C. I., De Jeu, M. T. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proc. Natl. Acad. Sci. U.S.A. 104 (40), 15911-15916 (2007).
- Rodríguez-Contreras, A., Van Hoeve, J. S., Habets, R. L., Locher, H., Borst, J. G. G. Dynamic development of the calyx of Held synapse. Proc. Natl. Acad. Sci. U.S.A. 105 (14), 5603-5608 (2008).
- Lorteije, J. A., Rusu, S. I., Kushmerick, C., Borst, J. G. G. Reliability and precision of the mouse calyx of Held synapse. J. Neurosci. 29 (44), 13770-13784 (2009).
- Tritsch, N. X., Rodríguez-Contreras, A., Crins, T. T., Wang, H. C., Borst, J. G. G., Bergles, D. E. Calcium action potentials in hair cells pattern auditory neuron activity before hearing onset. Nat. Neurosci. 13 (9), 1050-1052 (2010).
- Tong, H., Steinert, J. R., Robinson, S. W., Chernova, T., Read, D. J., Oliver, D. L., Forsythe, I. D. Regulation of Kv channel expression and neuronal excitability in rat medial nucleus of the trapezoid body maintained in organotypic culture. J. Physiol. 588 (9), 1451-1468 (2010).
- Sonntag, M., Englitz, B., Kopp-Scheinpflug, C., Rübsamen, R. Early postnatal development of spontaneous and acoustically evoked discharge activity of principal cells of the medial nucleus of the trapezoid body: an in vivo study in mice). J. Neurosci. 29 (30), 9510-9520 (2008).
- García-Villalón, A. L., Roda, J. M., Alvarez, F., Gómez, B., Diéguez, G. Carotid blood flow in anesthetized rats: effects of carotid ligation and anastomosis. Microsurgery. 13 (5), 258-261 (1992).
- Yuan, W., Lv, Y., Zeng, M., Fu, B. M. Non-invasive method for the measurement of solute permeability of rat pial microvessels. Microvasc. Res. 77 (2), 166-173 (2009).
- Kitamura, K., Judkewitz, B., Kano, M., Denk, W., Haüsser, M. Targeted patch-clamp recordings and single-cell electroporation of unlabeled neurons in vivo. Nat. Methods. 5 (1), 61-67 (2008).
- Mostany, R., Portera-Cailliau, C. A method for 2-photon imaging of blood flow in the neocortex through a cranial window. J. Vis. Exp. (12), (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados