Method Article
新生児げっ歯類の腹スカルに開頭術を行うには方法
要約
外科的方法は、新生児ラットにおいて腹側頭骨を露出させるために記載されている。このアプローチを使用すると、麻酔仔の脳幹における急性電気生理学及び二光子顕微鏡実験を行うために開頭術を開くことが可能である。
要約
in vivo実験のために開頭の使用は、成人期に、哺乳動物の脳内に、開発時に多様な細胞過程の動態を調査する機会を提供する。 インビボアプローチでは、最も背側に位置する脳の領域を研究するために開頭術を使用しているが、腹側に位置するような橋のような脳幹領域は、比較的代役残る。このプロトコルの主な目標は、電気生理学的およびイメージングの方法を用いてin vivoで試験することができるように、腹側脳幹構造体へのアクセスを容易にすることである。このアプローチは、長い範囲の軸索、単一細胞のアンサンブルにおける電気的活動のパターン、および新生児動物における血液脳関門の透過性の変化における構造変化の研究を可能にする。このプロトコルは、新生児ラットにおいて聴性脳幹を研究するために主に使用されてきたが、それは容易に、例えば、新生児マウスのような他のげっ歯類での研究に適合させることができる、成体ローデンTSと他の脳幹領域。
概要
蛍光イメージングおよび電気生理学の技術と組み合わせて開頭術の使用は、監視血流、血液脳関門透過性および生きた動物1-3のニューロンおよびグリア細胞の活性を測定することを可能にする。いくつかの研究室では、健康と病気の状態の脳生理学への洞察を提供するために、このアプローチを使用しているが、ギャップがこれらのプロセスは、開発中に発生するかについての我々の理解にとどまる。さらに、ほとんどの研究は、多様な生理的役割を有する腹側脳幹構造はex vivoでのアプローチを用いて主に研究されているように、頭蓋骨の背側表面から容易にアクセス可能である脳領域に焦点を当てている。
このプロトコルの主な目的は、齧歯動物の腹側頭骨に開頭術を開くための方法を提供することである。このアプローチは、このような感覚神経生理学のRECOのための犬や猫などの大型哺乳類で行われ、古典的研究から適応されました聴性脳幹4-7のrdings。このプロトコルではしかしながら、新生児動物において処置を行うの新規な課題がある。血管系のランドマークを使用して、この適応プロトコルは、新生児ラット、成体マウスおよび下オリーブ8月11日 ( 図1)のような他の脳幹領域の聴性脳幹を研究するために以前に使用されています。
腹側脳幹核を研究するために、既存の方法よりも腹側開頭術の主な利点は、生きている動物への関心の構造に直接アクセスを提供することである。例えば、上オリーブ複合体の聴細胞、プローブの標的の配置および撮像深さは0.5 [mm]に限定することができる二光子イメージングアプローチを使用するために重要である脳表面から数十マイクロメートルに局在している光組織の散乱·吸収。腹開頭もWH、比較的無傷で神経接続と準備を提供していますICHは、急性および器官スライス標本12で破壊されています。 in vivoでの神経生理学実験13のための他のプロトコルとは対照的に、腹側アプローチは、細胞アンサンブル( 図6および7)についての情報を提供する多電極記録及び撮像方法と組み合わせることができる。最後に、このプロトコルと組み合わせて、蛍光標識された溶質を溶質の血液脳関門の透過性の変化( 図8)を測定する脈管構造に注入することができる。
プロトコル
次のプロトコルは、ニューヨーク市立大学の施設内動物管理使用委員会(IACUC)によって確立された動物のケアのガイドラインに従っています。
1。動物挿管(10〜20分)
- 手術前に、哺乳類リンゲル液を調製する。手術器具、加熱パッド、およびベンチで小動物人工呼吸器( 図2)を構築。
- 血液脳関門の透過性の測定のためにリンガー中の1%ウシ血清アルブミン(BSA)溶液10mlを作成し、1%BSA溶液を、25mmのシリンジフィルター(0.2μmのフィルタ液中の8ミリグラム/ mlでTRITC-デキストラン155 kDのを溶解孔径)し、暗所での箔で覆われた注射器に保管してください。
- イソフルランを用いた動物を麻酔。誘導および維持のための1.5から3.0パーセントのために5.0%を使用してください。あるいはケタミン(41.7 mg / kgで)およびキシラジン(2.5 mg / kg体重)の混合物を使用することができる。麻酔の深さは、つま先のピンチ反射のことでチェックできます上下肢。
- ケタミン(41.7 mg / kg体重)およびキシラジン(2.3 mg / kg体重)のその後の用量は、過剰投与を避けるために最大用量の⅓単位で投与されるべきである。げっ歯類の人工呼吸器の使用は、キシラジン誘発の呼吸抑制に対抗することをお勧めします。
- その背側に横たわって麻酔をかけた子犬を置き、麻酔( 図3a)を配信するために使用されるプラスチックのコーンと頭を固定します。
- 前肢と尾( 図3a)に粘着テープで動物を固定します。
- 子犬の頭を固定する代替方法は、金属棒に取り付けられたヘッドプレートを使用することである。
注 :加熱パッドは低体温( 図3a)を避けるために、37℃に設定されていることを確認してください。
- (首を覆う皮膚に1縦方向および横方向の4切開を作るためにハサミ( 図2b)を使用して、図3b)。鈍技術を使用して、皮膚を解剖し、鉗子( 図2Cおよび3C)を使用して脇に置きます。
- 粘着テープを用いて皮膚を押したままにします。水平位置( 図3c)でヘッドを安定させる。
- 春のはさみ( 図2d)とブラント技術を使用して、気管( 図3c)を露出するために確保腺と脂肪層を押してください。頸動脈の位置を特定します。
- 気管から頸動脈を遠ざけること。
注 :頸動脈を穿刺すると、子犬の大量の失血と死に至ることができます。
- 気管から頸動脈を遠ざけること。
- 春のはさみを使用して( 図2d)、気管をカバー縦走筋を解剖。気管( 図3d)の下にある縦方向の筋を切った。
注 :気管リングは( 図3e)は明らかに見えるはずです。- 使い方鉗子( 図2C)、気管の周りの縫合糸の2枚を接続します。縫合糸の一枚は換気チューブを固定し、第二のねじ山は、換気チューブの挿入ポイント( 図4a)に気管吻側を閉じるために使用される。
注意 :湿らせ、脱水を防ぐためにリンゲル液と定期的に組織を暴露した。
- 使い方鉗子( 図2C)、気管の周りの縫合糸の2枚を接続します。縫合糸の一枚は換気チューブを固定し、第二のねじ山は、換気チューブの挿入ポイント( 図4a)に気管吻側を閉じるために使用される。
- 春のはさみを使用した( 図2d)ステップ1.6.1( 図4c)に配置された二つのスレッドの間に位置し、気管リングの1に切り込みを入れる。
注 :流体が開いて気管に入らないようにしてください。気管内の流体は、窒息の原因となります。 - 気管に挿管チューブ( 図4b)を挿入し、それを固定するための下糸を締めます。ピンセットを用いて( 図2C)、挿管チューブの挿入ポイントに気管後部を閉じるには、上糸を締めます。
- TighteNと2スレッド( 図4D-F)の端をトリミングします。
注 : 挿管チューブ内部の蒸気は、気流制御の良い兆候です。
- TighteNと2スレッド( 図4D-F)の端をトリミングします。
- 速やかに人工呼吸器にイソフルラン供給に切り替える。動物の体重に応じて拍出量と換気率を調整します。
- エラストマー( 図5a)で公開される周囲の組織をシール。湿らせた、清潔な表面を保ちます。
2。気管および筋肉の取り外し頭蓋骨を露出させ(5〜10分)
- 換気チューブに隣接して気管をカットする春のはさみ( 図2d)を使用します。口蓋( 図5b)の尾の端を露出するために口腔の筋肉壁に沿って2つのカットを行う。
注 :必要に応じて、出血を止めるために焼灼器を使用しています。制御不能な出血は、動物の死の原因となります。 - クリーンリンゲル液の大量を使用してエリア( 図5c)。最後の脊椎とバシ後頭の骨(図5d)との間のギャップを識別します。
注意 :骨の間のギャップは脳幹の構造を特定する便利な頭蓋骨のランドマークとなっています。下オリーブは、このギャップの下に位置しています。聴覚上オリーブ複合体( 図1も参照)は、この隙間から頭側方向にバシ後頭の骨の下に位置しています。 - 鉗子( 図2c)と春のはさみ( 図2d)を使用してエリアを清掃してください。血管穴を開けたりしないでください。
注 :必要に応じて、出血を止めるために焼灼する。- 露出面積が脂肪と筋肉組織のクリーンされた後、バシ後頭の骨と最後の脊椎骨を分離する空間が目に見える( 図5d)である必要があります。
3。開頭術(15〜30分)
- マイクロドリルまたは超を使用ソニッククレンザー。水疱の内側の壁の位置を確認します。
- 根底にある動脈が( 図5e)表示されるまで反転次元形状とすることにより、薄い頭蓋骨。
注 :脳底動脈(BAS)は脳幹の正中線の上で実行されます。前下小脳動脈(AICA)支店両側性で、それを別の動物での一定の位置を持っているようにランドマークとして信頼して使用することができます。 - 頭蓋骨を薄くすると、静かに解剖チゼル( 図2e)を使用して、それを破る。鉗子で骨片( 図2c)を取り外します。別の方法として、リフト、曲がった針を用いて頭蓋骨を破る。
注意 :開頭の大きさや形状は、計画の実験に適しているまでこの手順を繰り返します。 BASとAICAは硬膜膜( 図5F)を介して表示されるはずです。
- 根底にある動脈が( 図5e)表示されるまで反転次元形状とすることにより、薄い頭蓋骨。
- 地域の新鮮なリンゲル液で数回清掃してください。吸収性PAを使用したDSは硬膜膜の表面を乾燥させます。
- 必要に応じて、画期的な動脈のBASとAICAを変位または壊すことなく、硬膜膜を除去して縫合針を使用しています。
注意 :脳脊髄液を穿刺硬膜が流出する際に。リンゲル液で領域をきれいにし、実験を通して湿らせておく。
- 必要に応じて、画期的な動脈のBASとAICAを変位または壊すことなく、硬膜膜を除去して縫合針を使用しています。
4。電気生理学実験
- 実験の設計( 図7a)に従ってpolytrodeを選択します。のDiIでpolytrodeをコーティングするために細い絵筆を使用してください。 1 mlのマイクロチューブにのDiI液を移し、溶液中絵筆を浸し、軽く(ステレオスコープを使用してIE)視覚的な指導の下polytrodeを打つ。プローブの先端から開始し、慎重にすべての電極が均一に塗布されるまで継続する。
- 口腔内部の接地電極を配置します。電極ホルダー( 図7bにpolytrodeを読み込む)。
- アンプの電源を入れ、すべての接続がうまく機能することを確認してください。
- AICA(ポジションゼロ)の分岐点にBAS上記の電極を配置します。適切な吻側横座標( 図7c)を使用して、所望の目標ポイントに電極を移動します。
- 脳の表面に電極を配置し、5〜10ミクロンのステップで所望の深さに移動します。
- 実験計画に応じて記録を行う。さらなる分析のためにデータを保存します。
5。二光子イメージング実験
- 顕微鏡の電源をオンにします。励起波長を設定し、適切な発光フィルターを使用しています。 800nmにおける励起およびTRITC-デキストランを画像化するためのウェル607±45nmのバンドパス放射フィルタの仕事。
- 右または左の頸動脈を識別します。平滑技術を用いて、隣接結合組織又は神経から頸動脈を切開。
- 頸動脈を選ぶとホールド止血鉗子で動脈。頸動脈の周りに縫合糸の3個を接続します。
- 血液の流れを停止し、緩んその他2のスレッドを残す近い心臓側へ糸を締めます。
- 縛らスレッドと次の緩いスレッド間の頸動脈に45°の角度で小さなカットを作るために細かいハサミを使用しています。
注意 :吸収紙で血をきれいにします。
- 頸動脈にカニューレを挿入。約5ミリメートルの深子犬の頭を志向頸動脈上のカットにTRITC-デキストラン溶液を充填し、チューブを挿入します。
- 一緒にチューブと動脈を保持するために動脈の周りの他の二つのスレッドを締めます。スレッドを締めトリミングし、さらに安定させるためにエラストマーを追加します。
注意 :チューブのもう一方の側は(ステップ1.1で調製した)TRITC-デキストラン溶液を含む注射器に接続されている。
- 一緒にチューブと動脈を保持するために動脈の周りの他の二つのスレッドを締めます。スレッドを締めトリミングし、さらに安定させるためにエラストマーを追加します。
- シリンジポンプにシリンジを固定します。
- セット子犬の頚動脈血流量の速度。数秒間、シリンジポンプの電源を入れ、色素溶液を頸動脈に注入することができることを手動で確認してください。注:成体ラット(240-g)を頸動脈内の血液流量を約3ml /分で14、ラットの仔(15〜25グラム体重例えば、P10仔)のための血液流量を算出することができると仮定すると0.16-0.3 ml /分の範囲。
- 顕微鏡の対物レンズの下に動物を配置します。血流に蛍光デキストランを注入する。
- 5Xエアを目的とし、腹側脳幹に関心のある分野を特定する。関心領域(ROI)を集中させる20Xや40X目標(浸水、NA = 0.5または0.8、それぞれ)に切り替えます。
- 撮像を開始して、ROIの脈管構造における蛍光強度が最適化されるまで画像取得パラメータ( 例えば、露光時間、レーザパワー、検出器利得)を調整する( すなわち、低すぎないが、飽和しないように)。
- 頸動脈に色素溶液を注入し、固定焦点面に時系列を取得するためにシリンジポンプの電源をオンにします。
6。動物実験は、以下の手順
- これは、端末の手順である。実験動物の最後に、ペントバルビタールの過剰摂取(100 mg / kgで、腹腔内注射)またはアメリカ獣医師会安楽死ガイドラインが承認した安楽死の他の方法で安楽死させなければなりません。
注意 :灌流がリンガー溶液で心臓を固定溶液に続いて、さらに組織学的分析のために推奨されます。
結果
神経トレーサーのエレクトロポレーション
台形体(MNTB)の内側核は、このプロトコルを使用して、以前に検討されている上オリーブ複合体中のセルのグループである。例えば、パッチクランプピペットは、神経トレーサー( 図6)9 を電気穿孔するために使用することができる。 図6aに示すように、ピペットは、正中線の近くに配置されている場合、結果はdecussating求心性軸索が標識されることである。高開口数水浸対物レンズを装備した二光子顕微鏡は、非常に微細な側副枝( 図6bの矢印)を含むMNTBに到達画像繊維に使用することができる。 図6cに示されるように、神経トレーサーはまた、直接MNTBに送達することができる。結果は、下側開口数水浸対物レンズ( 図6d)により撮像して理解できるように、MNTB細胞および求心性軸索の標識である。 M低倍率の対物レンズを用いてのアインの利点は、より広い視野を検査することができることであり、これは、より低い客観的な開口数に空間分解能の低下をもたらすものの、個々のMNTB細胞がウェル( 図6dの矢印)を識別することができる。年齢P1〜P5のため、これらの実験の平均期間は3.1±1.4時間(N = 22匹)である。
電気生理学の録音
自発的なバースト発火は11,13難聴の発症前に、単一MNTB細胞で観察発達電気的活動の一形態である。この外科用プロトコルを使用すると、それはMNTB(図7a-b)のに多極アレイ(polytrodes)を標的とすることも可能である。結果はMNTB細胞のアンサンブルの自発活動の記録である。 図7eは 、P6ラットからの代表的なpolytrode記録を示しています。この実験では、polytrodeを用いて親油性色素DiIで被覆した細い絵筆(ステップ4.1を参照)。記録を行った後に脳を組織学的分析のために処理したDiI標識polytrodeトラックの位置がMNTB( 図7d)に適切なターゲティングを確認した。年齢P1〜P6のための実験の平均期間は2.0±0.7時間(N = 33匹)である。
微小血管透過性を測定する
このプロトコルはまた、血管透過性の2光子イメージング実験を行うために使用することができる。蛍光溶質(TRITC-デキストラン、MW 155 kDの、ストークス半径〜8.5 nm)の1%BSAリンゲル液に溶解し、頸動脈14内に挿入されたカニューレを介して脳循環に注入した。尾静脈注射とは異なり、この手順では、心をバイパスし、直接脳の微小循環への蛍光溶質を導入しています。図8aは、この手順を使用することから生じる血管系の標識の品質を示す。連続した後図8bに示すように、血流中への標識された溶質の灌流は、それは、関心領域の経時的配列を得ることができる。関心領域内の総蛍光強度をオフラインで測定され、数学的モデルは、蛍光( 図8c)15溶質を標識するために、血液脳関門透過性を決定するために使用された。年齢のP9-P10のための実験の平均期間は2.3±0.8時間(N = 3匹)である。
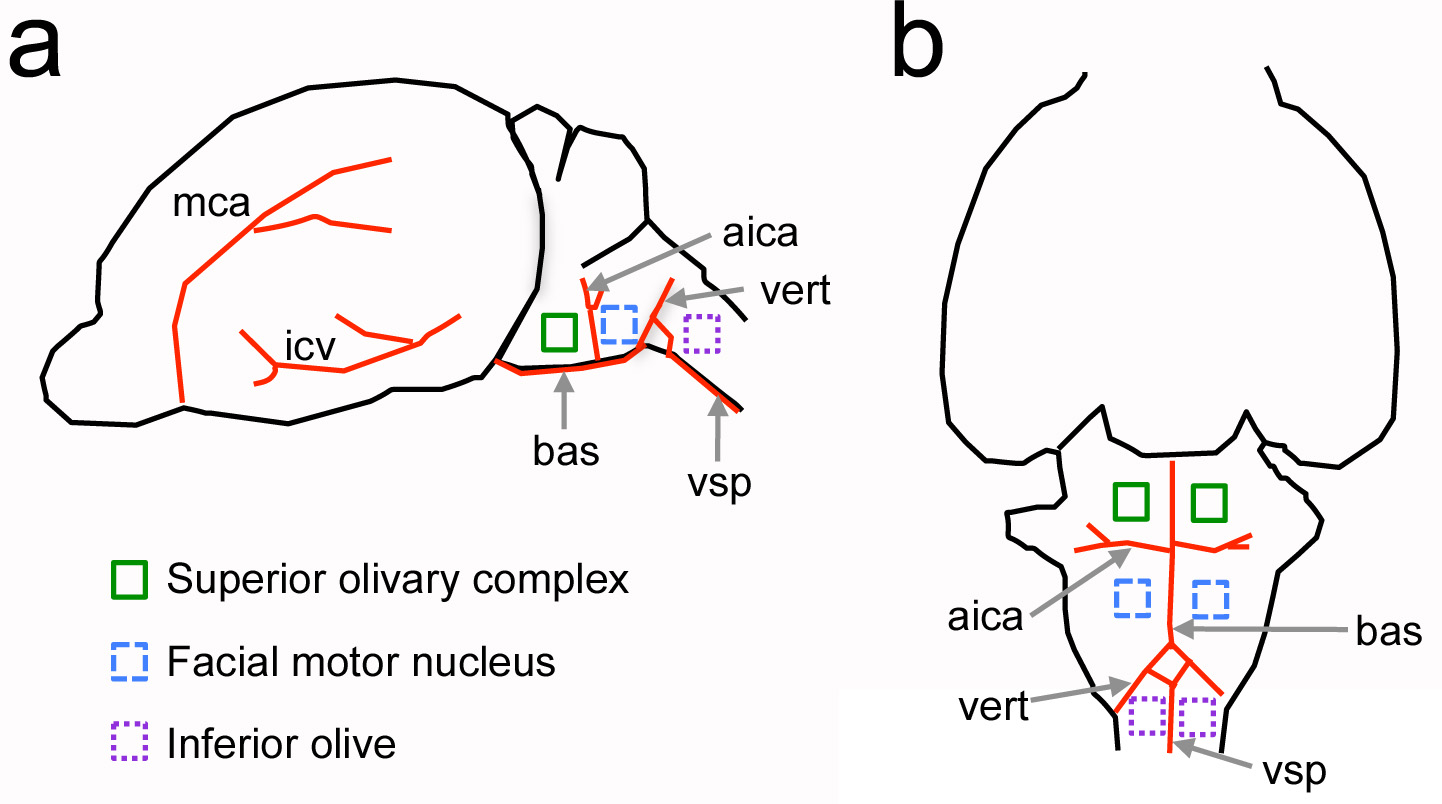
図1。新生児ラットにおける血管系のランドマークに関して腹側脳幹神経構造の相対的な位置。脳の側面図。B、脳の腹側を見る。主要な血管は、目的の赤色及び神経構造に示されているインドールであるカラー四角でicated。スケールで描かれていない。 AICA =前下小脳動脈; BAS =脳底動脈; ICV =下大脳静脈; MCA =中大脳動脈; VERT =椎骨動脈; VSP =腹側脊髄動脈。 拡大画像を表示するにはここをクリックしてください。

図2。手術のセットアップ。、手術は(1)安定したテーブルトップの上に載っ小さなブレッドボード上で行うことができます。加熱パッド(2)及び小動物人工呼吸器(3)必要なときに全体の製造を容易にするために移動させるブレッドボードに固定することができる。小動物人工呼吸器がバッテリーで駆動することができます(4)。マグネットホルダー(5)麻酔薬を送達するために使用ノーズコーンを固定するために使用することができる。ノーズコーン缶また、安定した位置にヘッドを固定するのに役立ちます。動物を再配置する必要がない場合、マイクロマニピュレーター(6)電気生理学または神経トレーシング実験に位置プローブに使用することができる。光源(7)及びステレオスコープ(図示せず)は、顕微手術中にランドマークの構造を可視化するために必要である。B、小さなはさみは、ステップ1.4において使用される。cの鉗子は、ステップ1.4、1.6.1、1.8および1.8.1で使用されているするd、スプリングのはさみはステップ1.5、1.6および1.7(e)に使用される、解剖刀、ステップ3.1.2で使用される。 E = 1ミリメートル中のスケールバーは、BDに適用されます。 拡大画像を表示するにはここをクリックしてください。
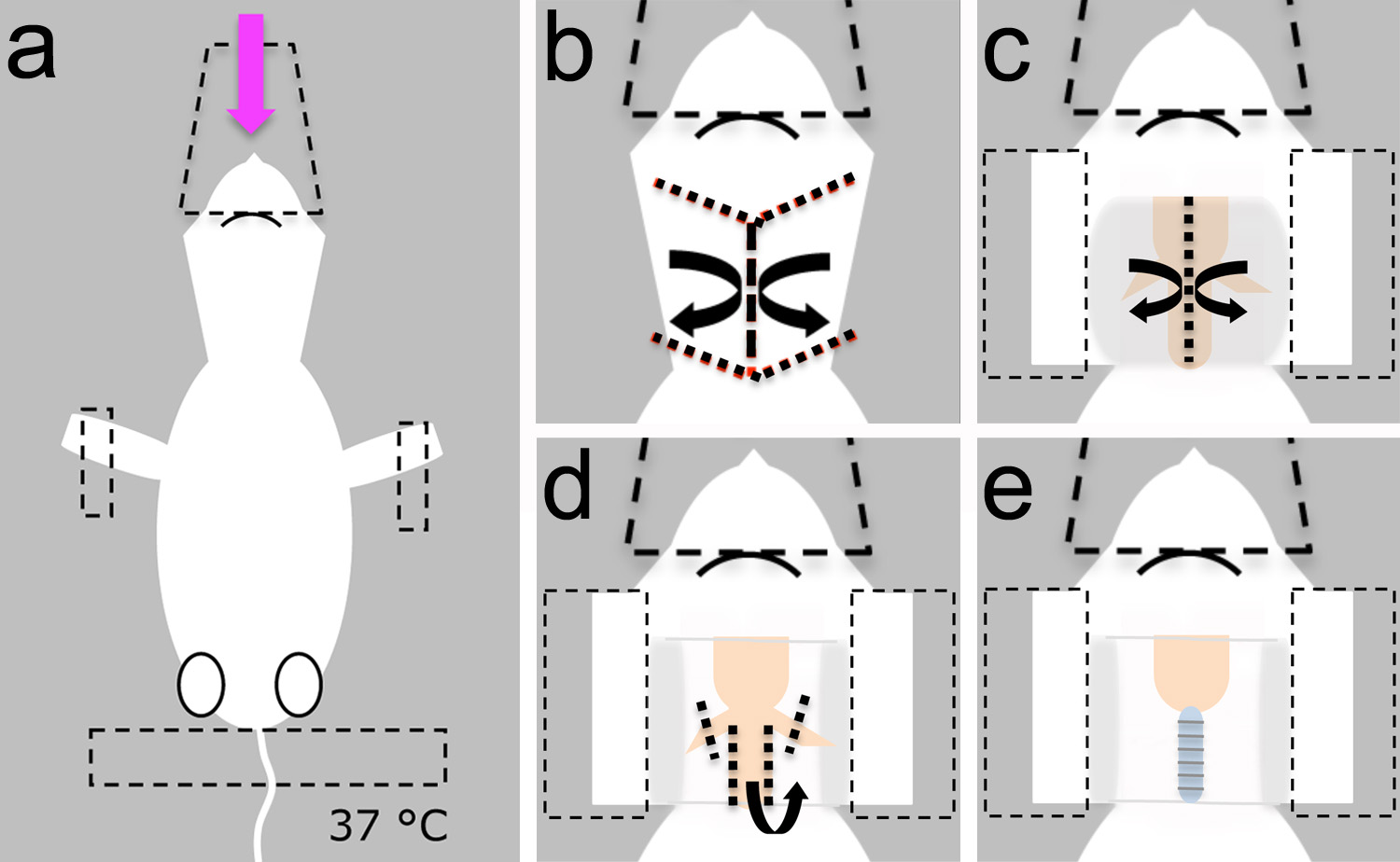
図3。挿管のための気管を露出させる。動物は、麻酔をしやすい位置に配置し、ノーズコーンとテープ(破線)で固定されています。B、皮膚が根底にある脂肪層が露出するようにカットし、脇に置かれている。C、その上の脂肪と腺(図示グレー)、気管を露出するように脇にプッシュされます。テープが覆っている皮膚(破線)を固定するために使用される。D、気管が筋肉組織から解剖されており、E、気管リングの可視化は、その上、筋肉の正常な削除を示しています。 拡大画像を表示するにはここをクリックしてください。
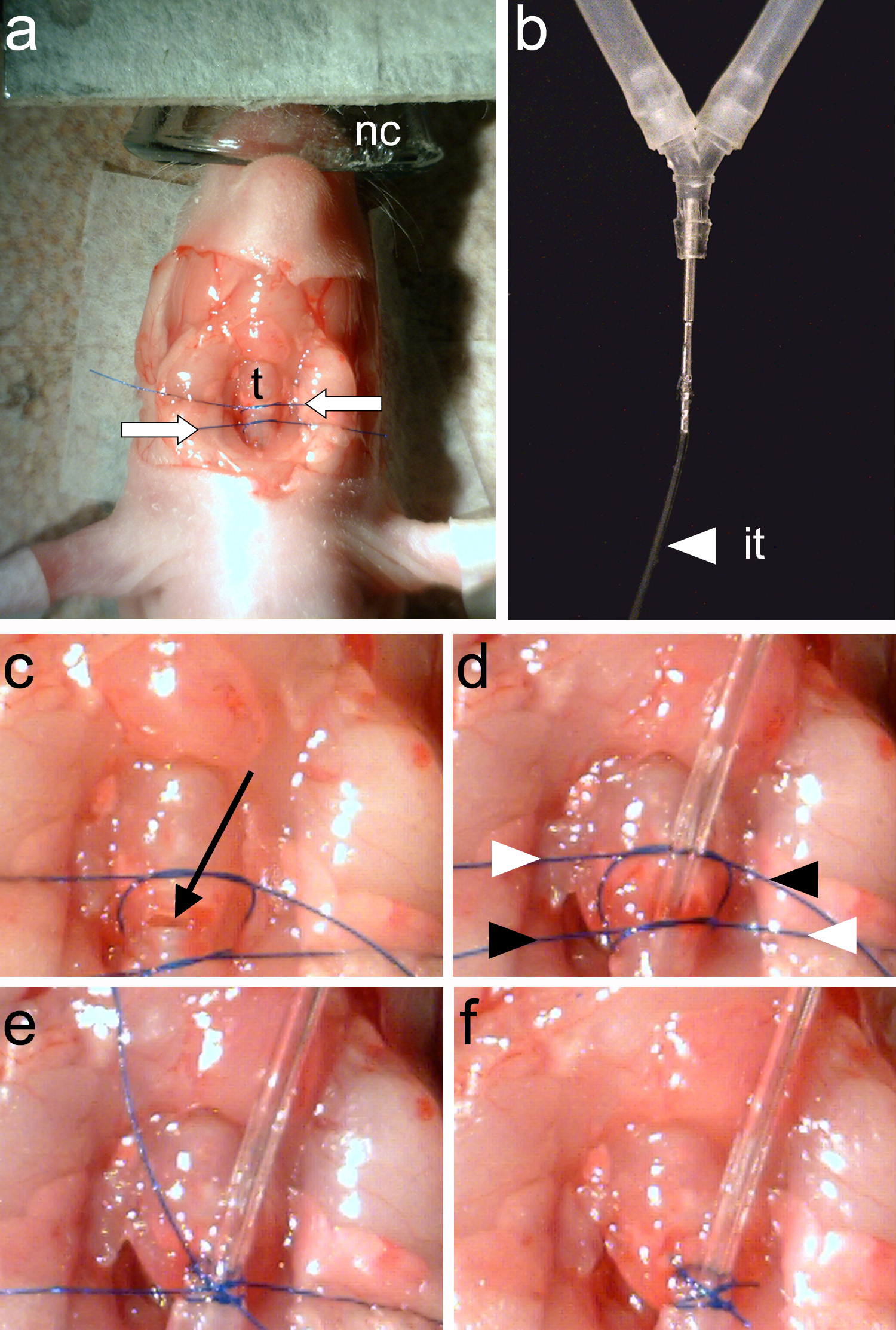
図4。動物に挿管する。、二つの縫合糸(白矢印)が気管の周りに結び付けられている(t)をB、挿管チューブ(it)がしっかりと動物ベンチレータするcのy管に接続する必要があり、気管切開は、2つの縫合糸(黒矢印)。dは、換気チューブが挿入される間に行われる2の縫合糸が締められている。スレッドの端部は、E。(白と黒の矢印で示される)交差方式で再び締め付けられて縫合糸終末が接続されています。F、縫合糸終末をトリミングし、挿管が完了している。 拡大画像を表示するにはここをクリックしてください。
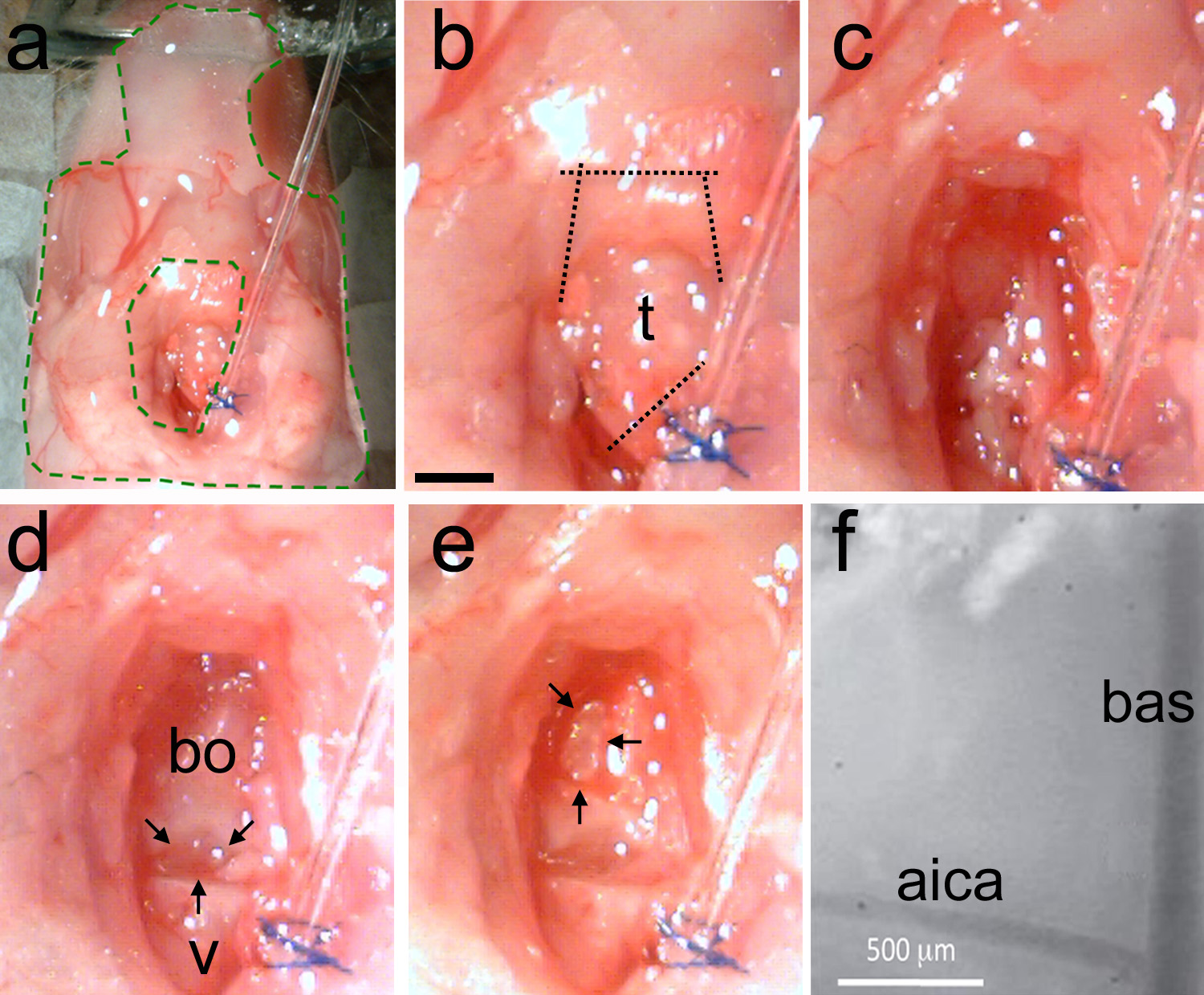
図5。気管の取り外しと開頭を作る。、準備がエラストマーで安定化されている(エリアINSIデ緑破線) ます#b、気管が識別され、次いでカットが離れて挿管チューブから気管を分離すること、次いで下顎筋(点線)に切断するために最初に製造されている。cの平滑用いて頭蓋骨の表面を清掃技術の筋肉を除去し、脂肪と血。Dを削除するために吸収紙を使用するには、クリーンな領域の例は、最後の脊椎(V)とバシ-後頭骨(BO)を示している。 2つの骨(黒矢印)の間に自然なギャップがある。E、反転次元形状(黒矢印)でのマイクロドリルや超音波洗剤の薄い頭蓋骨を使用する。そっと薄くなった頭蓋骨を破壊した骨の一部を除去します。ランドマーク血管系が表示されるはずです。 女露出脳幹表面の血管ランドマークの高倍率ビュー。 BAS =脳底動脈; AICA =前下小脳動脈。 B = 1ミリメートル中のスケールバーは、CE。highres.jpg "ターゲット=" _blank ">拡大画像を表示するにはここをクリックしてください。
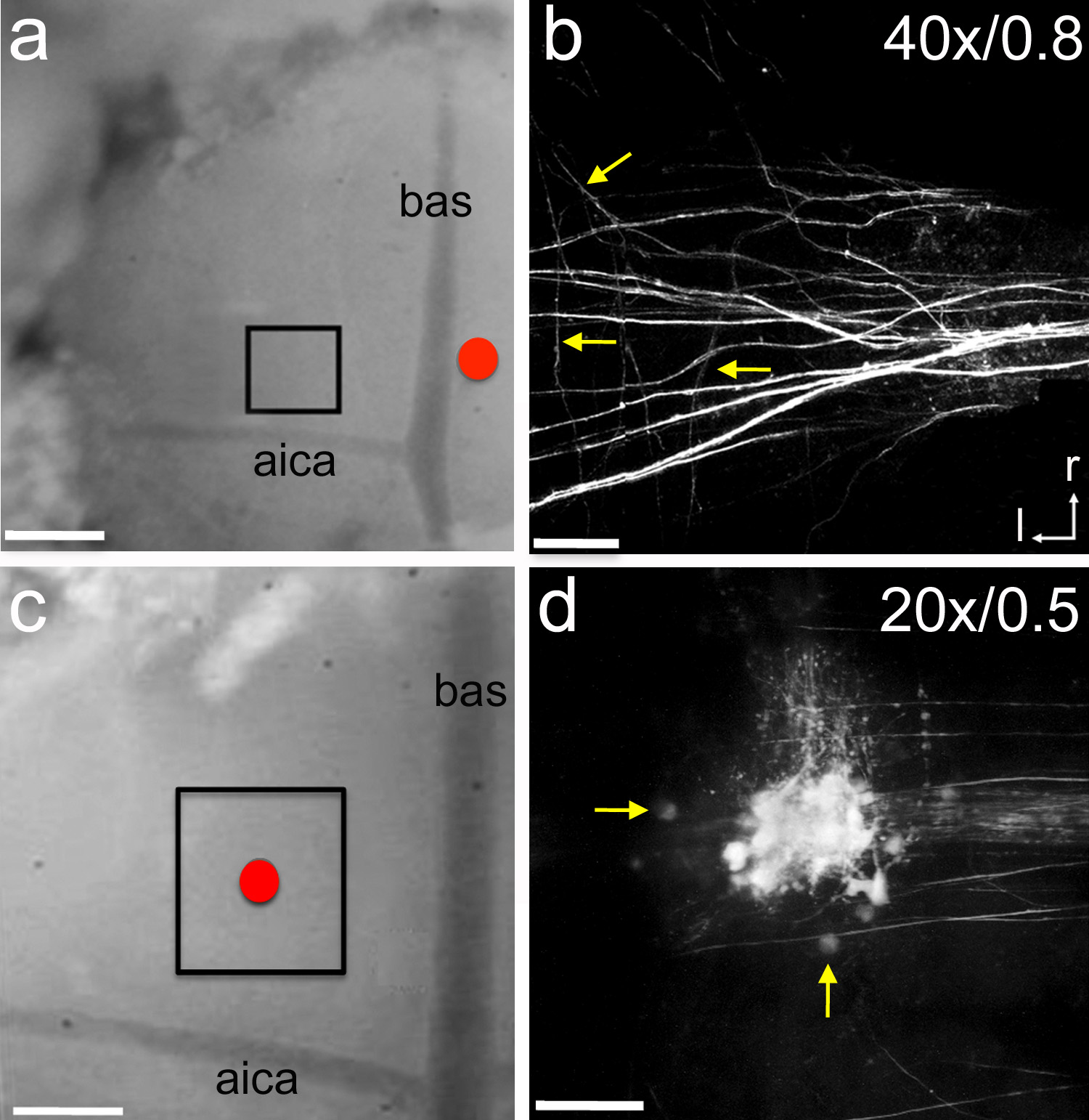
図6の神経トレーサーのエレクトロポレーション、神経トレーサーマイクロルビーを含むガラス電極は、正中線(赤い円)の近傍に配置した。トレーサーは7秒の長さ-5μAパルスを用いて電気穿孔した15分間ごとに14秒を達成しました。回復時間の1時間後、ボックス領域は、二光子顕微鏡で画像化した。 P1のラットの子犬。B、MNTBにおける求心性軸索ラベルの模範zスタック画像。矢印は、個々の担保の枝を指す。C、マイクロルビーを充填したガラス電極はMNTB(赤い円)の上に配置した。トレーサーはで説明したのと同じ設定を使用して電気穿孔した。回復時間の1時間後、四角で囲んだ領域があった二光子顕微鏡で画像化した。 P5ラット子犬。D、MNTBにおける標識細胞と軸索の模範zスタック画像。矢印は、単一のMNTB細胞を示している。 b及びcのラベルは、それぞれ、対物レンズの倍率及び開口数を示している。スケールバー、およびC = 300ミクロン; =45μmのB中のスケールバー; D =90μmの中のスケールバー。 AICA =前下小脳動脈; BAS =脳底動脈; Rは吻側; L =横。 拡大画像を表示するにはここをクリックしてください。
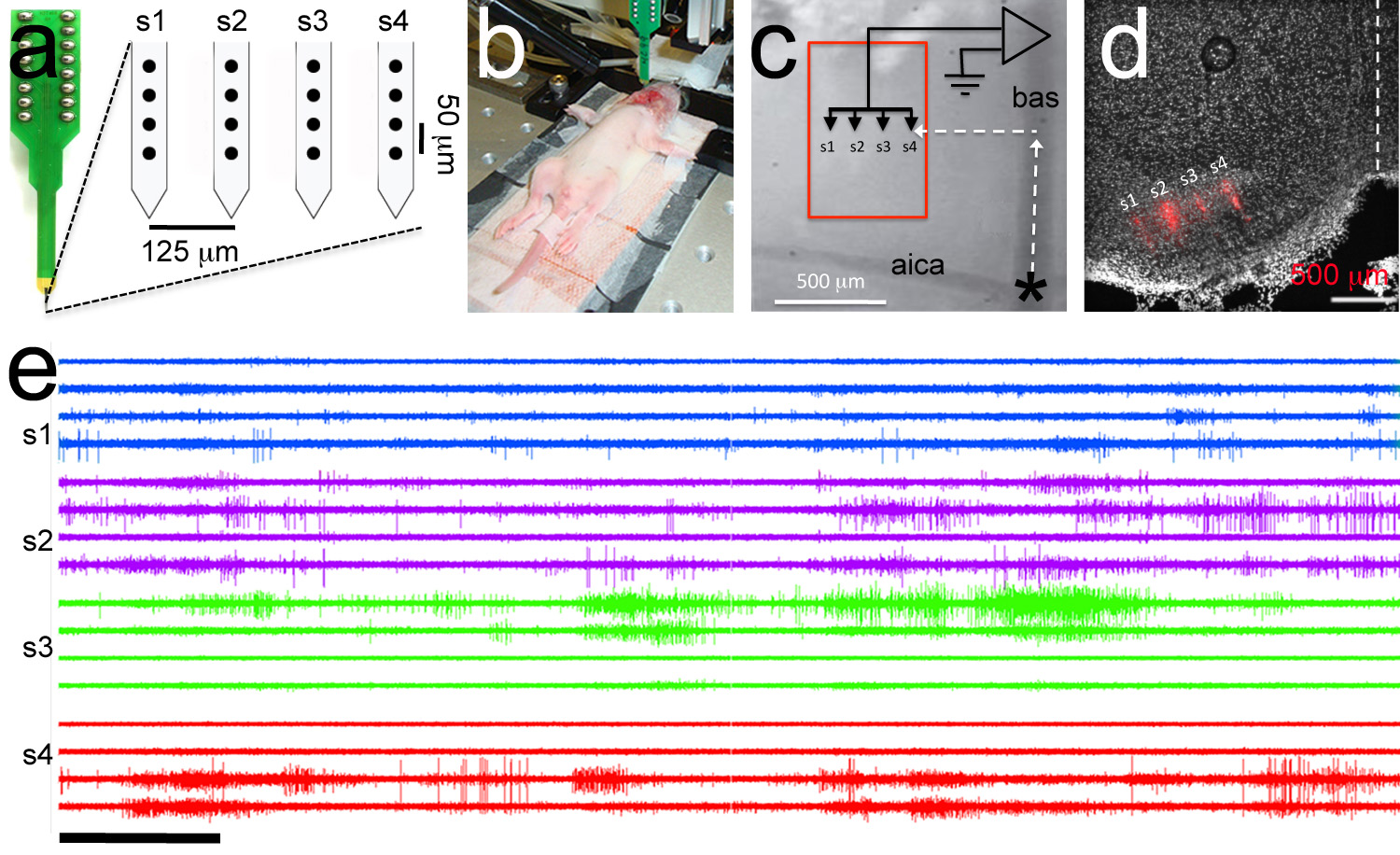
図7。polytrode記録を対象とした、Polytrode、シャンクあたり4電極(黒丸)との4シャンクで構成されています。電極間のイントラとインターシャンクの距離が示されている。B、 電気生理学実験の模範画像。参照電極は、頬空洞内に挿入され、ploytrodeはヘッドステージに接続されている。 P6ラット子犬。C、polytrode標的とするために使用される血管系のランドマークの高倍率ビュー。 polytrodeは(polytrodeトラックは赤で表示されます)台形ボディ(赤箱)。D、ポストホック組織学的分析は、DiIでコーティングされたpolytrodeの正しい標的化を実証するの内側核をターゲットに吻側横座標を使用して配置されている。 電子、模範マルチ·単位記録。トレース順序は、パネルaの電極の順序と同じである。シャンクの録音の中に同じ色を持っている。 E中のスケールバーは5秒間。 拡大画像を表示するにはここをクリックしてください。
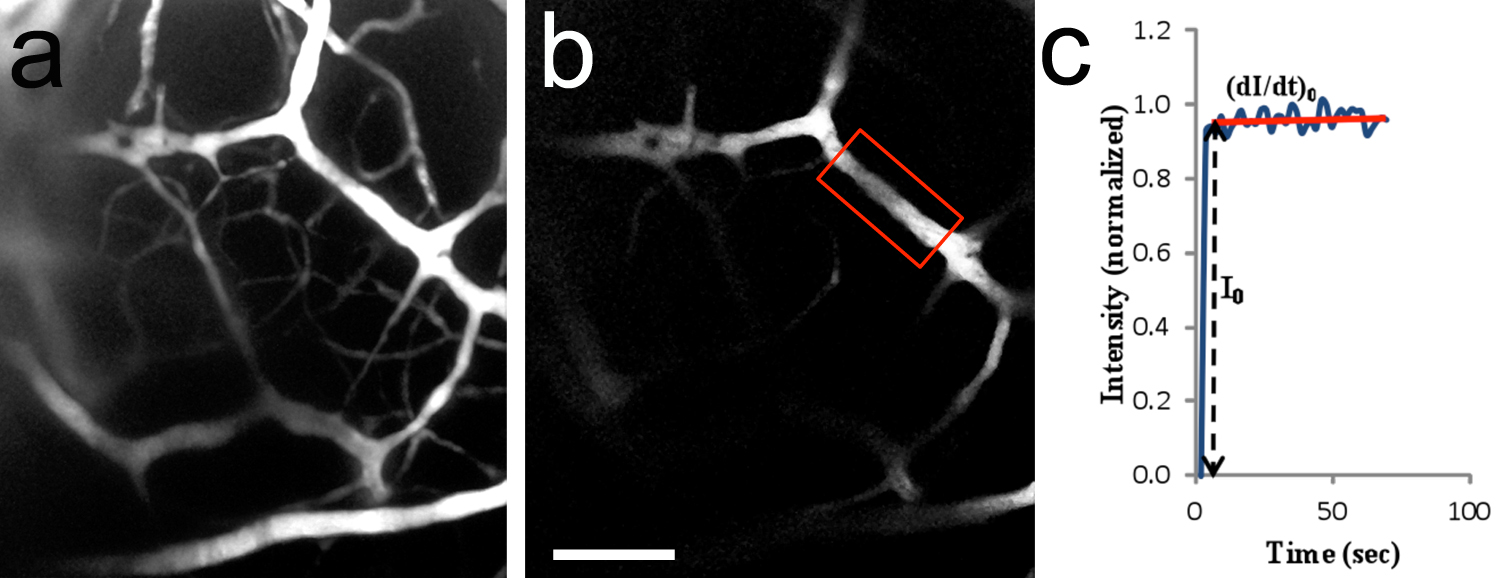
脳の微小血管の図8 のin vivo二光子イメージング。頸動脈へのTRITC-デキストラン155 kDの灌流後の脳血管系のA、2-D画像(折りたたまZ-スタック)。結像領域は、 図7cに示したものと同様である。 20x/0.5水浸対物レンズ。 P10ラット子犬ます#b、関心領域(ROI)は、蛍光強度(赤枠囲った領域)を測定するために使用した。微小血管は、〜14.2ミクロンの直径を有し、182ミクロン脳幹面の下に位置していた。時間の関数としての蛍光強度(正規化値)のcの典型的な曲線。 fluoresenceソリューションだけで血管内腔を埋めたとき、私0は、ROI内の蛍光強度の段階的増加である。 (のdI / dt)は0およびI 0は溶質に微小血管透過性を決定するために使用される。 TRITC-デキストラン155 kDの透過性は、1.5×10 -7 cm /秒であると計算された。B =100μmの中のスケールバーは、に適用されます。 拡大画像を表示するにはここをクリックしてください。
ディスカッション
時間は重要である。経験を積んだ研究者は(1-3ステップ)1時間で、このプロトコルを完了することができるはずです。異なる工程について記載されている時間は、専門性の高いレベルにメディアを前提としています。貧弱な換気制御、動物の窒息死につながることができるため、適切かつタイムリーな気管切開や挿管は、重要である。間違いが動物の制御されない出血や死につながる可能性があるため、筋肉や脂肪組織の慎重な隙間も非常に重要です。カニューレ挿入のために頸動脈を調製する場合、スレッド結び目に緩みが制御されない出血が起こるとなった場合同様に、人は、慎重に動脈を締めて切断する必要がある。最後に、開頭は、血管系のランドマークを中断することなく、慎重になされるべきである。外部髄膜層(硬膜)の不注意な除去は、重度の出血や動脈供給の損傷につながることができます。
換気設定は、動物の年齢に応じて選択される。ほとんどの商業的供給者は、そのような設定に関する有用な情報を提供する。 P15より古いラットでの実験は、大型動物人工呼吸器の使用が必要になります。大人の動物はケタミン/キシラジンで麻酔した場合、換気を必要としないかもしれませんが、挿管は、気管に入る流体を避けることをお勧めします。
このプロトコルの主な制限は、一つの実験は、急性のみ行うことができることである。当研究室では、2つの間と10時間まで持続する実験を行った。第2の制限は、実験は麻酔下で実施しなければならないことである。そのため、麻酔薬の選択は、実験の計画·設計する際に考慮すべき重要な変数である。関連する問題は、新生児動物は、過剰投与に特に敏感であることである。例えば、ケタミン/キシラジンミックスを選択する場合には、子犬の体重に基づいて投与量の計算と最大音量の⅓で薬物を投与。つま先のピンチrで5〜10分毎の動物の状態を確認してくださいesponse。イソフルランを使用している場合は、予防措置にも研究者(適切な換気、および適切に校正気化器)用の安全な環境を維持するために必要とされています。
実体顕微鏡視野角を調整し、二光子顕微鏡に電極および動物の再配置を配置する空間クリアランスを促進するためにフレキシブルホルダに取り付けることができる。人工呼吸器に電力を供給するバッテリーを使用すると、動物の移動を容易にし、電気生理学的実験の間に電気的なアーティファクトを減らすことができます。この目的のために、小さなブレッドボード(7.5×12インチ)人工呼吸器、加温パッド及び麻酔した動物(図2a)を一緒に組み立てるために使用することができる。このセットアップに有用かつ重要な変更は、手術中のバイタルサインを監視する装置の追加である。オキシメータまたは他の類似のデバイスは、実験室の予算に応じて使用することができる。
このプロトコルは、会った電気生理学とイメージングで使用されていますパッチクランプ記録8,10,11、polytrode記録( 図7)、および二光子イメージング9を含むhods、( 図6および8)。一つの可能な将来のアプリケーションは、電気生理学的記録16のため、蛍光標識された細胞を標的とするために、これらの方法を組み合わせることであろう。
新しいイメージングアプリケーションは、2次元または二光子顕微鏡を用いた3-Dの時系列を含むことができる。例えば、脳幹神経細胞およびグリア細胞集団の活性を研究するためにカルシウム指示薬のボーラス負荷を用いた。 図8に示すように、頸動脈を介して血液循環に注入された色素溶液は、脳血管系の高コントラスト画像を生成するために使用することができる。蛍光色素が微小血管の内腔を満たし、周囲の組織の中に広がるように、溶質拡散coefを、血液脳関門の見かけの溶質透過率を算出するだけでなく、使用することができる脳組織3でficient。頸動脈を経由して、蛍光標識された溶質を注入するための一つの主な理由は、色素溶液を直接尾静脈注射のように最初の心臓に行かずに、脳内の微小血管に行くことができるということです。これは、少なくとも二つの利点をもたらす。一つは、灌流速度をカニュレーション部位に固定されている場合、微小血管内腔の蛍光色素濃度が実質的に一定であることである。これは、血液脳関門の透過性の正確な決定を保証する。もう一つは、試験剤が灌流液に含まれている場合、それが直接体内循環から他の要因で希釈または結合されずに血液脳関門に行くことである。
新しい実験はまた、遺伝的にコード化された蛍光レポーターでトランスジェニック動物を利用することができる。これは(蛍光プローブは、 その場でロードする必要がないことの利点を提供しない限り、実験の設計そうでない状態)、時間を節約し、おそらく、より完全な製剤( 例頭蓋窓17)を可能にする。
最後に、実験は、下オリーブや顔面運動核として他の脳幹領域で行うことができます。ある種の中で、特定の細胞集団の神経解剖学と開発についての知識は、解剖学的ランドマークが動物が( 図1)成長に合わせて変更されることが特にこの目的に向けて重要であろう。我々は、このプロトコルは、生体内の電気生理学的およびイメージングの方法で使用して腹側脳幹の構造を研究する他の人を奨励したいと考えています。
開示事項
著者らは、開示することは何もありません。
謝辞
この作品は、NIH / NCRR / RCMIから助成G12-RR003060によってサポートされていました、新市立大学から児童の健康と人間開発、国立科学財団CBET 0754158およびPSC-CUNY 62337から00 40のユーニスシュライバー国立研究所からSC1HD068129を付与ニューヨーク州。
資料
| Name | Company | Catalog Number | Comments |
| Absorbant pads | Kettenbach | Sugi 31603 | Other options may be available from different companies |
| Cautery | Braintree Scientific, INC | GEM 5917 | Other options may be available from different companies |
| Tetramethyl rhodamine Isothiocyanate dextran | Sigma | T1287-500MG | Other options may be available from different companies |
| Dissecting Chisel | Fine Science Tools | 10095-12 | Other options may be available from different companies |
| DiI | Invitrogen | V-22885 | Other options may be available from different companies |
| Elastomer | World Precision Instruments | KWIK-SIL | Other options may be available from different companies |
| Fine Scissors | Fine Science Tools | 14060-09 | Other options may be available from different companies |
| Forceps | Fine Science Tools | 11027-12,11617-12, 11616-16 | Other options may be available from different companies |
| Spring Scissors | Fine Science Tools | 15009-08 | Other options may be available from different companies |
| Heating pad | FHC | 40-90-2 | Other options may be available from different companies |
| Intubation tubing | Braintree Scientific, INC | BIO CO-KIT | Choose age appropriate size |
| Light source | Spach Optics | Schott Ace illuminator | Other options may be available from different companies |
| Micro drill | Braintree Scientific, INC | MD-1200 120V | Other options may be available from different companies |
| Paper tape | Walgreens | Generic brand | Other options may be available from different companies |
| Syringe filter | VWR | 28145-483 | Other options may be available from different companies |
| Syringe pump | VWR | 52459-008 | Other options may be available from different companies |
| Stereomicroscope | Olympus | SZ61 | Other options may be available from different companies |
| Suture | Ethicon | Prolene 86979 | 6-0 size |
| Tubing | Braintree Scientific, INC | Micro-Renathane (MRE033); SUBL-120 | Other options depending on pup’s age |
| Vaporizer (isoflurane) | Vetequip Incorporated | 911103 | Other options may be available from different companies |
| Ventilator (minivent) | Harvard Apparatus | 730043 | Use for P0-P12 rats |
参考文献
- Kerr, J. N. D., Denk, W. Imaging in vivo: watching the brain in action. Nat. Rev. Neurosci. 9 (3), 195-205 (2008).
- Sigler, A., Murphy, T. H. In vivo 2-photon imaging of fine structure in the rodent brain: before, during, and after stroke. Stroke. 41 (10), 117-123 (2010).
- Shi, L., Zeng, M., Sun, Y., Fu, B. M. Quantification of blood-brain barrier solute permeability and brain transport by multiphoton microscopy. ASME J. of Biomech. Eng. 136 (3), 031005-031005 (2014).
- Galambos, R., Schwartzkopff, J., Rupert, A. Microelectrode study of superior olivary nuclei. Am. J. Physiol. 197, 527-536 (1959).
- Goldberg, J., Brown, P. B. Response of binaural neurons of dog superior olivary complex to dichotic tonal stimuli: some physiological mechanisms of sound localization. J. Neurophysiol. 32 (4), 613-636 (1969).
- Guinan, J. J., Guinan, S. S., Norris, B. E. Single auditory units in the superior olivary complex I: responses to sounds and classifications based on physiological properties. Intern. J. Neurosci. 4, 101-120 (1972).
- Spirou, G. A., Brownell, W. E., Zidanic, M. Recordings from cat trapezoid body and HRP labeling of globular bushy cell axons. J. Neurophysiol. 63 (5), 1169-1190 (1990).
- Khosrovani, S., Der Giessen, R. S. V. a. n., De Zeeuw, C. I., De Jeu, M. T. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proc. Natl. Acad. Sci. U.S.A. 104 (40), 15911-15916 (2007).
- Rodríguez-Contreras, A., Van Hoeve, J. S., Habets, R. L., Locher, H., Borst, J. G. G. Dynamic development of the calyx of Held synapse. Proc. Natl. Acad. Sci. U.S.A. 105 (14), 5603-5608 (2008).
- Lorteije, J. A., Rusu, S. I., Kushmerick, C., Borst, J. G. G. Reliability and precision of the mouse calyx of Held synapse. J. Neurosci. 29 (44), 13770-13784 (2009).
- Tritsch, N. X., Rodríguez-Contreras, A., Crins, T. T., Wang, H. C., Borst, J. G. G., Bergles, D. E. Calcium action potentials in hair cells pattern auditory neuron activity before hearing onset. Nat. Neurosci. 13 (9), 1050-1052 (2010).
- Tong, H., Steinert, J. R., Robinson, S. W., Chernova, T., Read, D. J., Oliver, D. L., Forsythe, I. D. Regulation of Kv channel expression and neuronal excitability in rat medial nucleus of the trapezoid body maintained in organotypic culture. J. Physiol. 588 (9), 1451-1468 (2010).
- Sonntag, M., Englitz, B., Kopp-Scheinpflug, C., Rübsamen, R. Early postnatal development of spontaneous and acoustically evoked discharge activity of principal cells of the medial nucleus of the trapezoid body: an in vivo study in mice). J. Neurosci. 29 (30), 9510-9520 (2008).
- García-Villalón, A. L., Roda, J. M., Alvarez, F., Gómez, B., Diéguez, G. Carotid blood flow in anesthetized rats: effects of carotid ligation and anastomosis. Microsurgery. 13 (5), 258-261 (1992).
- Yuan, W., Lv, Y., Zeng, M., Fu, B. M. Non-invasive method for the measurement of solute permeability of rat pial microvessels. Microvasc. Res. 77 (2), 166-173 (2009).
- Kitamura, K., Judkewitz, B., Kano, M., Denk, W., Haüsser, M. Targeted patch-clamp recordings and single-cell electroporation of unlabeled neurons in vivo. Nat. Methods. 5 (1), 61-67 (2008).
- Mostany, R., Portera-Cailliau, C. A method for 2-photon imaging of blood flow in the neocortex through a cranial window. J. Vis. Exp. (12), (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved