Method Article
Un método para hacer una craneotomía en el cráneo ventral del Neonato Roedores
En este artículo
Resumen
Un método quirúrgico se describe para exponer el cráneo ventral en ratas neonatas. El uso de este enfoque es posible abrir una craneotomía para llevar a cabo la electrofisiología aguda y experimentos de microscopía de dos fotones en el tronco cerebral de las crías anestesiados.
Resumen
El uso de una craneotomía para experimentos in vivo proporciona la oportunidad de investigar la dinámica de los diversos procesos celulares en el cerebro de los mamíferos en la edad adulta y durante el desarrollo. Aunque la mayoría de los enfoques en vivo utilizan una craneotomía para estudiar las regiones del cerebro situadas en la cara dorsal, las regiones del tronco cerebral, tales como el puente, situado en la parte ventral siguen siendo relativamente poco estudiada. El principal objetivo de este protocolo es facilitar el acceso a las estructuras del tronco cerebral ventral para que puedan ser estudiados in vivo utilizando electrofisiológico y métodos de imagen. Este enfoque permite el estudio de los cambios estructurales en los axones de largo alcance, los patrones de actividad eléctrica en un solo y conjuntos de células y cambios en la permeabilidad de la barrera de sangre del cerebro en los animales recién nacidos. Aunque este protocolo se ha utilizado sobre todo para estudiar el tronco cerebral auditivo en ratas recién nacidas, que se puede adaptar fácilmente para estudios en otras especies de roedores, como ratones recién nacidos, Roden adultosts y de otras regiones del tronco cerebral.
Introducción
El uso de una craneotomía en combinación con imágenes de fluorescencia y técnicas de electrofisiología permite el flujo de supervisión de la sangre, la permeabilidad de la barrera hematoencefálica y la medición de la actividad de las neuronas y las células gliales en los animales vivos 1-3. Varios laboratorios han utilizado este enfoque para dar una idea de la fisiología del cerebro en condiciones saludables y las enfermedades, pero persisten lagunas en nuestra comprensión de cómo surgen estos procesos durante el desarrollo. Además, la mayoría de los estudios se han centrado en las regiones del cerebro que son fácilmente accesibles desde la superficie dorsal del cráneo, de tal manera que las estructuras del tronco cerebral ventral con diversas funciones fisiológicas se han estudiado principalmente usando enfoques in vivo ex.
El objetivo principal de este protocolo es proporcionar un método para la apertura de una craneotomía en el cráneo ventral de los roedores. Este enfoque es una adaptación de los estudios clásicos realizados en mamíferos más grandes, tales como perros y gatos para reco neurofisiología sensorialesrdings del tronco cerebral auditivo 4-7. En este protocolo sin embargo, no es la novela reto de realizar el procedimiento en los animales recién nacidos. El uso de puntos de referencia de la vasculatura, este protocolo adaptado se ha utilizado previamente para estudiar el tronco cerebral auditivo de las ratas recién nacidas, ratones adultos y otras regiones del tronco cerebral, como la oliva inferior 8-11 (Figura 1).
Una ventaja principal de una craneotomía ventral sobre los métodos existentes para estudiar núcleos del tronco cerebral ventral es que proporciona acceso directo a las estructuras de interés en animales vivos. Por ejemplo, las células auditivas del complejo olivar superior se localizan unas pocas decenas de micrómetros de la superficie del cerebro, lo cual es importante para la colocación selectiva de sondas y para el uso de métodos de imagen de dos fotones en el que la profundidad de imágenes puede quedar limitada a 0,5 mm por dispersión de tejido ligero y absorción. Una craneotomía ventral también proporciona una preparación con conexiones neurales relativamente intactos, quich se interrumpen en el tramo preparativos agudos y organotypic 12. En contraste con otros protocolos para experimentos in vivo neurofisiología 13, un enfoque ventral se puede combinar con la grabación de múltiples electrodos y los métodos de formación de imágenes que proporcionan información sobre conjuntos celulares (Figuras 6 y 7). Por último, en combinación con este protocolo un soluto marcado de manera fluorescente puede ser inyectado en la vasculatura para medir los cambios en la barrera hematoencefálica permeabilidad al soluto (Figura 8).
Protocolo
El siguiente protocolo sigue las pautas de cuidado de animales establecidas por el Cuidado de Animales y el empleo Comisión Institucional (IACUC) en el City College de Nueva York.
1. Intubación animal (10-20 min)
- Antes de la cirugía, preparar la solución de Ringer mamíferos. Reúna las herramientas quirúrgicas, almohadilla eléctrica y animal pequeño ventilador en el banco (Figura 2).
- Para las mediciones de la permeabilidad de la barrera de sangre del cerebro hacen 10 ml de 1% de albúmina de suero bovino solución (BSA) en Ringer y se disuelven TRITC-dextrano 155 kD a 8 mg / ml en solución de BSA al 1%, solución de filtro con 25 mm de filtro de jeringa (0,2 micras tamaño de poro) y almacenar en una jeringa forrada con papel aluminio en la oscuridad.
- Se anestesia al animal utilizando isoflurano. Use 5,0% para la inducción y 1,5-3,0% para el mantenimiento. Alternativamente, una mezcla de ketamina (41,7 mg / kg) y xilazina (2.5 mg / kg de peso corporal) se puede utilizar. Profundidad de la anestesia se puede comprobar por los pies pizca de reflejoextremidades superiores e inferiores.
- Las dosis posteriores de la ketamina (41,7 mg / kg de peso corporal) y xilazina (2.3 mg / kg de peso corporal) se deben administrar en incrementos de ⅓ de la dosis máxima para evitar la sobredosificación. Se recomienda el uso de un ventilador de roedores para contrarrestar la depresión respiratoria inducida por la xilazina-.
- Coloque el cachorro anestesiado miente en su lado dorsal y asegurar su cabeza con el cono de plástico que se utiliza para entregar el anestésico (Figura 3a).
- Asegure el animal con cinta adhesiva en las extremidades delanteras y la cola (Figura 3a).
- Una alternativa para asegurar la cabeza del cachorro es usar una placa de cabeza unida a una barra de metal.
Nota: Asegúrese de que la almohada eléctrica se establece en 37 ° C para evitar la hipotermia (Figura 3a).
- Use las tijeras (Figura 2b) para hacer uno longitudinal y cuatro incisiones laterales en la piel que recubre el cuello (Figura 3b). Utilizando una técnica contundente, diseccionar la piel y colocarlo a un lado el uso de fórceps (Figuras 2c y 3c).
- Mantenga la piel hacia abajo con cinta adhesiva. Estabilice la cabeza en una posición horizontal (Figura 3c).
- Usando tijeras de primavera (Figura 2d) y la técnica de romo, glándulas de empuje y las capas de grasa a un lado para exponer la tráquea (Figura 3c). Identificar la localización de las arterias carótidas.
- Mantenga las arterias carótidas de distancia de la tráquea.
Nota: La punción de las carótidas puede resultar en la pérdida masiva de sangre y muerte del cachorro.
- Mantenga las arterias carótidas de distancia de la tráquea.
- Usando tijeras de primavera (Figura 2d) disecar los músculos longitudinales que cubren la tráquea. Cortar los músculos longitudinales situados bajo la tráquea (Figura 3d).
Nota: Los anillos traqueales deben ser claramente visibles (Figura 3e).- Usofórceps (Figura 2c), atar dos pedazos de sutura alrededor de la tráquea. Un pedazo de sutura asegurar el tubo de ventilación y el segundo hilo se utiliza para cerrar la tráquea rostral al punto de inserción de tubos de ventilación (Figura 4a).
Nota: Humedezca el tejido expuesto regularmente con solución de Ringer para prevenir la deshidratación.
- Usofórceps (Figura 2c), atar dos pedazos de sutura alrededor de la tráquea. Un pedazo de sutura asegurar el tubo de ventilación y el segundo hilo se utiliza para cerrar la tráquea rostral al punto de inserción de tubos de ventilación (Figura 4a).
- Usando tijeras de primavera (Figura 2d) hacer una incisión en uno de los anillos traqueales situados entre los dos hilos colocados en el paso 1.6.1 (Figura 4c).
Nota: Asegúrese de que ningún líquido entra en la tráquea abierta. El líquido en la tráquea provocará asfixia. - Inserte el tubo de intubación (Figura 4b) en la tráquea y apretar el hilo inferior para asegurarlo. El uso de pinzas (Figura 2c), apretar el hilo superior para cerrar la parte posterior tráquea hasta el punto de la inserción de tubo de la intubación.
- Tighten y recorte los extremos de los dos hilos (Figura 4d-f).
Nota: El vapor en el interior del tubo de intubación es una buena señal de control de flujo de aire.
- Tighten y recorte los extremos de los dos hilos (Figura 4d-f).
- Rápidamente cambiar el suministro isoflurano al ventilador. Ajustar el volumen sistólico y la tasa de ventilación de acuerdo con el peso del animal.
- Selle el tejido circundante expuesta con elastómero (Figura 5a). Mantenga la superficie humedecida y limpia.
2. Tráquea y Remoción del músculo para exponer el cráneo (5-10 min)
- Use las tijeras de resorte (Figura 2d) para cortar la tráquea adyacente al tubo de ventilación. Realice dos cortes a lo largo de la pared muscular de la cavidad bucal para exponer el extremo caudal del paladar (Figura 5b).
Nota: Si es necesario, utilice un cauterizador para detener el sangrado. El sangrado incontrolable causará la muerte del animal. - Limpie elárea con abundante cantidad de solución de Ringer (Figura 5c). Identificar la diferencia entre la última vértebra y el hueso básica-occipital (Figura 5d).
Nota: La distancia entre los huesos es un hito cráneo útil para localizar las estructuras del tronco cerebral. La oliva inferior se encuentra debajo de este vacío. El complejo olivar superior auditivo se encuentra debajo del hueso occipital basi-en dirección rostral de esta brecha (véase también la figura 1). - Limpie el área con unas pinzas (Figura 2c) y tijeras de primavera (Figura 2d). No perforar los vasos sanguíneos.
Nota: Si es necesario, cauterizar para detener el sangrado.- Después de que el área expuesta está limpio de grasa y tejido muscular, el espacio que separa el hueso Basi-occipital y la última vértebra debe ser visible (Figura 5d).
3. Craneotomía (15-30 min)
- Utilice un microtaladro o un ultralimpiador sónico. Localice la pared medial de la bulla.
- Thin cráneo al hacer una forma invertida D hasta que las arterias subyacentes son visibles (Figura 5e).
Nota: La arteria basilar (bas) se ejecuta en la parte superior de la línea media del tronco del encéfalo. La arteria cerebelosa inferior anterior (AICA) divisiones bilateralmente y se puede utilizar de forma fiable como un hito, ya que tiene una posición constante en diferentes animales. - Cuando se adelgaza el cráneo, suavemente romper utilizando un cincel de disección (Figura 2e). Retire la pieza de hueso con fórceps (figura 2c). Alternativamente, levantar y romper el cráneo con una aguja doblada.
Nota: Repita este procedimiento hasta que el tamaño y la forma de la craneotomía es apropiado para el experimento planeado. Los bas y AICA deben ser visibles a través de la membrana duramadre (Figura 5f).
- Thin cráneo al hacer una forma invertida D hasta que las arterias subyacentes son visibles (Figura 5e).
- Limpie la zona varias veces con solución de Ringer fresco. Usando pa absorbenteds secar la superficie de la membrana duramadre.
- Si es necesario, utilice una aguja de sutura para quitar la membrana duramadre sin desplazar o romper las arterias hito bas y AICA.
Nota: Tras la dura punción de líquido cefalorraquídeo fluya hacia fuera. Limpie el área con una solución de Ringer y mantener húmedo durante todo el experimento.
- Si es necesario, utilice una aguja de sutura para quitar la membrana duramadre sin desplazar o romper las arterias hito bas y AICA.
4. Experimento Electrofisiología
- Seleccione la polytrode según diseño de experimentos (Figura 7). Utilice un pincel fino para recubrir el polytrode con Dil. Transferir la solución con Dil en un tubo de microcentrífuga de 1 ml, sumergir el pincel en la solución y golpear suavemente el polytrode bajo control visual (es decir, utilizando un estereoscopio). Comience en la punta de la sonda y seguir con cuidado hasta que todos los electrodos se recubren uniformemente.
- Coloque el electrodo de tierra dentro de la cavidad oral. Cargue el polytrode en el soporte del electrodo (Figura 7b ).
- Encienda el amplificador y compruebe que todas las conexiones funcionan bien.
- Coloque el electrodo anteriormente bas en el punto de la AICA (posición cero) rama. Mueva el electrodo hasta el punto de destino que desee con el rostral-lateral de coordenadas (Figura 7c) apropiado.
- Coloque el electrodo en la superficie del cerebro y moverlo a la profundidad deseada en pasos de 5-10 micras.
- Realice la grabación según el diseño experimental. Guarde los datos para su posterior análisis.
5. Experimento de dos fotones
- Encienda el microscopio. Ajuste la longitud de onda de excitación y utilizar un filtro de emisión correspondiente. Excitación a 800 nm y un trabajo de 607 ± 45 nm de paso de banda del filtro de emisión así para obtener imágenes de TRITC-dextrano.
- Identificar la arteria carótida derecha oa la izquierda. Utilizando una técnica contundente disección de la arteria carótida de los tejidos o los nervios conectivos adyacentes.
- Elija y mantenga la carótidaarteria con una pinza hemostática. Ate tres piezas de sutura alrededor de la arteria carótida.
- Apretar el hilo más cerca del lado del corazón para detener el flujo de sangre y dejar los otros dos hilos sueltos.
- Con unas tijeras finas para hacer un pequeño corte en un ángulo de 45 ° en la arteria carótida entre el hilo de atado y el siguiente hilo suelto.
Nota: Limpie la sangre con papel absorbente.
- Canular la arteria carótida. Introduzca el tubo de llenado con solución TRITC-dextrano en el corte en la arteria carótida unos 5 mm de profundidad orientada hacia la cabeza del cachorro.
- Apriete los otros dos temas alrededor de la arteria para mantener la tubería y la arteria juntos. Apriete las roscas, recortar y añadir elastómero para estabilizar aún más.
Nota: El otro lado de la tubería se conecta con la jeringa que contiene la solución TRITC-dextrano (preparado en el paso 1.1).
- Apriete los otros dos temas alrededor de la arteria para mantener la tubería y la arteria juntos. Apriete las roscas, recortar y añadir elastómero para estabilizar aún más.
- Fije la jeringa en la bomba de jeringa.
- Conjuntola velocidad a la velocidad del flujo sanguíneo de la arteria carótida del cachorro. A su vez en la bomba de jeringa durante unos pocos segundos y comprobar manualmente de que la solución de tinte puede ser inyectado en la arteria carótida. Nota: Suponiendo que la tasa de flujo de sangre en la arteria carótida de ratas adultas (240-280 g) es de aproximadamente 3 ml / min 14, la tasa de flujo de sangre para una cría de rata (perrito por ejemplo P10 peso de 15-25 g) se puede calcular a rango de 0,16 a 0,3 ml / min.
- Colocar el animal en el marco del objetivo de microscopio. Inyectar el dextrano fluorescente en el torrente sanguíneo.
- Identificar áreas de interés en el tronco cerebral ventral con un objetivo de 5X aire. Cambiar a un objetivo 20X o 40X (inmersión en agua, ND = 0,5 o 0,8, respectivamente) para enfocar la región de interés (ROI).
- Comience la imagen y ajustar los parámetros de adquisición de imágenes (por ejemplo, tiempo de exposición, la potencia del láser, ganancia del detector) hasta que la intensidad de fluorescencia en la vasculatura del ROI está optimizado (es decir,no muy baja, pero no saturado).
- Encienda la bomba de jeringa para inyectar la solución de colorante en la arteria carótida y adquirir una serie de tiempo en un plano focal fija.
6. Cuidado Animal Procedimiento Siguiendo
- Este es un procedimiento terminal. Al final de un experimento los animales deben ser sacrificados con una sobredosis de pentobarbital (100 mg / kg, intraperitoneal) o cualquier otro método de eutanasia aprobados por las Directrices de la eutanasia de la Asociación Veterinaria.
Nota: La perfusión a través del corazón con solución Ringer siguió con una solución de fijación se recomienda para su posterior análisis histológico.
Resultados
Electroporación de trazadores neuronales
El núcleo medial del cuerpo trapezoide (MNTB) es un grupo de células en el complejo olivar superior que se ha estudiado previamente utilizando este protocolo. Por ejemplo, pipetas de patch clamp se pueden utilizar para electroporar trazadores neuronales (Figura 6) 9. Cuando las pipetas se colocan cerca de la línea media como se muestra en la Figura 6a, el resultado es que decussating axones aferentes están etiquetados. Un microscopio de dos fotones equipado con una alta apertura numérica objetivo de inmersión en agua se puede utilizar para la imagen de las fibras que llegan al MNTB, incluyendo ramas colaterales muy finas (flechas en la Figura 6b). Trazadores neuronales también se pueden entregar a la MNTB directamente, como se muestra en la Figura 6c. El resultado es el etiquetado de las células MNTB y axones aferentes, como se puede apreciar por formación de imágenes con un objetivo de inmersión en agua inferior apertura numérica (Figura 6d). La mAin ventaja de utilizar el objetivo aumento menor es que un campo de visión más amplio puede ser examinada, y aunque esto se traduce en una disminución de la resolución espacial debido a la apertura numérica objetivo inferior, células MNTB individuales se puede discernir bien (flechas en la Figura 6d) . La duración media de estos experimentos para las edades P1-P5 es de 3,1 ± 1,4 horas (n = 22 cachorros).
Grabaciones electrofisiológicos
Despido estallido espontáneo es una forma de actividad eléctrica en el desarrollo observado en células MNTB individuales antes del inicio de la audición 11,13. El uso de este protocolo quirúrgico también es posible orientar las matrices multielectrodo (polytrodes) a la MNTB (Figura 7a-b). El resultado es un registro de la actividad espontánea en un conjunto de células MNTB. Figura 7e muestra una grabación polytrode representante de una rata P6. En este experimento, la polytrode se revistió con los Dil colorantes lipófilos utilizandoun pincel fino (véase el paso 4.1). Después de realizar la grabación del cerebro se procesó para el análisis histológico y se usó la ubicación de la pista polytrode marcada con Dil para confirmar el correcto direccionamiento al MNTB (Figura 7d). La duración media de los experimentos para las edades P1-P6 es de 2,0 ± 0,7 horas (n = 33 cachorros).
Medición de la permeabilidad microvascular
Este protocolo también se puede utilizar para llevar a cabo de dos fotones experimentos de imagen de la permeabilidad vascular. Un soluto fluorescente (TRITC-dextrano, PM 155 kD, el radio de Stokes ~ 8,5 nm) se disolvió en solución de BSA al 1% en dos colores y se inyecta en la circulación cerebral a través de una cánula insertada en la arteria carótida 14. A diferencia de inyecciones en la vena de la cola, este procedimiento no pasa por el corazón e introduce el soluto fluorescente directamente en la microcirculación cerebral. La figura 8a ilustra la calidad de etiquetado de la vasculatura de la sangre que resulta de usar este procedimiento. Después continuala perfusión de solutos marcados en el torrente sanguíneo que es posible obtener una secuencia de lapso de tiempo de una región de interés, como se muestra en la Figura 8b. La intensidad total de fluorescencia en la región de interés se midió fuera de línea y un modelo matemático usado para determinar la permeabilidad de la barrera de sangre del cerebro para marcado fluorescentemente solutos (Figura 8c) 15. La duración media de los experimentos para las edades P9-P10 es de 2.3 ± 0.8 horas (n = 3 cachorros).
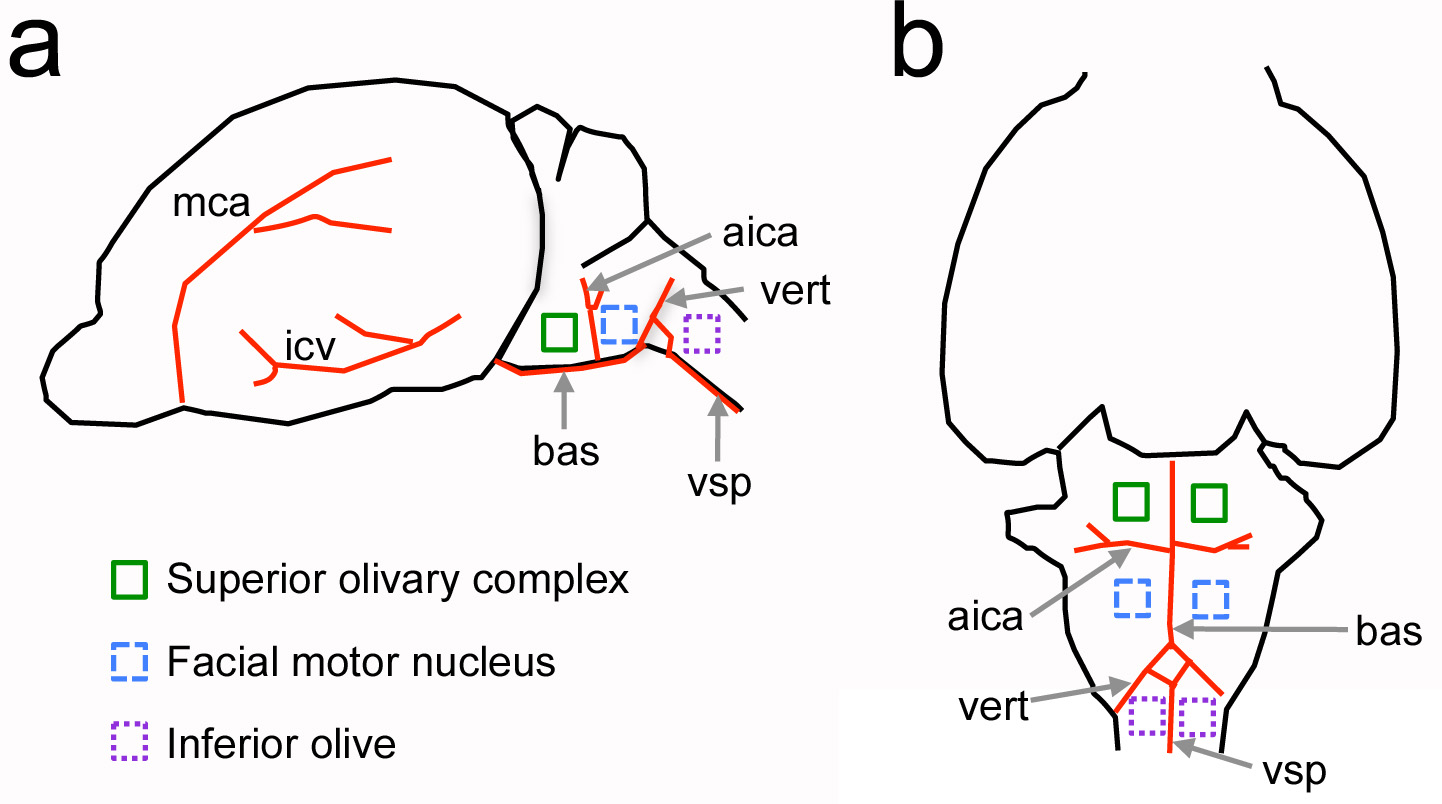
Figura 1. Ubicación relativa de las estructuras neuronales del tronco cerebral ventral con respecto a la vasculatura hitos en la rata recién nacido. Un Vista lateral del cerebro. B, vista ventral del cerebro. Los vasos sanguíneos principales se muestran en rojo y estructuras neurales de interés son indicated por cuadrados de colores. No está dibujado a escala. AICA = arteria cerebelosa inferior; bas = arteria basilar; icv = vena cerebral inferior; mca = arteria cerebral media; vert = arteria vertebral; vsp = arteria espinal ventral. Haz clic aquí para ver la imagen más grande.

Figura 2. Instalación quirúrgica. Una cirugía se puede hacer en un pequeño tablero de pan (1) descansando en la parte superior de una mesa estable. Una almohadilla térmica (2) y un pequeño ventilador para animales (3) se puede fijar a la mesa de pan para facilitar el desplazamiento de toda la preparación cuando sea necesario. El animal pequeño ventilador puede ser alimentado por una batería (4). Un soporte magnético (5) se puede utilizar para fijar el cono de la nariz utilizado para entregar el anestésico. El cono de la nariz puedetambién ayudar a proteger la cabeza en una posición estable. Si el animal no necesita ser reubicado, un micromanipulador (6) se puede utilizar para sondas de posición para electrofisiología o experimentos de rastreo neuronales. Una fuente de luz (7) y un estereoscopio (no en la foto) son necesarios para visualizar estructuras de marca durante la microcirugía. B, tijeras pequeñas se utilizan en el paso 1.4. C, fórceps se utilizan en los pasos 1.4, 1.6.1, 1.8 y 1.8.1 . d, tijeras de primavera se utilizan en los pasos 1.5, 1.6 y 1.7. e, cincel de disección se utiliza en el paso 3.1.2. La barra de escala en e = 1 mm, se aplica a bd. Haga clic aquí para ver la imagen más grande.
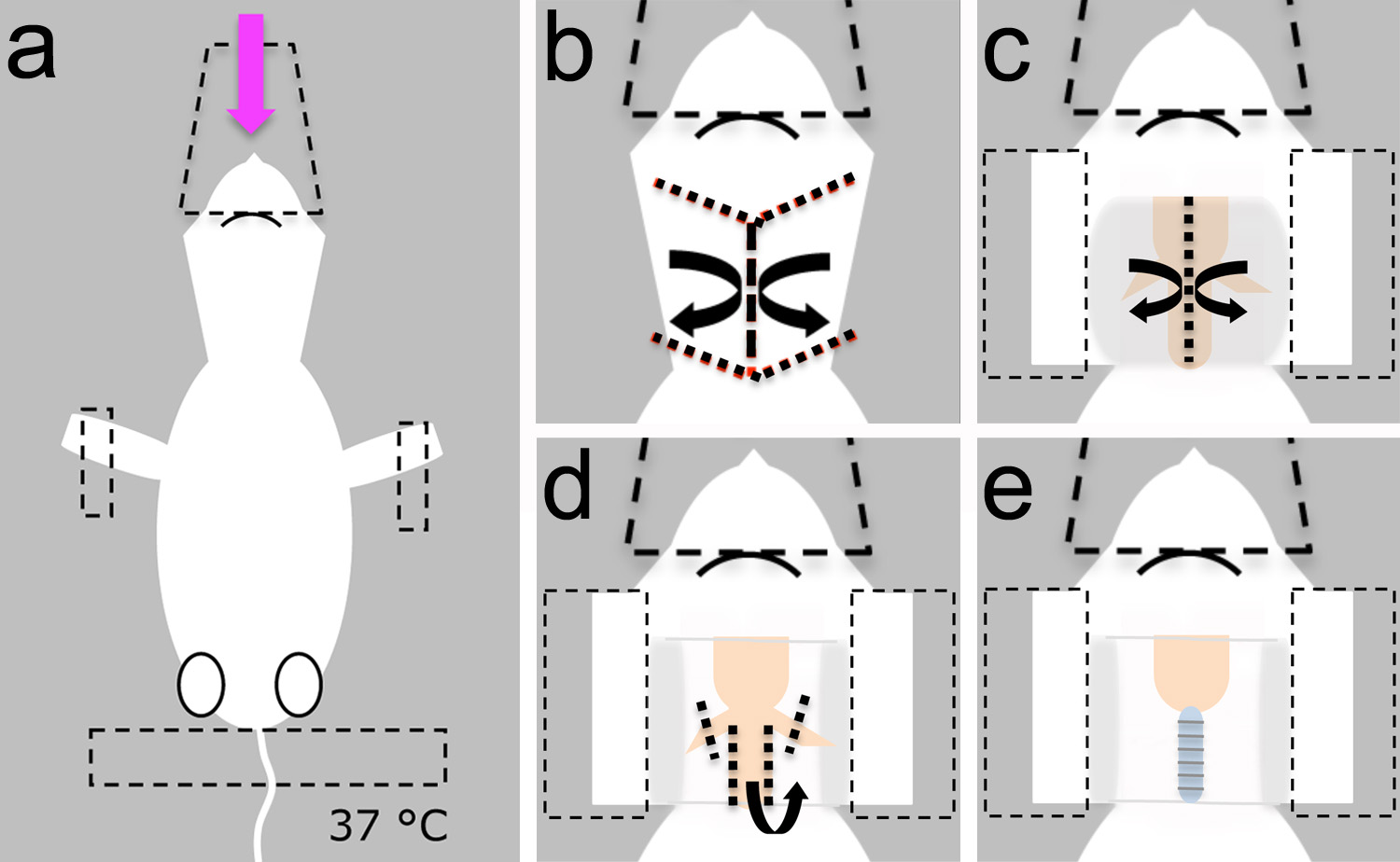
Figura 3. La exposición de la tráquea para la intubación.una, el animal es anestesiado, colocado en la posición de decúbito prono y se asegura con el cono de la nariz y la cinta (líneas de trazos). B, la piel se corta y se coloca a un lado para dejar al descubierto la capa de grasa subyacente. c, la grasa y glándulas suprayacente (mostrado en gris) son empujados a un lado para exponer la tráquea. La cinta se utiliza para asegurar la piel que lo recubre (líneas discontinuas). D, La tráquea se diseca de la musculatura. Electrónico, la visualización de los anillos traqueales indica la remoción exitosa de los músculos que lo recubre. Haga clic aquí para ver la imagen más grande.
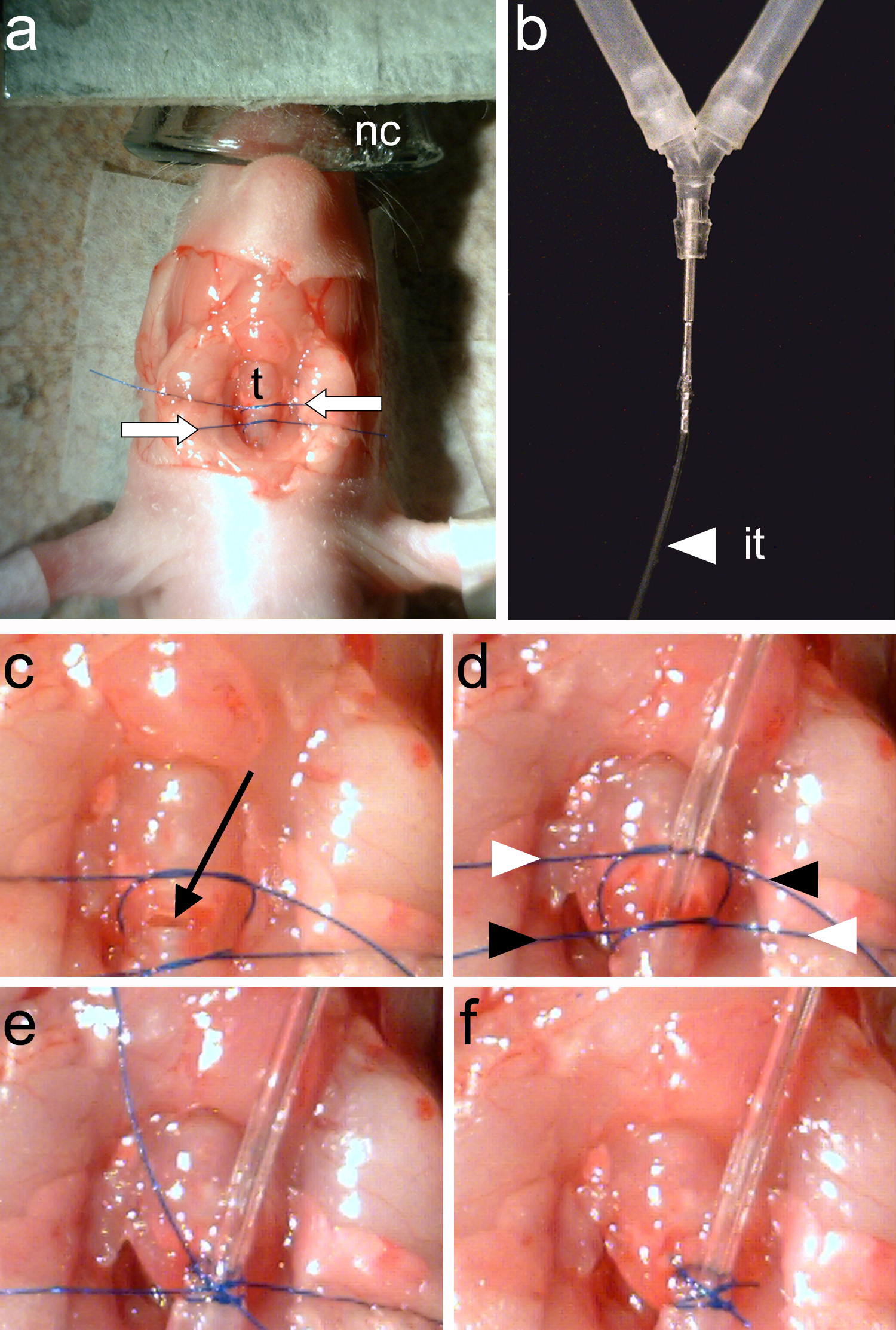
Figura 4. Intubating animal. Una, dos hilos de sutura (flechas blancas) están empatados alrededor de la tráquea(T). B, El tubo de intubación (ella) debe estar bien conectado al tubo y del animal del ventilador. C, Una traqueotomía se hace entre los dos hilos de sutura (flecha negro). D, se inserta el tubo de ventilación y el dos hilos de sutura se aprietan. Los extremos de los hilos se tensan de nuevo de manera cruzada (indicado por las puntas de flecha en blanco y negro). E, Las terminaciones de sutura se atan. F, Las terminaciones de sutura se recortan y la intubación se ha completado. Haz clic aquí para ver la imagen más grande.
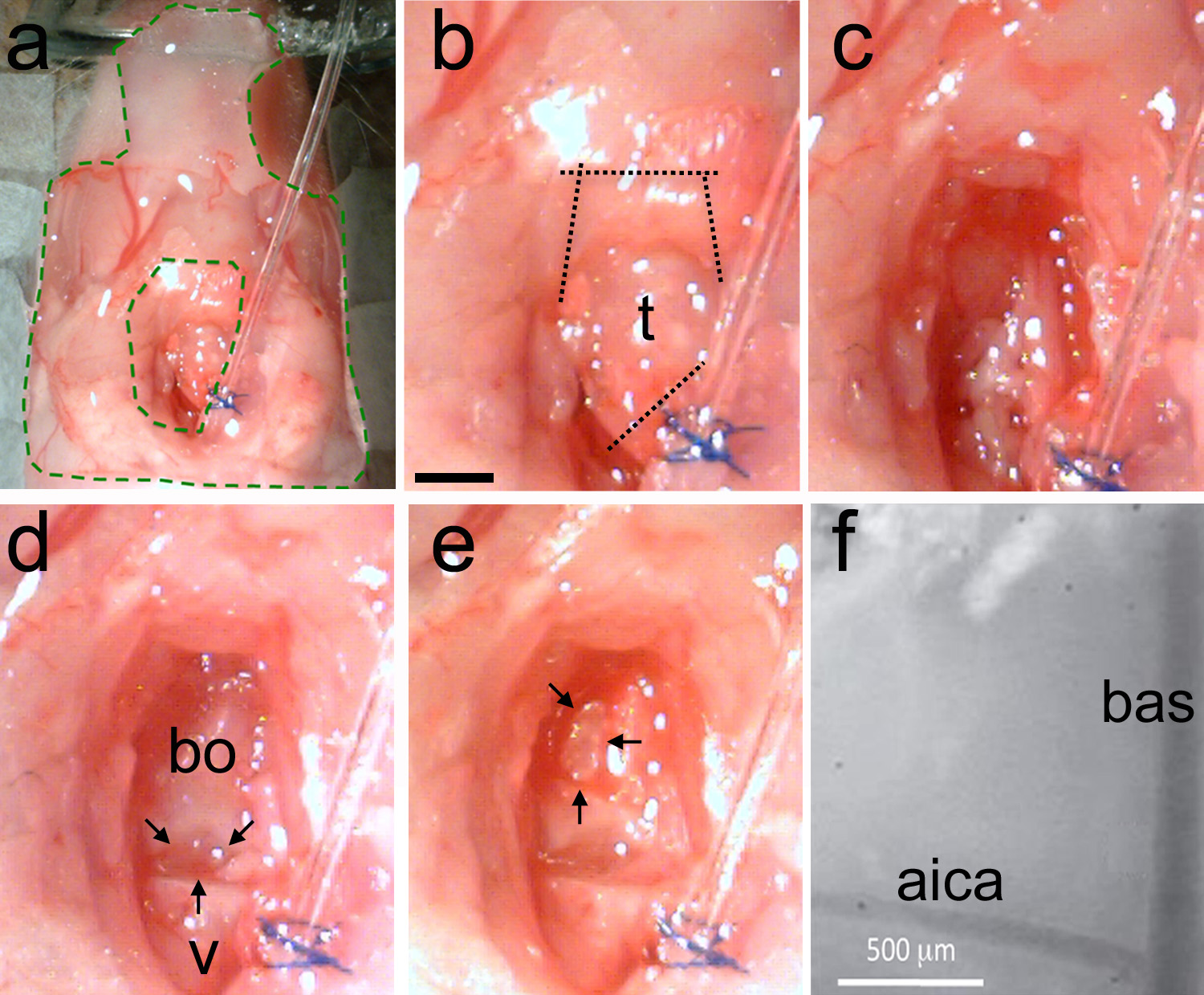
Figura 5. Extracción de la tráquea y hacer la craneotomía. Una, La preparación se estabiliza con elastómero (área INSI de verde líneas discontinuas). B, La tráquea se identifica y luego se hacen cortes primero para separar la tráquea lejos del tubo de la intubación, y a continuación, para cortar los músculos de la mandíbula (líneas de puntos). c, Limpiar la superficie del cráneo usando romo técnica para eliminar el músculo y utilizar papel absorbente para eliminar la grasa y la sangre. d, Ejemplo de un área limpia muestra las últimas vértebras (v) y el hueso basi-occipital (bo). Hay una brecha natural entre los dos huesos (flechas negras). Electrónico, uso de un microtaladro o limpiador ultrasónico delgada del cráneo en forma de D invertida (flechas negras). Romper suavemente el cráneo adelgazada y retire el trozo de hueso. Vasculatura Landmark debe ser visible f, Vista de gran ampliación de los monumentos vasculares en la superficie del tronco cerebral expuesto.. Bas = arteria basilar; AICA = arteria cerebelosa inferior. La barra de escala en b = 1 mm, se aplica a ce.highres.jpg "target =" _blank "> Haga clic aquí para ver la imagen más grande.
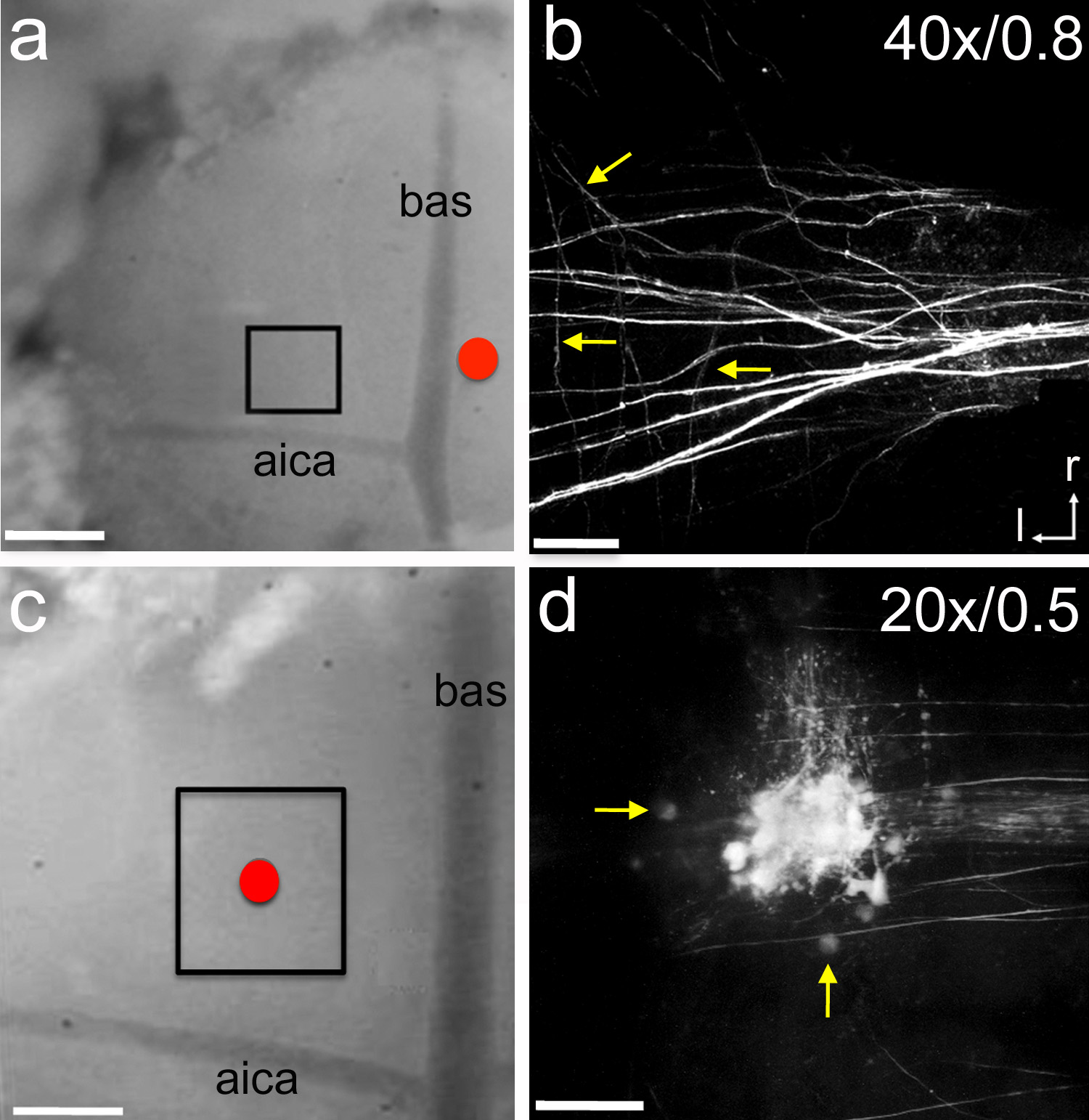
Figura 6. Electroporación de trazadores neuronales. A, un electrodo de vidrio que contiene el trazador neuronal micro-rubí se colocó cerca de la línea media (círculo rojo). El trazador se sometió a electroporación usando 7 segundos impulsos largo -5 μA entregan cada 14 segundos durante 15 minutos. Después de 1 hora de tiempo de recuperación de la zona en caja fue fotografiada con un microscopio de dos fotones. Rata P1 cachorro. B, z-stack imagen Ejemplar del axón aferente etiquetado en el MNTB. Las flechas apuntan a las ramas colaterales individuales. C, un electrodo de vidrio lleno de micro-rubí se posicionó en la cima de la MNTB (círculo rojo). El trazador se sometió a electroporación utilizando los mismos ajustes descritos en a. Después de 1 hora de tiempo de recuperación del área de caja fuefotografiada con un microscopio de dos fotones. Las crías de rata P5. D, z-stack imagen Ejemplar de células y axones marcados en la MNTB. Las flechas indican células individuales MNTB. Etiquetas en byc indican aumento del objetivo y la apertura numérica, respectivamente. La barra de escala en una y c = 300 m; barra de escala en b = 45 m; barra de escala en d = 90 m. AICA = arteria cerebelosa inferior; bas = arteria basilar; R = rostral; l = lateral. Haz clic aquí para ver la imagen más grande.
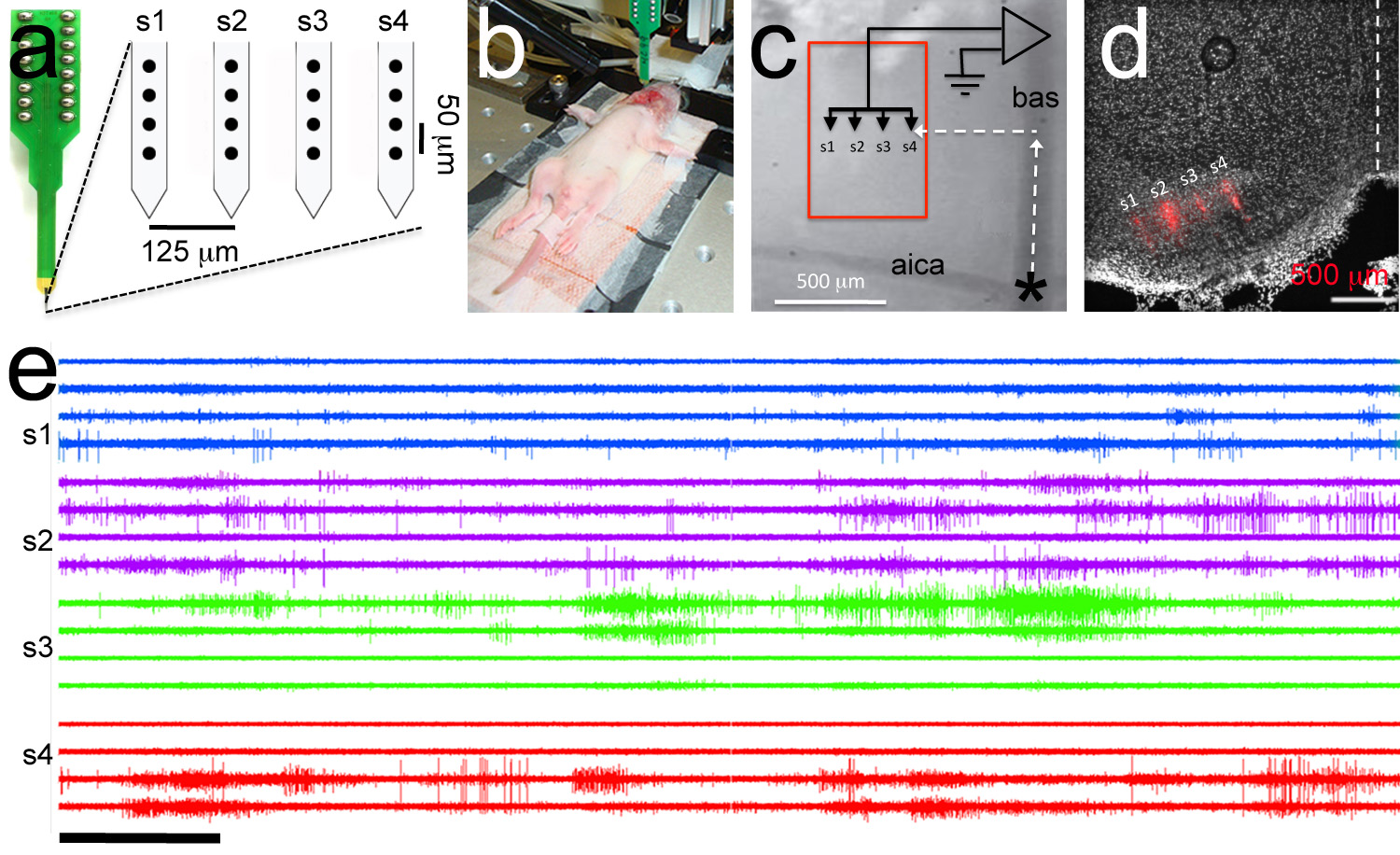
Figura 7. Targeted grabación polytrode. Un Polytrode consta de 4 espigas con 4 electrodos por espiga (círculos negros). Distancias intra-e inter-espiga entre electrodos se indican. B, imagen Ejemplar de experimentos de electrofisiología. Un electrodo de referencia se inserta en la cavidad bucal y un ploytrode está conectado a la headstage. Las crías de rata P6. C, Superior de ver la ampliación de la vasculatura de puntos de referencia utilizados para polytrode focalización. El polytrode se posiciona mediante coordenadas rostral-laterales para atacar el núcleo medial del cuerpo trapezoide (recuadro rojo). D, post hoc análisis histológico demuestra correcta orientación de la polytrode recubierto de Dil (pista polytrode se muestra en rojo). E, Ejemplar múltiples -unidad de grabación. Para Trace es el mismo que para el electrodo en el panel A. Dentro de grabaciones de vástago tener el mismo color. La barra de escala en e = 5 segundos. Haga clic aquí para ver la imagen más grande.
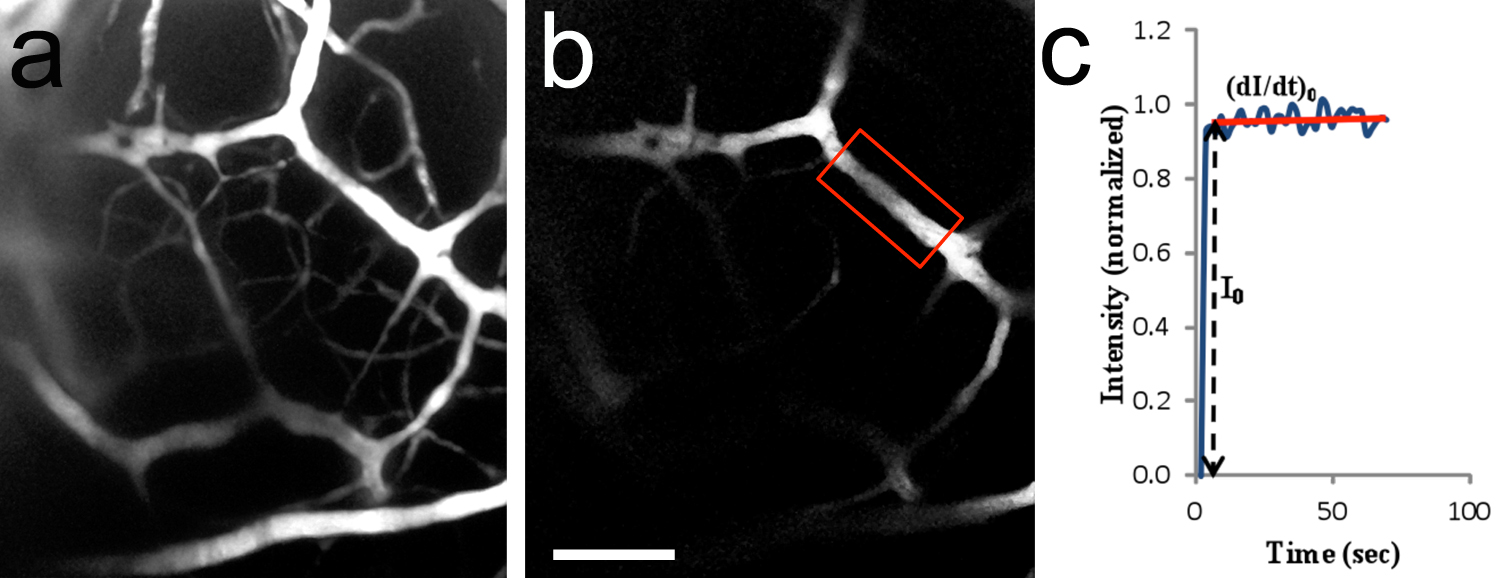
Figura 8. In vivo de dos fotones de microvasos cerebrales. una imagen 2-D (colapsado pila Z) de la vasculatura del cerebro después de la perfusión de TRITC-dextrano 155 kD en la arteria carótida. El área observada es similar a la mostrada en la Figura 7c. 20x/0.5 objetivo de inmersión en agua. Las crías de rata P10. B, Región de interés (ROI) utilizados para medir la intensidad de fluorescencia (región encerrada cuadro rojo). El microvasos tenía un diámetro de ~ 14,2 micras y se encuentra 182 m por debajo de la superficie del tronco cerebral. C, curva típica de la intensidad de fluorescencia (valor normalizado) como una función del tiempo. I 0 es el incremento gradual de la intensidad de fluorescencia en el retorno de la inversión cuando la solución de fluorescencia sólo se llena la luz del vaso. (Di / dt) 0 y 0 se utilizan para determinar la permeabilidad microvascular al soluto. La permeabilidad a TRITC-dextrano 155 kD se calculó que era 1,5 x 10 -7 cm / seg.La barra de escala en b = 100 micras, se aplica a un archivo. Haga clic aquí para ver la imagen más grande.
Discusión
El tiempo es crítico. Un investigador con experiencia debe ser capaz de completar este protocolo en 1 hora (pasos 1-3). Los tiempos establecidos para los diferentes pasos se supone un nivel medio o alto de especialización. Traqueotomía y la intubación adecuada y oportuna es fundamental, ya que un mal control de la ventilación puede provocar asfixia y muerte del animal. Aclaramiento cuidadoso de los tejidos musculares y de grasa es también muy importante, ya que los errores pueden conducir a la hemorragia no controlada y la muerte del animal. Del mismo modo, en la preparación de la arteria carótida para la inserción de una cánula, hay que apretar y cortar la arteria cuidadosamente, si el nudo del hilo se afloja la hemorragia no controlada se llevará a cabo. Por último, la craneotomía debe hacerse con cuidado, sin interrumpir su vasculatura hitos. Eliminación descuidada de la capa meníngea externa (duramadre) puede llevar a un sangrado severo y el daño de la irrigación arterial.
Ajustes de ventilación se eligen de acuerdo con la edad del animal.La mayoría de los proveedores comerciales proporcionan información útil acerca de estos ajustes. Experimentos en ratas mayores de P15 requerirán el uso de un gran ventilador para animales. Los animales adultos pueden no necesitar ventilación si anestesiados con ketamina / xilazina, pero se recomienda la intubación para evitar fluido que entra en la tráquea.
Una limitación principal de este protocolo es que los experimentos sólo se pueden realizar de forma aguda. En nuestro laboratorio hemos realizado experimentos que duran entre dos y hasta diez horas. Una segunda limitación es que los experimentos tienen que realizarse bajo anestesia. Por lo tanto, la elección de anestesia es una variable importante a considerar en la planificación y diseño de experimentos. Un problema relacionado es que los animales recién nacidos pueden ser especialmente sensibles a una sobredosis. Por ejemplo, si la elección de la ketamina mezcla / xilazina, calcular la dosis en función del peso de las crías y administrar medicamentos a ⅓ del volumen máximo. Compruebe el estado del animal cada 5-10 minutos en los pies pizca respuesta. Si se utiliza el isoflurano, también es necesario tomar precauciones para mantener un ambiente seguro para el investigador (ventilación adecuada, y un vaporizador calibrado correctamente).
El microscopio estereoscópico se puede montar en un soporte flexible para ajustar el ángulo de visión y facilitar el despacho de espacio para colocar los electrodos y la reubicación del animal para el microscopio de dos fotones. El uso de una batería para alimentar el ventilador puede facilitar el desplazamiento de los animales y reducir los artefactos eléctricos durante los experimentos de electrofisiología. Para este fin, un pequeño tablero (7,5 x 12 pulgadas) se puede utilizar para montar juntos el ventilador, la almohadilla de calefacción y la anestesiado de los animales (Figura 2a). Una modificación útil e importante para esta configuración es la adición de un dispositivo para el seguimiento de los signos vitales durante la cirugía. Un oxímetro u otros dispositivos analógicos pueden ser utilizados en función del presupuesto de laboratorio.
Este protocolo se ha utilizado con la electrofisiología y la imagen se reuniócapachos, incluyendo grabaciones de patch clamp 8,10,11, grabaciones polytrode (Figura 7), y de dos fotones 9 (Figuras 6 y 8). Una posible aplicación futura sería combinar estos métodos para atacar a las células marcadas con fluorescencia para el registro electrofisiológico 16.
Las nuevas aplicaciones de imágenes también pueden incluir 2-D o de series de tiempo 3-D utilizando microscopía de dos fotones. Por ejemplo, el uso de bolo de carga de indicadores de calcio para estudiar la actividad neuronal de tronco cerebral y las poblaciones de células gliales. Como se muestra en la Figura 8, una solución de colorante se inyecta en la circulación de la sangre a través de la arteria carótida se puede utilizar para generar imágenes de alto contraste de la vasculatura del cerebro. Como el colorante de fluorescencia llena el lumen de microvasos y se propaga en el tejido circundante, que puede ser utilizado no sólo para el cálculo de la permeabilidad de solutos aparente de la barrera de sangre del cerebro, sino también el coeficiente de difusión de solutosciente en el tejido cerebral 3. Una razón principal para la inyección de los solutos marcados con fluorescencia a través de la arteria carótida es que la solución de colorante puede ir directamente a la microvasculatura del cerebro sin entrar en el corazón por primera vez como una inyección en la vena de la cola. Esto trae al menos dos ventajas. Una es que la concentración de colorante de fluorescencia en el lumen de microvasos puede ser prácticamente constante si la tasa de perfusión se fija en el sitio de canulación. Esto garantiza una determinación exacta de la permeabilidad barrera sangre-cerebro. Otra es que si un agente de ensayo está incluido en el perfundido, irá directamente a la barrera sangre-cerebro sin ser diluido o combinado con otros factores de la circulación del cuerpo.
Nuevos experimentos también pueden hacer uso de animales transgénicos con los reporteros fluorescentes codificadas genéticamente. Esto proporcionaría la ventaja de que no tendrían que ser cargado in situ de sondas fluorescentes (a menos que el diseño del experimentoafirma lo contrario), el ahorro de tiempo y, posiblemente, lo que permite para las preparaciones intactas más (por ejemplo, ventana craneal 17).
Por último, los experimentos se pueden realizar en otras regiones del tronco cerebral como la oliva inferior o el núcleo motor facial. El conocimiento de la neuroanatomía y el desarrollo de las poblaciones celulares específicas en una determinada especie, será importante para este fin, especialmente en lo puntos de referencia anatómicos pueden cambiar a medida que los animales crecen (Figura 1). Esperamos que este protocolo anima a otros a estudiar las estructuras del tronco cerebral ventral utilizando en electrofisiológicos in vivo y métodos de imagen.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el subsidio G12-RR003060 de NIH / CNRR / RCMI, conceder SC1HD068129 del Instituto Nacional Eunice Shriver de Salud Infantil y Desarrollo Humano, la Fundación Nacional para la Ciencia CBET 0.754.158 y PSC-CUNY 62337-00 40 de la City University de Nueva York.
Materiales
| Name | Company | Catalog Number | Comments |
| Absorbant pads | Kettenbach | Sugi 31603 | Other options may be available from different companies |
| Cautery | Braintree Scientific, INC | GEM 5917 | Other options may be available from different companies |
| Tetramethyl rhodamine Isothiocyanate dextran | Sigma | T1287-500MG | Other options may be available from different companies |
| Dissecting Chisel | Fine Science Tools | 10095-12 | Other options may be available from different companies |
| DiI | Invitrogen | V-22885 | Other options may be available from different companies |
| Elastomer | World Precision Instruments | KWIK-SIL | Other options may be available from different companies |
| Fine Scissors | Fine Science Tools | 14060-09 | Other options may be available from different companies |
| Forceps | Fine Science Tools | 11027-12,11617-12, 11616-16 | Other options may be available from different companies |
| Spring Scissors | Fine Science Tools | 15009-08 | Other options may be available from different companies |
| Heating pad | FHC | 40-90-2 | Other options may be available from different companies |
| Intubation tubing | Braintree Scientific, INC | BIO CO-KIT | Choose age appropriate size |
| Light source | Spach Optics | Schott Ace illuminator | Other options may be available from different companies |
| Micro drill | Braintree Scientific, INC | MD-1200 120V | Other options may be available from different companies |
| Paper tape | Walgreens | Generic brand | Other options may be available from different companies |
| Syringe filter | VWR | 28145-483 | Other options may be available from different companies |
| Syringe pump | VWR | 52459-008 | Other options may be available from different companies |
| Stereomicroscope | Olympus | SZ61 | Other options may be available from different companies |
| Suture | Ethicon | Prolene 86979 | 6-0 size |
| Tubing | Braintree Scientific, INC | Micro-Renathane (MRE033); SUBL-120 | Other options depending on pup’s age |
| Vaporizer (isoflurane) | Vetequip Incorporated | 911103 | Other options may be available from different companies |
| Ventilator (minivent) | Harvard Apparatus | 730043 | Use for P0-P12 rats |
Referencias
- Kerr, J. N. D., Denk, W. Imaging in vivo: watching the brain in action. Nat. Rev. Neurosci. 9 (3), 195-205 (2008).
- Sigler, A., Murphy, T. H. In vivo 2-photon imaging of fine structure in the rodent brain: before, during, and after stroke. Stroke. 41 (10), 117-123 (2010).
- Shi, L., Zeng, M., Sun, Y., Fu, B. M. Quantification of blood-brain barrier solute permeability and brain transport by multiphoton microscopy. ASME J. of Biomech. Eng. 136 (3), 031005-031005 (2014).
- Galambos, R., Schwartzkopff, J., Rupert, A. Microelectrode study of superior olivary nuclei. Am. J. Physiol. 197, 527-536 (1959).
- Goldberg, J., Brown, P. B. Response of binaural neurons of dog superior olivary complex to dichotic tonal stimuli: some physiological mechanisms of sound localization. J. Neurophysiol. 32 (4), 613-636 (1969).
- Guinan, J. J., Guinan, S. S., Norris, B. E. Single auditory units in the superior olivary complex I: responses to sounds and classifications based on physiological properties. Intern. J. Neurosci. 4, 101-120 (1972).
- Spirou, G. A., Brownell, W. E., Zidanic, M. Recordings from cat trapezoid body and HRP labeling of globular bushy cell axons. J. Neurophysiol. 63 (5), 1169-1190 (1990).
- Khosrovani, S., Der Giessen, R. S. V. a. n., De Zeeuw, C. I., De Jeu, M. T. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proc. Natl. Acad. Sci. U.S.A. 104 (40), 15911-15916 (2007).
- Rodríguez-Contreras, A., Van Hoeve, J. S., Habets, R. L., Locher, H., Borst, J. G. G. Dynamic development of the calyx of Held synapse. Proc. Natl. Acad. Sci. U.S.A. 105 (14), 5603-5608 (2008).
- Lorteije, J. A., Rusu, S. I., Kushmerick, C., Borst, J. G. G. Reliability and precision of the mouse calyx of Held synapse. J. Neurosci. 29 (44), 13770-13784 (2009).
- Tritsch, N. X., Rodríguez-Contreras, A., Crins, T. T., Wang, H. C., Borst, J. G. G., Bergles, D. E. Calcium action potentials in hair cells pattern auditory neuron activity before hearing onset. Nat. Neurosci. 13 (9), 1050-1052 (2010).
- Tong, H., Steinert, J. R., Robinson, S. W., Chernova, T., Read, D. J., Oliver, D. L., Forsythe, I. D. Regulation of Kv channel expression and neuronal excitability in rat medial nucleus of the trapezoid body maintained in organotypic culture. J. Physiol. 588 (9), 1451-1468 (2010).
- Sonntag, M., Englitz, B., Kopp-Scheinpflug, C., Rübsamen, R. Early postnatal development of spontaneous and acoustically evoked discharge activity of principal cells of the medial nucleus of the trapezoid body: an in vivo study in mice). J. Neurosci. 29 (30), 9510-9520 (2008).
- García-Villalón, A. L., Roda, J. M., Alvarez, F., Gómez, B., Diéguez, G. Carotid blood flow in anesthetized rats: effects of carotid ligation and anastomosis. Microsurgery. 13 (5), 258-261 (1992).
- Yuan, W., Lv, Y., Zeng, M., Fu, B. M. Non-invasive method for the measurement of solute permeability of rat pial microvessels. Microvasc. Res. 77 (2), 166-173 (2009).
- Kitamura, K., Judkewitz, B., Kano, M., Denk, W., Haüsser, M. Targeted patch-clamp recordings and single-cell electroporation of unlabeled neurons in vivo. Nat. Methods. 5 (1), 61-67 (2008).
- Mostany, R., Portera-Cailliau, C. A method for 2-photon imaging of blood flow in the neocortex through a cranial window. J. Vis. Exp. (12), (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados