Method Article
方法以使对新生儿鼠害的腹头骨开颅手术
摘要
一种手术方法被描述,暴露腹头骨在新生大鼠。使用这种方法,可以打开一个开颅麻醉幼仔的脑干进行急性电生理和双光子显微镜实验。
摘要
采用了开颅手术,在体内实验提供了一个机会,探讨不同的细胞过程的动态在哺乳动物的大脑在成年和发展过程中。虽然大多数体内方法使用一个开颅研究位于背侧的大脑区域,脑干区域如脑桥,位于腹侧保持相对充分研究。该协议的主要目标是促进进入脑干腹侧结构,使他们能够利用电生理和影像学方法加以研究的体内 。这种方法允许研究的远距离轴突结构的变化,电活动的单一模式和细胞的合奏,以及新生动物的变化,血脑屏障的通透性。虽然这个协议被用于大部分研究在新生大鼠听觉脑干,它可以很容易地适应于其他啮齿动物的研究,如新生儿小鼠,成年罗登TS等脑干区域。
引言
在荧光成像和电生理技术组合使用开颅允许监测血流量,血脑屏障通透性和测量神经元和神经胶质细胞在活的动物1-3的活性。几个实验室都用这个方法来洞察在健康和疾病状态脑生理学,但差距仍然在我们的这些进程的发展过程中是如何产生的理解。此外,大多数研究都集中在那些容易从头骨的背表面接触,这样,脑干腹侧结构与不同的生理作用进行了研究,大多采用体外方法的大脑区域。
该协议的主要目标是提供对啮齿动物的头骨腹开开颅手术的方法。这种方法是改编自大型哺乳动物如狗和猫的感官神经生理学RECO进行的经典研究听觉脑干4-7 rdings。在此协议然而,有一个在新生儿动物进行该过程的新颖的挑战。使用血管的地标,这个改编协议之前已用于研究新生大鼠,成年小鼠和其他脑干区域,如劣质橄榄8-11( 图1)的听觉脑干。
腹开颅比现有的方法来研究脑干腹侧核的主要优点是它提供了直接访问的活体动物兴趣的结构。例如,上橄榄复杂的听觉细胞被本地化为几十微米的距离脑表面,这对探针的目标的位置和使用双光子成像方法,其中成像深度可以通过以下方式限定到0.5mm重要组织光散射和吸收。腹开颅还提供了制备具有相对完整的神经连接,WH非物质文化遗产被破坏的急性和器官切片制剂12。而相比之下,其他的协议, 在体内神经生理学实验13,腹侧的方法可以用多电极记录和提供有关蜂窝合奏信息成像方法相结合( 图6和图7)。最后,在与该协议结合荧光标记的溶质可在血管注射来衡量溶质( 图8)的变化血脑屏障通透性。
研究方案
以下协议遵循的机构动物护理和使用委员会(IACUC)在该纽约城市大学设立的动物护理指引。
1,动物插管(10-20分钟)
- 手术前准备哺乳动物林格液。组装外科手术刀具,加热垫,并在板凳上小动物呼吸机( 图2)。
- 对于血脑屏障渗透性测量使加入10ml 1%牛血清白蛋白(BSA)溶液中林格和溶解TRITC-葡聚糖155 kD的8毫克/毫升,以1%BSA溶液中,为25mm注射器过滤器(0.2微米过滤溶液孔径),并存储在一个在黑暗中箔覆盖的注射器。
- 用异氟烷麻醉动物。对感应和1.5-3.0%的维护使用5.0%。备选地氯胺酮(41.7毫克/千克)和赛拉嗪(2.5毫克/公斤体重)的混合物都可以使用。麻醉深度可以通过脚趾捏反射检查上肢和下肢。
- 氯胺酮随后的剂量(41.7毫克/公斤体重)和甲苯噻嗪(2.3毫克/公斤体重),应给予最大剂量,以避免过量的⅓增量。利用啮齿类动物呼吸机的建议,以抵消甲苯噻嗪引起的呼吸抑制。
- 将麻醉的小狗趴在它的背侧,并取得其头部用来传递麻醉剂( 图3a)的塑料圆锥。
- 固定动物用胶带上的前肢和尾巴( 图3a)。
- 以确保小狗的头一个替代方法是使用连接到一个金属棒头板。
注意 :请确保加热垫设置为37℃,以避免体温过低( 图3a)。
- 用剪刀( 图2b),以使一个纵向和皮肤上的四个横向切口覆盖在颈部(图3b)。用生硬的技术,剖析皮肤和使用镊子把它放在一边( 图2c和3c)。
- 用胶带保持肌肤下来。稳定的头部在水平位置( 图3c)。
- 使用弹簧剪刀( 图2d)和生硬的技术,推腺体和脂肪层一边,露出气管( 图3c)。识别颈动脉的位置。
- 保持颈动脉远离气管。
注 :穿刺颈动脉可导致大量失血而死亡小狗的。
- 保持颈动脉远离气管。
- 使用弹簧剪刀( 图2d)解剖纵向肌肉覆盖气管。切纵肌位于下气管( 图3d)。
注 :气管环应清晰可见( 图3e)。- 运用镊子( 图2c),配合周围的气管两片缝合。连衣裙缝线将确保通风管和第二线将用于关闭气管嘴侧的通风管的插入点( 图4a)。
注 :润经常暴露组织林格氏液,以防止脱水。
- 运用镊子( 图2c),配合周围的气管两片缝合。连衣裙缝线将确保通风管和第二线将用于关闭气管嘴侧的通风管的插入点( 图4a)。
- 使用弹簧剪刀( 图2d)就位于放置在步骤1.6.1( 图4c),两个线程之间的气管环中的一个切口。
注意 : 请确保没有液体进入气管开放。流体在气管会导致窒息。 - 插入插管( 图4b)进入气管,拧紧下部的线程来将其固定。使用镊子( 图2c),拧紧螺纹上以关闭气管后到插管的插入点。
- Tighten和修剪两个线程( 图4d-F)的两端。
注 : 蒸气的插管内是气流控制的一个好兆头。
- Tighten和修剪两个线程( 图4d-F)的两端。
- 迅速切换的异氟醚供应呼吸机。根据动物的体重调整的每搏输出量和通风量。
- 密封露出的周围组织与弹性体( 图5a)。保持湿润,洁净的表面。
2,气管和肌肉去除,露出颅骨(5-10分钟)
- 使用弹簧剪刀( 图2d),以切断相邻的通风管的气管。执行两个切口沿着口腔内的肌肉壁,以暴露的上腭的尾端( 图5b)。
注 :如有必要,可使用cauterizer止血。不受控制的出血会导致动物的死亡。 - 清洁区域内使用的林格氏液( 图5c)丰富金额。确定最后的椎骨和巴斯 - 枕骨(图5d)之间的差距。
注意 :骨头之间的间隙是有用的头骨的地标来定位脑干结构。下橄榄位于下了这一空白。听觉上橄榄复合体位于下的巴斯-枕骨从这个缺口吻端方向(参见图1)。 - 使用镊子( 图2c)和弹簧剪刀( 图2d)的清洁区。请勿刺破血管。
注 :如有必要,烧灼止血。- 后露出的面 积是干净的脂肪和肌肉组织,分离巴斯-枕骨和最后椎骨的空间应该是可见的( 图5d)。
3,开颅手术(15-30分钟)
- 用微型钻头或超声波清洁剂。找到内侧壁上的肺大泡的。
- 薄颅骨通过做一个倒立三维形状,直到相关动脉均可见( 图5e)。
注 :基底动脉(BAS)在脑干中线之上运行。小脑前下动脉(AICA)双侧分支并能可靠地作为一个具有里程碑意义,因为它在不同的动物恒定位置。 - 当颅骨变薄,用解剖凿( 图2e)轻轻地打破它。取出骨片用钳子( 图2c)。另外,解除和使用弯曲的针折断的头骨。
注意 :重复此过程,直到开颅手术的大小和形状适合于计划 的实验。在BAS和AICA应通过硬脑膜膜( 图5f)是可见的。
- 薄颅骨通过做一个倒立三维形状,直到相关动脉均可见( 图5e)。
- 清洁该部位数次用新鲜林格液。使用吸水PADS干燥硬脑膜膜的表面上。
- 如有必要,可使用缝合针,除去硬脑膜膜而不替换或破坏的标志性浅动脉和小脑前下动脉。
注 :在硬脑膜穿刺脑脊液就会流出来。请用林格液的面积和整个实验过程中保持湿润。
- 如有必要,可使用缝合针,除去硬脑膜膜而不替换或破坏的标志性浅动脉和小脑前下动脉。
4,电生理实验
- 根据实验设计( 图7a)选择polytrode。用细画笔大衣与DiI荧光的polytrode。转移的DiI溶液倒入1毫升离心管中,浸画笔在溶液中和( 即使用立体镜)轻轻撞击视觉引导下的polytrode。开始在探针的尖端,并小心地继续下去,直到所有的电极被均匀地涂敷。
- 放置在口腔内的接地电极。加载polytrode到电极支架( 图7b 的)。
- 打开放大器,并检查所有的连接工作。
- 定位上面浅的电极在AICA(位置零)的分支点。通过使用适当的嘴侧-外侧坐标( 图7c)移动电极至所需的目标点。
- 把电极对大脑的表面,并将其移动到在步骤5-10微米的所需深度。
- 根据实验设计进行记录。保存的数据进行进一步的分析。
5,双光子成像实验
- 打开显微镜。设定激发波长和使用适当的发射滤波器。激发波长为800 nm和一个607±45 nm的带通滤波器的发射工作以及成像TRITC-葡聚糖。
- 确定左侧或右侧颈总动脉。用钝技术从相邻的结缔组织或神经解剖颈动脉。
- 挑选并保持颈动脉动脉止血。领带的颈动脉大约3枚缝合。
- 拧紧螺纹靠近心脏一侧,以阻止血液流动并保留其他两个线程松动。
- 用细剪刀做一个小切口在上绑线和下一个松散的线程之间的颈动脉成45°角。
注 :清洁血液用吸水纸。
- 导管插入颈总动脉。插入充满了TRITC-葡聚糖溶液插入颈内动脉约5毫米深的面向小狗的头切管。
- 拧紧动脉周围的其他两个线程持有油管和动脉在一起。拧紧螺纹,修剪和添加弹性体进一步稳定。
注意 :该管的另一侧与含有TRITC-葡聚糖溶液(在步骤1.1的方法制备)的注射器相连。
- 拧紧动脉周围的其他两个线程持有油管和动脉在一起。拧紧螺纹,修剪和添加弹性体进一步稳定。
- 固定在注射泵的注射器。
- 集的速度在小狗的颈动脉的血流量。打开注射器泵几秒钟,并手动检查该染料溶液可以注入到颈动脉。注意:假设在成年大鼠的颈动脉血液流动速率(240-280克)的约3毫升/分钟14,血流量为大鼠幼崽( 如 P10小狗称重15-25克)可被计算为范围从0.16-0.3毫升/分钟。
- 将动物在显微镜下的目标。注入荧光葡聚糖进入血液。
- 标识与5X物镜的空气对脑干腹侧感兴趣的领域。切换到20X或40X的目标(水浸泡,NA = 0.5或0.8,分别)集中的感兴趣区(ROI)的区域。
- 启动成像和调整图像采集参数( 如曝光时间,激光电源,检测器增益),直到在ROI的血管荧光强度进行优化( 即也不算低,但不饱和)。
- 打开注射泵,以将染料溶液注入到颈内动脉和获取时间序列在一个固定的焦平面上。
6。动物护理以下步骤
- 这是一个终端程序。在实验动物的结尾必须安乐死与戊巴比妥钠的过量(100毫克/公斤,腹腔注射)或经美国兽医协会安乐死安乐死准则的任何其他方法。
注 :灌注通过与林格液的心脏遵循的固定液,建议作进一步的组织学分析。
结果
神经示踪剂的电
内侧核梯形体(MNTB)是一组细胞中使用该协议之前已经研究了上橄榄复合体。例如,膜片钳吸量管,可用于电穿孔神经示踪剂( 图6)9。当吸液管被放置在中线附近, 如图6A所示 ,其结果是,decussating传入轴突被标记。一种双光子显微镜配备有高数值孔径水浸物镜可用于图像到达MNTB的纤维,包括非常精细侧支(在图6b中的箭头)。神经示踪剂也可以输送到MNTB直接, 如图6c所示 。其结果是MNTB细胞和传入轴突的标记,如可以通过成像可以理解具有较低的数值孔径水浸物镜( 图6d)。该米使用低倍率物镜的AIN优点是,更宽的视野可以被检查,并且,虽然这导致在空间分辨率的降低是由于较低的物镜的数值孔径,从个人MNTB细胞可以辨别阱(在图6d箭头) 。这些实验的年龄P1-P5的平均持续时间为3.1±1.4小时(N = 22幼崽)。
电生理记录
自发的点射是发展电活动的一种形式听取11,13发病前在单MNTB细胞中观察到。使用这种手术协议,也可以以多电极阵列(polytrodes)靶向到MNTB( 图7a-b)中。其结果是在MNTB细胞的合奏自发性活动的记录。 图7E示出了从P6大鼠的代表polytrode记录。在该实验中,polytrode用涂有亲脂性染料的DiI薄画笔(见步骤4.1)。执行该记录后的大脑进行处理,用于组织学分析和DiI荧光标记polytrode轨道的位置来确认正确定位到MNTB( 图7d)。实验了好半天P1-P6的平均持续时间为2.0±0.7小时(N = 33幼崽)。
测量微血管通透性
这个协议也可以被用于执行血管通透性的双光子成像实验。一种荧光溶质(TRITC-葡聚糖,分子量155 kD的,斯托克斯半径〜8.5毫微米)溶解在1%BSA的林格溶液并注入通过在颈动脉14插入插管脑循环。不同于尾静脉注射,此程序绕过心脏并介绍了荧光溶质直接进入大脑微循环。图8a说明血液血管的结果,从使用此程序的贴标质量。经过不断的灌注标记的溶质进入血流,可以得到的感兴趣区域的一个时移序列, 如图8b所示 。在感兴趣的区域中的总荧光强度脱机测量和数学模型用于确定血脑屏障通透性到荧光标记的溶质( 图8c)15。实验了好半天P9-P10的平均持续时间为2.3±0.8小时(n = 3的幼崽)。
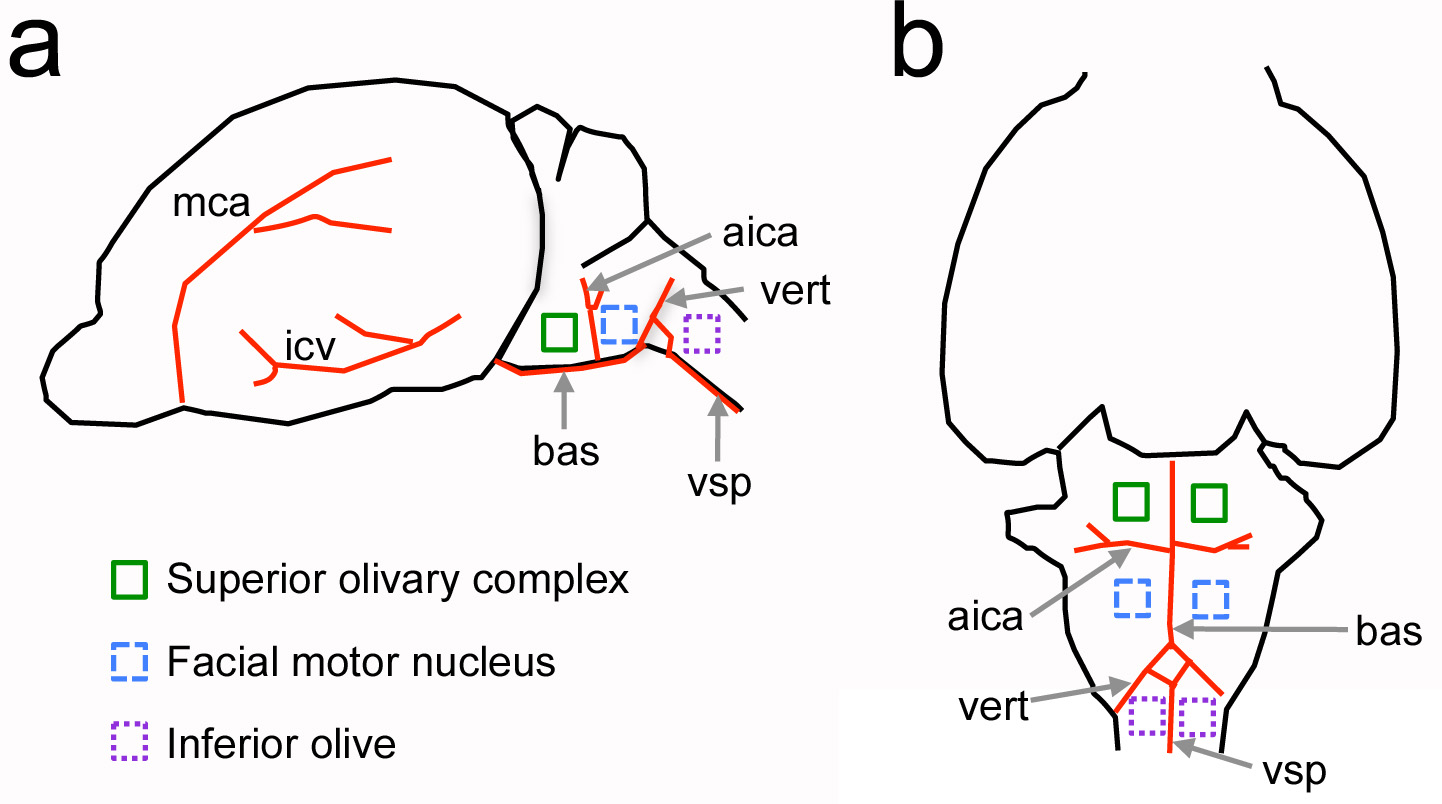
图1。脑干腹侧神经结构相对于新生儿大鼠血管标志性建筑的相对位置。一,大脑的侧视图,B,大脑的腹面观。如图利息红色和神经结构主要血管IND通过颜色的正方形icated。不按比例绘制。 AICA =小脑前下动脉; BAS =基底动脉; ICV =劣质脑静脉; MCA =大脑中动脉; VERT =椎动脉; VSP =腹侧脊髓动脉。 点击这里查看大图。

图2。手术的设置。一,手术可以在一个小面包板(1)搁在一个稳定的台面之上完成的。一个加热垫(2)和一个小动物呼吸机(3)可固定在面包板上,以方便在需要时移动整个准备。小动物呼吸机可以由电池来供电(4)。一种磁性夹持器(5)可以被用来确保用于递送麻醉剂的鼻锥。鼻锥可以也有助于确保头在一个稳定的位置。如果动物并不需要被重定位,显微操作(6)可用于位置探测器为电或神经示踪实验。光源(7)和体视镜(图中未显示)是必要的显微可视化:B过程中具有里程碑意义的结构,小剪刀是用来在步骤1.4℃,产钳术在步骤1.4,1.6.1,1.8和1.8.1中使用,D,弹簧剪刀步长1.5,1.6和1.7 的 E使用,解剖凿用于步骤3.1.2。在E = 1 mm弦杆,适用于BD。 点击这里查看大图。
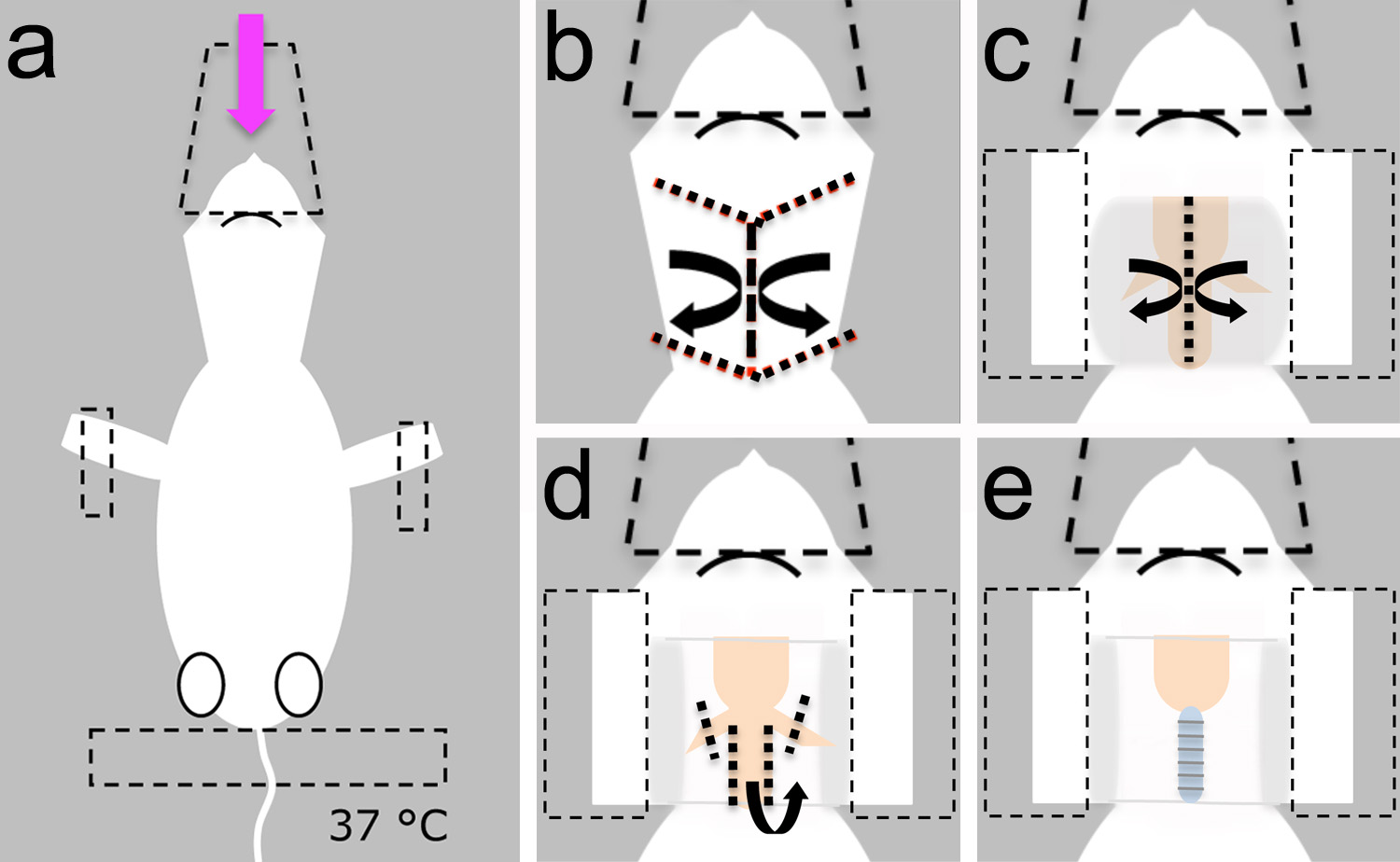
图3。暴露气管插管。一,将动物麻醉,置于俯卧位,并用鼻锥和磁带(虚线)。B时,皮肤被切割并置于一旁,露出底层的脂肪层C,其上覆的脂肪和腺体(示在灰色)被推开,露出气管。胶带是用来保护表面皮肤(虚线),D,气管是从肌肉解剖。E,气管环的可视化表示成功去除覆盖的肌肉。 点击这里查看大图。
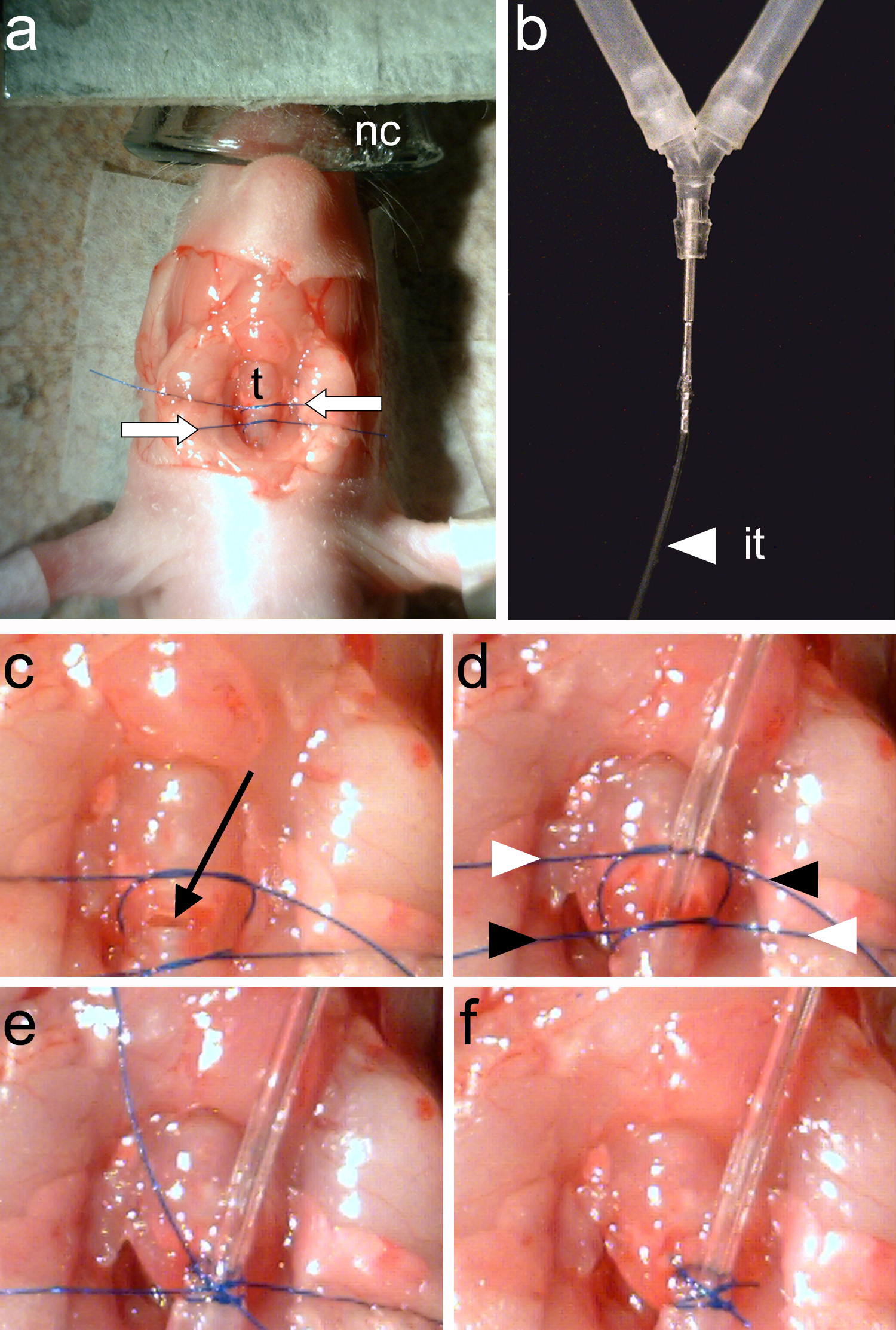
图4。插管的动物,一个,两个缝合线(白色箭头)周围的气管被缚(吨)B时,插管(它)必须紧紧连接到动物呼吸机。C的在y管,气管造口术在两缝合线(黑箭头)。D中,通风管被插入并之间所作的二期缝合线是否拧紧。螺纹的端于划线的方式(由白色和黑色箭头表示)再次收紧。E,缝合结局被缚。 楼全层缝合末梢被修剪和气管插管完成。 点击这里查看大图。
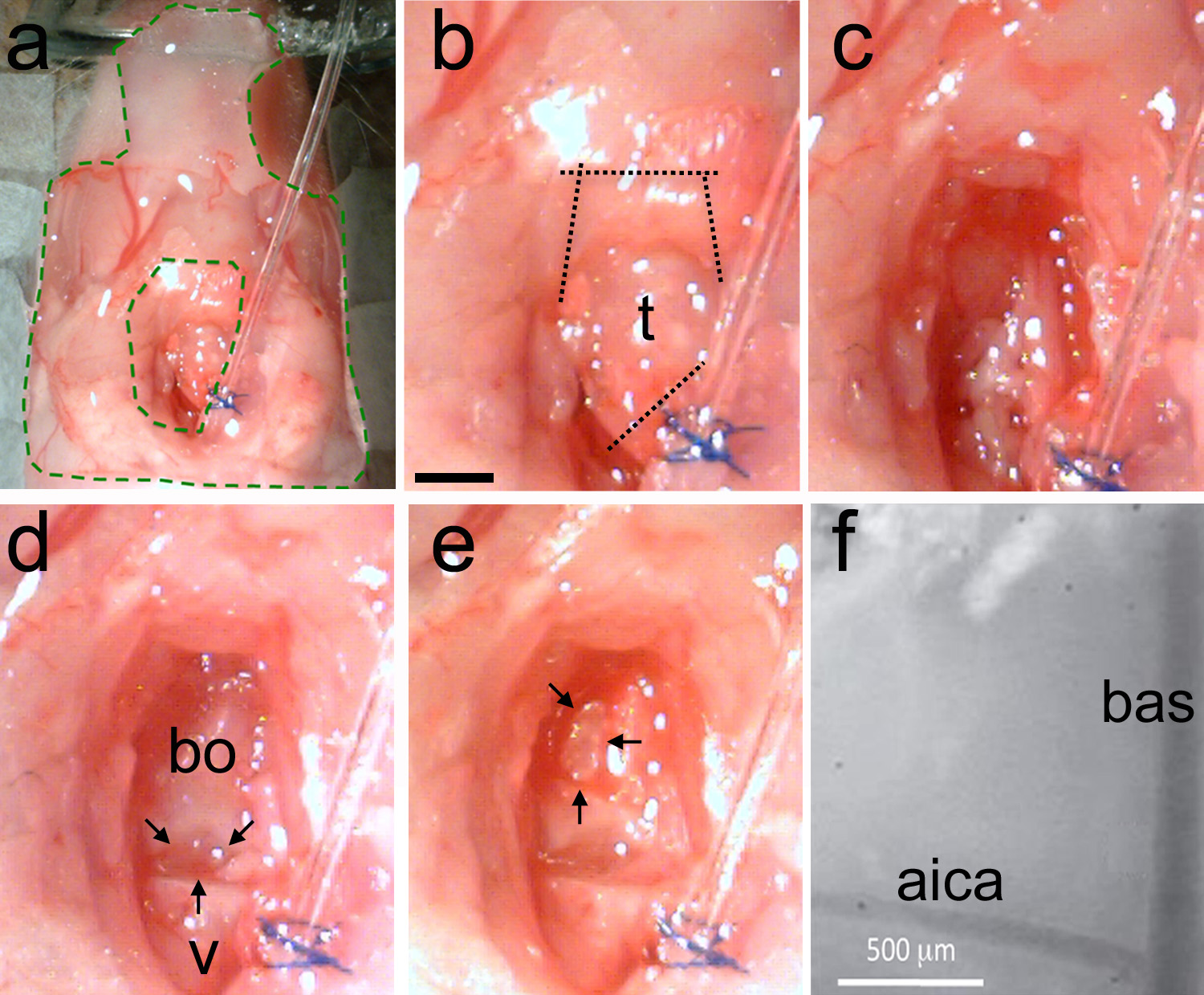
图5。取出气管并使得开颅手术。一个,该制剂是稳定的与弹性体(面积INSI德绿色虚线)。B时,气管被识别,然后切口的第一分离气管远离插管,然后切下颌骨肌肉(虚线)C,使用钝清洁颅骨的表面技术去除肌肉并用吸水纸以除去脂肪和血液。D,洁净区的实施例示出的最后一个椎骨(V)和巴斯-枕骨(BO)。还有就是两根骨头(黑色箭头)之间的天然差距。E,使用在一个倒置的D型(黑色箭头)微钻头或超声波清洗薄的头骨。轻轻地打破变薄颅骨,取出骨片。具有里程碑意义的血管应该是可见的。 楼对暴露脑干表面血管的地标高倍放大视图。 BAS =基底动脉; AICA =小脑前下动脉。在B = 1 mm弦杆,适用于行政长官。highres.jpg“目标=”_blank“>点击这里查看大图。
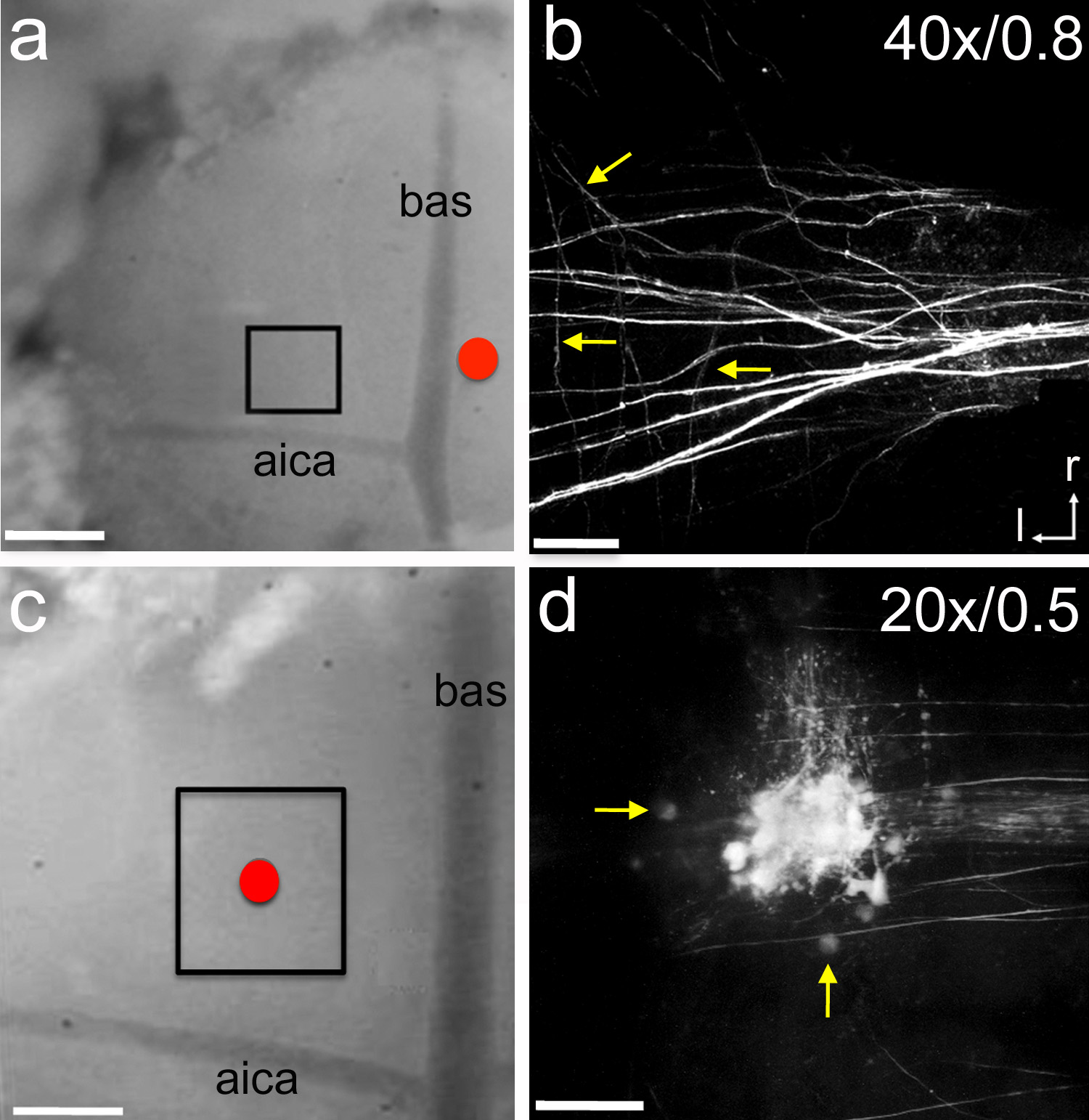
图6。神经示踪物的电穿孔。一,含神经示踪微红宝石玻璃电极置于中线附近(红色圆圈)。以7秒长-5μA脉冲15分钟,每14秒一个交付的示踪电穿孔。 1小时的恢复时间之后盒装区域进行成像用双光子显微镜。 P1大鼠幼鼠。b,则在MNTB传入轴突标记示例Z堆叠图像。箭头指向个别侧支C,充斥着微红宝石玻璃电极放置在MNTB(红圈)的顶部。使用一个描述的相同设置的示踪电穿孔。 1个小时的恢复时间之后盒装面积为成像用双光子显微镜。 P5大鼠小狗。D,在MNTB标记细胞和轴突的模范Z - Stack的图像。箭头表示单MNTB细胞。在b和c标签表示物镜放大倍数和数值孔径,分别。 ;在a和c = 300微米刻度条在B = 45微米比例尺;在D = 90μm的比例尺。 AICA =小脑前下动脉; BAS =基底动脉; R =喙; L =横向。 点击这里查看大图。
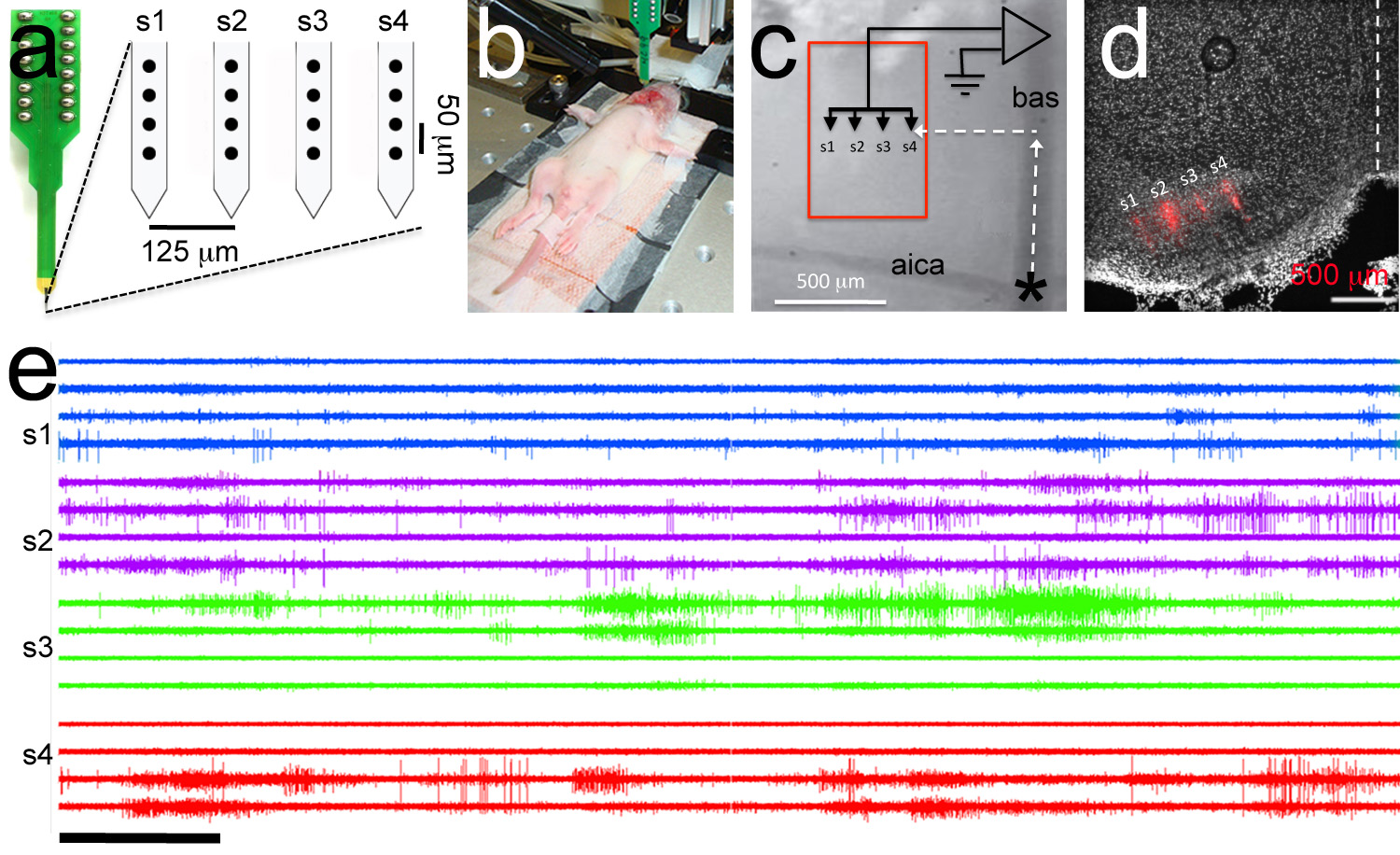
图7。针对性polytrode录音。一,Polytrode由4柄,每柄4电极(黑色圆圈)。电极之间的区域内和跨杆的距离表示。B, 电生理实验的模范形象。参比电极被插入到bucal腔和ploytrode连接到探头。 P6大鼠小狗。C,用于polytrode靶向血管的地标高倍看法。该polytrode是用喙,横向坐标为目标的内侧核梯形体(红色框)。D,POSTHOC组织学分析表明了DII-涂层polytrode的正确定位的(polytrode轨迹显示为红色)定位。E,多示例单位记录。跟踪顺序是相同的面板中一个电极的顺序。于柄部的记录有相同的颜色。在电子比例尺= 5秒。 点击这里查看大图。
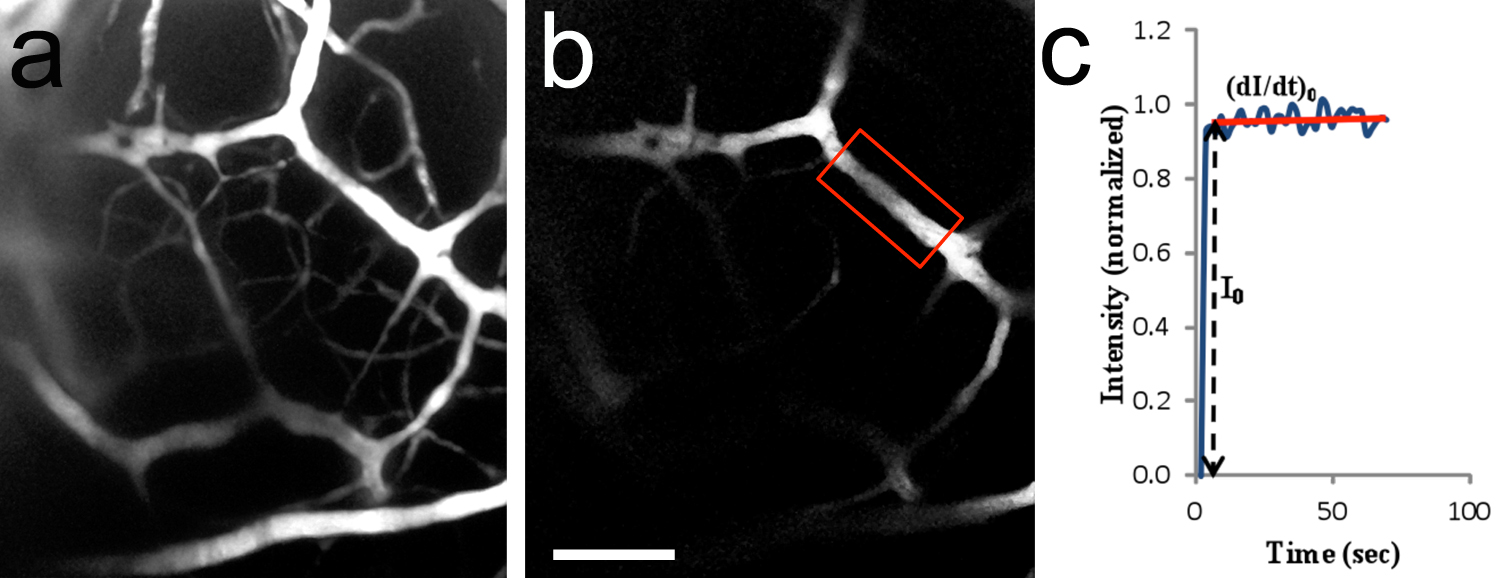
图8。 体内双光子脑微血管成像。一,二维脑血管图像(折叠的Z-堆栈)灌注TRITC-葡聚糖155 kD的进入颈动脉后。成像的区域是类似于在图7c中所示。 20x/0.5水浸泡的目的。 P10大鼠小狗,B,感兴趣区(ROI)用来测量荧光强度(红框封闭区域)。微血管的直径为〜14.2微米,位于182微米以下的脑干表面C,荧光强度(标准化值)的典型曲线作为时间的函数。 I 0是在ROI的步骤荧光强度增加时,荧光溶液刚好填满血管腔。 (的dI / dt)的0和I 0是用来确定微血管渗透性的溶质。通透性,TRITC-葡聚糖155 kD的经计算为1.5×10 -7 cm / sec的。在B = 100微米刻度条,适用于。 点击这里查看大图。
讨论
时间是至关重要的。一个有经验的研究人员应该能够完成这个协议在1小时内(步骤1-3)。说明对于不同的步骤,时间假设中等专业技术水平高。适当和及时的气管切开及插管是至关重要的,因为透气性差控制,可导致窒息的动物和死亡。肌肉和脂肪组织中的间隙细心也是很重要的,因为错误会导致无法控制的出血动物和死亡。同样地,准备颈动脉插管插入时,需要收紧并切断动脉小心,如果线程结松脱无法控制的出血会发生。最后,开颅手术应慎重,不破坏血管的地标。粗心罢免外聘脑膜层(硬膜),可导致严重的出血和动脉供应的伤害。
通风设置,根据动物的年龄选择。大多数商业供应商提供关于此类设置的有用信息。在年龄大于P15大鼠实验将需要使用大量的动物呼吸机。成年动物可能不需要通风如果用氯胺酮/赛拉嗪,但插管建议,以避免流体进入气管。
此协议中的一个主要限制是,实验只能剧烈进行。在我们的实验室,我们两个长达十几个小时之间进行的实验持久。第二个限制是实验有麻醉下进行。因此,麻醉的选择是在实验的规划和设计需要考虑的重要变量。一个相关的问题是,新生儿的动物可以是特别敏感的过量。例如,如果选择氯胺酮/甲苯噻嗪组合,计算的基础上的小狗的体重剂量和给药的药物在最大音量的⅓。由脚趾捏r检查下动物的状态每隔5-10分钟响应声学。如果使用异氟醚,也需要预防措施,以维持一个安全的环境,让调查员(适当通风,并正确校准蒸发器)。
在体视显微镜可被安装在柔性支架来调整视角和促进空间间隙放置的电极和安置动物的双光子显微镜。使用电池为呼吸机的供电可以方便移动的动物和在电生理学实验减少电气文物。为此,小面包板(7.5×12英寸),可用于装配在一起的换气装置中,加热垫和被麻醉的动物( 图2a)。一个有用的和重要的修改,这种设置是增加了装置的手术过程中监测生命体征。一血氧计或其它模拟设备可根据实验室预算使用。
该协议已被用于与电生理和影像学会见部门首长,包括膜片钳记录8,10,11,polytrode记录( 图7),和双光子成像9( 图6和图8)。一个可能的未来的应用将结合这些方法的电生理记录16靶向荧光标记的细胞。
新的成像应用中也可包括2-D或使用双光子显微镜的3-D时间序列。例如,使用钙指标丸剂负荷研究脑干神经元和神经胶质细胞群的活性。 如图8所示 ,染料溶液通过颈动脉注入血液循环,可以用来产生大脑脉管系统的高对比度图像。作为荧光染料填充微血管管腔并扩散到周围组织中,它可以不仅用于计算血脑屏障的表观渗透性溶质而且溶质扩散系数ficient在脑组织3。一个主要的原因为通过颈动脉注入荧光标记的溶质是,该染料溶液可以直接到在大脑微血管无需首先对心脏在尾静脉注射。这带来了至少两个优点。之一是,在微血管管腔的荧光染料的浓度可以是基本恒定的,如果灌注速率是固定在插管位置。这可确保准确测定血脑屏障通透性。另一个原因是,如果测试试剂被包括在灌注液,它会直接进入血 - 脑屏障而不会稀释或与自体循环的其他因素。
新的实验也可以采取转基因动物的基因编码的荧光记者的优势。这将提供以下优点:荧光探针不会需要在原位被加载(除非该实验的设计另有规定),从而节省时间和可能允许更多的完整制剂( 如颅窗口17)。
最后,实验可以在其他脑干区域如下橄榄或面部运动核来完成。知识神经解剖学在一个给定的物种特异性细胞群的发展将是重要的实现这一目标,特别是解剖标志可能会改变动物的生长( 图1)。我们希望该协议鼓励别人学习脑干腹侧结构采用活体电生理和影像学检查方法。
披露声明
作者什么都没有透露。
致谢
这项工作是由授出G12-RR003060从NIH / NCRR / RCMI支持,从儿童健康与人类发展,国家科学基金会CBET 0754158和PSC-CUNY 62337-00 40来自新城市大学尤妮斯Shriver国家学院授予SC1HD068129约克。
材料
| Name | Company | Catalog Number | Comments |
| Absorbant pads | Kettenbach | Sugi 31603 | Other options may be available from different companies |
| Cautery | Braintree Scientific, INC | GEM 5917 | Other options may be available from different companies |
| Tetramethyl rhodamine Isothiocyanate dextran | Sigma | T1287-500MG | Other options may be available from different companies |
| Dissecting Chisel | Fine Science Tools | 10095-12 | Other options may be available from different companies |
| DiI | Invitrogen | V-22885 | Other options may be available from different companies |
| Elastomer | World Precision Instruments | KWIK-SIL | Other options may be available from different companies |
| Fine Scissors | Fine Science Tools | 14060-09 | Other options may be available from different companies |
| Forceps | Fine Science Tools | 11027-12,11617-12, 11616-16 | Other options may be available from different companies |
| Spring Scissors | Fine Science Tools | 15009-08 | Other options may be available from different companies |
| Heating pad | FHC | 40-90-2 | Other options may be available from different companies |
| Intubation tubing | Braintree Scientific, INC | BIO CO-KIT | Choose age appropriate size |
| Light source | Spach Optics | Schott Ace illuminator | Other options may be available from different companies |
| Micro drill | Braintree Scientific, INC | MD-1200 120V | Other options may be available from different companies |
| Paper tape | Walgreens | Generic brand | Other options may be available from different companies |
| Syringe filter | VWR | 28145-483 | Other options may be available from different companies |
| Syringe pump | VWR | 52459-008 | Other options may be available from different companies |
| Stereomicroscope | Olympus | SZ61 | Other options may be available from different companies |
| Suture | Ethicon | Prolene 86979 | 6-0 size |
| Tubing | Braintree Scientific, INC | Micro-Renathane (MRE033); SUBL-120 | Other options depending on pup’s age |
| Vaporizer (isoflurane) | Vetequip Incorporated | 911103 | Other options may be available from different companies |
| Ventilator (minivent) | Harvard Apparatus | 730043 | Use for P0-P12 rats |
参考文献
- Kerr, J. N. D., Denk, W. Imaging in vivo: watching the brain in action. Nat. Rev. Neurosci. 9 (3), 195-205 (2008).
- Sigler, A., Murphy, T. H. In vivo 2-photon imaging of fine structure in the rodent brain: before, during, and after stroke. Stroke. 41 (10), 117-123 (2010).
- Shi, L., Zeng, M., Sun, Y., Fu, B. M. Quantification of blood-brain barrier solute permeability and brain transport by multiphoton microscopy. ASME J. of Biomech. Eng. 136 (3), 031005-031005 (2014).
- Galambos, R., Schwartzkopff, J., Rupert, A. Microelectrode study of superior olivary nuclei. Am. J. Physiol. 197, 527-536 (1959).
- Goldberg, J., Brown, P. B. Response of binaural neurons of dog superior olivary complex to dichotic tonal stimuli: some physiological mechanisms of sound localization. J. Neurophysiol. 32 (4), 613-636 (1969).
- Guinan, J. J., Guinan, S. S., Norris, B. E. Single auditory units in the superior olivary complex I: responses to sounds and classifications based on physiological properties. Intern. J. Neurosci. 4, 101-120 (1972).
- Spirou, G. A., Brownell, W. E., Zidanic, M. Recordings from cat trapezoid body and HRP labeling of globular bushy cell axons. J. Neurophysiol. 63 (5), 1169-1190 (1990).
- Khosrovani, S., Der Giessen, R. S. V. a. n., De Zeeuw, C. I., De Jeu, M. T. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proc. Natl. Acad. Sci. U.S.A. 104 (40), 15911-15916 (2007).
- Rodríguez-Contreras, A., Van Hoeve, J. S., Habets, R. L., Locher, H., Borst, J. G. G. Dynamic development of the calyx of Held synapse. Proc. Natl. Acad. Sci. U.S.A. 105 (14), 5603-5608 (2008).
- Lorteije, J. A., Rusu, S. I., Kushmerick, C., Borst, J. G. G. Reliability and precision of the mouse calyx of Held synapse. J. Neurosci. 29 (44), 13770-13784 (2009).
- Tritsch, N. X., Rodríguez-Contreras, A., Crins, T. T., Wang, H. C., Borst, J. G. G., Bergles, D. E. Calcium action potentials in hair cells pattern auditory neuron activity before hearing onset. Nat. Neurosci. 13 (9), 1050-1052 (2010).
- Tong, H., Steinert, J. R., Robinson, S. W., Chernova, T., Read, D. J., Oliver, D. L., Forsythe, I. D. Regulation of Kv channel expression and neuronal excitability in rat medial nucleus of the trapezoid body maintained in organotypic culture. J. Physiol. 588 (9), 1451-1468 (2010).
- Sonntag, M., Englitz, B., Kopp-Scheinpflug, C., Rübsamen, R. Early postnatal development of spontaneous and acoustically evoked discharge activity of principal cells of the medial nucleus of the trapezoid body: an in vivo study in mice). J. Neurosci. 29 (30), 9510-9520 (2008).
- García-Villalón, A. L., Roda, J. M., Alvarez, F., Gómez, B., Diéguez, G. Carotid blood flow in anesthetized rats: effects of carotid ligation and anastomosis. Microsurgery. 13 (5), 258-261 (1992).
- Yuan, W., Lv, Y., Zeng, M., Fu, B. M. Non-invasive method for the measurement of solute permeability of rat pial microvessels. Microvasc. Res. 77 (2), 166-173 (2009).
- Kitamura, K., Judkewitz, B., Kano, M., Denk, W., Haüsser, M. Targeted patch-clamp recordings and single-cell electroporation of unlabeled neurons in vivo. Nat. Methods. 5 (1), 61-67 (2008).
- Mostany, R., Portera-Cailliau, C. A method for 2-photon imaging of blood flow in the neocortex through a cranial window. J. Vis. Exp. (12), (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。