Method Article
שיטה להרוויח Craniotomy על גולגולת הגחון של מכרסמים ילוד
In This Article
Summary
שיטה כירורגית מתוארת לחשוף את גולגולת הגחון בחולדות ילוד. שימוש בגישה זו ניתן לפתוח craniotomy לבצע אלקטרופיזיולוגיה חריפה וניסויים במיקרוסקופ שני פוטונים בגזע המוח של גורים מורדמים.
Abstract
השימוש בפתיחת גולגולת לin vivo ניסויים מספקת הזדמנות לחקור את הדינמיקה של תהליכים תאיים שונים במוח של היונקים בבגרות ובפיתוח. למרות שרוב in vivo גישות להשתמש craniotomy ללמוד אזורים במוח הממוקמים בצד הגב, אזורי גזע המוח כגון גשר המוח, הממוקם בצד הגחון יישארו יחסית understudied. המטרה העיקרית של פרוטוקול זה היא כדי להקל על גישה למבני גזע המוח הגחון, כך שהם יכולים להיות למדו בvivo באמצעות אלקטרו ושיטות הדמיה. גישה זו מאפשרת למחקר של שינויים מבניים באקסונים ארוך טווח, דפוסים של פעילות חשמלית באחת והרכבים של תאים, ושינויים בחדירות מחסום דם מוח בבעלי חיים ילוד. למרות שפרוטוקול זה נעשה שימוש בעיקר כדי ללמוד את גזע המוח השמיעתי אצל חולדות ילודות, זה יכול בקלות להיות מותאם ללימודים במינים מכרסמים אחרים כגון עכברים ילודים, רודן מבוגרts ואזורי גזע המוח אחרים.
Introduction
השימוש בפתיחת גולגולת בשילוב עם דימות פלואורסצנטי וטכניקות אלקטרופיזיולוגיה מאפשרת זרימת דם ניטור, חדירות מחסום דם המוח ומדידת פעילותם של תאי עצב ותאי גליה בבעלי החיים 1-3. מספר מעבדות השתמשו בגישה זו כדי לספק תובנות לגבי הפיסיולוגיה של מוח בתנאים בריאים ומחלה, אך נותרו פערים בהבנה של איך תהליכים אלה להתעורר במהלך פיתוח שלנו. יתר על כן, רוב המחקרים התמקדו באזורים במוח שהם נגישים מהשטח הגבי של הגולגולת, כך שמבני גזע המוח הגחון עם תפקידים פיסיולוגיים מגוונים נחקרו בעיקר באמצעות vivo לשעבר גישות.
המטרה העיקרית של פרוטוקול זה היא לספק שיטה לפתיחת craniotomy בגולגולת הגחון של מכרסמים. גישה זו הותאמה ממחקרים קלאסיים שבוצעו ביונקים גדולים יותר כגון כלבים וחתולים לreco נוירופיזיולוגיה חושיrdings של גזע המוח השמיעתי 4-7. בפרוטוקול זה לעומת זאת, יש את אתגר הרומן של ביצוע ההליך בבעלי חיים ילוד. באמצעות ציוני דרך בכלי דם, פרוטוקול מותאם זה כבר נעשה שימוש בעבר כדי ללמוד גזע המוח השמיעתי של חולדות ילודות, עכברים בוגרים ואזורי גזע המוח אחרים כמו הזית הנחותה 8-11 (איור 1).
יתרון עיקרי של פתיחת גולגולת הגחון על פני שיטות קיימות ללמוד גרעיני גזע המוח הגחון הוא שהיא מספקת גישה ישירה למבני עניין בחי חיות. לדוגמא, התאים הקוליים של מתחם olivary מעולה הם נקודתיים כמה עשרות מיקרומטרים ממשטח המוח, וזה חשוב עבור מיקום ממוקד של בדיקות ולשימוש בגישות הדמיה שני פוטונים שבעומק ההדמיה יכול להיות מוגבלת ל0.5 מ"מ על ידי פיזור אור רקמות וקליטה. פתיחת גולגולת הגחון מספקת גם הכנה עם קשרים עצביים יחסית ללא פגע, WHich הם שיבשו בהכנות פרוסה חריפות וorganotypic 12. בניגוד לפרוטוקולים אחרים לניסויי in vivo נוירופיזיולוגיה 13, גישת הגחון יכולה להיות משולבת במכשירי הקלטה רבת האלקטרודה ושיטות הדמיה המספקות מידע על הרכבים סלולריים (איורים 6 ו -7). לבסוף, בשילוב עם פרוטוקול זה מומס שכותרתו fluorescently ניתן להזריק בכלי הדם כדי למדוד שינויים בחדירות מחסום דם מוח למומס (איור 8).
Protocol
הפרוטוקול הבא עוקב אחר הנחיות טיפול בבעלי החיים שהוקמו על ידי הוועדה המוסדית טיפול בבעלי חיים ושימוש (IACUC) בסיטי קולג' של ניו יורק.
1. בעלי החיים אינטובציה (דקות 10-20)
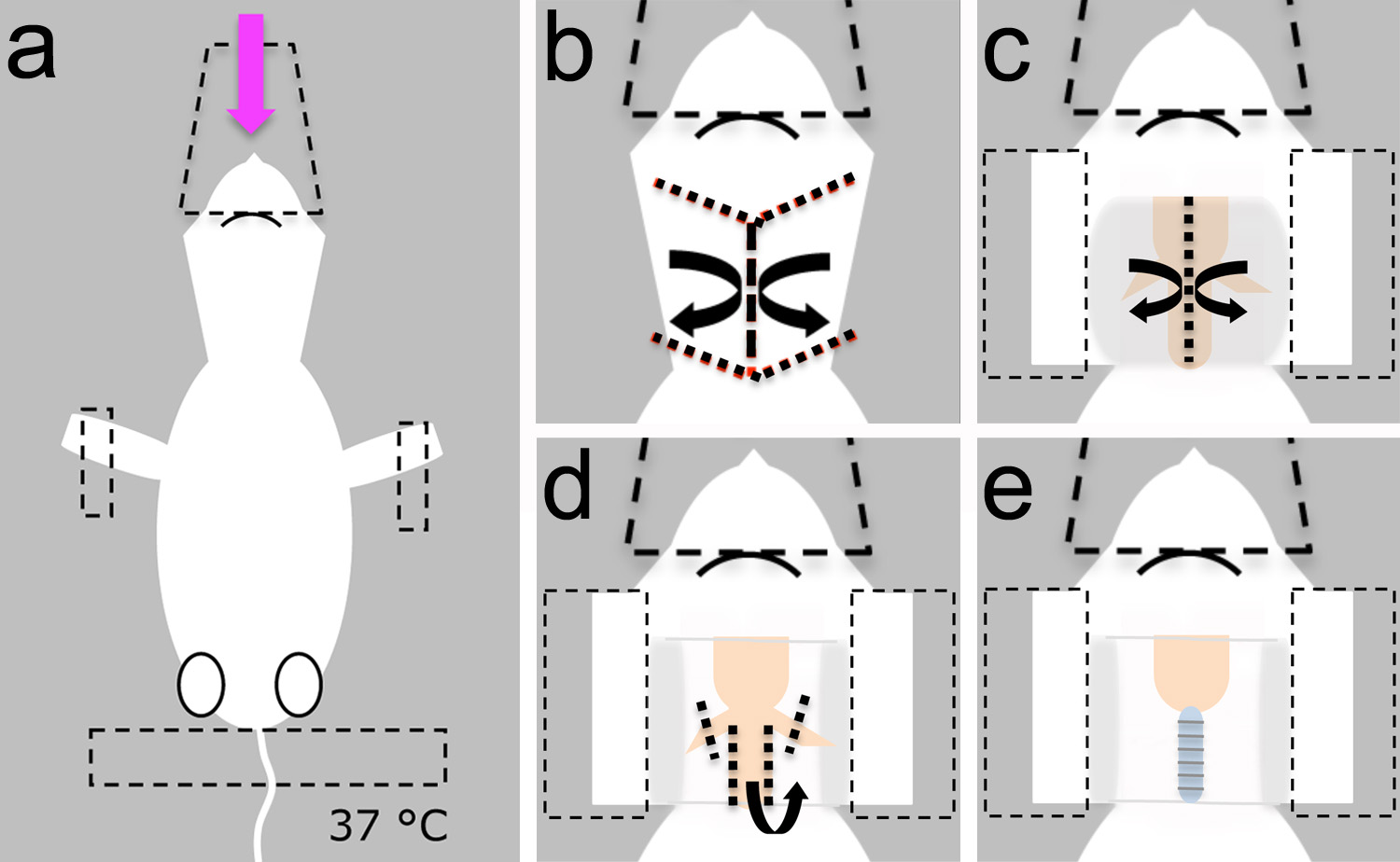
- לפני הניתוח, להכין פתרון Ringer של יונקים. להרכיב את הכלים כירורגיים, כרית חימום, והנשמת חיה קטנה על הספסל (איור 2).
- למדידות של חדירות מחסום דם המוח להפוך 10 מיליליטר של 1% אלבומין בסרום שור פתרון (BSA) ברינגר ולפזר TRITC-dextran 155 KD ב8 מ"ג / מיליליטר בפתרון BSA 1%, פתרון סינון עם מסנן מזרק 25 מ"מ (0.2 מיקרומטר גודל הנקבובית) ולאחסן במזרק מכוסה בנייר כסף בחושך.
- להרדים את החיה באמצעות isoflurane. השתמש .5.0% לזירוז ו1.5-3.0% לצורך התחזוקה. לחלופין תערובת של קטמין (41.7 מ"ג / קילוגרם) ו xylazine (2.5 מ"ג / קילוגרם גוף) יכולה לשמש. עומק ההרדמה ניתן לבדוק על ידי רפלקס קמצוץ הבוהן שלגפיים העליונים ותחתונים.
- המנות הבאות של קטמין (41.7 מ"ג / קילוגרם משקל גוף) ו xylazine (2.3 מ"ג / קילוגרם משקל גוף) צריכה להינתן במרווחים של ⅓ מהמינון המקסימאלי, כדי למנוע מינון יתר. שימוש בהנשמת מכרסמים מומלץ לנטרל דיכאון בדרכי הנשימה הנגרם xylazine.
- הנח את הגור הרדים שוכב על צד הגב שלו ולאבטח את ראשה עם קונוס הפלסטיק המשמש כדי לספק את חומר ההרדמה (איור 3 א).
- אבטח את החיה עם דבק על הגפיים הקדמי וזנב (איור 3 א).
- חלופי כדי לאבטח את ראשו של הגור הוא להשתמש בצלחת את הראש המחובר לסרגל מתכת.
הערה: ודא שכרית החימום מוגדרת 37 ° C כדי למנוע היפותרמיה (איור 3 א).
- השתמש במספריים (איור 2b) לעשות אחד אורכי וארבעה חתכים לרוחב על העור שמעל הצוואר (איור 3 ב). באמצעות טכניקה בוטה, לנתח את העור ומניח אותו בצד באמצעות מלקחיים (2c דמויות וג 3).
- החזק את העור כלפי מטה באמצעות נייר דבק. לייצב את הראש במצב אופקי (איור 3c).
- בעזרת מספריים באביב (איור 2) וטכניקה בוטה, בלוטות דחיפה ושכבות שומן הצידה כדי לחשוף את קנה הנשימה (איור 3c). לזהות את המיקום של עורקי הראש.
- שמור את עורקי הראש מקנה הנשימה.
הערה: ניקוב עורקי הצוואר יכול לגרום לאובדן מסיבי דם ומותו של הגור.
- שמור את עורקי הראש מקנה הנשימה.
- בעזרת מספריים באביב (איור 2) לנתח את שרירי אורך המכסים את קנה הנשימה. חותכים את שרירי האורך ממוקמים מתחת ל( 3d איור) קנה הנשימה.
הערה: טבעות קנה הנשימה צריכה להיות לעין (3E איור).- באמצעותמלקחיים (איור 2 ג), לקשור את שתי חתיכות של תפר סביב קנה הנשימה. פיסת תפר אחד לא לאבטח את צינור אוורור ואת החוט השני יהיה בשימוש כדי לסגור את קנה הנשימה מקורי עד לנקודת שצינור אוורור ההכנסה (איור 4 א).
הערה: ללחלח נחשף רקמות באופן קבוע עם פתרון Ringer כדי למנוע התייבשות.
- באמצעותמלקחיים (איור 2 ג), לקשור את שתי חתיכות של תפר סביב קנה הנשימה. פיסת תפר אחד לא לאבטח את צינור אוורור ואת החוט השני יהיה בשימוש כדי לסגור את קנה הנשימה מקורי עד לנקודת שצינור אוורור ההכנסה (איור 4 א).
- בעזרת מספריים באביב (איור 2) עושה חתך באחת הטבעות קנה הנשימה ממוקמות בין שני הנושאים שהציבו בשלב 1.6.1 (איור 4C).
הערה: יש לוודא שאין נוזל נכנס לקנה הנשימה הפתוח. נוזלים בקנה הנשימה יגרמו לחנק. - הכנס את צינור אינטובציה (איור 4) לתוך קנה הנשימה ולהדק את החוט התחתון כדי לאבטח אותו. בעזרת מלקחיים (איור 2 ג), להדק את החוט העליון כדי לסגור אחורי קנה הנשימה עד לנקודה של צינור אינטובציה הכניסה.
- Tighten ולקצץ את הקצוות של שני החוטים (4d-f איור).
הערה: החמקן בתוך צינור אינטובציה זה סימן טוב של שליטת זרימת אוויר.
- Tighten ולקצץ את הקצוות של שני החוטים (4d-f איור).
- מייד להחליף את אספקת isoflurane למכונת ההנשמה. התאם את שבץ קצב תחלופת אוויר נפח ובהתאם למשקלו של בעל החיים.
- חותם את הרקמה שמסביב החשוף עם אלסטומר (איור 5 א). שמור על המשטח טבול ונקי.
2. קנו נשימה והסרת שריר כדי לחשוף את הגולגולת (5-10 דקות)
- השתמש במספריים באביב (איור 2) לחתוך את קנה הנשימה בסמוך לצינור האוורור. מבצע שני חתכים לאורך קיר השרירים של חלל buccal לחשוף את קצה הזנב של החיך (איור 5).
הערה: במידת צורך, השתמש cauterizer כדי לעצור את הדימום. דימום בלתי מבוקר יגרום למותם של בעלי החיים. - נקה אתאזור באמצעות כמויות עצומות של תמיסת רינגר (איור 5 ג). לזהות את הפער בין החוליות האחרונות והעצם בשיא-העורפי (5D איור).
הערה: הפער בין עצמות גולגולת הוא ציון דרך שימושית לאיתור מבני גזע המוח. הזית הנחותה נמצאת מתחת הפער הזה. מורכב olivary מעולה השמיעתית ממוקם מתחת לעצם בשיא-עורפי בכיוון מקורי מפער זה (ראה גם איור 1). - נקה את האזור באמצעות מלקחיים (איור 2 ג) ומספריים באביב (איור 2). אין לנקב כלי דם.
הערה: במידת צורך, לצרוב כדי לעצור את הדימום.- לאחר שהאיזור החשוף נקי של שומן ורקמת שריר, החלל המפריד בין העצם בשיא-עורפי והחוליה האחרונה צריך להיות (5D איור) נראה לעין.
3. Craniotomy (15-30 דקות)
- השתמש microdrill או אולטרהניקוי קולי. אתר את הקיר המדיאלי של הבולה.
- דקה הגולגולת על ידי ביצוע צורת D הפוך עד לעורקים שבבסיס נראים לעין (5e איור).
הערה: עורק basilar (BAS) פועל על גבי קו האמצע גזע המוח. העורק הקדמי cerebellar הנחות סניפים (aica) בילטרלי וניתן להשתמש בם באופן אמין כנקודת ציון שכן יש עמדה קבועה בבעלי חיים שונים. - כאשר הגולגולת היא דלילה, בעדינות לשבור אותו בעזרת אזמל ניתוחים (2E איור). הסר את פיסת העצם עם מלקחיים (איור 2 ג). לחלופין, להרים ולשבור את הגולגולת באמצעות מחט עקומה.
הערה: חזור על הליך זה עד לגודל והצורה של פתיחת הגולגולת היא מתאים לניסוי המתוכנן. Bas וaica צריך להיות גלויים דרך קרום הדורה (5F איור).
- דקה הגולגולת על ידי ביצוע צורת D הפוך עד לעורקים שבבסיס נראים לעין (5e איור).
- נקה את האזור מספר פעמים עם פתרון Ringer טרי. באמצעות הרשות סופגתds לייבש את פני השטח של קרום הדורה.
- במידת צורך, להשתמש במחט תפר כדי להסיר את קרום הדורה ללא עקירתם או לשבור את bas עורקי הציון וaica.
שים לב: עם הדורה ניקוב נוזל השדרתי תזרום החוצה. נקה את האזור עם פתרון Ringer ולשמור לחים לאורך כל הניסוי.
- במידת צורך, להשתמש במחט תפר כדי להסיר את קרום הדורה ללא עקירתם או לשבור את bas עורקי הציון וaica.
4. ניסוי אלקטרופיזיולוגיה
- בחר polytrode על פי עיצוב ניסוי (איור 7 א). השתמש במכחול דק למעייל polytrode עם DiI. מעביר את פתרון DiI לתוך צינור microcentrifuge 1 מיליליטר, לטבול את המכחול בפתרון ובעדינות להכות polytrode תחת הדרכה חזותית (כלומר באמצעות stereoscope). התחל בקצה של החללית ולהמשיך בזהירות עד שכל אלקטרודות מצופות באופן אחיד.
- מניחים את האלקטרודה הקרקע בתוך חלל הפה. טען את polytrode ל7b בעל אלקטרודה (איור ).
- הפעל את המגבר ולבדוק שכל החיבורים פועלים היטב.
- מקם את האלקטרודה מעל bas בנקודת aica (עמדה אפס) הסניף. הזז את האלקטרודה לנקודת היעד הרצויה על ידי שימוש ב( 7 ג איור) מקורי, לרוחב לתאם המתאימים.
- מניחים את האלקטרודה על פני המוח ולהעביר אותה לעומק הרצוי בקפיצות של 5-10 מיקרומטר.
- לבצע הקלטה על פי תכנון ניסוי. שמור את הנתונים לניתוח נוסף.
5. ניסוי ההדמיה שני פוטונים
- הפעל את המיקרוסקופ. קבע את אורך גל העירור ולהשתמש במסנן פליטה מתאים. עירור ב 800 ננומטר ועבודת ± מסנן פליטת להקה עוברת 45 ננומטר 607 גם הדמיה TRITC-dextran.
- זהה את העורק הראשי ימינה או שמאלה. באמצעות טכניקה בוטה לנתח את העורק הראשי מרקמות חיבור הסמוכות או עצבים.
- פיק ולהחזיק את הצווארעורק עם hemostat. לקשור את שלוש חתיכות של תפר סביב העורק הראשי.
- הדק את החוט קרוב יותר לצד הלב כדי לעצור את זרימת הדם ולהשאיר את שני אשכולות האחרים רופפים.
- השתמש במספריים בסדר לעשות חתך קטן בזווית של ° 45 על העורק הראשי בין החוט קשור והחוט הרופף הבא.
הערה: נקה את הדם עם נייר סופג.
- Cannulate העורק הראשי. הכנס את צינורות התמלאו פתרון TRITC-dextran לחתך בעורק הראשי כ -5 מ"מ אוריינטציה עמוק כלפי ראשו של הגור.
- הדק את שני נושאים האחרים סביב העורק להחזיק את צינורות ואת העורק יחד. הדק את החוטים, קיצוץ ולהוסיף אלסטומר לייצב עוד יותר.
הערה: הצד השני של הצינור מחובר עם המזרק המכיל פתרון TRITC-dextran (מוכן בשלב 1.1).
- הדק את שני נושאים האחרים סביב העורק להחזיק את צינורות ואת העורק יחד. הדק את החוטים, קיצוץ ולהוסיף אלסטומר לייצב עוד יותר.
- תקן את המזרק במשאבת המזרק.
- ערכהמהירות זרימת דם בעורקי התרדמה השיעור של הגור. הפעל את משאבת המזרק לכמה שניות ולבדוק באופן ידני שפתרון הצבע יהיה ניתן להזריק לתוך העורק הראשי. הערה: בהנחת שקצב זרימת דם בעורק הראשי של חולדות בוגרות (240-280 ז) היא כ 3 מיליליטר / דקה 14, את קצב זרימת הדם לגור חולדה (גור למשל P10 במשקל 15-25 גר ') ניתן לחשב כדי מגוון 0.16-0.3 מיליליטר / דקה.
- מניחים את החיה תחת מטרת מיקרוסקופ. הזרק dextran הניאון למחזור הדם.
- זיהוי תחומי העניין בגזע מוח הגחון עם מטרת מיזוג 5X. לעבור לאובייקטיבי 20X או 40X (טבילה במים, NA = 0.5 או 0.8, בהתאמה) להתמקד באזור של עניין (ROI).
- התחל הדמיה ולהתאים את הפרמטרים רכישת תמונה (למשל זמן חשיפה, כוח הלייזר, רווח גלאי) עד שעוצמת הקרינה בכלי הדם של ההחזר על ההשקעה הוא מותאם (כלומרלא נמוך מדי אבל לא רווי).
- הפעל את משאבת המזרק כדי להזריק את פתרון הצבע לתוך העורק הראשי ולרכוש סדרת זמן במישור מוקד קבוע.
6. ההליך הבא טיפול בבעלי חיים
- זהו הליך מסוף. בסופו של חיות ניסוי חייב להיות מורדמים עם מנת יתר של Pentobarbital (100 מ"ג / קילוגרם, זריקת intraperitoneal) או כל שיטה אחרת של המתת חסד שאושר על ידי הנחיות המתת חסד אמריקנית לרפואת וטרינרית.
הערה: זלוף דרך הלב עם פתרון Ringer אחריו עם פתרון מקבע מומלצת לניתוח היסטולוגית נוסף.
תוצאות
Electroporation של קליעים נותבים עצביים
הגרעין המדיאלי של הגוף בצורת הטרפז (MNTB) הוא קבוצה של תאים במתחם olivary מעולה שנחקר בעבר שימוש בפרוטוקול זה. לדוגמא, ניתן להשתמש בטפטפות מהדק התיקון לelectroporate קליעים נותבים עצביים (איור 6) 9. כאשר טפטפות ממוקמות ליד קו האמצע, כפי שמוצגת באיור 6 א, התוצאה היא שהאקסונים מביא decussating מסומנים. מיקרוסקופ שני פוטונים מצויד מטרת טבילה במים גבוהה מספרית צמצם יכול לשמש לתמונת הסיבים להגיע MNTB, כולל סניפים בטחונות דקים מאוד (חיצים באיור 6). קליעים נותבים עצביים יכולים גם להיות מועברים לMNTB ישירות, כפי שמוצגים באיור 6 ג. התוצאה היא תיוג של תאי MNTB ואקסונים מביא, כפי שיכול להיות מוערך על ידי הדמיה עם מטרה נמוכה יותר צמצם מספרי טבילה במים (6 ד 'איור). מ 'יתרון של שימוש בעין אובייקטיבי ההגדלה הנמוכה הוא ששדה רחב יותר של ראייה ניתן לבחון, ולמרות שזה גורם לירידה ברזולוציה מרחבית בשל הצמצם המספרי האובייקטיבי נמוך יותר, ניתן להבחין בתאי MNTB בודדים היטב (חיצים באיור 6 ד) . משך הניסויים אלה הממוצע לגילים P1-P5 הוא 3.1 ± 1.4 שעה (n = 22 גורים).
הקלטות אלקטרופיזיולוגיה
ירי פרץ ספונטני הוא סוג של פעילות חשמלית התפתחותיות נצפה בתאי MNTB בודדים לפני תחילת שמיעת 11,13. באמצעות פרוטוקול זה כירורגית אפשר גם למקד מערכי multielectrode (polytrodes) לMNTB (איור 7 א-B). התוצאה היא הקלטה של פעילות ספונטנית בהרכב של תאי MNTB. 7e איור מראה הקלטת polytrode נציג מעכברוש P6. בניסוי זה, polytrode היה מצופה DiI צבע lipophylic באמצעותבמכחול דק (ראה שלב 4.1). לאחר ביצוע הקלטת המוח היה מעובד לניתוח היסטולוגית ומיקומו של מסלול polytrode כותרת DiI שימש כדי לאשר נכון מיקוד לMNTB (7d איור). משך הניסויים הממוצע לגילים P1-P6 הוא 2.0 ± 0.7 שעה (n = 33 גורים).
מדידת חדירות microvessel
גם פרוטוקול זה יכול לשמש כדי לבצע ניסויי הדמיה שני פוטונים של חדירות כלי דם. מומס ניאון (TRITC-dextran, MW 155 KD, סטוקס רדיוס ~ 8.5 ננומטר) פורקה ב 1% פתרון BSA רינגר ומוזרק למחזור הדם המוחי באמצעות canula הוכנס לעורק הראשי 14. בניגוד לזריקות לוריד זנב, הליך זה עוקף את הלב ומציג את מומס הניאון ישירות לזרימת הדם במוח. איור 8 א ממחיש את האיכות של תיוג של כלי דם בדם, הנובע משימוש בהליך זה. לאחר רציףזלוף של מומסים שכותרתו לתוך זרם הדם זה אפשרי להשיג רצף הזמן לשגות של אזור של עניין, כפי שמוצג באיור 8 ב. עוצמת הקרינה הכוללת באזור של העניין נמדדה במצב לא מקוון ומודל מתמטי המשמש לקביעת חדירות מחסום דם במוח לכותרתו fluorescently מומסים (8C איור) 15. משך הניסויים הממוצע לגילאי P9-P10 הוא 2.3 ± 0.8 שעה (n = 3 גורים).
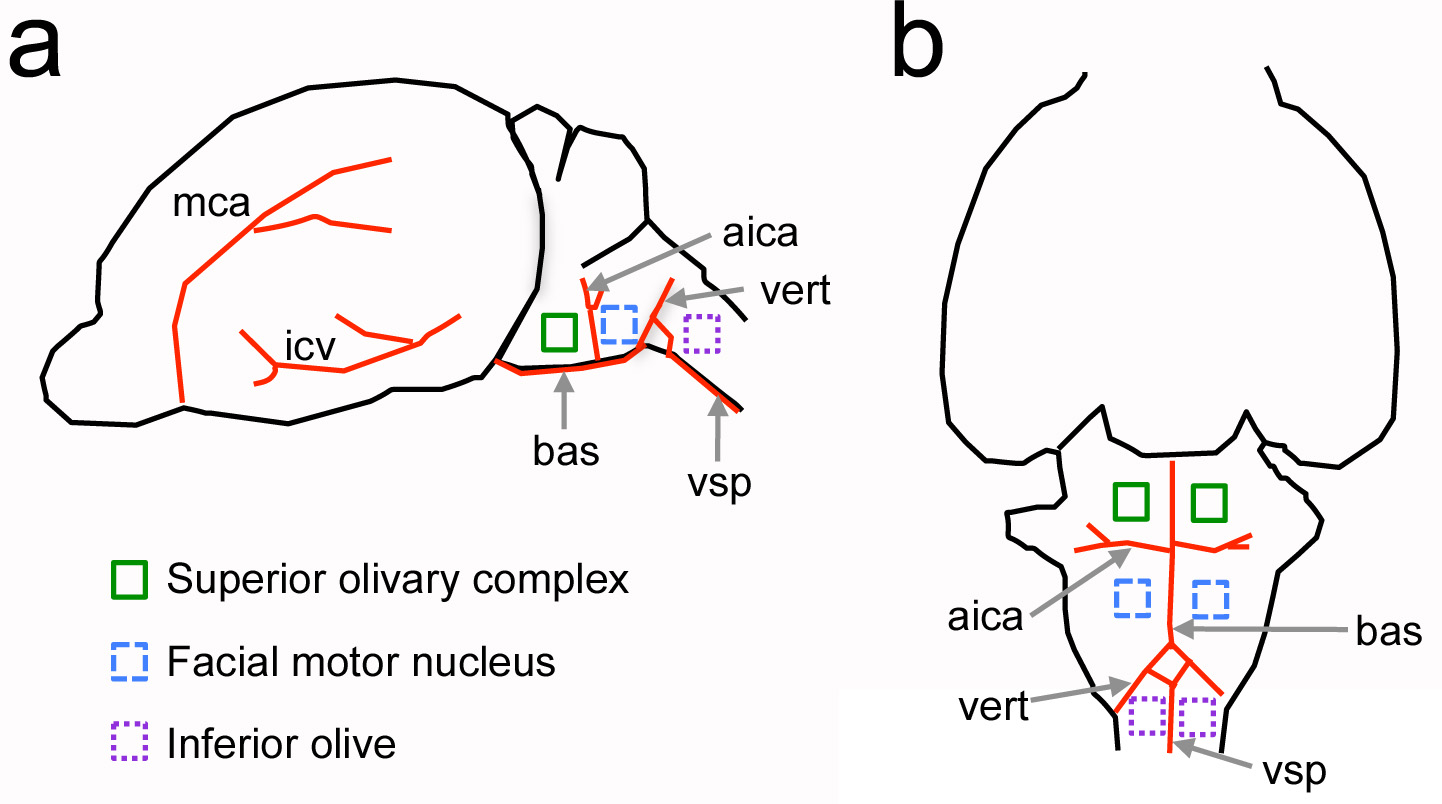
איור 1. מיקום יחסי של מבנים עצביים בגזע מוח הגחון ביחס לציוני דרך בכלי דם בעכברים הילודים., נוף לצד של המוח. ב, נוף הגחון של המוח. כלי דם גדולים מוצגים במבנים אדומים ועצביים של עניין הם indicated ידי ריבועי צבע. לא נמשך לקנה מידה. aica = קדמי עורק המוח הקטן נחות; bas = עורק basilar; ICV = וריד מוחין נחותים; MCA = עורק המוח אמצעי; vert = עורק השדרה; VSP = עורק השדרה הגחון. לחץ כאן לצפייה בתמונה גדולה יותר.

איור 2. התקנת כירורגי., ניתוח יכול להיעשות על לוח לחם קטן (1) מונח על החלק העליון של ראש טבלה יציב. כרית חימום (2) והנשמת חיה קטנה (3) ניתן לחבר ללוח הלחם כדי להקל על העברת כל ההכנה בעת צורך. הנשמה של בעלי החיים הקטנים יכולה להיות מופעל על ידי סוללה (4). בעל מגנטי (5) ניתן להשתמש בו כדי לאבטח את חרטומו משמש כדי לספק את חומר ההרדמה. חרטומו יכולגם לעזור לאבטח את הראש במצב יציב. אם בעל החיים לא צריך להיות עקרים, micromanipulator (6) יכול לשמש לבדיקות עמדה לאלקטרופיזיולוגיה או ניסויי מעקב עצביים. מקור אור (7) וstereoscope (לא בתמונה) יש צורך לדמיין מבני ציון דרך במייקרו. ב, מספריים קטנים המשמשים בשלב 1.4. ג, מלקחיים המשמשים בצעדי 1.4, 1.6.1, 1.8.1 ו1.8 . ד, מספריים באביב נמצאים בשימוש בצעדים 1.5, 1.6 ו1.7. דואר, אזמל מנתחים משמש בשלב 3.1.2. סרגל קנה מידה במ"מ e = 1, חל על BD. לחץ כאן לצפייה בתמונה גדולה יותר.
איור 3. חשיפת קנה הנשימה לאינטובציה., בעל החיים הוא מורדם, להציב בעמדה המועדת ומאובטח עם חרטומו וקלטת (קווים מקווקווים). ב, העור נחתך והניח הצידה כדי לחשוף את שכבת שומן שבבסיס. ג, השומן שמעליה ובלוטות (המוצג באפור) נדחקים הצידה כדי לחשוף את קנה הנשימה. קלטת משמשת כדי לאבטח את העור שמעליה (קווים מקווקווים). ד, קנה הנשימה היא גזור מהשרירים. דואר, ויזואליזציה של טבעות קנה הנשימה מצביעה על ההסרה מוצלחת של שרירים שמעליה. לחץ כאן לצפייה בתמונה גדולה יותר.
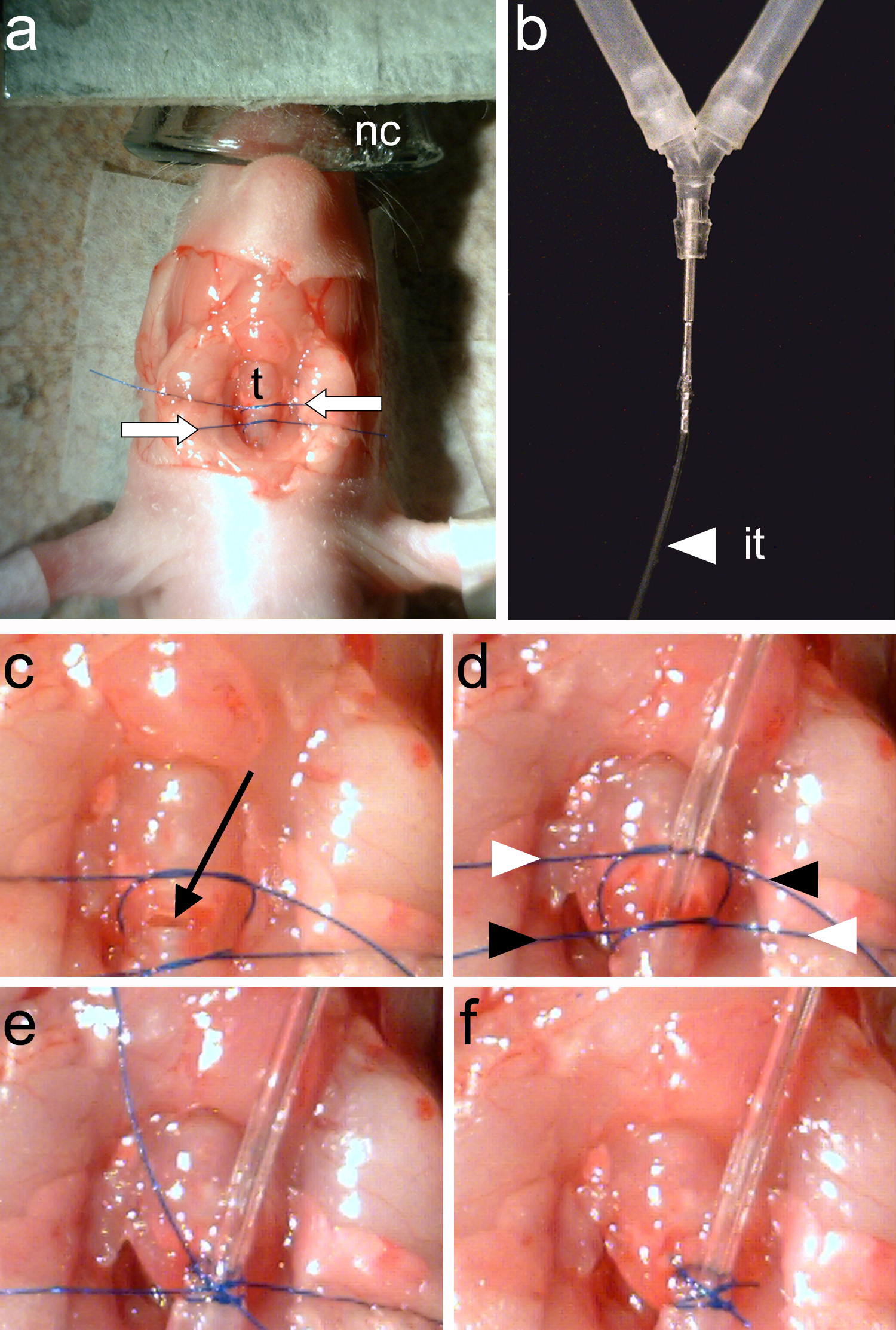
איור 4. Intubating בעלי החיים., שני נושאים שתפר (חצים לבנים) נקשרים סביב קנה הנשימה(T). ב, צינור אינטובציה (זה) חייב להיות קשור באופן הדוק לצינור y של החיה הנשמה. ג, ההנשמה מורכבת בין חוטי שני תפר (חץ שחור). ד, צינור האוורור מוכנס ו שני נושאים שתפרם התהדקו. קצות החוטים הם הידקו שוב באופנה חצתה (מסומן על ידי ראשי חץ לבנים ושחורים). דואר, קצות תפר כבולות. F, קצות התפר הם גזומים ואינטובציה הושלמה. לחצו כאן לצפייה בתמונה גדולה יותר.
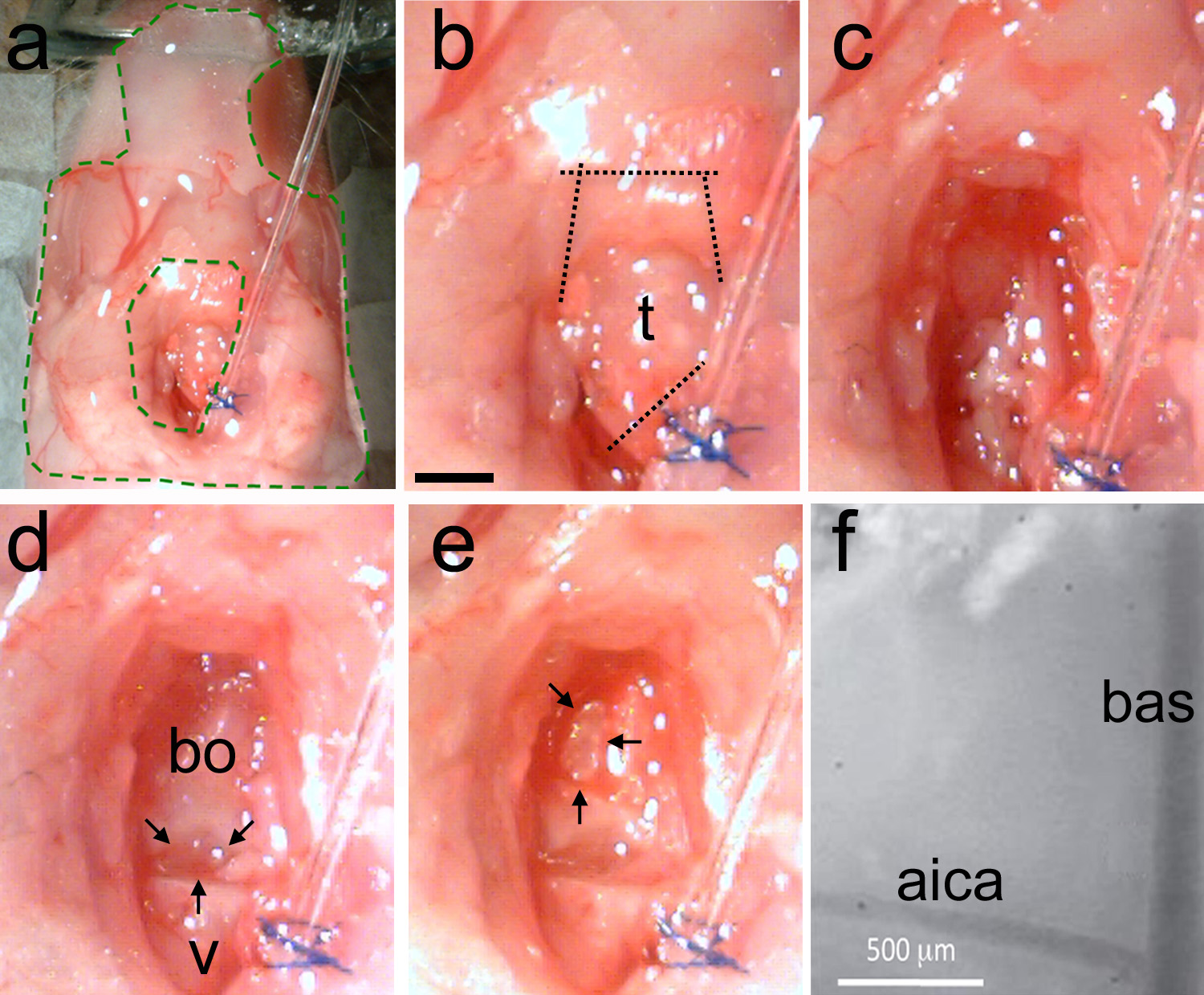
איור 5. הסרת קנה הנשימה ומה שהופך את פתיחת הגולגולת., ההכנה הוא התייצב עם insi אלסטומר (האזור ירוק דה קווים מקווקווים). ב, קנה הנשימה מזוהה ולאחר מכן קיצוצים נעשים ראשון להפריד את קנה הנשימה מצינור אינטובציה, ולאחר מכן לחתוך את שרירי לסת התחתונים (קווים מקווקווים). ג, נקה את פני השטח של הגולגולת באמצעות בוטה טכניקה להסרת שריר ולהשתמש בנייר סופג כדי להסיר. ד שומן ודם, דוגמא לאזור נקי מציגה את החוליות שעברה (v) ועצם בשיא-עורפי (בו). יש פער טבעי בין שתי העצמות (חיצים שחורים). דואר, באמצעות microdrill או ניקוי קולי דקה הגולגולת בצורה הפוכה D (חיצים שחורים). בעדינות לשבור את הגולגולת דליל ולהסיר את פיסת העצם. כלי דם לנדמרק צריך להיות גלויה. f, נוף הגדלה גבוהה מציוני הדרך של כלי דם על פני השטח גזע המוח החשופים. "ס = עורק basilar; עורק המוח הקטן נחות aica = קדמי. סרגל קנה מידה במ"מ b = 1, חל על הספירה.highres.jpg "target =" _blank "> לחץ כאן לצפייה בתמונה גדולה יותר.
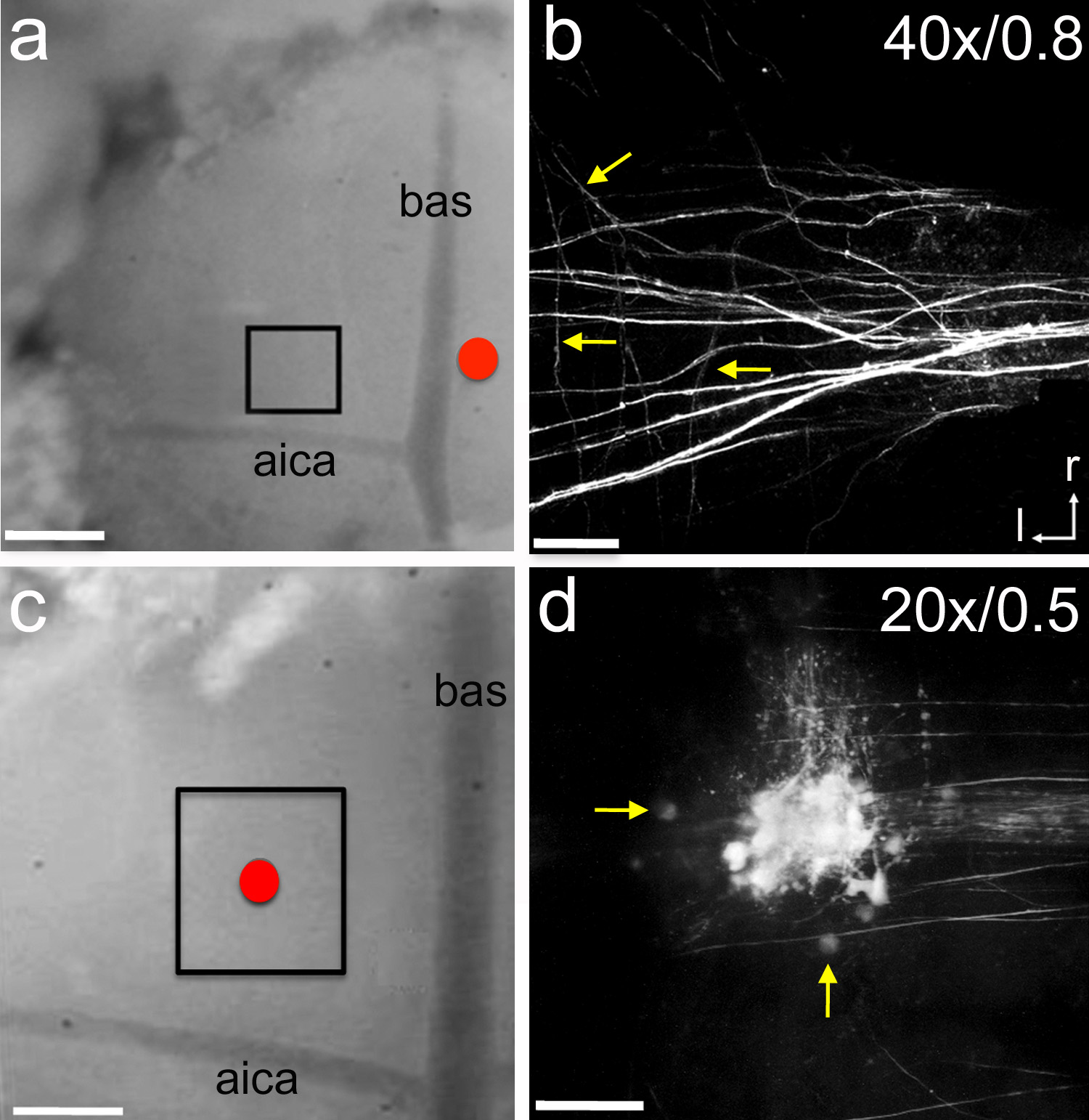
איור 6. Electroporation של קליעים נותבים עצביים., אלקטרודת זכוכית המכילה מיקרו האודם נותב העצבי הוצבה ליד קו האמצע (העיגול אדום). נותב היה electroporated באמצעות 7 פולסים ארוך -5 μA שני נמסרו כל 14 שניות ל15 דקות. אחרי השעה 1 של זמן החלמה האזור התאגרף היה צילם עם מיקרוסקופ שני פוטונים. עכברוש P1 גור. ב, תמונת Z-מחסנית דוגמה מובהקת של תיוג האקסון מביא בMNTB. חיצים מצביעים על סניפים בטחונות אישיים. ג, אלקטרודת זכוכית מלאה במייקרו אודם הוצב על גבי MNTB (העיגול האדום). נותב היה electroporated עם אותן ההגדרות שתוארו ב. אחרי השעה 1 של זמן החלמה האזור בארגזים היהצילם עם מיקרוסקופ שני פוטונים. גור עכברוש P5. ד, תמונת Z-מחסנית דוגמה מובהקת של תאים שכותרתו ואקסונים בMNTB. חצים מצביעים על תאי MNTB אחת. תוויות בB ו-C מצביעות ההגדלה אובייקטיבית וצמצם מספרי, בהתאמה. סרגל קנה מידה ובc = 300 מיקרומטר; סרגל קנה מידה בb = 45 מיקרומטר; סרגל קנה מידה בד = 90 מיקרומטר. aica = קדמי עורק המוח הקטן נחות; bas = עורק basilar; r = מקורי; l = רוחב. לחץ כאן לצפייה בתמונה גדולה יותר.
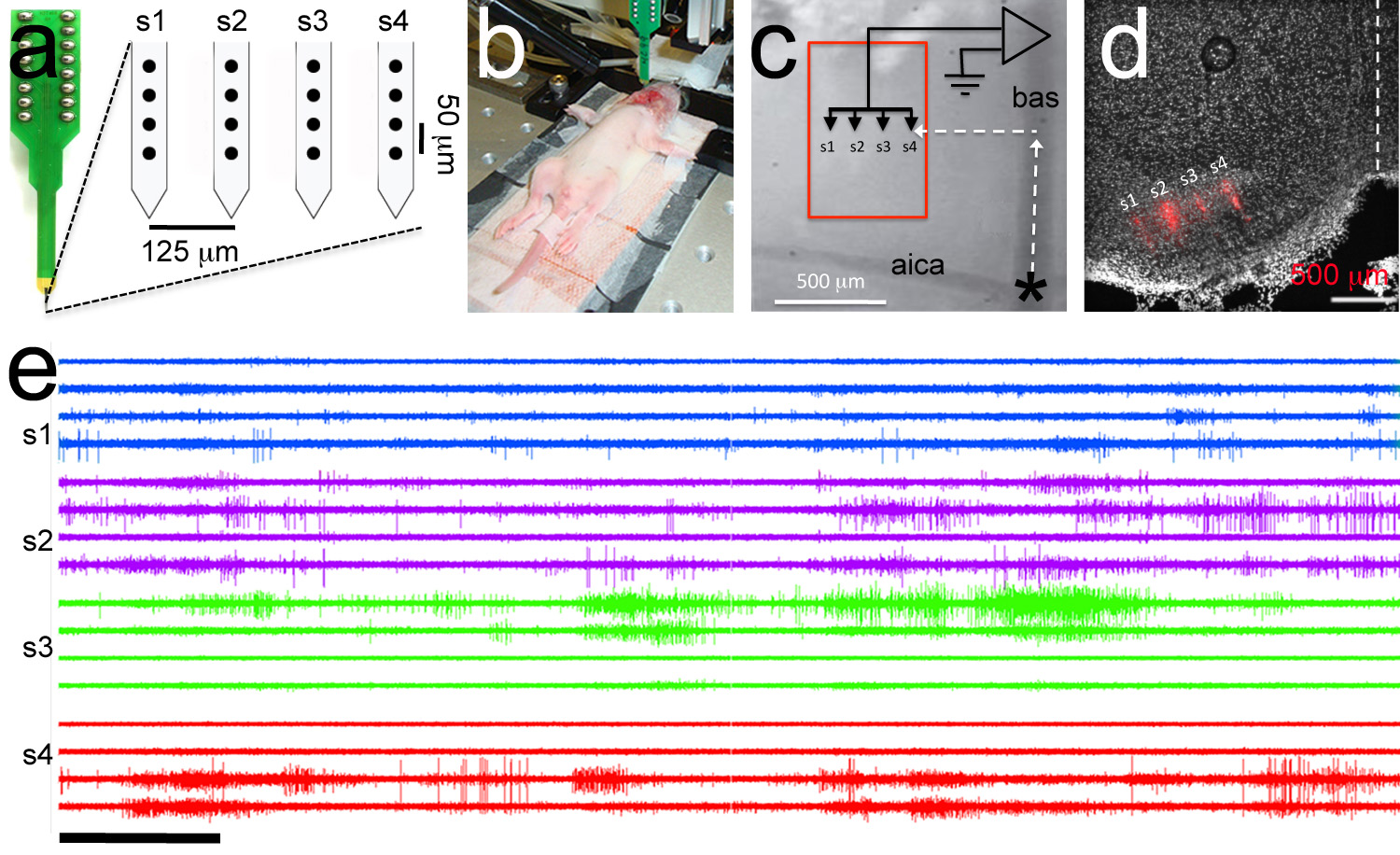
איור 7. ממוקד הקלטת polytrode., Polytrode כולל 4 אנקס עם 4 אלקטרודות לשוק (עיגולים שחורים). מרחקי התוך ובין שוק בין האלקטרודות מצוינים. ב, תמונת דוגמה מובהקת של ניסוי אלקטרופיזיולוגיה. אלקטרודה השוואתית מוכנסת בחלל bucal וploytrode מחוברת לheadstage. גור החולדה P6. ג, נוף לגדלה גבוהה של ציוני דרך בכלי דם המשמשים לpolytrode מיקוד. Polytrode ממוקם באמצעות קואורדינטות מקורי, לרוחב למקד את הגרעין המדיאלי של הגוף בצורת הטרפז (תיבה אדומה). ד, ניתוח היסטולוגית Posthoc מדגים מיקוד נכון של polytrode מצופה DiI (מסלול polytrode מוצג באדום). דואר, רב דוגמה מובהקת יחידת הקלטה. כדי מעקב הוא זהה כדי האלקטרודה בפנל. בתוך הקלטות שוק יש את אותו צבע. סרגל קנה מידה בe = 5 שניות. לחץ כאן לצפייה בתמונה גדולה יותר.
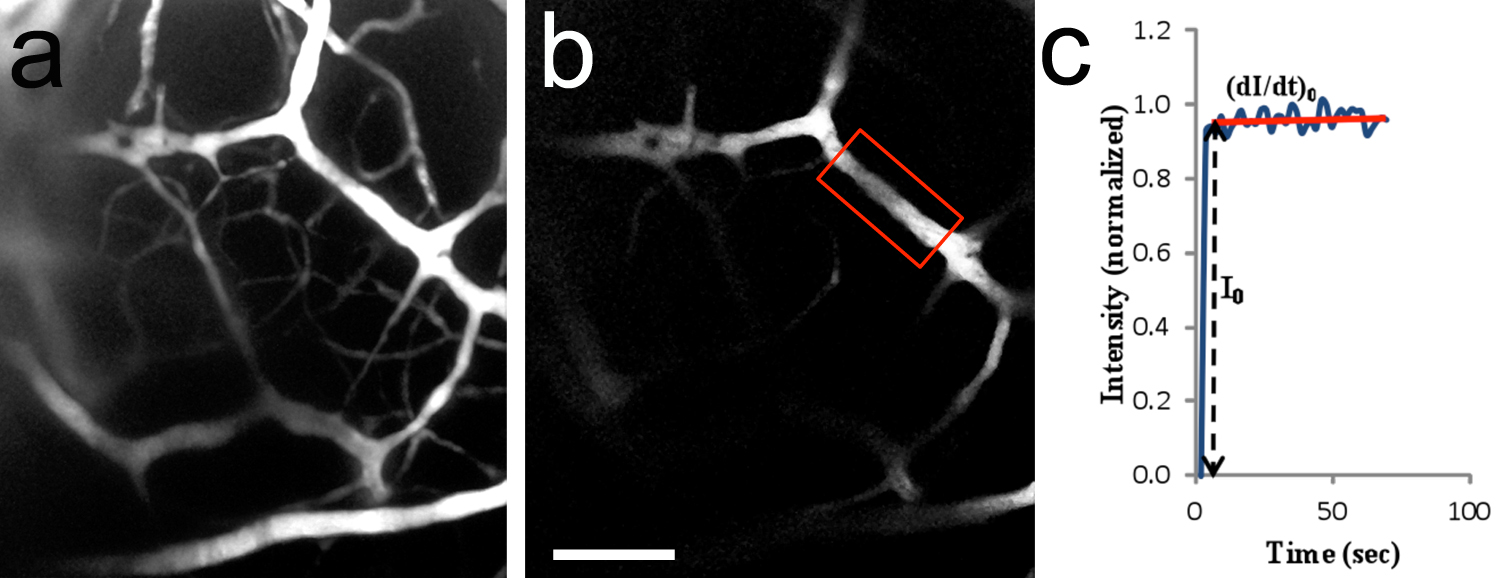
איור 8. בשני פוטונים ההדמיה vivo של microvessels המוח. , תמונת 2-D (Z-ערימה התמוטטה) של כלי דם במוח לאחר טפטוף של TRITC-dextran 155 KD לתוך העורק הראשי. האזור צילם דומה לזה שמוצג באיור 7 ג. 20x/0.5 מטרת טבילה במים. גור החולדה P10. ב, אזור של העניין (ROI) המשמש למדידת עוצמת הקרינה (אזור מוקף מסגרת אדומה). היה הדם הקטן בקוטר של ~ 14.2 מיקרומטר והיה ממוקם 182 מיקרומטר מתחת לפני השטח גזע המוח. ג, עקומה אופיינית של עוצמת הקרינה (ערך מנורמל) כפונקציה של זמן. אני 0 הוא עליית המדרגה בעוצמת הקרינה בהחזר על ההשקעה, כאשר פתרון fluoresence רק ממלא את חלל כלי הדם. (Di / dt) 0 0 ואני משמשים כדי לקבוע את חדירות microvessel למומס. החדירות לTRITC-dextran 155 KD הייתה מחושבת להיות 1.5 x 10 -7 סנטימטר / שנייה.סרגל קנה מידה בb = 100 מיקרומטר, חל על. לחץ כאן לצפייה בתמונה גדולה יותר.
Discussion
זמן הוא קריטי. חוקר מנוסה צריך להיות מסוגל להשלים את הפרוטוקול זה בשעה 1 (שלבים 1-3). הפעמים נאמרו לצעדים השונים מניחות בינוניות לרמה הגבוהה של מומחיות. הנשמה ואינטובציה נכונה בזמן נכון הן קריטיים, שכן שליטת אוורור הלקויה יכולה להוביל לחנק ומוות של בעלי החיים. פינוי זהיר של רקמות שריר ושומן הוא גם מאוד חשוב, כי טעויות יכולות להוביל לדימום ולמוות בלתי מבוקרים של בעלי החיים. בדומה לכך, בעת הכנת העורק הראשי להכנסה canula, צריך להדק ולחתוך את העורק בזהירות, אם קשר החוט הופך רפוי דימום בלתי נשלט יתקיים. לבסוף, פתיחת הגולגולת צריכה להיעשות בזהירות, מבלי לשבש את ציוני הדרך בכלי הדם. ההסרה רשלנית של השכבה החיצונית קרום המוח (דורה) יכולה להוביל לדימום ונזק של אספקת העורקים חמורים.
הגדרות אוורור נבחרות בהתאם לגילו של בעל החיים.רוב הספקים המסחריים מספקים מידע שימושי אודות הגדרות כאלה. ניסויים בחולדות מבוגרות יותר P15 ידרשו שימוש במכונת הנשמה של בעלי חיים גדולה. בעלי חיים מבוגרים ייתכן שלא צריכים אוורור אם מורדם עם קטמין / xylazine, אבל אינטובציה מומלצת להימנע מנוזל שנכנס לקנה הנשימה.
מגבלה העיקרית אחת של פרוטוקול זה היא שניתן לבצע רק ניסויים בחריפות. במעבדה שלנו יש לנו לבצע ניסויים שנמשכו בין שניים לעד עשר שעות. מגבלה שנייה היא שניסויים צריכים להתבצע תחת הרדמה. לכן, הבחירה של חומר הרדמה היא משתנה חשוב להביא בחשבון בתכנון ובעיצוב של ניסויים. סוגיה קרובה היא כי בעלי חיים ילוד יכולים להיות רגישים במיוחד למינון יתר. לדוגמא, אם בוחר קטמין / תמהיל xylazine, לחשב את המינון המבוסס על המשקל של הגור ולנהל תרופות ב⅓ מהנפח המקסימאלי. בדוק את מצבו של בעל החיים בכל 5-10 דקות על ידי r קמצוץ הבוהןesponse. אם באמצעות isoflurane, אמצעי זהירות נחוץ גם כדי לשמור על סביבה בטוחה לחוקר (אוורור נאות, ומאדה מכויל כראוי).
סטראו יכול להיות מותקן על בעל גמיש כדי להתאים את זווית צפייה ולהקל על פינוי מקום למקום אלקטרודות והעברה של בעלי החיים למיקרוסקופ שני פוטונים. שימוש בסוללה לשלטון ההנשמה יכול להקל על העברת בעלי החיים ולצמצם את החפצים חשמליים במהלך ניסויי אלקטרופיזיולוגיה. לשם כך, קרש חיתוך קטן (7.5 x 12 סנטימטר) יכול לשמש כדי להרכיב יחד את מכונת ההנשמה, כרית חימום ו( איור 2 א) חיה הרדים. שינוי שימושי וחשוב להגדרה זו הוא התוספת של מכשיר לניטור סימנים חיוניים במהלך ניתוח. Oxymeter או התקנים אנלוגיים אחרים ניתן להשתמש בהתאם לתקציב המעבדה.
פרוטוקול זה כבר נעשה שימוש באלקטרופיזיולוגיה והדמיה נפגשהמגשי בנאים, כולל הקלטות צמד תיקון 8,10,11, הקלטות polytrode (איור 7), ושני פוטונים הדמיה 9 (איורים 6 ו -8). יישום עתידי אפשרי אחת יהיה לשלב שיטות אלה למיקוד תאים שכותרתו fluorescently להקלטת אלקטרו 16.
יישומי הדמיה חדשים עשויים לכלול גם 2-D או סדרת זמן 3-D באמצעות מיקרוסקופ שני פוטונים. לדוגמא, באמצעות טעינת בולוס של מדדי סידן כדי ללמוד את הפעילות עצבית בגזע המוח ואוכלוסיות תאי גליה. כפי שניתן לראות באיור 8, פתרון צבע מוזרק לתוך מחזור הדם דרך העורק הראשי יכול לשמש כדי ליצור תמונות עם ניגודיות גבוהות של כלי הדם במוח. כצבע פלואורסצנטי ממלא את לומן הדם הקטן ומתפשט לרקמות שמסביב, זה יכול לשמש לא רק לחישוב החדירות מומסות, לכאורה, של מחסום דם המוח, אלא גם COEF דיפוזיה המומסficient ברקמת המוח 3. אחת סיבות עיקריות להזרקת המומסים שכותרתו fluorescently דרך עורק התרדמה היא שהפתרון לצבוע ישירות יכול ללכת לmicrovessels במוח מבלי להיכנס ללב הראשון כמו בהזרקה לוריד זנב. זה מביא לפחות שני יתרונות. אחת הוא שריכוז צבע פלואורסצנטי בלומן הדם הקטן יכול להיות קבוע כמעט, אם קצב טפטוף קבוע באתר cannulation. זה מבטיח קביעה מדויקת של חדירות מחסום דם המוח. נוסף הוא שאם סוכן בדיקה כלול בperfusate, זה יהיה ללכת ישירות למחסום דם המוח מבלי להיות מדולל או בשילוב עם גורמים אחרים ממחזור הגוף.
ניסויים חדשים יכולים גם לקחת את יתרון של בעלי חיים מהונדסים עם כתבי ניאון מקודדים גנטי. זה יספק את היתרון שבדיקות ניאון לא צריכה להיות טעונות באתרו (אלא אם כן את העיצוב של הניסויקובע אחר), תוך חיסכון בזמן ואולי גם מאפשר ליותר הכנות שלמות (לדוגמא חלון גולגולתי 17).
לבסוף, ניתן לעשות ניסויים באזורי גזע המוח אחרים כגון זית הנחות או בגרעין המוטורי פנים. ידע על neuroanatomy ופיתוח של אוכלוסיות תאיות ספציפיות במין נתון יהיה חשוב לקראת מטרה זו, במיוחד כציוני דרך אנטומיים עשויות להשתנות כחיות לגדול (איור 1). אנו מקווים פרוטוקול זה מעודד אחר ללמוד מבני גזע המוח הגחון באמצעות באלקטרו vivo ושיטות הדמיה.
Disclosures
יש המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענק G12-RR003060 מ-NIH / NCRR / RCMI, להעניק SC1HD068129 מהמכון הלאומי יוניס שרייבר של בריאות ופיתוח אנושי לילדים, הקרן הלאומית למדע CBET 0,754,158 וPSC-CUNY 62,337-00 40 מאוניברסיטת העיר ניו יורק.
Materials
| Name | Company | Catalog Number | Comments |
| Absorbant pads | Kettenbach | Sugi 31603 | Other options may be available from different companies |
| Cautery | Braintree Scientific, INC | GEM 5917 | Other options may be available from different companies |
| Tetramethyl rhodamine Isothiocyanate dextran | Sigma | T1287-500MG | Other options may be available from different companies |
| Dissecting Chisel | Fine Science Tools | 10095-12 | Other options may be available from different companies |
| DiI | Invitrogen | V-22885 | Other options may be available from different companies |
| Elastomer | World Precision Instruments | KWIK-SIL | Other options may be available from different companies |
| Fine Scissors | Fine Science Tools | 14060-09 | Other options may be available from different companies |
| Forceps | Fine Science Tools | 11027-12,11617-12, 11616-16 | Other options may be available from different companies |
| Spring Scissors | Fine Science Tools | 15009-08 | Other options may be available from different companies |
| Heating pad | FHC | 40-90-2 | Other options may be available from different companies |
| Intubation tubing | Braintree Scientific, INC | BIO CO-KIT | Choose age appropriate size |
| Light source | Spach Optics | Schott Ace illuminator | Other options may be available from different companies |
| Micro drill | Braintree Scientific, INC | MD-1200 120V | Other options may be available from different companies |
| Paper tape | Walgreens | Generic brand | Other options may be available from different companies |
| Syringe filter | VWR | 28145-483 | Other options may be available from different companies |
| Syringe pump | VWR | 52459-008 | Other options may be available from different companies |
| Stereomicroscope | Olympus | SZ61 | Other options may be available from different companies |
| Suture | Ethicon | Prolene 86979 | 6-0 size |
| Tubing | Braintree Scientific, INC | Micro-Renathane (MRE033); SUBL-120 | Other options depending on pup’s age |
| Vaporizer (isoflurane) | Vetequip Incorporated | 911103 | Other options may be available from different companies |
| Ventilator (minivent) | Harvard Apparatus | 730043 | Use for P0-P12 rats |
References
- Kerr, J. N. D., Denk, W. Imaging in vivo: watching the brain in action. Nat. Rev. Neurosci. 9 (3), 195-205 (2008).
- Sigler, A., Murphy, T. H. In vivo 2-photon imaging of fine structure in the rodent brain: before, during, and after stroke. Stroke. 41 (10), 117-123 (2010).
- Shi, L., Zeng, M., Sun, Y., Fu, B. M. Quantification of blood-brain barrier solute permeability and brain transport by multiphoton microscopy. ASME J. of Biomech. Eng. 136 (3), 031005-031005 (2014).
- Galambos, R., Schwartzkopff, J., Rupert, A. Microelectrode study of superior olivary nuclei. Am. J. Physiol. 197, 527-536 (1959).
- Goldberg, J., Brown, P. B. Response of binaural neurons of dog superior olivary complex to dichotic tonal stimuli: some physiological mechanisms of sound localization. J. Neurophysiol. 32 (4), 613-636 (1969).
- Guinan, J. J., Guinan, S. S., Norris, B. E. Single auditory units in the superior olivary complex I: responses to sounds and classifications based on physiological properties. Intern. J. Neurosci. 4, 101-120 (1972).
- Spirou, G. A., Brownell, W. E., Zidanic, M. Recordings from cat trapezoid body and HRP labeling of globular bushy cell axons. J. Neurophysiol. 63 (5), 1169-1190 (1990).
- Khosrovani, S., Der Giessen, R. S. V. a. n., De Zeeuw, C. I., De Jeu, M. T. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proc. Natl. Acad. Sci. U.S.A. 104 (40), 15911-15916 (2007).
- Rodríguez-Contreras, A., Van Hoeve, J. S., Habets, R. L., Locher, H., Borst, J. G. G. Dynamic development of the calyx of Held synapse. Proc. Natl. Acad. Sci. U.S.A. 105 (14), 5603-5608 (2008).
- Lorteije, J. A., Rusu, S. I., Kushmerick, C., Borst, J. G. G. Reliability and precision of the mouse calyx of Held synapse. J. Neurosci. 29 (44), 13770-13784 (2009).
- Tritsch, N. X., Rodríguez-Contreras, A., Crins, T. T., Wang, H. C., Borst, J. G. G., Bergles, D. E. Calcium action potentials in hair cells pattern auditory neuron activity before hearing onset. Nat. Neurosci. 13 (9), 1050-1052 (2010).
- Tong, H., Steinert, J. R., Robinson, S. W., Chernova, T., Read, D. J., Oliver, D. L., Forsythe, I. D. Regulation of Kv channel expression and neuronal excitability in rat medial nucleus of the trapezoid body maintained in organotypic culture. J. Physiol. 588 (9), 1451-1468 (2010).
- Sonntag, M., Englitz, B., Kopp-Scheinpflug, C., Rübsamen, R. Early postnatal development of spontaneous and acoustically evoked discharge activity of principal cells of the medial nucleus of the trapezoid body: an in vivo study in mice). J. Neurosci. 29 (30), 9510-9520 (2008).
- García-Villalón, A. L., Roda, J. M., Alvarez, F., Gómez, B., Diéguez, G. Carotid blood flow in anesthetized rats: effects of carotid ligation and anastomosis. Microsurgery. 13 (5), 258-261 (1992).
- Yuan, W., Lv, Y., Zeng, M., Fu, B. M. Non-invasive method for the measurement of solute permeability of rat pial microvessels. Microvasc. Res. 77 (2), 166-173 (2009).
- Kitamura, K., Judkewitz, B., Kano, M., Denk, W., Haüsser, M. Targeted patch-clamp recordings and single-cell electroporation of unlabeled neurons in vivo. Nat. Methods. 5 (1), 61-67 (2008).
- Mostany, R., Portera-Cailliau, C. A method for 2-photon imaging of blood flow in the neocortex through a cranial window. J. Vis. Exp. (12), (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved