Method Article
في المختبر إعادة تشكيل مجمعات خفيفة حصاد النباتات والطحالب الخضراء
In This Article
Summary
This protocol details the reconstitution of light-harvesting complexes in vitro. These integral membrane proteins coordinate chlorophylls and carotenoids and are responsible for harvesting light in higher plants and green algae.
Abstract
في النباتات والطحالب الخضراء، وضوء استولت عليها المجمعات حصاد الضوء (LHCs)، وهي عائلة من بروتينات الغشاء لا يتجزأ التي تنسق الكلوروفيل والكاروتينات. في الجسم الحي، يتم طي هذه البروتينات مع المواد الملونة لتشكيل المجمعات التي يتم إدراجها في الغشاء الثايلاكويد للبلاستيدات الخضراء. التشابه عالية في الخصائص الكيميائية والفيزيائية للأعضاء الأسرة، جنبا إلى جنب مع حقيقة أنها يمكن أن يخسر بسهولة أصباغ خلال العزلة، ويجعل تنقية في حالة الأم صعبة. وقد وضعت نهجا بديلا للحصول على الاستعدادات متجانسة من LHCs بواسطة Plumley وشميت في عام 1987 1، الذي أظهر أنه من الممكن لإعادة بناء هذه المجمعات في المختبر بدءا من أصباغ المنقى وapoproteins تكشفت، مما أدى إلى المجمعات مع خصائص مشابهة جدا لتلك التي من مواليد المجمعات. هذا فتح الطريق لاستخدام البكتيرية البروتينات المؤتلف وأعرب عن في المختبر (مثل صبغة ملزمة المواقع) أو مجال البروتين (مثل التفاعل البروتين البروتين، قابلة للطي). وقد تم تحسين هذه الطريقة في العديد من المختبرات وتطبيقها على معظم المجمعات حصاد الضوء. بروتوكول الموصوفة هنا تفاصيل طريقة إعادة تشكيل المجمعات ضوء حصاد في المختبر المستخدمة حاليا في المختبر لدينا، ويتم توفير أمثلة تصف تطبيقات الأسلوب.
Introduction
جهاز التمثيل الضوئي للنباتات والطحالب تشمل البروتينات التي تربط الغشاء لا يتجزأ من الكلوروفيل (شيلي) أ، ب (شيلي ب) والكاروتينات (سيارة). هذه المجمعات الصباغ البروتين تنشط في مجال الطاقة ضوء الحصاد ونقل أن طاقة الإثارة إلى مراكز رد فعل، حيث يتم استخدامه للترويج تهمة الفصل 2. وهم يشاركون أيضا في آليات التغذية المرتدة التنظيمية التي تحمي الجهاز من التلف الضوئي ضوء ارتفاع 3،4. تتكون المجمعات حصاد الضوء (LHCs) من عائلة كبيرة من البروتينات ذات الصلة في النباتات والطحالب 5.
تنقية متجانسة من كل عضو من أعضاء الأسرة وقد تعقدت من الخصائص الكيميائية والفيزيائية مشابهة إلى حد كبير من المجمعات. بالإضافة إلى ذلك، غالبا ما تؤدي الإجراءات تنقية في فقدان أصباغ أو العوامل المساعدة الأخرى المحتملة مثل الدهون. في المختبر تمثيلا إعادةTS وسيلة قوية للتغلب على هذه المشاكل. وأعيد تشكيل LHC المرتبطة الضوئي الثاني (LHC-II) لأول مرة في المختبر بواسطة Plumley وشميت في عام 1987 1. استخراج الباحثون delipidated البروتين وأصباغ بشكل منفصل من البلاستيدات الخضراء النباتية، ومن ثم الجمع بين الحرارة التشويه والتحريف بروتين مع أصباغ في وجود ليثيوم دوديسيل كبريتات (LDS)، تليها ثلاث دورات التجميد والذوبان 1. وأظهر الباحثون أن الخصائص الطيفية للمجمعات المصادم أعيد كانت مشابهة جدا لمجمعات تنقيته من النباتات. سهولة إعادة تشكيل المصادم المجمعات الصباغ البروتين، من المحتمل بسبب بعض المتأصلة ميزة التجميع الذاتي، جنبا إلى جنب مع صعوبة في عزل المجمعات المنقى من الكائنات الحية، أدى إلى اعتماد سريع للطريقة قبل باحثين آخرين. وقد تحقق إعادة تشكيل البروتينات الضوئي overexpressed في القولونية (E. كولاي) عن طريق بولسن وزملاؤه في عام 1990 6. في E.وعادة ما ترد القولونية والبروتينات الغشاء overexpressed في الهيئات إدراج، الذي مرافق تنقية بهم. ويتحقق من خلال إعادة تمسخ الحرارة الهيئات إدراج تحتوي على البروتين المؤتلف في وجود LDS، تليها إضافة أصباغ الذي يبدأ البروتين للطي. للطي من مجمع LHCII هي عملية من خطوتين: أولا، لا بد من الكلوروفيل في أقل من 1 دقيقة. ثانيا، لا بد الكلوروفيل ب واستقرت على مدى عدة دقائق 7.
بالإضافة إلى توفير نظرة ثاقبة على ديناميات قابلة للطي، في إعادة المختبر جنبا إلى جنب مع الطفرات الموجهة الموقع قد يسمح بتحديد الأحماض الأمينية محددة هامة للاستقرار (على سبيل المثال، 8،9) أو التنسيق الصباغ (على سبيل المثال، 10). وقد حددت التلاعب refolding الظروف من خلال تعديل معايير مثل تكوين الصباغ أو المنظفات أيضا عناصر criticaلتر للطي السليم، مثل شرط من Xanthophylls للمجمع LHCII (على سبيل المثال، 1،11). وبالإضافة إلى ذلك، فإن التحقيق في خصائص أصباغ الفردية منضمة إلى المجمعات الممكن استخدام المجمعات تشكيلها في الجسم الحي (على سبيل المثال، 10).
الطريقة الموصوفة هنا يبدأ عزل الصبغات (الكلوروفيل والكاروتين) من السبانخ والطحالب الخضراء كلاميدوموناس reinhardtii. التعبير وتنقية البروتين LHC من E. القولونية في شكل هيئات إدراج بعد ذلك بالتفصيل، تليها إعادة تشكيل LHC وتنقية اللاحقة ني عمود النسب. في الخطوة النهائية، وتنقيته المجمعات أعيد مزيد من السكروز التدرج الطرد المركزي لإزالة أصباغ حرة وتكشفت صميم بروتيني. يمثل هذا البروتوكول إجراء الأمثل دمج العديد من التعديلات التي أدخلت من قبل مختبرات مختلفة خلالالوقت 1،6،10،12 -14.
Protocol
1. إجمالي صبغات استخراج من أوراق السبانخ
- التجانس حفنة من أوراق السبانخ (20 ~ غ) في 100 مل من البرد العازلة طحن (انظر الجدول 1) باستخدام الخلاط لمدة 20 ثانية.
- تصفية الحل من خلال طبقتين من القماش والنايلون التي يبلغ قطرها 20 ميكرون المسام من أجهزة الطرد المركزي والترشيح في 1،500 x ج لمدة 10 دقيقة في 4 درجات مئوية.
- resuspend الكرية التي تحتوي على البلاستيدات الخضراء مع الفنانين لينة فرشاة الطلاء في 1 مل من البرد غسل العازلة (انظر الجدول 1). بمجرد معلق بيليه، إضافة 50 مل من غسل العازلة وأجهزة الطرد المركزي في حل 10،000 x ج لمدة 10 دقيقة في 4 درجات مئوية.
- إزالة طاف وبلطف resuspend الكرية (thylakoids) في 50 مل من غسل العازلة (انظر الجدول 1).
- الحل الطرد المركزي في 10،000 x ج لمدة 10 دقيقة في 4 درجات مئوية وإزالة طاف تماما. في هذه المرحلة، تنفيذ الخطوات التالية في الظلام، لتجنب الصباغ الأكسدة.
- إضافة ~ 20 مل من 80٪ الأسيتون مخزنة مع نا 2 CO 3 (انظر الجدول 1) لاستخراج الصبغات. ترك الحل على الجليد لمدة 10 دقيقة، vortexing لفي بعض الأحيان.
- بيليه المكونات الخلوية بواسطة الطرد المركزي عند 12،000 x ج لمدة 15 دقيقة على 4 درجات مئوية.
ملاحظة: إذا لم يتم استخراج الصبغات تماما، فإن بيليه لديهم اللون الأخضر وخطوة 1.6 يجب أن تتكرر. - جمع طاف في قمع separatory. إضافة 0.4 حجم diethylether، يهز بقوة وفتح صمام للتنفيس الغاز.
- إضافة 0.8 حجم 0.33 M كلوريد الصوديوم ومزيج بقوة. سماح ~ 10 دقيقة لطبقات لفصل. المرحلة الأثير على رأس تحتوي على أصباغ المستخرج. إزالة مرحلة أقل واضحة.
ملاحظة: إذا كان الانفصال غير واضح، وتجميد وذوبان الجليد الحل لتحسين فصل المرحلة. - إزالة الأثير عن طريق سكب عليه من أعلى القمع separatory في وعاء زجاجي مناسبة. الجافة عن طريق إضافة ملعقة من غرانالجزيئية كبريتات الصوديوم اللامائية. دوامة الحل والسماح ~ 5 دقائق لالمجففة لامتصاص المياه من الأثير.
ملاحظة: تكرار هذه الخطوة إذا ظهرت كبريتات الصوديوم تجمعت معا تماما. ينبغي أن يكون هناك بعض البلورات التعويم الحر عند المجففة الأثير بما فيه الكفاية. إذا كانت أشكال طبقة المياه، وإزالة هذا مع الماصة باستور قبل إضافة كبريتات الصوديوم اللامائية إضافية. - صب الأثير إلى وعاء زجاجي جديدة، وترك كبريتات الصوديوم الصلبة وراءها.
- تتبخر الأثير في speedvac الدوارة أو تحت تيار من N 2.
- حل أصباغ تماما في 10 مل من 100٪ الأسيتون.
- تخفيف كمية صغيرة (~ 3 ميكرولتر) إلى 1 مل من 80٪ الأسيتون وقياس أطياف الامتصاص وتحديد شيلي أ / ب ونسبة تركيز شيلي مع أسلوب صفها Porra وآخرون. (1989) 15.
- قسامة وتجف أصباغ في speedvac الدوارة أو تحت N 2 تيار حتى الأسيتون هوتبخرت تماما. تخزين الأصباغ المجففة في -80 درجة مئوية.
2. استخراج الكاروتينات من السبانخ
- اتبع الخطوات من 1،1-1،5. في هذه المرحلة، تنفيذ الخطوات التالية في الظلام، لتجنب الصباغ الأكسدة.
- resuspend الكرية في الثايلاكويد ~ 50 مل 96٪ من الإيثانول مخزنة مع نا 2 CO 3 (انظر الجدول 1) لاستخراج الصبغات. ترك الحل على الجليد لمدة 5 دقائق.
- بيليه المكونات الخلوية بواسطة الطرد المركزي عند 12،000 x ج لمدة 15 دقيقة على 4 درجات مئوية.
ملاحظة: إذا لم يتم استخراج الصبغات تماما، فإن بيليه لديهم اللون الأخضر وخطوة 2.2 يجب أن تتكرر. - جمع طاف وإضافة 0.1 حجم KOH 80٪ (ث / ت) لبدء التصبين.
- ترك الحل في 4 درجات CO / N، توج بإحكام ومحمية من الضوء.
- جمع الحل في قمع separatory. إضافة 1 حجم ايثر وتخلط بلطف.
- إضافة 0.8 المجلدumes 0.33 M كلوريد الصوديوم وتخلط بلطف. سماح ~ 10 دقيقة لطبقات لفصل. المرحلة الأثير البرتقال على رأس تحتوي على الكاروتينات تصبن. إزالة المرحلة أقل الخضراء استنزاف من خلال محبس من القمع.
- إضافة 3 مجلدات من الماء وتخلط برفق لإزالة هيدروكسيد البوتاسيوم. السماح للطبقات منفصلة. ملاحظة: إذا ظهرت المرحلة العليا جزئيا، إضافة كمية صغيرة من كلوريد الصوديوم (على سبيل المثال، 3 غرام من كلوريد الصوديوم في 200 مل من محلول) ودوامة بلطف إلى حل.
- إزالة المرحلة الدنيا من استنزاف من خلال محبس من القمع.
- اتبع الخطوات 1،10-1،13.
- تخفيف كمية صغيرة (~ 3 ميكرولتر) إلى 1 مل من 80٪ الأسيتون وقياس أطياف الامتصاص في 440 نانومتر في 80٪ الأسيتون. لتحديد تركيز، استخدم متوسط معامل الانقراض لالكاروتينات (ε 440 = 255) 16 في الصيغة التالية: سيارة [مغ / مل] = (القيمة المطلقة 440 نانومتر / 225) × 11 (مسار بصري) = 1 سم.
- قسامة وتجفيف carotenoiوقد تبخرت DS في speedvac أو تحت N 2 تيار حتى كل diethylether. تخزين الأصباغ المجففة في -80 درجة مئوية.
3. إجمالي صبغات وكاروتينويد استخراج من كلاميدوموناس reinhardtii
- تنمو C. reinhardtii على TAP الصلبة المتوسطة 17 في طبق بتري عن طريق نشر كمية صغيرة من السائل الثقافة على السطح. تنمو تحت إضاءة تدفق مستمر من 20 ميكرومول الصور PSA -1 م -2 ثانية حتى طبقة خضراء من خلايا مرئيا.
- باستخدام حلقة عقيمة بتلقيح، حصد كمية صغيرة من C. reinhardtii من المتوسطة TAP الصلبة ووضع الخلايا في 500 مل من TAP المتوسطة 17 في قارورة 1 لتر. تنمو ثقافة عند 25 درجة مئوية مع 170 دورة في الدقيقة التحريض تحت إضاءة تدفق مستمر من 20 ميكرومول الصور PSA -1 م -2 ثانية.
- بعد 5-6 أيام، ينبغي للثقافة تصل إلى نهاية المرحلة لوغاريتمي (6 × 10 6 خلية / ملأو 2-2.5 الكثافة البصرية في 750 نانومتر). أجهزة الطرد المركزي في الثقافة 4،000 x ج لمدة 15 دقيقة على 4 درجات مئوية.
- لمجموع استخراج الصباغ، اتبع الخطوات 1،6-1،15.
- العائد من إجمالي استخراج الصباغ تبدأ من 500 مل من ثقافة كاملة من النمو C. reinhardtii حوالي 5 مل من محلول بتركيز 0.5 ملغ شيلي أ + ب / مل.
- لاستخراج الكاروتينات، اتبع الخطوات 2،2-2،12.
4. تنقية الهيئات إدراج
- استنساخ تسلسل ترميز البروتين LHC ذات الاهتمام الى ناقلات التعبير الذي يؤدي إلى C-محطة علامة تنصهر له باستخدام إجراءات البيولوجيا الجزيئية القياسية. تحويل هذا التصور إلى E. سلالة المضيف القولونية مثل BL21 (DE3).
- إعداد تحلل العازلة، عازلة منظفات، عازلة تريتون، TE (الجدول 1)، 1 الآيزوبروبيل M β-D-1-thiogalactopyranoside (IPTG) وLB المتوسطة 18 مع المضادات الحيوية المناسبة.
- اختيار سينغله E. القولونية مستعمرة تحتوي على استنساخ التعبير من لوحة يشوبه حديثا إلى ~ 5 مل من LB المتوسطة مع المضادات الحيوية المناسبة باستخدام إجراءات القياسية 6. ينمو بمعدل 37 درجة مئوية مع 220 دورة في الدقيقة الانفعالات لمدة 16 ساعة على الأقل.
- إضافة 2.5 مل من O / N الثقافة في قارورة 1 لتر مخروطي مع 250 مل من LB تستكمل مع المضادات الحيوية المناسبة.
- تنمو الخلايا لمدة 2-3 ساعة (أو حتى غير OD 600 ~ 0.6) عند 37 درجة مئوية في 220 دورة في الدقيقة.
- إضافة IPTG إلى تركيز النهائي من 1 ملم. يستمر نمو الخلايا عند 37 درجة مئوية مع 220 دورة في الدقيقة 3-4 ساعة.
- أجهزة الطرد المركزي ثقافة لمدة 10 دقيقة في 5،000 x ج في 4 درجات مئوية في أنبوب وزنه قبل الطرد المركزي. تجاهل طاف بدقة وتحديد الوزن بيليه من وزنها مرة أخرى وطرح وزن أنبوب الطرد المركزي.
- Resuspend وE. بيليه الخلية القولونية في 0.8 مل / ز من الاحتياطي تحلل من قبل vortexing قوية.
ملاحظة: بدلا من ذلك، يمكن تجميد بيليه خلية في -80C لاستخدامها لاحقا. إذا بدءا من بيليه المجمدة، والسماح لذوبان الجليد تماما قبل إضافة تحلل العازلة. - إضافة 2 ملغ من الليزوزيم لكل غرام من الخلايا، واحتضان على الجليد الرطب مع vortexing لعرضية لمدة 30 دقيقة.
- إضافة 20 ميكروغرام / مل الدناز، 10 ملم MgCl 2، 1 مم كلوريد الصوديوم، و 20 ميكروغرام / مل ريبونوكلياز. دوامة ووضع على الجليد لمدة 30 دقيقة.
- إضافة 2 مل من العازلة منظفات البارد في كل غرام من الخلايا. تخلط جيدا والحفاظ على RT لمدة 5 دقائق.
- نقل إلى 2 مل أنابيب الطرد المركزي (تنقسم إلى أنبوبين إذا لزم الأمر). الطرد المركزي لمدة 10 دقيقة على 12،000 XG في 4 درجات مئوية لتكوير الهيئات إدراج.
- إضافة 1 مل من تريتون الباردة العازلة و resuspend تماما بيليه بواسطة sonification (3 × 5 البقول ثانية × 50٪ السلطة مع فترات 20 ثانية). ملاحظة: لديك الأنبوب في دورق صغير محاط الماء المثلج لإبقائه باردا خلال sonification. في حالة أنابيب متعددة، والجمع بين الهيئات إدراج معلق في أنبوب واحد بعد إعادة تعليق.
- أجهزة الطرد المركزي لمدة 10 دقيقة عند 12،000XG في 4 درجات مئوية لتكوير الهيئات إدراج.
- كرر الخطوة 4.13 و 4.14 مرتين.
- Resuspend والهيئات إدراجها في 1 مل من TE الباردة مع sonification لغسل النهائي لإزالة عازلة تريتون. الطرد المركزي لمدة 10 دقيقة على 12،000 XG في 4 درجات مئوية لتكوير الهيئات إدراج.
- resuspend الكرية في 1 مل من TE الباردة sonification.
- تقييم تركيز البروتين بالطرق العادية مثل فحص برادفورد 19. مخزن aliquots من الهيئات إدراج في -20 درجة مئوية.
5. إعادة إعماره
هذا البروتوكول ينتج عادة 1-2 مل من البروتين أعيد مع OD 4 عندما يتم قياس الامتصاصية في المنطقة QY (600-750 نانومتر). يمكن تعديل الكمية حسب الرغبة، على الرغم من الرعاية التي ينبغي اتخاذها للحفاظ على النسب الصحيحة أثناء العملية.
- إعداد الحلول التالية كما هو موضح في الجدول رقم 1: 2X العازلة إعادة إعماره، 20٪ OG، 2 M بوكل، TE. أداء ق التاليةteps في الضوء الخافت.
- و resuspend 800 ميكروغرام من الهيئات إدراج المصادم في ما مجموعه 400 ميكرولتر TE في أنبوب microfuge 2 مل. إضافة 400 ميكرولتر من 2X العازلة إعادة إعماره ودوامة لفترة وجيزة.
- إضافة 0.6 ميكرولتر من β-المركابتويثانول (الأسهم 14.8 M) أن يكون تركيز النهائي من 10 ملم. تسخين البروتين لمدة 1 دقيقة في 98 درجة مئوية. دوامة لفترة وجيزة ومكان في RT لمدة 3 دقائق.
- و resuspend 500 ميكروغرام من إجمالي أصباغ الكلوروفيل المجففة بالإضافة إلى 80 ميكروغرام أصباغ كاروتينويد في 30 ميكرولتر 100٪ ETOH قبل vortexing بقوة لمدة 1 دقيقة أو مكان في sonicator الحمام لمدة 1-2 دقيقة.
- تدور مزيج الصباغ ~ 30 ثانية في 15،800 XG في 4 درجات مئوية وتأكيد أنه لا يوجد بيليه. إذا كان هناك بيليه، كرر vortexing لو / أو sonification. هام: بعد إعادة تعليق وتدور، إضافة على الفور الصباغ للبروتين، أو أنه يمكن تجميع وسوف تحتاج إلى معلق مرة أخرى.
- إضافة ببطء مزيج الصباغ للبروتين في حين vortexing لتبرد. الاستمرار في دوامة 5-10 قالمفوضية الأوروبية ومكان أنبوب على الجليد الرطب. يجب الحرص على عدم دوامة بقوة أيضا، حيث البروتين يمكن تجاوز الجزء العلوي من الأنبوب.
- إضافة 94 ميكرولتر من 20٪ الأوكتيل β-D-glucopyranoside (OG) (التركيز النهائي 2٪)، دوامة لفترة وجيزة والحفاظ على الجليد 10 دقيقة.
- إضافة 90 ميكرولتر من بوكل 2 M (التركيز النهائي 150-200 ملم)، ودوامة لفترة وجيزة والحفاظ على الجليد 20 دقيقة. ملاحظة: إعداد العمود (القسم 6) ويمكن البدء في هذا الوقت.
- تدور لمدة 10 دقيقة على 15،800 XG في 4 درجات مئوية. إزالة طاف دون الإخلال بيليه (عجل LDS) إلى أنبوب 10 مل. تبقي باردة ومحمية من الضوء.
6. النيكل العمود تنقية
- إعداد الحلول التالية كما هو موضح في الجدول رقم 1: عازلة OG، OG عازلة شطف، شطف العازلة.
- ربط عمود ني سيفاروز (1 مل) أو ما يعادلها لمضخة تحوي ضمان أن يحصل أي الهواء داخل العمود خلال هذه الخطوة والخطوات التالية.
- ضبط سرعة رانه ضخ إلى 1 مل / دقيقة وشطف العمود مع 5-10 مل من الماء لإزالة الحل التخزين.
- يوازن العمود مع 3-4 مل من العازلة OG.
- إضافة 3-4 مل من العازلة OG للعينة البروتين والحمولة إلى العمود. ملاحظة: إذا كان البروتين قد يجلس على الجليد لمدة أطول من 10 دقيقة بعد إزالة LDS، وتدور مرة أخرى في 15،800 XG في 4 درجة مئوية لمدة 1 دقيقة لإزالة أي هطول LDS إضافية.
- شطف العمود مع 5 مل من العازلة OG.
- شطف العمود مع 2 مل من العازلة OG الشطف.
- أزل البروتين ملزمة مع 3 مل شطف العازلة. جمع أزل الأخضر الذي يحتوي على البروتين المعاد. ملاحظة: هذا هو عادة حوالي 1 مل في المجموع.
7. السكروز التدرج الطرد المركزي
- إعداد الحلول التالية كما هو موضح في الجدول رقم 1: محلول السكروز، 0.06٪ β-DM، 0.01 M HEPES، ودرجة الحموضة 7.6.
- ملء أنابيب نابذة فائقة السرعة مع حل السكروز وتجميد في -20 درجة CO / N سص -80 درجة مئوية لمدة 1 ساعة على الأقل.
- إزالة أنبوب من الثلاجة والسماح لذوبان الجليد دون عائق في 4 درجات مئوية. ملاحظة: عملية التجميد / الذوبان يخلق التدرج 0،1-1 M السكروز. أنبوب 15 مل يذوب عادة في حوالي 3 ساعة.
- إزالة بعناية من أعلى نفس الحجم باعتبارها جزء أخضر مزال من النيكل عمود سيفاروز في الخطوة 6.8. ثم تحميل عينة تتشكل من جديد على أعلى ببطء لتجنب تعكير التدرج.
- أنابيب التوازن وتدور في 200،000 XG في 4 درجات مئوية في نابذة فائقة السرعة باستخدام دلو الدوار SW-SW-41 أو 60 يتأرجح لمدة 18 ساعة، تعيين لإبطاء تسارع ووقف دون فرامل.
- تأخذ بعناية التدرج من حامل أنبوب بالملقط. استخدام حقنة بإبرة طويلة له افتتاح حادة لجمع جزء من الأعلى. ملاحظة: بالتناوب، وجمع الكسور من أسفل بواسطة ثقب أنبوب بإبرة وجمع قطرات.
النتائج
هذا البروتوكول تفاصيل طريقة لإعادة chorophyll أ / ب البروتينات ملزمة في المختبر. هذه التقنية تسمح للطي من هذه المجمعات الصباغ البروتين في المختبر بدءا من صميم بروتيني، والتي يمكن الحصول عليها عن طريق overexpression في نظام مغاير، والأصباغ المستخرجة من النباتات أو الطحالب. بعد إعادة، يتم تنقيته من مجمع الصباغ البروتين refolded عن زيادة الصبغات وصميم بروتيني تكشفت في خطوتين. ويستند الخطوة الأولى (الشكل 1 AB) على وجود صاحب العلامة في C-محطة من البروتين، الذي يسمح بإزالة جزء كبير من أصباغ غير منضم. الخطوة الثانية تنقية تستخدم كثافة السكروز الطرد المركزي التدرج، (الشكل 2) حيث عادة ما يهاجر البروتين تكشفت أبطأ من الفرقة الخضراء التي تحتوي على البروتين المعاد. الهدف من إعادة في المختبر هو الحصول على المجمعات مع نفسه السليمالروابط ومنها الأم. لتوضيح هذه النتيجة، تتم مقارنة الخصائص الطيفية للضوء في الجسم الحي مجمع حصاد بنفس المجمع LHC تشكيلها في المختبر 13،20،21. طيف الامتصاص للLHCs في النطاق المرئي (350 نانومتر و 750 نانومتر) يعتمد على تكوين الصباغ للمجمع، وكذلك على بيئة الصباغ (التي تشمل البروتين)، وبالتالي فمن أداة حساسة للتحقق من جودة للإعادة. في الشكل 3، والامتصاص من CP24، وهو الكلوروفيل أ / ب البروتين من thaliana نبات الأرابيدوبسيس، أعيد تشكيله في المختبر ملزمة، تتم مقارنة مع الطيف من نفس المجمع تنقيته من نبات الأرابيدوبسيس thylakoids 21. في أطياف، فمن الممكن الاعتراف QY والانتقال سوريه من شيلي و(قمم في 671/439 نانومتر) وشيلي ب (قمم في 649/466 نانومتر). تظهر المجمعات المحلية وأعيد abso متطابقةأطياف rption، مما يشير إلى تكوين الصباغ متطابقة تقريبا والتنظيم. مضان الطيفي يمكن استخدامها لتقييم نوعية المجمع المجدد. يتم قياس أطياف مضان الانبعاثات على الإثارة عند أطوال موجية مختلفة، والتي تثير تفضيلي أصباغ مختلفة: داا لفي 440 نانومتر، داا ب في 475 نانومتر، وXanthophylls في 500 نانومتر. في مجمع البروتين الصباغ مطوية بشكل صحيح، وشيلي ب Xanthophylls نقل طاقة الإثارة في المقام الأول إلى شيلي في غضون بضعة picoseconds، ومضان ينشأ من نظام معايرتها حراريا مما أدى إلى ذروة واحدة بنفس الشكل وماكسيما في كل ثلاثة الإثارة موجات (الشكل 4A-B). وجود داا ب غير منسقة للبروتين يمكن أن يعترف بها ذروة إضافية أو الكتف حوالي 650 نانومتر 475 نانومتر على الإثارة (الشكل 4C). وجود حرية شيلي وبدلا يؤديلانبعاث إضافية حول 675 نانومتر، والتي هي موجودة أساسا على 440 نانومتر الإثارة. أطياف الانبعاثات مضان على 475 نانومتر الإثارة من كلا تشكيلها والمجمعات CP24 الأم (الشكل 4D) تظهر ذروة واحدة في 681 نانومتر، مشيرا إلى أن المجمع المعاد هو مطوية بشكل صحيح. تأكيدا إضافيا أن يتم إعادة تشكيل مجمع الصباغ البروتين بشكل صحيح يأتي من ازدواج اللون دائرية (CD) القياسات. إشارة CD في المنطقة المرئية تعتمد على التفاعلات بين excitonic أصباغ وبالتالي فمن حساسة جدا للتغيرات الصغيرة حتى في تنظيم chromophores 22. الشكل 5 يبين CD أطياف وأعيد الأصلي CP24، مع قمم بصمة نموذجية في 681 نانومتر، 650 نانومتر و 481 نانومتر. وفي الختام، والتشابه الكبير بين الخصائص الطيفية للمواطن وCP24 أعيد يؤكد أن المجمعات غلة إجراء إعادة تشبه مواليد-سويتا بلي للدراسة في المختبر من البروتينات حصاد الضوء.
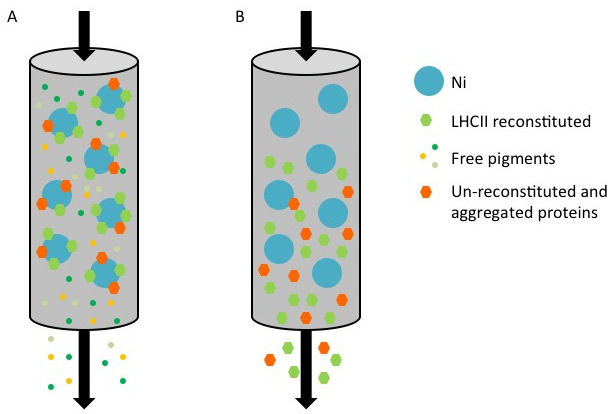
الرقم 1. تمثيل تنقية البروتينات المصادم المؤتلف مع علامة صاحب باستخدام عمود النيكل. (A) خلال تنقية، صاحب الموسومة البروتين، ويتألف من كل المجمعات المعاد (مسدس الأخضر) والامم المتحدة وأعيد / مجمعة البروتين (البرتقال مسدس) لا بد أن سطح ني سيفاروز (بقعة زرقاء)، بينما أصباغ غير منضم (بقع ملونة صغيرة) تتدفق من خلال. (B) عندما يتم غسلها العمود مع شطف العازلة التي تحتوي على إميدازول، يتم جمع البروتينات وأعيد تشكيلها في الامم المتحدة وتدفق من خلال.
hres.jpg "العرض =" 500 "/>
الشكل 2. السكروز التدرج من LHCII تشكيلها بعد تنقيتها بواسطة عمود النيكل. يتم فصل المجمعات تشكيلها من الصباغ المجاني من التدرج الكثافة. تمثل الفرقة الخضراء الداكنة LHCII المعاد تشكيلها وتتكون من خلفية خضراء شاحبة من أصباغ الحرة.
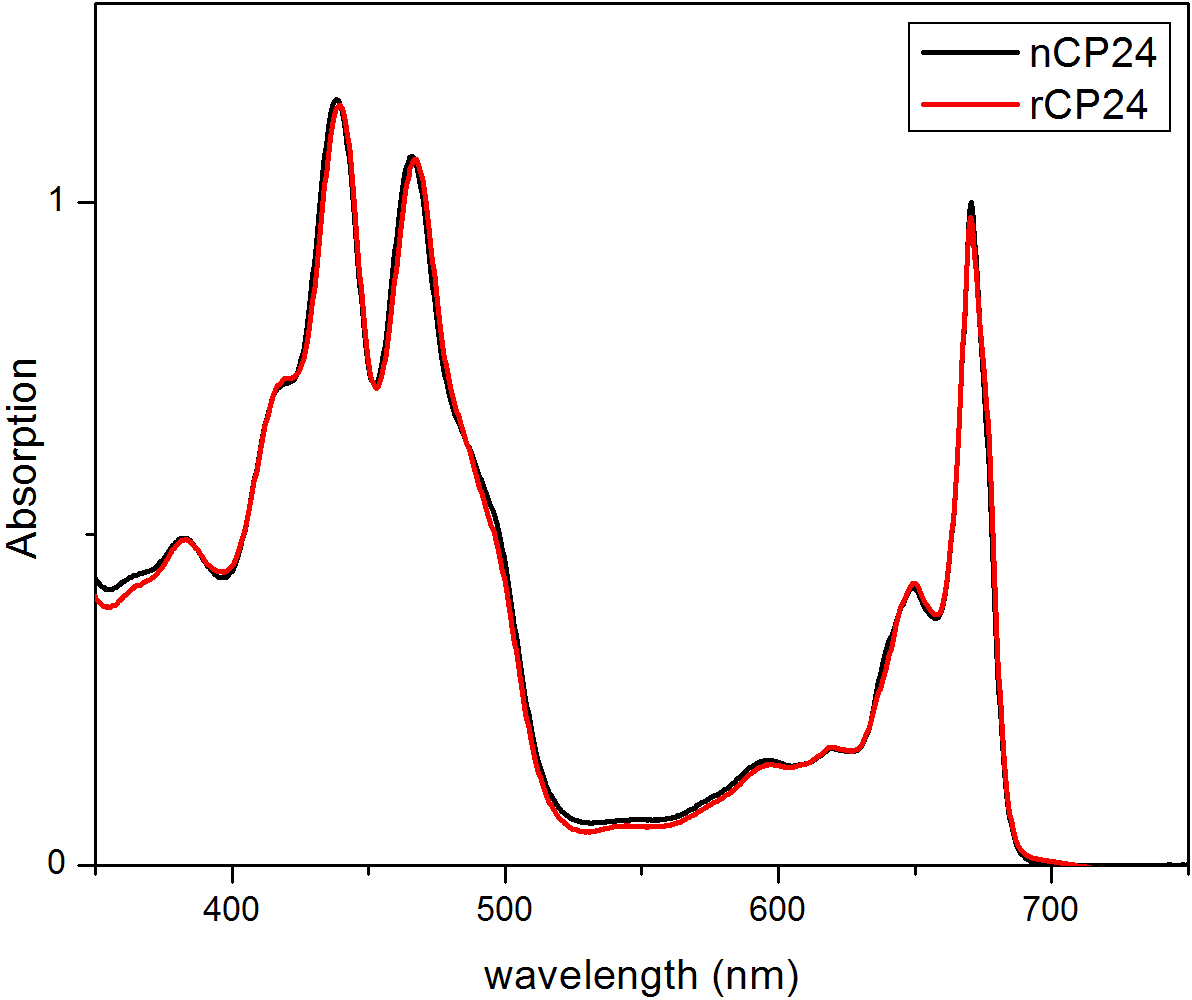
الرقم 3. أطياف الامتصاص من البروتين أعيد CP24 (rCP24، خط أحمر) واحد الأصلي (nCP24، خط أسود) المعزولة من نبات الأرابيدوبسيس thaliana. وفي كلتا الأطياف، فمن الممكن الاعتراف QY والانتقال سوريه من شيلي و(قمم في 671/439 نانومتر) وشيلي ب (قمم في 649/466 نانومتر). تم تعديل هذا الرقم من Passarini وآخرون. 2014 21.
ther.within الصفحات = "دائما"> 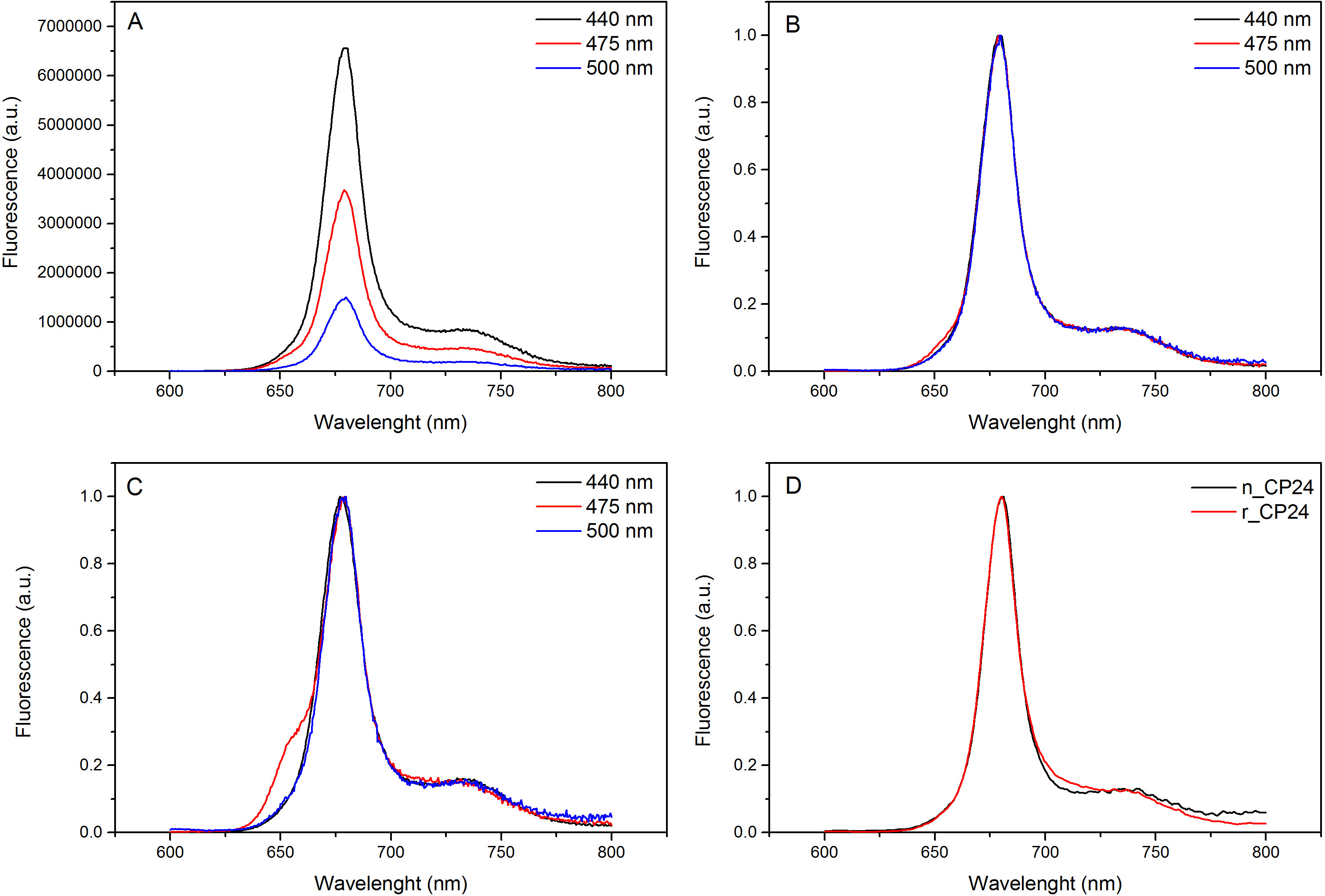
الرقم 4. الإسفار أطياف الانبعاثات. الأطياف الانبعاثات مضان من إعادة تشكيل مجمع CP24 wildtype (A) وتطبيع الحد الأقصى (B) تظهر كفاءة نقل الطاقة من شيلي وب Xanthophyls إلى شيلي أ. (C) الإسفار أطياف انبعاث أعيد CP24 (rCP24) ومجمع مواطن (nCP24) المعزولة من نبات الأرابيدوبسيس thaliana. والأطياف هم تطبيع إلى أقصى ذروة (D). يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
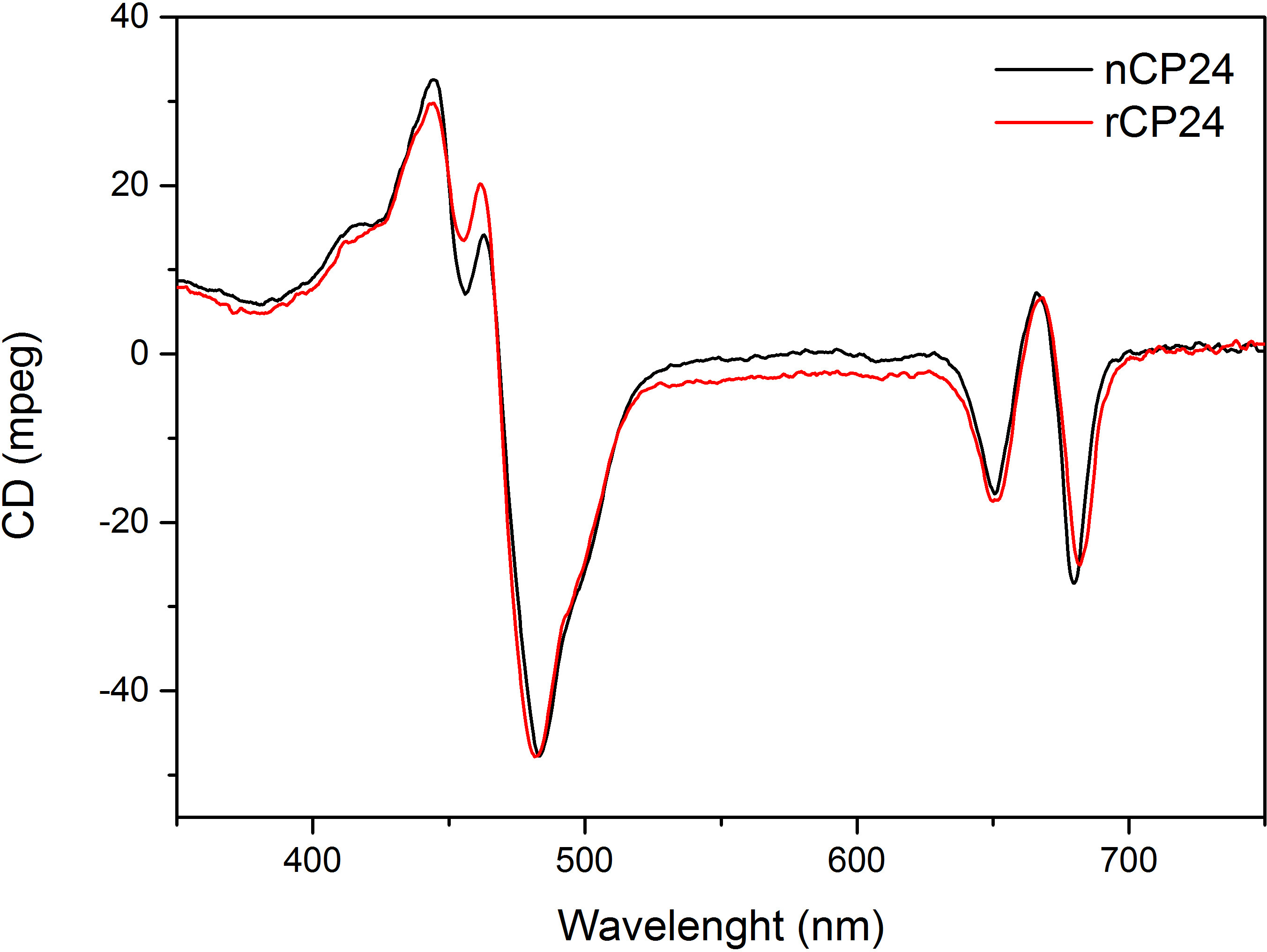
الشكل 5. التعميم ازدواج اللون الأطياف. المعاد CP24 (rCP24، خط أحمر) ومواطن مجمع (nCP24، خط أسود) المعزولة من نبات الأرابيدوبسيس thaliana معارض أطياف مشابهة جدا.

الرقم 6. امتصاص أطياف CP29 النوع البري (CP29_WT) وتحور CP29 (CP29_A2). الخط الأخضر يظهر الاختلافات بين قطعتي الأرض.
| يمكن تخزين كافة المخازن المؤقتة في 4 درجات مئوية. | |||
| مكونات | تركيز النهائي | ملاحظات إضافية | |
| طحن العازلة | السوربيتول | 0.4 M | |
| Tricine | 0.1 M | الرقم الهيدروجيني 7.8 | |
| كلوريد الصوديوم | 10 ملي | ||
| MgCl 2 | 5 ملي | ||
| مسحوق الحليب | 0.5٪ ث / ت | ||
| غسل العازلة | السوربيتول | 50 ملي | |
| Tricine | 5 ملي | الرقم الهيدروجيني 7.8 | |
| EDTA | 10 ملي | الرقم الهيدروجيني 8 | |
| تحلل العازلة | تريس | 50 ملي | الرقم الهيدروجيني 8 |
| السكروز | 2.5٪ ث / ت | ||
| EDTA | 1 ملم | الرقم الهيدروجيني 8 | |
| عازلة المنظفات | كلوريد الصوديوم | 200 مم كلوريد الصوديوم | |
| حمض Deoxycholic | 1٪ ث / ت | ||
| NONIDET-P 40 | 1٪ ث / ت | ||
| تريس | 20 ملي | ودرجة الحموضة 7.5 | |
| EDTA | 2 مم | الرقم الهيدروجيني 8 | |
| بيتا المركابتويثانول | 10 ملي | ||
| تريتون العازلة | تريتون X-100 | 0.5٪ ث / ت | |
| تريس | 20 ملي | ودرجة الحموضة 7.5 | |
| بيتا المركابتويثانول | 1 ملم | ||
| العازلة TE | تريس | 50 ملي | الرقم الهيدروجيني 8 |
| EDTA | 1 ملم | الرقم الهيدروجيني 8 | |
| إعادة العازلة | HEPES | 200 ملي | |
| السكروز | 5٪ ث / ت | ||
| Lithiumdodecylsulfate (LDS) | 4٪ ث / ت | ||
| Benzamidine | 2 مم | ||
| حمض الأمينوكابرويك | 10 ملي | ||
| OG العازلة | Octylglucoside | 1٪ ث / ت | |
| 12.5٪ ث / ت | |||
| كلوريد الصوديوم | 0.2 M | ||
| HEPES | 20 ملي | ||
| إميدازول | 10 ملي | ||
| OG شطف العازلة | ن دوديسيل بيتا-D-مالتوزيد (β-DM) | 0.06٪ ث / ت | |
| HEPES | 40 ملي | الرقم الهيدروجيني 7،5-9 | |
| كلوريد الصوديوم | 0.2 M | ||
| شطف العازلة | إميدازول | 0.5 M | |
| ن دوديسيل بيتا-D-مالتوزيد (β-DM) | 0.06٪ ث / ت | ||
| HEPES | 40 ملي | الرقم الهيدروجيني 8 | |
| كلوريد الصوديوم | 0.2 M | ||
| محلول السكروز | السكروز | 20٪ ث / ت | |
| ن دوديسيل بيتا-D-مالتوزيد (β-DM) | 0.06٪ ث / ت | ||
| HEPES | 0.01 M | الرقم الهيدروجيني 7.6 | |
| الأسيتون 80٪ مخزنة مع كربونات الصوديوم | الأسيتون | 80٪ V / V | |
| كربونات الصوديوم | 1 M | ||
| الإيثانول 96٪ مخزنة مع كربونات الصوديوم | الإيثانول | 96٪ V / V | |
| كربونات الصوديوم | 1 M | ||
الجدول 1. قائمة مخازن والحلول المستخدمة في هذا البروتوكول.
rCP26| Chla أ / ب مزيج | Chla أ / ب | شيلي و | شيلي ب | الجدد | فيولا | العود | شيلي TOT | شيلي / سيارة | |
| nCP26 | - | 2.2 ± 0.05 | 6.2 | 2.8 | 0.61 | 0.38 | 1.02 | 9 | 4.5 ± 0.1 |
| rCP26 | 8 | 2.71 ± 0.05 | 6.57 | 2.43 | 0.72 | 0.32 | 0.97 | 3.9 ± 0.04 | |
| rCP26 | 5.5 | 2.25 ± 0.05 | 6.23 | 2.77 | 0.77 | 0.3 | 0.96 | 9 | 4.0 ± 0.1 |
| rCP26 | 3 | 2.08 ± 0.04 | 6.08 | 2.92 | 0.76 | 0.3 | 1.04 | 9 | 4.1 ± 0.1 |
| rCP26 | 1 | 1.7 ± 0.05 | 5.7 | 3.3 | 0.7 | 0.3 | 0.9 | 9 | 4.3 ± 0.05 |
| rCP26 | 0.3 | 1.11 ± 0.04 | 4.7 | 4.28 | 0.7 | 0.3 | 0.9 | 9 | 4.2 ± 0.2 |
| 0.05 | 0.23 ± 0.01 | 1.4 | 5.6 | 0.58 | 0.24 | 1.11 | 7 | 3.1 ± 0.06 | |
| rCP26 | <0.01 | 0.11 ± 0.01 | 0.7 | 6.3 | 0.64 | 0.3 | 1.08 | 7 | 3.06 ± 0.06 |
الجدول 2. المحتوى الصباغ من مواليد مجمع CP26 مقارنة أعيد المجمعات البروتين الصباغ مع مختلف شيلي أ / ب النسب 39.
Discussion
بروتينات غشاء ليست سهلة حتى للدراسة. عزل بروتينات غشاء الأم معقد بسبب الحاجة إلى ذوبان طبقة ثنائية الدهون مع المنظفات، التي يمكن أن تتلف البروتينات وإزالة العوامل المساعدة الأساسية. قد تكون هذه البروتينات موجودة أيضا عند مستويات منخفضة في الأغشية البيولوجية، أو تكون مختلطة مع البروتينات ترتبط ارتباطا وثيقا، كما في حالة المجمعات الحصاد الخفيفة، التي تجعل تنقية المجمعات واحدة صعبة. مغاير التعبير البروتين في E. القولونية وإعادة المختبر توفر إمكانية تجنب هذه المشاكل. في المختبر وإعادة تنقية النتائج البروتينات مطوية في المجمعات التي تمتلك خصائص مشابهة جدا لتلك المجمعات الأم 20،21،23، وبالتالي يمكن استخدامها لدراسة المجمعات التي لا يمكن تنقيته لالتجانس 24 - 27.
يستخدم هذا الأسلوب السبانخ، وهو بسهولة attainabلو مدار السنة، كمصدر لمجموع كاروتينويد الصباغ والاستعدادات. لبعض reconstitutions البروتينات الأم إلى الطحالب، ويفضل استخدام أصباغ تنقيته من الطحالب بسبب التراكيب الصباغ مختلفة. وشيلي أ / ب نسبة ونسبة شيلي / سيارة لا يزال هو نفسه بغض النظر عن مصدر الصباغ.
من المهم أن ندرك أن كفاءة إعادة عادة حوالي 35 28٪. وبالتالي فمن الضروري إزالة أصباغ غير منضمة وصميم بروتيني تكشفت من الحل بعد إعادة. ويرد بروتوكول تنقية من خطوتين في هذا البروتوكول (انظر النتائج أيضا). ومع ذلك، تجدر الإشارة إلى أن الخطوة التدرج السكروز لا يسمح الفصل التام بين الاشتقاق وهولو البروتين. بالنسبة لمعظم التحليلات هذه ليست مشكلة، لأن صميم بروتيني لا يحتوي على أصباغ وبالتالي لا تتداخل مع القياسات الوظيفية. ومع ذلك، في حال كان من الضروري إزالة تماما صميم بروتيني من الابعمل تتضمن مجمع تشكيلها (على سبيل المثال، لحساب الصباغ إلى البروتين رياضيات الكيمياء)، يمكن استخدام عمود الصرف أنيوني (انظر Passarini وآخرون 2009 29 للحصول على التفاصيل).
القدرة على refold البروتينات المؤتلف حصاد الضوء مع أصباغ معزولة في المختبر يوفر فرصة ل"التلاعب" المجمعات عن طريق تعديل إعادة تشكيل "البيئة" بطرق مختلفة، وبالتالي تغيير خصائص معقدة الناتجة عن ذلك. على سبيل المثال، تغيير تشكيل الصباغ خلال إعادة يمكن أن يؤدي في مجمع مع تكوين الصباغ غيرت. ويمكن استخدام هذه الميزة لدراسة تأثير مختلف الصبغات لها على بنية واستقرار المجمع. عادة إعداد الصباغ الحصول عليها من السبانخ يحتوي على نسبة شيلي أ / ب من 3: 1 ونسبة / سيارة شيلي من 2.9: 1. هذا ينتج عادة نسبة البروتين أعيد مع نفس الخصائص كما نسالبة واحدة. ومع ذلك، يمكن تعديل نسبة شيلي أ / ب بإضافة تنقية شيلي A أو B تؤثر ربط أصباغ مختلفة بسبب الانتقائية من مواقع الربط متفاوتة 30 - 33. وهذا ممكن لأن معظم المواقع الصباغ ملزم لا انتقائية تماما لشيلي في شيلي أو ب، ولكن يمكن أن تستوعب كلا، على الرغم من تقارب مع مختلف 10،30،34. بطريقة مماثلة، وعرضت مواقع الربط كاروتينويد أيضا أن تكون قادرة على استيعاب أكثر من الأنواع كزانتوفيل 8،35 - 38. وترد reconstitutions مختلف من CP26، مجمع الصباغ البروتين أخرى من النباتات العليا، وذلك باستخدام مختلف التراكيب الصباغ في الجدول 2 39. واستخدمت هذه reconstitutions لتقييم تقارب من مواقع معينة أصباغ 39 ملزمة. ومن المثير للاهتمام أن نلاحظ أنه من أجل الحصول على مجمع بنفس الصباغ جomposition باعتبارها واحدة الأصلي، يجب أن تكون نسبة داا / ب من مزيج الصباغ 3: 1. يبدو أن هذا هو الحال بالنسبة لجميع المجمعات المصادم من النباتات العليا 20،40.
مزيج من البيولوجيا الجزيئية مع تقنية إعادة يسمح خصائص مجمع شيلي ملزم لدراستها بمزيد من التفصيل. أهمية البروتين المجالات المختلفة على استقرار وقابلة للطي من المجمعات، أو مشاركتهم في البروتين البروتين التفاعلات، وقد تم تحديد من قبل اقتطاع صميم بروتيني أو أداء الطفرات العشوائية 8،41 - 44. بقايا حمض أميني واحد مهمة لتنسيق أصباغ مختلفة يمكن تغييرها من خلال الطفرات الموجهة الموقع من أجل تحليل خصائص أصباغ الفردية أو تقييم مساهمتها في وظيفة واستقرار معقدة 10،28،29،45 - 52. الشكل 6 يبين إعادة تكوين Lhcb4 (CP29) معطفرة من الحامض الاميني في موقف 216 53. مقارنة بين تكوين الصباغ من wildtype والمجمعات متحولة تبين أن طفرة يستحث فقدان شيلي جزيء واحد، مشيرا إلى أن الموقع المستهدف يستوعب لشيلي في مجمع WT. الاختلافات من أطياف امتصاص WT ومتحولة، على تطبيع إلى المحتوى الصباغ، ويظهر أيضا خصائص امتصاص الصبغة المفقودة. في هذه الحالة، يمكن رؤية الفرق في ذروة الرئيسية في 680 نانومتر، مشيرا إلى أن شيلي منسقة من قبل His216 يمتص في هذا الطول الموجي (لمزيد من التفاصيل حول هذا المسخ والخصائص الطيفية MOZZO يرى آخرون 2008 53). كما يمكن استخدام تحليل طفرة لتحديد تأثير البيئة على الخواص الطيفية للأصباغ 54.
في الختام، حصاد البروتينات الخفيفة يمكن بسهولة إعادة تشكيل في المختبر مما أدى الصباغ-البروتيناتن المجمعات مع خصائص مشابهة جدا لالمجمعات الأصلية. في هذه الطريقة، يتم استبعاد صعوبات عزل البروتينات الأم، بينما كان يلقى أيضا إعداد البروتين مع ارتفاع العائد والنقاء لمزيد من الدراسة. وأكد داا نسبة 1 أ / ب في إنتاج مجمع أصيلة، وقدمت أمثلة من wildtype تشكيلها وLHCs متحولة لتوضيح تطبيقات هذه التقنية: أهمية وجود 3.
Disclosures
The authors declare no conflict of interest
Acknowledgements
This work was supported by the European research council by a ERC starting/consolidator grant to RC and by the Dutch Foundation for research on matter (FOM) via a FOM program (10TM01).
Materials
| Name | Company | Catalog Number | Comments |
| HisTrap HP | GE Healthcare | 17-5247-01 | |
| Nylon cloth | 20 μm pores | ||
| Soft artists paint brush | |||
| NONIDET P-40 | Sigma | 74385 | |
| Beta-DM | Sigma | D4641 | |
| DNAase | ThermoScientific | EN0525 | |
| Milk Powders | |||
| RNAase | ThermoScientific | EN0531 | |
| Sonicator | |||
| Octyl β-D-glucopyranoside | Sigma | O8001 | |
| Ultracentrifuge XL | Beckman-Coulter | ||
| TAP medium | see reference 17 | ||
| LB medium | see reference 19 |
References
- Plumley, F. G., Schmidt, G. W. Reconstitution of chlorophyll a/b light-harvesting complexes: Xanthophyll-dependent assembly and energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 84, 146-150 (1987).
- Croce, R., van Amerongen, H. Light-harvesting and structural organization of Photosystem II from individual complexes to thylakoid membrane. Journal of photochemistry and photobiology B Biology. 104 (1-2), 142-153 (2011).
- Li, Z., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and responding to excess light. Annual review of plant biology. 60, 239-260 (2009).
- De Bianchi, S., Ballottari, M., Dall’osto, L., Bassi, R. Regulation of plant light harvesting by thermal dissipation of excess energy. Biochemical Society transactions. 38 (2), 651-660 (2010).
- Neilson, J. A. D., Durnford, D. G. Structural and functional diversification of the light-harvesting complexes in photosynthetic eukaryotes. Photosynthesis research. 106 (1-2), 57-71 (2010).
- Paulsen, H., Rümler, U., Rüdiger, W. Reconstitution of pigment-containing complexes from light-harvesting chlorophyll a/b-binding protein overexpressed in Escherichia coli. Planta. 181 (2), 204-211 (1990).
- Horn, R., Grundmann, G., Paulsen, H. Consecutive binding of chlorophylls a and b during the assembly in vitro of light-harvesting chlorophyll-a/b protein (LHCIIb). Journal of molecular biology. 366 (3), 1045-1054 (2007).
- Cammarata, K. V., Schmidt, G. W. In vitro reconstitution of a light-harvesting gene product: deletion mutagenesis and analyses of pigment binding. Biochemistry. 31 (10), 2779-2789 (1992).
- Paulsen, H., Hobe, S. Pigment-binding properties of mutant light-harvesting chlorophyll-a/b-binding protein. European journal of biochemistry / FEBS. 205 (1), 71-76 (1992).
- Bassi, R., Croce, R., Cugini, D., Sandonà, D. Mutational analysis of a higher plant antenna protein provides identification of chromophores bound into multiple sites. Proceedings of the National Academy of Sciences of the United States of America. 96 (18), 10056-10061 (1999).
- Paulsen, H., Finkenzeller, B., Kühlein, N. Pigments induce folding of light-harvesting chlorophyll a/b-binding protein. European journal of biochemistry / FEBS. 215 (3), 809-816 (1993).
- Caffarri, S., Croce, R., Cattivelli, L., Bassi, R. A look within LHCII differential analysis of the Lhcb1-3 complexes building the major trimeric antenna complex of higher-plant photosynthesis. Biochemistry. 43 (29), 9467-9476 (2004).
- Giuffra, E., Cugini, D., Croce, R., Bassi, R. Reconstitution and pigment-binding properties of recombinant CP29. European journal of biochemistry / FEBS. 238 (1), 112-120 (1996).
- Rogl, H., Kosemund, K., Kühlbrandt, W., Collinson, I. Refolding of Escherichia coli produced membrane protein inclusion bodies immobilised by nickel chelating chromatography. FEBS letters. (1-2), 21-26 (1998).
- Porra, R. J., Thompson, W. A., Kriedemann, P. E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 975 (3), 384-394 (1989).
- Davies, B. H. Identification of carotenoids by their absorption characteristics. Biochem J. 103 (2), (1967).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. Journal of bacteriology. 62 (3), 293-300 (1951).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical biochemistry. 72, 248-254 (1976).
- Wientjes, E., Croce, R. The light-harvesting complexes of higher-plant Photosystem I Lhca1/4 and Lhca2/3 form two red-emitting heterodimers. The Biochemical journal. 433 (3), 477-485 (2011).
- Passarini, F., Xu, P., Caffarri, S., Hille, J., Croce, R. Towards in vivo mutation analysis knock-out of specific chlorophylls bound to the light-harvesting complexes of Arabidopsis thaliana - the case of CP24 (Lhcb6). Biochimica et biophysica acta. , (2014).
- Georgakopoulou, S., van der Zwan, G., Bassi, R., van Grondelle, R., van Amerongen, H., Croce, R. Understanding the changes in the circular dichroism of light harvesting complex II upon varying its pigment composition and organization. Biochemistry. 46 (16), 4745-4754 (2007).
- Croce, R., Müller, M. G., Caffarri, S., Bassi, R., Holzwarth, A. R. Energy transfer pathways in the minor antenna complex CP29 of photosystem II a femtosecond study of carotenoid to chlorophyll transfer on mutant and WT complexes. Biophysical journal. 84 (4), 2517-2532 (2003).
- Schmid, V. H., Cammarata, K. V., Bruns, B. U., Schmidt, G. W. In vitro reconstitution of the photosystem I light-harvesting complex LHCI-730 heterodimerization is required for antenna pigment organization. Proceedings of the National Academy of Sciences of the United States of America. 94 (14), 7667-7672 (1997).
- Castelletti, S., Morosinotto, T., Robert, B., Caffarri, S., Bassi, R., Croce, R. Recombinant Lhca2 and Lhca3 subunits of the photosystem I antenna system. Biochemistry. 42 (14), 4226-4234 (2003).
- Storf, S., Jansson, S., Schmid, V. H. R. Pigment binding, fluorescence properties, and oligomerization behavior of Lhca5, a novel light-harvesting protein. The Journal of biological chemistry. 280 (7), 5163-5168 (2005).
- Mozzo, M., Mantelli, M., Passarini, F., Caffarri, S., Croce, R., Bassi, R. Functional analysis of photosystem I light-harvesting complexes (Lhca) gene products of Chlamydomonas reinhardtii. Biochimica et biophysica acta. 1797 (2), 212-221 (2010).
- Remelli, R., Varotto, C., Sandonà, D., Croce, R., Bassi, R. Chlorophyll binding to monomeric light-harvesting complex. A mutation analysis of chromophore-binding residues. The Journal of biological chemistry. 274 (47), 33510-33521 (1999).
- Passarini, F., Wientjes, E., Hienerwadel, R., Croce, R. Molecular basis of light harvesting and photoprotection in CP24 unique features of the most recent antenna complex. The Journal of biological chemistry. 284 (43), 29536-29546 (2009).
- Giuffra, E., et al. Analysis of some optical properties of a native and reconstituted photosystem II antenna complex, CP29 pigment binding sites can be occupied by chlorophyll a or chlorophyll b and determine spectral forms. Biochemistry. 36 (42), 12984-12993 (1997).
- Pagano, A., Cinque, G., Bassi, R. In vitro reconstitution of the recombinant photosystem II light-harvesting complex CP24 and its spectroscopic characterization. The Journal of biological chemistry. 273 (27), 17154-17165 (1998).
- Kleima, F. J., et al. Decreasing the chlorophyll a/b ratio in reconstituted LHCII structural and functional consequences. Biochemistry. 38 (20), 6587-6596 (1999).
- Croce, R., Morosinotto, T., Castelletti, S., Breton, J., Bassi, R. The Lhca antenna complexes of higher plants photosystem I. Biochimica et biophysica acta. 1556 (1), 29-40 (2002).
- Hobe, S., Trostmann, I., Raunser, S., Paulsen, H. Assembly of the major light-harvesting chlorophyll-a/b complex Thermodynamics and kinetics of neoxanthin binding. The Journal of biological chemistry. 281 (35), 25156-25166 (2006).
- Croce, R., Weiss, S., Bassi, R. Carotenoid-binding sites of the major light-harvesting complex II of higher plants. The Journal of biological chemistry. 274 (42), 29613-29623 (1999).
- Hobe, S., Niemeier, H., Bender, A., Paulsen, H. Carotenoid binding sites in LHCIIb. Relative affinities towards major xanthophylls of higher plants. European journal of biochemistry / FEBS. 267 (2), 616-624 (2000).
- Jahns, P., Depka, B., Trebst, A. Xanthophyll cycle mutants from Chlamydomonas reinhardtii indicate a role for zeaxanthin in the D1 protein turnover. Plant Physiology and Biochemistry. 38 (5), 371-376 (2000).
- Wehner, A., Grasses, T., Jahns, P. De-epoxidation of violaxanthin in the minor antenna proteins of photosystemII, LHCB4, LHCB5, and LHCB6. The Journal of biological chemistry. 281 (31), 21924-21933 (2006).
- Croce, R., Canino, G., Ros, F., Bassi, R. Chromophore organization in the higher-plant photosystem II antenna protein CP26. Biochemistry. 41 (23), 7334-7343 (2002).
- Caffarri, S., Passarini, F., Bassi, R., Croce, R. A specific binding site for neoxanthin in the monomeric antenna proteins CP26 and CP29 of Photosystem II. FEBS letters. 581 (24), 4704-4710 (2007).
- Hobe, S., Förster, R., Klingler, J., Paulsen, H. N-proximal sequence motif in light-harvesting chlorophyll a/b-binding protein is essential for the trimerization of light-harvesting chlorophyll a/b complex. Biochemistry. 34 (32), 10224-10228 (1995).
- Kuttkat, A., Hartmann, A., Hobe, S., Paulsen, H. The C-terminal domain of light-harvesting chlorophyll-a/b-binding protein is involved in the stabilisation of trimeric light-harvesting complex. European journal of biochemistry / FEBS. 242 (2), 288-292 (1996).
- Rupprecht, J., Paulsen, H., Schmid, V. H. Protein domains required for formation of stable monomeric Lhca1- and Lhca4-complexes. Photosynthesis research. 63 (3), 217-224 (2000).
- Yang, C., et al. The negatively charged amino acids in the lumenal loop influence the pigment binding and conformation of the major light-harvesting chlorophyll a/b complex of photosystem II. Biochimica et biophysica acta. 1777 (11), 1463-1470 (2008).
- Rogl, H., Kühlbrandt, W. Mutant trimers of light-harvesting complex II exhibit altered pigment content and spectroscopic features. Biochemistry. 38 (49), 16214-16222 (1999).
- Yang, C., Kosemund, K., Cornet, C., Paulsen, H. Exchange of pigment-binding amino acids in light-harvesting chlorophyll a/b protein. Biochemistry. 38 (49), 16205-16213 (1999).
- Morosinotto, T., Castelletti, S., Breton, J., Bassi, R., Croce, R. Mutation analysis of Lhca1 antenna complex. Low energy absorption forms originate from pigment-pigment interactions. The Journal of biological chemistry. 277 (39), 36253-36261 (2002).
- Morosinotto, T., Breton, J., Bassi, R., Croce, R. The nature of a chlorophyll ligand in Lhca proteins determines the far red fluorescence emission typical of photosystem I. The Journal of biological chemistry. 278 (49), 49223-49229 (2003).
- Ballottari, M., Mozzo, M., Croce, R., Morosinotto, T., Bassi, R. Occupancy and functional architecture of the pigment binding sites of photosystem II antenna complex Lhcb5. The Journal of biological chemistry. 284 (12), 8103-8113 (2009).
- Croce, R., et al. Origin of the 701-nm fluorescence emission of the Lhca2 subunit of higher plant photosystem I. The Journal of biological chemistry. 279 (47), 48543-48549 (2004).
- Morosinotto, T., Mozzo, M., Bassi, R., Croce, R. Pigment-pigment interactions in Lhca4 antenna complex of higher plants photosystem I. The Journal of biological chemistry. 280 (21), 20612-20619 (2005).
- Mozzo, M., Morosinotto, T., Bassi, R., Croce, R. Probing the structure of Lhca3 by mutation analysis. Biochimica et biophysica acta. 1757 (12), 1607-1613 (2006).
- Mozzo, M., Passarini, F., Bassi, R., van Amerongen, H., Croce, R. Photoprotection in higher plants the putative quenching site is conserved in all outer light-harvesting complexes of photosystem II. Biochimica et biophysica acta. 1777 (10), 1263-1267 (2008).
- Wientjes, E., Roest, G., Croce, R. From red to blue to far-red in Lhca4 how does the protein modulate the spectral properties of the pigments. Biochimica et biophysica acta. 1817 (5), 711-717 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved