Method Article
במבחנת כינונה מחדש של מכלולי אור קציר של צמחים ואצות ירוקות
In This Article
Summary
This protocol details the reconstitution of light-harvesting complexes in vitro. These integral membrane proteins coordinate chlorophylls and carotenoids and are responsible for harvesting light in higher plants and green algae.
Abstract
בצמחים ואצות ירוקות, אור הוא נתפס על ידי מתחמי אור הקציר (LHCs), משפחה של חלבוני קרום נפרד שירכזו chlorophylls וקרוטנואידים. בחי, חלבונים אלה מקופלים עם פיגמנטים ליצירת קומפלקסים אשר מוכנסים בקרום thylakoid של הכלורופלסט. הדמיון הגבוה בתכונות כימיות ופיסיות של בני המשפחה, יחד עם העובדה שהם יכולים בקלות לאבד את הפיגמנטים בבידוד, עושה הטיהור שלהם במדינה האם של מאתגרת. גישה חלופית כדי להשיג הכנות הומוגנית של LHCs פותחה על ידי Plumley ושמידט בשנת 1987 1, שהראה כי ניתן היה להקים מחדש מתחמים אלה במבחנה החל מפיגמנטים מטוהרים וapoproteins פרש, וכתוצאה מכך מתחמים עם מאפיינים מאוד דומים לזה של ילידים מתחמים. זה פתח את הדרך לשימוש בחלבוני רקומביננטי הביעו חיידקים במבחנה (לדוגמא, אתרי פיגמנט מחייב) או תחום חלבון (למשל, אינטראקציה בין חלבונים, קיפול). שיטה זו כבר מותאמת במספר מעבדות ומוחלת על רוב מתחמי אור הקציר. הפרוטוקול המתואר כאן מפרט את השיטה של הבנייה מחדש מתחמי אור קציר במבחנה המשמשים כיום במעבדה שלנו, ודוגמאות המתארות יישומים של השיטה מסופקות.
Introduction
מנגנון הפוטוסינתזה של צמחים ואצות כוללים חלבונים נפרד קרום שקושרים כלורופיל (CHL), ב (CHL ב) וקרוטנואידים (מכונית). מתחמי פיגמנט החלבון אלה הם פעילים בקצירת אנרגיית אור ומעביר שאנרגיית העירור למרכזי התגובה, שבו נעשה בו שימוש כדי לקדם את תשלום ההפרדה 2. הם גם מעורבים במנגנוני משוב רגולציה המגנים על מנגנון הפוטוסינתזה מפני נזק אור הגבוה 3,4. מתחמי קצירת האור (LHCs) מורכבים ממשפחה גדולה של חלבונים הקשורים בצמחים ואצות 5.
הטיהור הומוגנית של כל אחד מבני המשפחה כבר מסובכת על ידי התכונות כימיות ופיסיות דומות מאוד של מתחמים. בנוסף, הליכי טיהור לעתים קרובות לגרום לאובדן של פיגמנטים או cofactors הפוטנציאלי האחר כגון שומנים. במבחנה represen הכינון מחדשts שיטה רבת עוצמה כדי להתגבר על בעיות אלה. LHC הקשורים Photosystem II (LHC-II) הוקם מחדש ראשון במבחנה על ידי Plumley ושמידט בשנת 1987 1. החוקרים שחולצו חלבון ופיגמנטים delipidated בנפרד מכלורופלסטים מפעל, ולאחר מכן בשילוב חלבון החום מפוגל עם פיגמנטים בנוכחות ליתיום Dodecyl סולפט (LDS), ואחריו שלושה מחזורים של הקפאה להפשרה 1. הם הראו שהתכונות ספקטרליות של מתחמי LHC מחדש היו מאוד דומות למתחמים מטוהרים מצמחים. קלות מחדש של מתחמי פיגמנט חלבון LHC, סביר להניח בשל כמה תכונת הרכבה עצמית טבועה, יחד עם הקושי בבידוד מתחמים מטוהרים מאורגניזמים, הובילו לאימוץ מהיר של השיטה על ידי חוקרים אחרים. הכינון מחדש של חלבונים פוטוסינתטיים ביתר בEscherichia coli (E. coli) הושג על ידי פאולסן ועמיתים בשנת 1990 6. בתוך א 'coli, חלבוני קרום ביטוי יתר כלולים בדרך כלל בגופי הכללה, שמתקני הטיהור שלהם. הכינון מחדש מושגת באמצעות denaturation חום של גופי ההכללה המכילים חלבון רקומביננטי בנוכחות LDS, ואחריו התוספת של פיגמנטים היוזמת את קיפול החלבונים. קיפול של מתחם LHCII הוא תהליך בן שני שלבים: ראשון, כלורופיל כרוך בדקות פחות מ 1; שני, כלורופיל b מאוגדת והתייצבה מעל 7 מספר דקות.
בנוסף לאספקת תובנה הדינמיקה מתקפל, בכינון מחדש חוץ גופית בשילוב עם מכוון mutagenesis אתר אפשר זיהוי של חומצות אמינו ספציפיות חשובות ליציבות (לדוגמא, 8,9) או תיאום פיגמנט (למשל, 10). גם מניפולציה של קיפול מחדש של תנאים על ידי התאמת פרמטרים כמו הרכב פיגמנט או בדטרגנטים זיהו critica אלמנטיםl לקיפול נכון, כגון הדרישה של Xanthophylls למורכב LHCII (למשל, 1,11). בנוסף, החקירה של התכונות של פיגמנטים בודדים קשורים למתחמים הייתה אפשרית באמצעות מתחמים מחדש in vivo (למשל, 10).
השיטה המתוארת כאן מתחילה עם בידוד של פיגמנטים (chlorophylls וקרוטנואידים) מתרד וreinhardtii Chlamydomonas האצה הירוק. הביטוי וטיהור של חלבון LHC מE. coli בצורה של גופי הכללה לאחר מכן מפורט, ואחריו את הכינון מחדש של LHC וטיהור שלאחר מכן לפי עמודה זיקת Ni. בשלב האחרון, מתחמים מחדש הם מטוהרים עוד יותר על ידי צנטריפוגה שיפוע סוכרוז כדי להסיר פיגמנטים חופשיים וapoprotein פרש. פרוטוקול זה מייצג הליך מותאם בשילוב כמה שינויים שהוכנסו על ידי מעבדות שונות על פניזמן 1,6,10,12 -14.
Protocol
.1 סך פיגמנט הפקה מעליי תרד
- Homogenize קומץ אחד של עליי תרד (~ 20 ז) בקור גריסה מאגר 100 מ"ל (ראה טבלה 1), תוך שימוש בבלנדר ל20 שניות.
- סנן את הפתרון באמצעות שתי שכבות של בד ניילון עם נקבוביות בקוטר של 20 מיקרומטר ו צנטריפוגות התסנין ב1,500 XG 10 דקות ב 4 ° C..
- Resuspend גלולה המכילה כלורופלסטים עם אמנים רכים לצייר מברשת ב 1 מ"ל של קרה לשטוף הצפת (ראה טבלה 1). ברגע שהגלולה היא resuspended, להוסיף 50 מ"ל של הצפת לשטוף צנטריפוגות הפתרון ב 10,000 XG 10 דקות ב 4 ° C..
- הסר את supernatant והעדינות resuspend גלולה (thylakoids) ב50 מ"ל של הצפת לשטוף (ראה טבלה 1).
- צנטריפוגה הפתרון ב 10,000 XG 10 דקות ב 4 ° C ולהסיר את supernatant לחלוטין. בשלב זה, לבצע את השלבים הבאים בחושך, כדי למנוע חמצון פיגמנט.
- להוסיף ~ 20 מ"ל של אצטון 80% שנאגרו עם Na 2 CO 3 (ראה טבלה 1) כדי לחלץ את הפיגמנטים. השאר את הפתרון על קרח עבור 10 דקות, vortexing מדי פעם.
- גלולה המרכיבים התאיים על ידי צנטריפוגה XG ב 12,000 ל15 דקות ב 4 ° C..
הערה: אם פיגמנטים לא לגמרי חילוץ, גלולה תהיה צבע ירוק וצעד 1.6 יש לחזור. - לאסוף את supernatant לתוך משפך separatory. הוספת 0.4 כרכים של diethylether, לנער במרץ ולפתוח את השסתום לפרוק את הגז.
- הוספת 0.8 כרכים של 0.33 M NaCl וערבב במרץ. לאפשר 10 דקות ~ לשכבות להפריד. שלב האתר על גבי מכיל פיגמנטים שחולצו. הסר את השלב נמוך יותר ברור.
הערה: אם ההפרדה אינה ברורה, להקפיא ולהפשיר את הפתרון כדי לשפר את ההפרדה פאזות. - הסר את האתר על ידי שפיכתו מחלק העליון של משפך separatory לתוך מיכל זכוכית מתאים. יבש על ידי הוספת כפית של גראןנתרן גופרתי נטול מים ular. לערבל את הפתרון ולאפשר ~ 5 דקות לתבושו לספוג מים מהאתר.
הערה: חזור על שלב זה אם נתרן גופרתי מופיע בכבדות לחלוטין יחד; לא צריך להיות כמה גבישי ריחוף ללא כאשר האתר הוא מיובש מספיק. אם טפסי שכבת מים, להסיר את זה עם pipet פסטר לפני הוספת נתרן גופרתי נטול מים נוספים. - למזוג האתר למכל זכוכית חדש, שעזב את נתרן גופרתי מוצק מאחורי.
- להתאדות האתר בspeedvac סיבובי או תחת זרם של N 2.
- ממיסים את הפיגמנטים לחלוטין ב10 מ"ל של אצטון 100%.
- לדלל כמות קטנה (~ 3 μl) ל1 מ"ל של 80 אצטון% ולמדוד את ספקטרום הקליטה ולקבוע / שיעור כלורופיל b וריכוז Chl עם השיטה המתוארת על ידי et Porra אל. (1989) 15.
- Aliquot ולייבש את הפיגמנטים בspeedvac סיבובי או תחת N זרם 2 עד אצטון הואהתאדה לחלוטין. אחסן את הפיגמנטים היבשים ב -80 מעלות צלזיוס.
2 הפקה של הקרוטנואידים מתרד
- בצע את פעולות 1.1-1.5. בשלב זה, לבצע את השלבים הבאים בחושך, כדי למנוע חמצון פיגמנט.
- Resuspend גלולה thylakoid ב~ אתנול 50 מ"ל 96% שנאגרו עם Na 2 CO 3 (ראה טבלה 1) כדי לחלץ את הפיגמנטים. השאר את הפתרון על קרח למשך 5 דקות.
- גלולה המרכיבים התאיים על ידי צנטריפוגה XG ב 12,000 ל15 דקות ב 4 ° C..
הערה: אם פיגמנטים לא לגמרי חילוץ, גלולה תהיה צבע ירוק וצעד 2.2 יש לחזור. - לאסוף את supernatant ולהוסיף 0.1 נפח של 80% KOH (w / v) ליזום סבון.
- השאר את הפתרון על 4 מעלות CO / N, תרים בחוזקה ומוגן מפני האור.
- לאסוף את הפתרון לתוך משפך separatory. הוסף 1 נפח של אתר diethyl ומערבבים בעדינות.
- הוספת 0.8 כרךumes של 0.33 M NaCl ומערבבים בעדינות. לאפשר 10 דקות ~ לשכבות להפריד. שלב אתר התפוז על גבי מכיל קרוטנואידים saponified. הסר את השלב התחתון הירוק על ידי ניקוז דרך ברזלים של המשפך.
- הוסף 3 כרכים של מים ומערבבים בעדינות כדי להסיר את אשלגן הידרוקסידי. לאפשר השכבות להפריד. הערה: במידה והשלב העליון מופיע מעונן, להוסיף כמות קטנה של NaCl (למשל, 3 גרם של NaCl ב200 מ"ל של תמיסה) ולערבל בעדינות כדי לפזר.
- הסר את השלב נמוך יותר בניקוז דרך ברזלים של המשפך.
- בצעו את הפעולות 1.10-1.13.
- לדלל כמות קטנה (~ 3 μl) ל1 מ"ל של 80 אצטון% ולמדוד את ספקטרום הקליטה ב440 ננומטר באצטון 80%. כדי לקבוע את הריכוז, להשתמש בהכחדה מקדם הממוצעת לקרוטנואידים (ε 440 = 255) 16 בנוסחא הבאה: רכב [מ"ג / מ"ל] = x 11 (נתיב אופטי) (440 ננומטר / 225 שרירי הבטן) = 1 סנטימטר.
- Aliquot ולייבש את carotenoids בspeedvac או תחת N 2 זרם עד שכל diethylether כבר התאדה. אחסן את הפיגמנטים היבשים ב -80 מעלות צלזיוס.
.3 סה"כ פיגמנט וקרוטנואידים הפקה מChlamydomonas reinhardtii
- לגדול ג reinhardtii על מדיום TAP מוצק 17 בצלחת פטרי על ידי הפצת כמות קטנה של תרבות הנוזלית על פני השטח. לגדול תחת שטף תאורה הרציף של 20 μmol מ -2 שניות PSA תמונות -1 עד שכבה ירוקה של תאים גלויה.
- באמצעות לולאת inoculating סטרילי, לקצור כמות קטנה של ג reinhardtii ממדיום TAP המוצק ולשים את התאים לתוך 500 מ"ל של מדיום TAP 17 בבקבוק 1 ליטר. לגדול התרבות ב25 C ° עם 170 תסיסה סל"ד תחת שטף תאורה רציף של 20 μmol תמונות מ -2 שניות PSA -1.
- אחרי 5-6 ימים, התרבות צריכה להגיע לסוף של שלב לוגריתמים (6 x 10 6 תאים / מ"לאו 2-2.5 צפיפות אופטית ב 750 ננומטר). צנטריפוגה התרבות ב4,000 XG במשך 15 דקות ב 4 ° C..
- לכלל מיצוי פיגמנט, בצע את פעולות 1.6-1.15.
- התשואה בסך הכל תמצית פיגמנט החל מ500 מ"ל של תרבות צמיחה מלאה של ג reinhardtii הוא סביב 5 מ"ל של תמיסה בריכוז של 0.5 CHL מ"ג + b / מ"ל.
- להפקת קרוטנואידים, בצע את פעולות 2.2-2.12.
.4 טיהור של גופי הכללה
- לשכפל את רצף הקידוד של חלבון LHC עניין לתוך וקטור ביטוי שתוצאתו תג C-מסוף התמזג באמצעות נהלי ביולוגיה מולקולריים סטנדרטיים. להפוך מבנה זה לE. זן coli מארח כגון BL21 (DE3).
- הכן תמוגה חיץ, חיץ דטרגנט, חיץ טריטון, TE (טבלת 1), 1 M איזופרופיל β-D-1-thiogalactopyranoside (IPTG) ובינוני LB 18 עם האנטיביוטיקה המתאימה.
- פיק singlהדואר E. המושבה coli המכילה שיבוט הביטוי מצלחת טרי מפוספסת ל~ 5 מ"ל של מדיום LB עם האנטיביוטיקה המתאימה באמצעות נהלים סטנדרטיים 6. לגדול ב 37 מעלות צלזיוס עם תסיסה 220 סל"ד לפחות 16 שעות.
- הוסף 2.5 מ"ל של O / תרבות N לתוך בקבוק 1 ליטר Erlenmeyer עם 250 מ"ל של LB בתוספת האנטיביוטיקה המתאימה.
- לגדול התאים ל2-3 שעה (או עד OD 600 הוא ~ 0.6) על 37 מעלות צלזיוס ב220 סל"ד.
- הוספת IPTG לריכוז סופי של 1 מ"מ. תמשיך לגדול תאים על 37 מעלות צלזיוס עם 220 סל"ד 3-4 שעות.
- צנטריפוגה התרבות 10 דקות ב XG 5,000 על 4 מעלות צלזיוס בצינור צנטריפוגות-שקל מראש. בטל supernatant ביסודיות ולקבוע את המשקל את הכדור על ידי שקילה שוב והפחתת משקל צינור צנטריפוגות.
- Resuspend E. תא גלולה coli ב0.8 מ"ל / גרם תמוגה חיץ על ידי vortexing הנמרץ.
הערה: לחלופין, התא גלולה יכול להיות קפוא ב -80C לשימוש מאוחר יותר. אם מתחיל עם גלולה קפוא, תאפשר להפשיר לחלוטין לפני הוספת מאגר תמוגה. - הוסף 2 מ"ג של ליזוזים לגרם של תאים, ולדגור על קרח רטוב עם vortexing מזדמן ל30 דקות.
- הוסף 20 מיקרוגרם / מ"ל DNAse, 10 מ"מ MgCl 2, 1 mM NaCl, 20 מיקרוגרם / מ"ל RNAse. וורטקס ולשים על קרח למשך 30 דקות.
- הוסף 2 מ"ל של חיץ דטרגנט הקר לגרם של תאים. מערבבים היטב ולשמור על RT במשך 5 דקות.
- העברה ל2 צינורות מ"ל צנטריפוגות (התפצלה לשני צינורות במידת צורך). צנטריפוגה ל10 דקות ב 12,000 XG ב 4 ° C עד גלולה גופי ההכללה.
- הוסף 1 מ"ל של טריטון הקר חיץ וresuspend את הכדור על ידי sonification (3 פולסים 5 שניות כוח x 50% x עם 20 מרווחי שניות) לחלוטין. הערה: יש לי הצינור בכוס קטנה המוקפת במי קרח כדי לשמור אותו קר בsonification. במקרה של צינורות מרובים, לשלב את גופי הכללת resuspended לתוך צינור אחד אחרי resuspension.
- צנטריפוגה ל10 דקות ב 12,000XG ב 4 ° C עד גלולה גופי ההכללה.
- חזור על שלב 4.13 ו4.14 שתי פעמים.
- Resuspend גופי ההכללה ב 1 מ"ל של TE הקר עם sonification לשטיפה סופית כדי להסיר את חיץ טריטון. צנטריפוגה ל10 דקות ב 12,000 XG ב 4 ° C עד גלולה גופי ההכללה.
- Resuspend גלולה ב 1 מ"ל של TE הקר על ידי sonification.
- להעריך את ריכוז החלבון בשיטות סטנדרטית כגון assay ברדפורד 19. aliquots חנות של גופי ההכללה ב -20 מעלות צלזיוס.
.5 כינונה מחדש
פרוטוקול זה בדרך כלל תשואות 1-2 מ"ל של חלבון מחדש עם OD של 4 כאשר הספיגה נמדדה באזור QY (600-750 ננומטר). כמות יכולה להיות מותאמת לפי צורך, אם כי יש להקפיד לשמור על היחסים התקינים במהלך ההליך.
- הכן את הפתרונות הבאים כפי שמתואר בטבלה 1: 2x הכינון המאגר, 20% OG, 2 M KCl, TE. בצע את ים הבאteps באור עמום.
- Resuspend 800 מיקרוגרם של גופי הכללת LHC בסך של 400 μl TE בצינור microfuge 2 מ"ל. הוספת 400 μl של 2x הכינון הצפת ובקצרה מערבולת.
- הוספת 0.6 μl של β-mercaptoethanol (M 14.8 המלאי) יש ריכוז סופי של 10 מ"מ. מחממים את החלבון 1 דקות ב98 מעלות צלזיוס. וורטקס בקצרה מקום ב RT במשך 3 דקות.
- Resuspend 500 מיקרוגרם בסך הכל פיגמנטים כלורופיל מיובש בתוספת 80 מיקרוגרם פיגמנטים קרוטנואידים ב30 μl 100% EtOH ידי נמרצות vortexing דקות 1 או מקום בsonicator אמבטיה ל1-2 דק '.
- ספין תערובת פיגמנט ~ 30 שניות ב15,800 XG ב 4 מעלות צלזיוס ולאשר כי אין גלולה. אם יש גלולה, לחזור vortexing ו / או sonification. חשוב: לאחר resuspension והספין, להוסיף מייד פיגמנט לחלבון, או שהוא יכול לצבור ויצטרך להיות מושעה שוב.
- לאט לאט להוסיף את תערובת פיגמנט לחלבון המקורר תוך vortexing. המשך מערבולת 5-10 שלצינור ec ומניחים על קרח רטוב. היזהר שלא המערבולת מדי במרץ, כאשר החלבון יכול לעלות על גדותיו העליונה של הצינור.
- הוספת 94 μl של 20% β-D-glucopyranoside Octyl (OG) (ריכוז סופי של 2%), בקצרה מערבולת ולשמור על קרח 10 דקות.
- הוסף 90 μl של KCl 2 M (ריכוז סופי 150-200 מ"מ), בקצרה מערבולת ולשמור על קרח 20 דקות. הערה: הכנת טור (סעיף 6) יכולה להיות יזם בשלב זה.
- ספין 10 דקות ב 15,800 XG ב 4 מעלות צלזיוס. הסר את supernatant מבלי להפריע גלולה (זירזה LDS) לצינור 10 מ"ל. שמור על קור ומוגן מפני אור.
.6 טיהור טור ניקל
- הכן את הפתרונות הבאים כפי שמתואר בטבלה 1: חיץ OG, חיץ לשטוף OG, חיץ Elution.
- חבר עמודה Ni-Sepharose (1 מ"ל) או שווה ערך למשאבת peristaltic להבטיח כי אין אוויר נכנס פנימה הטור בשלב זה והשלבים הבאים.
- קבע את המהירות של tהוא לשאוב עד 1 מ"ל / דקה ולשטוף את העמודה עם 5-10 מ"ל של מים כדי להסיר את פתרון האחסון.
- לאזן את העמודה עם 3-4 מ"ל של חיץ OG.
- להוסיף 3-4 מ"ל של חיץ OG למדגם החלבון והעומס לעמודה. הערה: אם החלבון כבר יושב על קרח ליותר מ 10 דקות לאחר הסרת LDS, ספין שוב ב15,800 XG ב 4 מעלות צלזיוס למשך 1 דקות כדי להסיר כל משקעים LDS נוספים.
- יש לשטוף את העמודה עם 5 מ"ל של חיץ OG.
- יש לשטוף את העמודה עם 2 מ"ל של חיץ לשטוף OG.
- Elute החלבון קשור עם חיץ elution 3 מ"ל. לאסוף elute הירוק המכיל את החלבון מחדש. הערה: זה בדרך כלל על 1 מ"ל בסך הכל.
.7 סוכרוז Gradient צנטריפוגה
- הכן את הפתרונות הבאים כפי שמתואר בטבלה 1: פתרון סוכרוז, 0.06% β-DM, 0.01 M HEPES, pH 7.6.
- מלא צינורות ultracentrifuge עם תמיסת סוכרוז וההקפאה ב -20 CO ° / o Nr -80 ° C לשעה לפחות 1.
- הסר את הצינור מהמקפיא ולאפשר להפשיר באין מפריע ב 4 ° C.. הערה: תהליך ההקפאה / הפשרה יוצר שיפוע 0.1 לסוכרוז 1 M. צינור 15 מ"ל בדרך כלל מפשיר בשעה בערך 3.
- מוציא בזהירות מהחלק העליון באותו נפח כחלק הירוק eluted מעמודת Sepharose ניקל בשלב 6.8. לאחר מכן טען את המדגם מחדש על גבי לאט כדי להימנע מלהפריע לשיפוע.
- צינורות איזון וספין ב200,000 XG ב 4 מעלות צלזיוס בultracentrifuge באמצעות הרוטור SW-41 או SW-60 מתנדנד דלי ל18 שעה, שנקבע כדי להאט האצה ועצירה ללא בלמים.
- להוציא בזהירות את השיפוע ממחזיק הצינור עם מלקחיים. השתמש במזרק עם מחט ארוכה שיש לה פתיחה בוטה כדי לאסוף את החלק יחסי מהחלק העליון. הערה: לחלופין, לאסוף שברים מהתחתית על ידי פירסינג הצינור עם מחט ואיסוף טיפות.
תוצאות
פרוטוקול זה מפרט שיטה כדי לשקם מחייבים חלבונים / b chorophyll במבחנה. טכניקה זו מאפשרת הקיפול של מתחמים אלה פיגמנט החלבון במבחנה החל מapoprotein, אשר ניתן להשיג על ידי ביטוי יתר במערכת Heterologous, ופיגמנטים המופקים מצמח או אצות. לאחר הכינון מחדש, מורכב פיגמנט החלבון קפל מטוהר מעודף פיגמנטים וapoprotein פרש בשני שלבים. הצעד הראשון (איור 1 AB) מבוסס על הנוכחות שלו התג בC-המסוף של החלבון, המאפשר את הסרת חלק גדול מפיגמנטים מאוגדים. שלב הטיהור השני מנצל צנטריפוגה צפיפות סוכרוז שיפוע, (איור 2) שבו החלבון המקופל בדרך כלל נודד איטי יותר מאשר הלהקה הירוקה המכילה את החלבון מחדש. המטרה של הכינון מחדש במבחנה היא להשיג מתחמים עם אותו ראויקשרים כילידים אלה. כדי להמחיש את התוצאה הזאת, התכונות ספקטרוסקופיות של אור מורכב קציר in vivo היא בהשוואה לאותו מורכב LHC מחדש במבחנה 13,20,21. ספקטרום הספיגה של LHCs בטווח הנראה לעין (350 ננומטר ו750 ננומטר) תלוי בהרכב פיגמנט של המתחם, כמו גם על הסביבה של פיגמנט (הכולל את החלבון) ומהווה למעשה כלי רגיש כדי לבדוק את האיכות של הכינון מחדש. באיור 3, ספקטרום הספיגה של CP24, כלורופיל / b מחייבת חלבון מthaliana ארבידופסיס, מחדש במבחנה, הוא בהשוואה לספקטרום של אותו מטוהר מורכב מארבידופסיס thylakoids 21. בספקטרום, זה אפשרי להכיר QY והמעבר Soret של Chl (פסגות ב671 / 439 ננומטר) וChl ב (פסגות ב649 / 466 ננומטר). מתחמי הילידים מחדש ולהראות abso הזההספקטרום rption, מה שמעיד על הרכב פיגמנט כמעט זהה וארגון. ספקטרוסקופיה הקרינה יכולה לשמש כדי להעריך את האיכות של המתחם מחדש. ספקטרום פליטת הקרינה נמדד על עירור באורכי גל שונה, שמרגשים את מעדיף פיגמנטים שונים: Chl ב440 ננומטר, Chl ב ב475 ננומטר, וXanthophylls ב500 ננומטר. בקומפלקס החלבון-פיגמנט מקופל כראוי, Chl ב וXanthophylls להעביר אנרגיית העירור שלהם בעיקר לChl בתוך כמה picoseconds, והקרינה שמקורה במערכת equilibrated תרמית וכתוצאה מכך לשיא יחיד עם אותה הצורה ומקסימום בכל שלושה עירור אורכי גל (4A-B באיור). הנוכחות של Chl ב אינם מתואמת לחלבון יכולה להיות מוכרת על ידי שיא או כתף נוסף סביב 650 ננומטר על עירור 475 ננומטר (איור 4C). הנוכחות של Chl החופשי במקום מובילהלפליטה נוספת סביב 675 ננומטר, אשר מקיים בעיקר על 440 עירור ננומטר. ספקטרום פליטת הקרינה על 475 עירור ננומטר של שני מחדש ומתחמי ילידי CP24 (איור 4D) להראות שיא יחיד ב681 ננומטר, המצביע על כך מורכב מחדש מקופל בצורה נכונה. אישור נוסף שהמורכב פיגמנט-החלבון מחדש בצורה נכונה מגיע מdichroism מעגלי מדידות (CD). אות CD באזור הגלוי תלויה באינטראקציות excitonic בין פיגמנטים ומהווה למעשה רגיש מאוד לשינויים קטנים אפילו בארגון של chromophores 22. איור 5 מציג את ספקטרום CD של CP24 מחדש וילידים, עם פסגות טביעת האצבע האופייניות ב 681 ננומטר, 650 ננומטר ו481 ננומטר. לסיכום, הדמיון הגבוה בין התכונות ספקטרוסקופיות של ילידים וCP24 מחדש מאשר כי suita מתחמים כמו ילידי תשואות הליך הכינון מחדש Ble למחקר במבחנה של חלבוני אור קצירה.
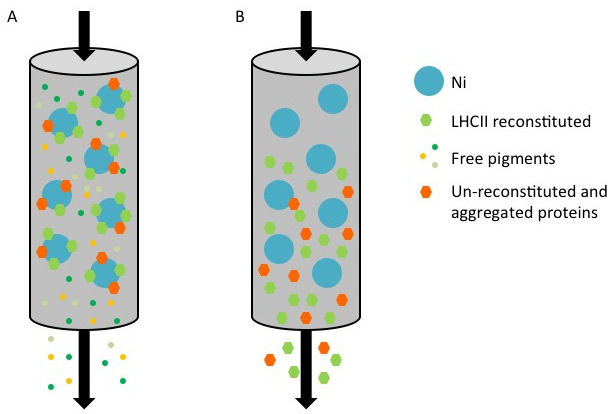
ייצוג איור 1 של הטיהור של חלבוני LHC רקומביננטי עם התג שלו באמצעות טור ניקל. () במהלך הטיהור, החלבון מתויג, מורכב משני מתחמים מחדש (משושה ירוקה) וחלבון מחדש un / מצטבר (כתומה משושה) חייבת את פני השטח של Ni-Sepharose (נקודה כחולה), ואילו פיגמנטים מאוגדים (נקודות צבעוניות קטנות) לזרום. (ב) כאשר העמודה נשטפה עם חיץ elution המכיל imidazole, החלבונים מחדש ומחדש un נאספים בזרימה דרך.
"Width =" hres.jpg 500 "/>
שיפוע 2 סוכרוז איור של LHCII מחדש לאחר הטיהור ידי טור ניקל. מתחמים מחדש מופרדים מפיגמנט בחינם על ידי שיפוע הצפיפות. הלהקה הירוקה הכהה מייצגת LHCII מחדש והרקע הירוק החיוור מורכב מפיגמנטים חופשיים.
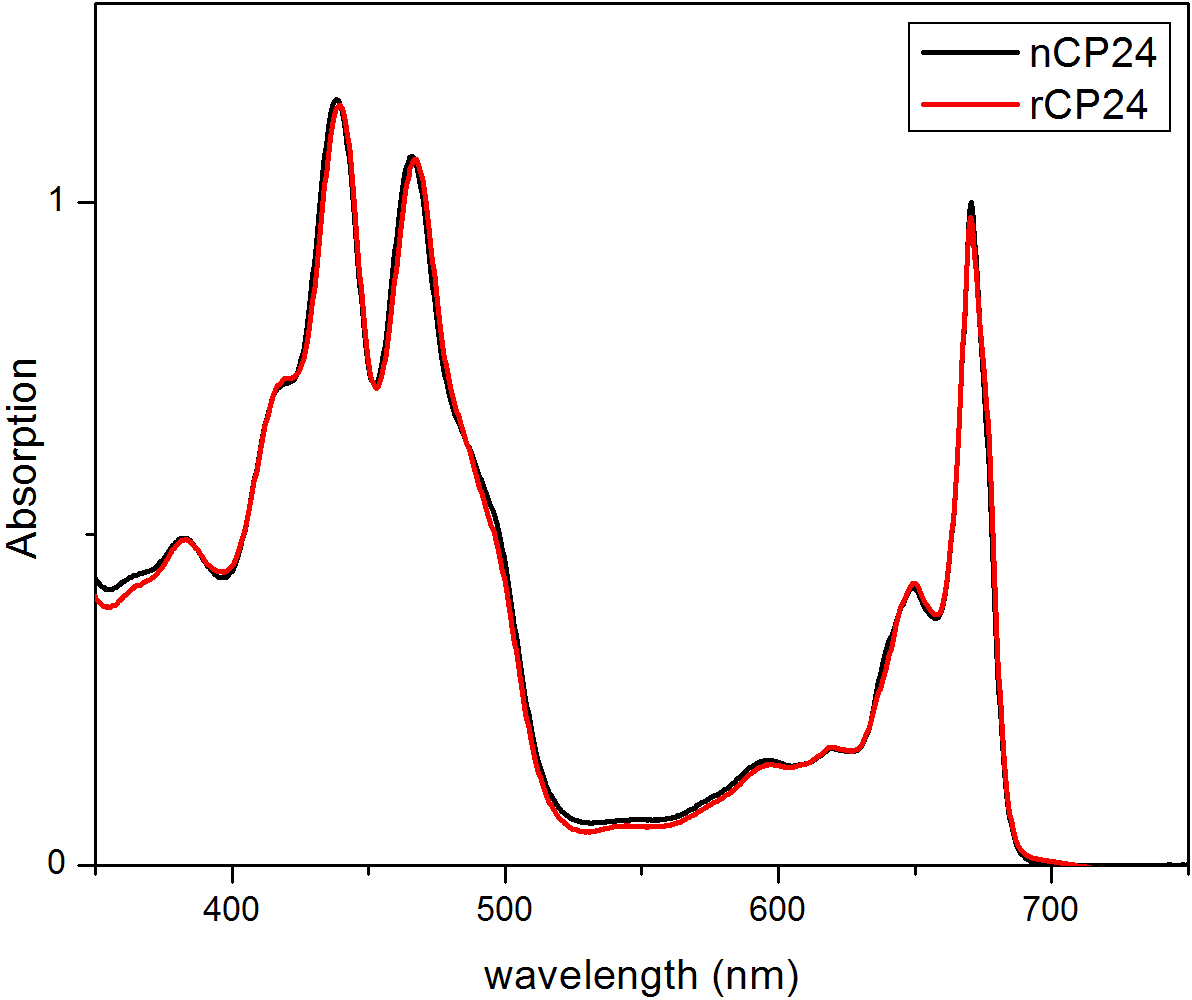
ספקטרום איור 3 קליטה של חלבון מחדש CP24 (rCP24, קו אדום) והאם אחד (nCP24, קו שחור) מבודד מthaliana ארבידופסיס. בשני הספקטרום, ניתן להכיר בQY והמעבר Soret של Chl (פסגות ב671 / 439 ננומטר) וChl ב (פסגות ב649 / 466 ננומטר). נתון זה שונה מאל Passarini et. 2014 21.
ther.within-page = "תמיד"> 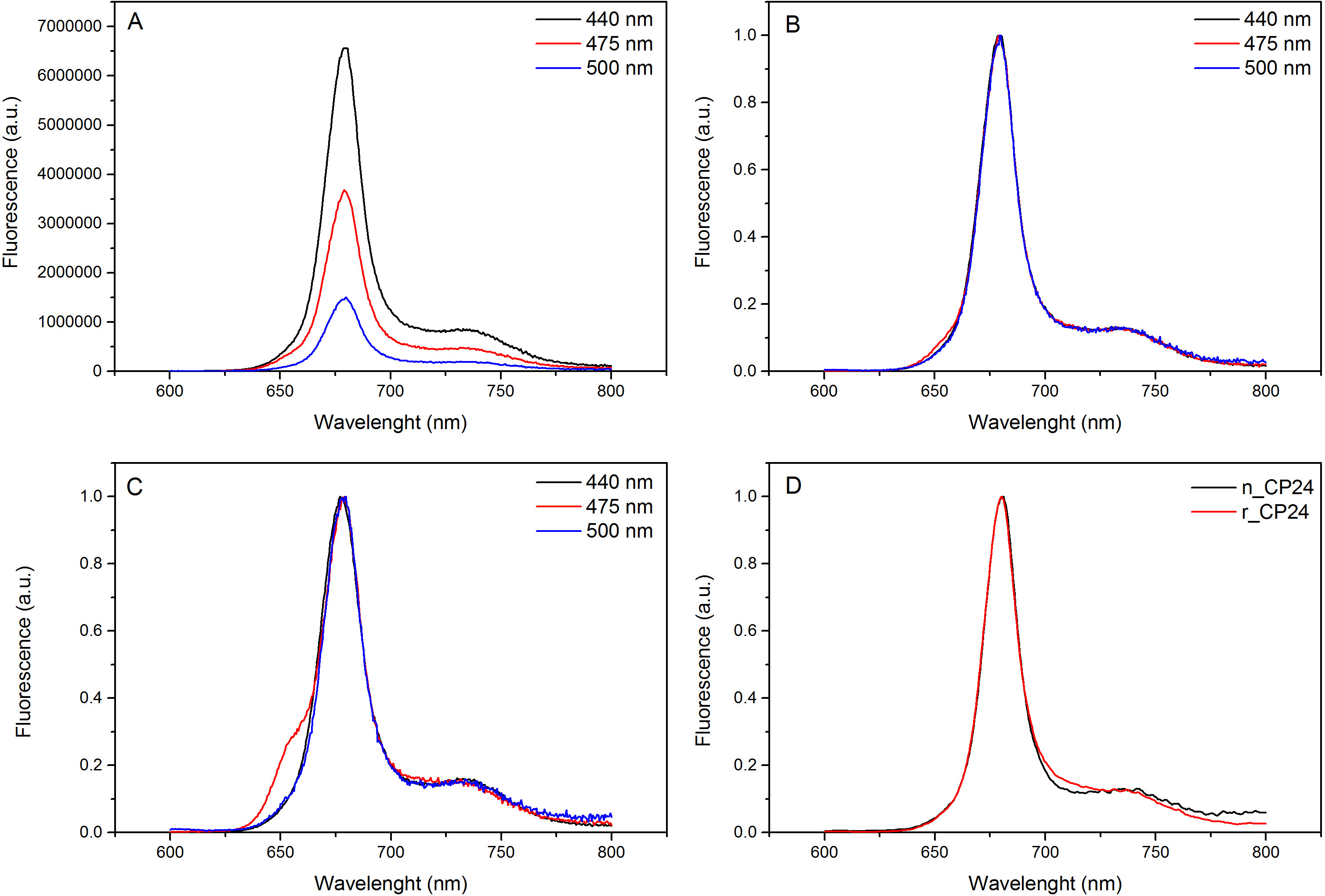
איור 4 ספקטרום פליטת הקרינה. ספקטרום פליטת הקרינה של מתחם מחדש CP24 wildtype () ומנורמל המרבי (B) מראה העברת אנרגיה יעילה מChl ב וXanthophyls לCHL. (C) ספקטרום פליטת הקרינה של CP24 מחדש (rCP24) וילידים מורכבים (nCP24) מבודד מthaliana ארבידופסיס. הספקטרום מנורמל למקסימום של השיא (D). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
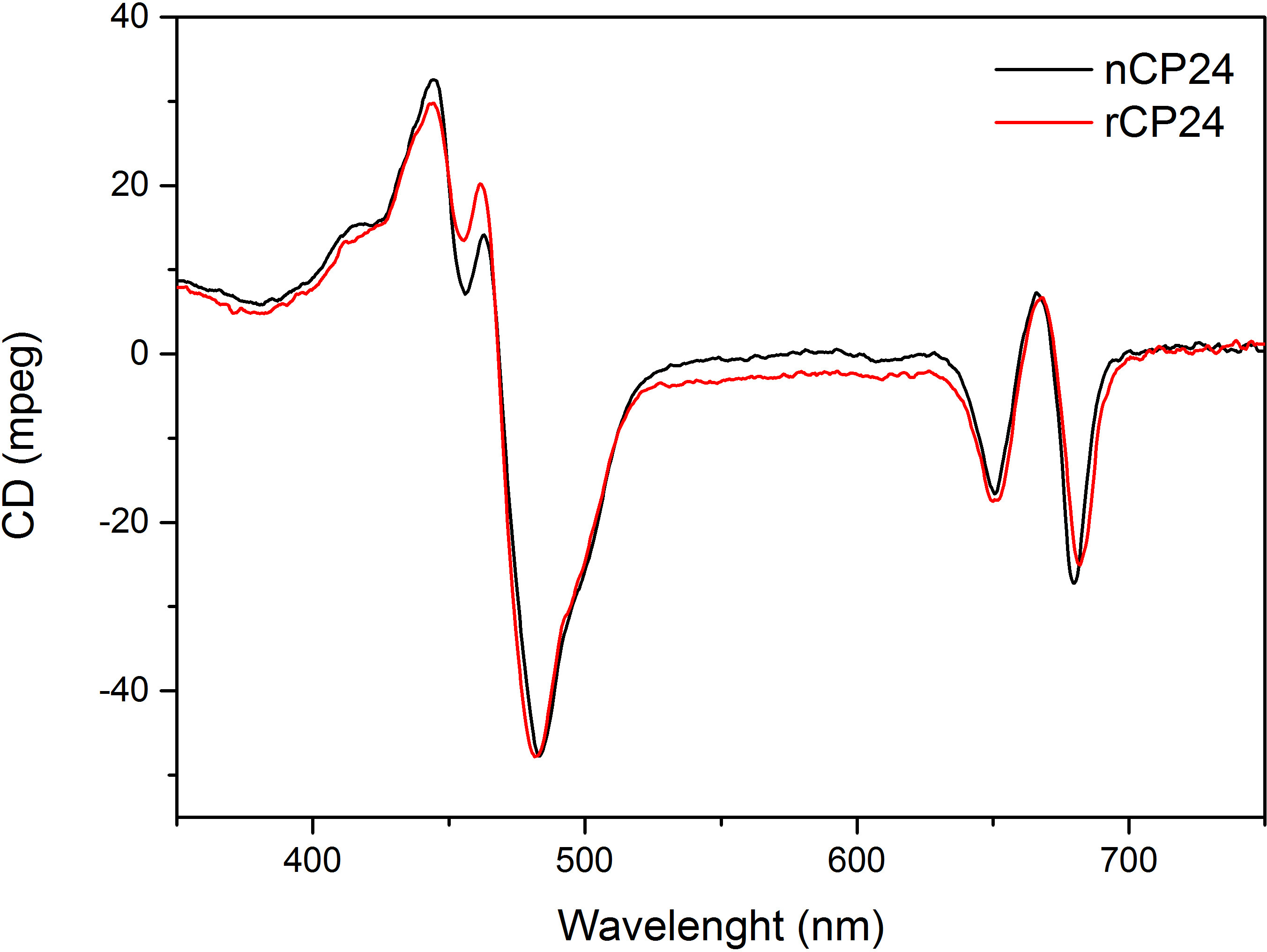
איור 5 החוזר Dichroism ספקטרה. מחדש CP24 (rCP24, קו אדום) והילידים המורכב (nCP24, קו שחור) מבודד מthaliana ארבידופסיס מציג ספקטרום דומה מאוד.

איור 6 ספקטרום קליטה של סוג CP29 הפראי (CP29_WT) וCP29 (CP29_A2) שעבר מוטציה. הקו הירוק מראה את ההבדלים בין שתי החלקות.
| ניתן לאחסן את כל המאגרים על 4 מעלות צלזיוס. | |||
| רכיבים | ריכוז סופי | הערות נוספות | |
| גריסה מאגר | סורביטול | 0.4 M | |
| Tricine | 0.1 M | pH 7.8 | |
| NaCl | 10 מ"מ | ||
| MgCl 2 | 5 מ"מ | ||
| אבקת חלב | 0.5% w / v | ||
| הצפת לשטוף | סורביטול | 50 מ"מ | |
| tricine | 5 מ"מ | pH 7.8 | |
| EDTA | 10 מ"מ | pH 8 | |
| תמוגה הצפת | טריס | 50 מ"מ | pH 8 |
| סוכרוז | 2.5% w / v | ||
| EDTA | 1 מ"מ | pH 8 | |
| חיץ חומר ניקוי | NaCl | 200 mM NaCl | |
| חומצת Deoxycholic | 1% w / v | ||
| NONIDET;: t = סגנון "21px גובה" "21" = | 1% w / v | ||
| טריס | 20 מ"מ | pH 7.5 | |
| EDTA | 2 מ"מ | pH 8 | |
| beta-mercaptoethanol | 10 מ"מ | ||
| טריטון מאגר | טריטון X-100 | 0.5% w / v | |
| טריס | 20 מ"מ | pH 7.5 | |
| beta-mercaptoethanol | 1 מ"מ | ||
| המאגר TE | טריס | 50 מ"מ | pH 8 |
| EDTA | 1 מ"מ | pH 8 | |
| הכינון מחדש הצפת | HEPES | 200 מ"מ | |
| סוכרוז | 5% w / v | ||
| Lithiumdodecylsulfate (LDS) | 4% w / v | ||
| Benzamidine | 2 מ"מ | ||
| Aminocaproic חומצה | 10 מ"מ | ||
| OG מאגר | Octylglucoside | 1% w / v | |
| 12.5% w / v | |||
| NaCl | 0.2 M | ||
| HEPES | 20 מ"מ | ||
| Imidazole | 10 מ"מ | ||
| OG לשטוף הצפת | n-Dodecyl-beta-D-Maltoside (β-DM) | 0.06% w / v | |
| HEPES | 40 מ"מ | pH 7.5-9 | |
| NaCl | 0.2 M | ||
| הצפת elution | Imidazole | 0.5 M | |
| n-Dodecyl-beta-D-Maltoside (β-DM) | 0.06% w / v | ||
| HEPES | 40 מ"מ | pH 8 | |
| NaCl | 0.2 M | ||
| פתרון סוכרוז | סוכרוז | 20% w / v | |
| n-Dodecyl-beta-D-Maltoside (β-DM) | 0.06% w / v | ||
| HEPES | 0.01 M | pH 7.6 | |
| אצטון שנאגרו 80% עם נתרן קרבונט | אצטון | 80% v / v | |
| סודיום קרבונט | 1 M | ||
| 96% אתנול שנאגרו עם נתרן קרבונט | אתנול | 96% v / v | |
| סודיום קרבונט | 1 M | ||
רשימת .1 טבלה של מאגרים ופתרונות בשימוש בפרוטוקול זה.
rCP26| Chla / תערובת b | Chla / b "font6" | CHL | CHL ב | ניאו | ויולה | לאוטה | tot CHL | CHL / רכב | |
| nCP26 | - | 2.2 ± 0.05 | 6.2 | 2.8 | 0.61 | 0.38 | 1.02 | 9 | 4.5 ± 0.1 |
| rCP26 | 8 | 2.71 ± 0.05 | 6.57 | 2.43 | 0.72 | 0.32 | 0.97 | 3.9 ± 0.04 | |
| rCP26 | 5.5 | 2.25 ± 0.05 | 6.23 | 2.77 | 0.77 | 0.3 | 0.96 | 9 | 4.0 ± 0.1 |
| rCP26 | 3 | 2.08 ± 0.04 | 6.08 | 2.92 | 0.76 | 0.3 | 1.04 | 9 | 4.1 ± 0.1 |
| rCP26 | 1 | 1.7 ± 0.05 | 5.7 | 3.3 | 0.7 | 0.3 | 0.9 | 9 | 4.3 ± 0.05 |
| rCP26 | 0.3 | 1.11 ± 0.04 | 4.7 | 4.28 | 0.7 | 0.3 | 0.9 | 9 | 4.2 ± 0.2 |
| 0.05 | 0.23 ± 0.01 | 1.4 | 5.6 | 0.58 | 0.24 | 1.11 | 7 | 3.1 ± 0.06 | |
| rCP26 | <0.01 | 0.11 ± 0.01 | 0.7 | 6.3 | 0.64 | 0.3 | 1.08 | 7 | 3.06 ± 0.06 |
לוח 2: תוכן פיגמנט של CP26 ילידים מורכבים בהשוואה לקומפלקסי החלבונים פיגמנט מחדש עם יחסים / b שונים Chl 39.
Discussion
חלבוני קרום הם לא כל כך קלים ללמוד. בידוד של חלבונים בממברנה ילידים הוא מסובך בשל צורך solubilize bilayer השומנים עם חומרי ניקוי, אשר יכול לגרום נזק לחלבון ולהסיר cofactors החיוני. חלבונים אלו עשויים גם להיות נוכחים ברמות נמוכות בממברנות ביולוגיות, או להיות מעורב עם חלבונים הקשורים באופן הדוק, כמו במקרה של מתחמי קצירת האור, שגורם לטיהור של מתחמים בודדים קשים. ביטוי חלבון Heterologous בE. coli ובכינון מחדש חוץ גופית מציע את האפשרות להימנע מבעיות אלה. במבחנה הכינון מחדש וטיהור של תוצאות חלבונים מקופלות במתחמים שיש להם מאפיינים דומים מאוד לאלו של מתחמי ילידי 20,21,23 ולכן יכול לשמש כדי לחקור מתחמים שלא יכול להיות מטוהר להומוגניות 24 - 27.
שיטה זו משתמשת בתרד, אשר בקלות attainabבכל ימות שנה le, כמקור לסך הכנות פיגמנט וקרוטנואידים. עבור חלק reconstitutions של חלבונים האם של אצות, שימוש בפיגמנטים מטוהרים מאצות הוא מועדף בשל יצירות פיגמנט שונות. / היחס ב Chl וChl היחס / מכונית נשארים זהה, ללא קשר למקור פיגמנט.
חשוב להבין כי היעילות של הכינון מחדש היא בדרך כלל סביב 35% 28. לכן יש צורך להסיר את הפיגמנטים שאינם כבולים וapoprotein פרש מהפתרון לאחר הכינון מחדש. פרוטוקול טיהור שני שלבים מוצג בפרוטוקול זה (ראה גם תוצאות). עם זאת, יש לציין כי צעד שיפוע סוכרוז אינו מאפשר הפרדת apo- והולו-חלבון המלאה. עבור רוב הניתוחים זה לא בעיה, כפי שapoprotein אינו מכיל פיגמנטים ולכן אינו מפריע למדידות פונקציונליות. עם זאת, במקרה זה יש צורך להסיר apoprotein באופן מלא מfrפעולה המכילה את הקומפלקס מחדש (לדוגמא, כדי לחשב את הפיגמנט לstoichiometry חלבון), ניתן להשתמש בעמודת מטבע אניוני (ראה Passarini et al. 2009 29 לפרטים נוספים).
היכולת לקפל חלבוני קצירת אור רקומביננטי עם פיגמנטים מבודדים במבחנה מספק הזדמנות "לתמרן" מתחמים על ידי שינוי "הסביבה" הכינון מחדש בדרכים שונות, וכך לשנות את המאפיינים של המתחם וכתוצאה מכך. לדוגמא, שינוי בהרכב פיגמנט במהלך הכינון מחדש יכול לגרום מורכב עם הרכב פיגמנט שונה. תכונה זו יכולה להיות מנוצלת כדי ללמוד את ההשפעה שיש לי פיגמנטים שונים על המבנה והיציבות של המתחם. בדרך כלל הכנת פיגמנט המתקבלת מתרד יש שיעור כלורופיל / b של 3: 1 וChl יחס / מכונית של 2.9: 1. יחס זה בדרך כלל מייצר חלבון מחדש עם אותם המאפיינים כמו nיצירתי אחד. עם זאת, התאמה של היחס / b Chl על ידי התוספת של Chl מטוהר או ב יכולה להשפיע על הכריכה של פיגמנטים שונים בשל שונה הסלקטיביות של אתרי הקישור 30-33. זה אפשרי משום שרוב אתרי פיגמנט מחייבים הם לא לגמרי סלקטיבית לChl או Chl ב, אבל יכול להכיל את שניהם, אם כי עם זיקה שונה 10,30,34. באופן דומה, אתרי קישור קרוטנואידים הוצגו גם להיות מסוגל להכיל מיני Xanthophyll יותר מאחד 8,35 - 38. reconstitutions שונה של CP26, אחר מורכב פיגמנט חלבון של צמחים גבוהים יותר, תוך שימוש ביצירות פיגמנט שונים מוצג בטבלה 2 39. reconstitutions אלה שמשו כדי להעריך את הזיקה של אתרי קישור לפיגמנטים מסוימים 39. זה מעניין לציין כי על מנת להשיג מורכב עם אותו ג פיגמנטomposition כילידים אחד, Chl היחס / b של תערובת פיגמנט חייב להיות 3: 1. זה נראה להיות מקרה לכל מתחמי LHC של צמחים גבוהים יותר 20,40.
השילוב של ביולוגיה מולקולרית עם טכניקת הכינון מחדש מאפשר את התכונות של מורכב Chl מחייב להיחקר ביתר פירוט. החשיבות של תחומים חלבון שונים על היציבות וקיפול של מתחמים, או מעורבותם באינטראקציות בין חלבונים, נקבעה על ידי מקצץ apoprotein או ביצוע mutagenesis האקראי 8,41 - 44. ניתן לשנות שאריות חומצת אמינו בודדת חשובות לתיאום של פיגמנטים שונים דרך מכוון mutagenesis אתר על מנת לנתח את המאפיינים של פיגמנטים בודדים או להעריך את תרומתם לתפקוד והיציבות של 10,28,29,45 המורכבים - 52. איור 6 מראה מחדש Lhcb4 (CP29) עםמוטציה של היסטידין בעמדת 216 53. השוואה של הרכב הפיגמנט של wildtype ומתחמי מוטציה מראה כי המוטציה גורמת לאובדן של אחד Chl מולקולה, המצביע על כך באתר הממוקד להכיל Chl במתחם WT. ההבדלים של ספקטרום הקליטה של WT ומוטציה, על נורמליזציה לתוכן פיגמנט, גם מציג את מאפייני הקליטה של פיגמנט שאבד. במקרה זה, ההבדל שניתן לראות בשיא העיקרי ב680 ננומטר, המצביע על כך Chl מתואם על ידי His216 סופג באורך גל זה (לפרטים נוספים על מוטציה זו והתכונות ספקטרוסקופיות לראות Mozzo et al. 2008 53). גם ניתוח מוטציה יכול לשמש כדי לקבוע את ההשפעה של הסביבה על התכונות ספקטרוסקופיות של פיגמנטים 54.
לסיכום, יכולים בקלות להיות משוחזר חלבוני קצירת אור במבחנה וכתוצאה מכך פיגמנט-proteiמתחמי n עם מאפיינים דומים מאוד למתחמי ילידים. בדרך זו, את הקשיים של בידוד חלבוני ילידים בוטלו, גם בעת מתן הכנת חלבון עם תשואה גבוהה וטוהר למחקר נוסף. חשיבותו של יחס 3: / b Chl 1 בהפקת מורכבת אותנטי יודגש, ודוגמאות של wildtype מחדש וLHCs מוטציה ניתנות להמחשת יישומים של הטכניקה.
Disclosures
The authors declare no conflict of interest
Acknowledgements
This work was supported by the European research council by a ERC starting/consolidator grant to RC and by the Dutch Foundation for research on matter (FOM) via a FOM program (10TM01).
Materials
| Name | Company | Catalog Number | Comments |
| HisTrap HP | GE Healthcare | 17-5247-01 | |
| Nylon cloth | 20 μm pores | ||
| Soft artists paint brush | |||
| NONIDET P-40 | Sigma | 74385 | |
| Beta-DM | Sigma | D4641 | |
| DNAase | ThermoScientific | EN0525 | |
| Milk Powders | |||
| RNAase | ThermoScientific | EN0531 | |
| Sonicator | |||
| Octyl β-D-glucopyranoside | Sigma | O8001 | |
| Ultracentrifuge XL | Beckman-Coulter | ||
| TAP medium | see reference 17 | ||
| LB medium | see reference 19 |
References
- Plumley, F. G., Schmidt, G. W. Reconstitution of chlorophyll a/b light-harvesting complexes: Xanthophyll-dependent assembly and energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 84, 146-150 (1987).
- Croce, R., van Amerongen, H. Light-harvesting and structural organization of Photosystem II from individual complexes to thylakoid membrane. Journal of photochemistry and photobiology B Biology. 104 (1-2), 142-153 (2011).
- Li, Z., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and responding to excess light. Annual review of plant biology. 60, 239-260 (2009).
- De Bianchi, S., Ballottari, M., Dall’osto, L., Bassi, R. Regulation of plant light harvesting by thermal dissipation of excess energy. Biochemical Society transactions. 38 (2), 651-660 (2010).
- Neilson, J. A. D., Durnford, D. G. Structural and functional diversification of the light-harvesting complexes in photosynthetic eukaryotes. Photosynthesis research. 106 (1-2), 57-71 (2010).
- Paulsen, H., Rümler, U., Rüdiger, W. Reconstitution of pigment-containing complexes from light-harvesting chlorophyll a/b-binding protein overexpressed in Escherichia coli. Planta. 181 (2), 204-211 (1990).
- Horn, R., Grundmann, G., Paulsen, H. Consecutive binding of chlorophylls a and b during the assembly in vitro of light-harvesting chlorophyll-a/b protein (LHCIIb). Journal of molecular biology. 366 (3), 1045-1054 (2007).
- Cammarata, K. V., Schmidt, G. W. In vitro reconstitution of a light-harvesting gene product: deletion mutagenesis and analyses of pigment binding. Biochemistry. 31 (10), 2779-2789 (1992).
- Paulsen, H., Hobe, S. Pigment-binding properties of mutant light-harvesting chlorophyll-a/b-binding protein. European journal of biochemistry / FEBS. 205 (1), 71-76 (1992).
- Bassi, R., Croce, R., Cugini, D., Sandonà, D. Mutational analysis of a higher plant antenna protein provides identification of chromophores bound into multiple sites. Proceedings of the National Academy of Sciences of the United States of America. 96 (18), 10056-10061 (1999).
- Paulsen, H., Finkenzeller, B., Kühlein, N. Pigments induce folding of light-harvesting chlorophyll a/b-binding protein. European journal of biochemistry / FEBS. 215 (3), 809-816 (1993).
- Caffarri, S., Croce, R., Cattivelli, L., Bassi, R. A look within LHCII differential analysis of the Lhcb1-3 complexes building the major trimeric antenna complex of higher-plant photosynthesis. Biochemistry. 43 (29), 9467-9476 (2004).
- Giuffra, E., Cugini, D., Croce, R., Bassi, R. Reconstitution and pigment-binding properties of recombinant CP29. European journal of biochemistry / FEBS. 238 (1), 112-120 (1996).
- Rogl, H., Kosemund, K., Kühlbrandt, W., Collinson, I. Refolding of Escherichia coli produced membrane protein inclusion bodies immobilised by nickel chelating chromatography. FEBS letters. (1-2), 21-26 (1998).
- Porra, R. J., Thompson, W. A., Kriedemann, P. E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 975 (3), 384-394 (1989).
- Davies, B. H. Identification of carotenoids by their absorption characteristics. Biochem J. 103 (2), (1967).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. Journal of bacteriology. 62 (3), 293-300 (1951).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical biochemistry. 72, 248-254 (1976).
- Wientjes, E., Croce, R. The light-harvesting complexes of higher-plant Photosystem I Lhca1/4 and Lhca2/3 form two red-emitting heterodimers. The Biochemical journal. 433 (3), 477-485 (2011).
- Passarini, F., Xu, P., Caffarri, S., Hille, J., Croce, R. Towards in vivo mutation analysis knock-out of specific chlorophylls bound to the light-harvesting complexes of Arabidopsis thaliana - the case of CP24 (Lhcb6). Biochimica et biophysica acta. , (2014).
- Georgakopoulou, S., van der Zwan, G., Bassi, R., van Grondelle, R., van Amerongen, H., Croce, R. Understanding the changes in the circular dichroism of light harvesting complex II upon varying its pigment composition and organization. Biochemistry. 46 (16), 4745-4754 (2007).
- Croce, R., Müller, M. G., Caffarri, S., Bassi, R., Holzwarth, A. R. Energy transfer pathways in the minor antenna complex CP29 of photosystem II a femtosecond study of carotenoid to chlorophyll transfer on mutant and WT complexes. Biophysical journal. 84 (4), 2517-2532 (2003).
- Schmid, V. H., Cammarata, K. V., Bruns, B. U., Schmidt, G. W. In vitro reconstitution of the photosystem I light-harvesting complex LHCI-730 heterodimerization is required for antenna pigment organization. Proceedings of the National Academy of Sciences of the United States of America. 94 (14), 7667-7672 (1997).
- Castelletti, S., Morosinotto, T., Robert, B., Caffarri, S., Bassi, R., Croce, R. Recombinant Lhca2 and Lhca3 subunits of the photosystem I antenna system. Biochemistry. 42 (14), 4226-4234 (2003).
- Storf, S., Jansson, S., Schmid, V. H. R. Pigment binding, fluorescence properties, and oligomerization behavior of Lhca5, a novel light-harvesting protein. The Journal of biological chemistry. 280 (7), 5163-5168 (2005).
- Mozzo, M., Mantelli, M., Passarini, F., Caffarri, S., Croce, R., Bassi, R. Functional analysis of photosystem I light-harvesting complexes (Lhca) gene products of Chlamydomonas reinhardtii. Biochimica et biophysica acta. 1797 (2), 212-221 (2010).
- Remelli, R., Varotto, C., Sandonà, D., Croce, R., Bassi, R. Chlorophyll binding to monomeric light-harvesting complex. A mutation analysis of chromophore-binding residues. The Journal of biological chemistry. 274 (47), 33510-33521 (1999).
- Passarini, F., Wientjes, E., Hienerwadel, R., Croce, R. Molecular basis of light harvesting and photoprotection in CP24 unique features of the most recent antenna complex. The Journal of biological chemistry. 284 (43), 29536-29546 (2009).
- Giuffra, E., et al. Analysis of some optical properties of a native and reconstituted photosystem II antenna complex, CP29 pigment binding sites can be occupied by chlorophyll a or chlorophyll b and determine spectral forms. Biochemistry. 36 (42), 12984-12993 (1997).
- Pagano, A., Cinque, G., Bassi, R. In vitro reconstitution of the recombinant photosystem II light-harvesting complex CP24 and its spectroscopic characterization. The Journal of biological chemistry. 273 (27), 17154-17165 (1998).
- Kleima, F. J., et al. Decreasing the chlorophyll a/b ratio in reconstituted LHCII structural and functional consequences. Biochemistry. 38 (20), 6587-6596 (1999).
- Croce, R., Morosinotto, T., Castelletti, S., Breton, J., Bassi, R. The Lhca antenna complexes of higher plants photosystem I. Biochimica et biophysica acta. 1556 (1), 29-40 (2002).
- Hobe, S., Trostmann, I., Raunser, S., Paulsen, H. Assembly of the major light-harvesting chlorophyll-a/b complex Thermodynamics and kinetics of neoxanthin binding. The Journal of biological chemistry. 281 (35), 25156-25166 (2006).
- Croce, R., Weiss, S., Bassi, R. Carotenoid-binding sites of the major light-harvesting complex II of higher plants. The Journal of biological chemistry. 274 (42), 29613-29623 (1999).
- Hobe, S., Niemeier, H., Bender, A., Paulsen, H. Carotenoid binding sites in LHCIIb. Relative affinities towards major xanthophylls of higher plants. European journal of biochemistry / FEBS. 267 (2), 616-624 (2000).
- Jahns, P., Depka, B., Trebst, A. Xanthophyll cycle mutants from Chlamydomonas reinhardtii indicate a role for zeaxanthin in the D1 protein turnover. Plant Physiology and Biochemistry. 38 (5), 371-376 (2000).
- Wehner, A., Grasses, T., Jahns, P. De-epoxidation of violaxanthin in the minor antenna proteins of photosystemII, LHCB4, LHCB5, and LHCB6. The Journal of biological chemistry. 281 (31), 21924-21933 (2006).
- Croce, R., Canino, G., Ros, F., Bassi, R. Chromophore organization in the higher-plant photosystem II antenna protein CP26. Biochemistry. 41 (23), 7334-7343 (2002).
- Caffarri, S., Passarini, F., Bassi, R., Croce, R. A specific binding site for neoxanthin in the monomeric antenna proteins CP26 and CP29 of Photosystem II. FEBS letters. 581 (24), 4704-4710 (2007).
- Hobe, S., Förster, R., Klingler, J., Paulsen, H. N-proximal sequence motif in light-harvesting chlorophyll a/b-binding protein is essential for the trimerization of light-harvesting chlorophyll a/b complex. Biochemistry. 34 (32), 10224-10228 (1995).
- Kuttkat, A., Hartmann, A., Hobe, S., Paulsen, H. The C-terminal domain of light-harvesting chlorophyll-a/b-binding protein is involved in the stabilisation of trimeric light-harvesting complex. European journal of biochemistry / FEBS. 242 (2), 288-292 (1996).
- Rupprecht, J., Paulsen, H., Schmid, V. H. Protein domains required for formation of stable monomeric Lhca1- and Lhca4-complexes. Photosynthesis research. 63 (3), 217-224 (2000).
- Yang, C., et al. The negatively charged amino acids in the lumenal loop influence the pigment binding and conformation of the major light-harvesting chlorophyll a/b complex of photosystem II. Biochimica et biophysica acta. 1777 (11), 1463-1470 (2008).
- Rogl, H., Kühlbrandt, W. Mutant trimers of light-harvesting complex II exhibit altered pigment content and spectroscopic features. Biochemistry. 38 (49), 16214-16222 (1999).
- Yang, C., Kosemund, K., Cornet, C., Paulsen, H. Exchange of pigment-binding amino acids in light-harvesting chlorophyll a/b protein. Biochemistry. 38 (49), 16205-16213 (1999).
- Morosinotto, T., Castelletti, S., Breton, J., Bassi, R., Croce, R. Mutation analysis of Lhca1 antenna complex. Low energy absorption forms originate from pigment-pigment interactions. The Journal of biological chemistry. 277 (39), 36253-36261 (2002).
- Morosinotto, T., Breton, J., Bassi, R., Croce, R. The nature of a chlorophyll ligand in Lhca proteins determines the far red fluorescence emission typical of photosystem I. The Journal of biological chemistry. 278 (49), 49223-49229 (2003).
- Ballottari, M., Mozzo, M., Croce, R., Morosinotto, T., Bassi, R. Occupancy and functional architecture of the pigment binding sites of photosystem II antenna complex Lhcb5. The Journal of biological chemistry. 284 (12), 8103-8113 (2009).
- Croce, R., et al. Origin of the 701-nm fluorescence emission of the Lhca2 subunit of higher plant photosystem I. The Journal of biological chemistry. 279 (47), 48543-48549 (2004).
- Morosinotto, T., Mozzo, M., Bassi, R., Croce, R. Pigment-pigment interactions in Lhca4 antenna complex of higher plants photosystem I. The Journal of biological chemistry. 280 (21), 20612-20619 (2005).
- Mozzo, M., Morosinotto, T., Bassi, R., Croce, R. Probing the structure of Lhca3 by mutation analysis. Biochimica et biophysica acta. 1757 (12), 1607-1613 (2006).
- Mozzo, M., Passarini, F., Bassi, R., van Amerongen, H., Croce, R. Photoprotection in higher plants the putative quenching site is conserved in all outer light-harvesting complexes of photosystem II. Biochimica et biophysica acta. 1777 (10), 1263-1267 (2008).
- Wientjes, E., Roest, G., Croce, R. From red to blue to far-red in Lhca4 how does the protein modulate the spectral properties of the pigments. Biochimica et biophysica acta. 1817 (5), 711-717 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved