Method Article
식물과 녹조류의 빛 수확 단지의 체외의 재구성에
요약
This protocol details the reconstitution of light-harvesting complexes in vitro. These integral membrane proteins coordinate chlorophylls and carotenoids and are responsible for harvesting light in higher plants and green algae.
초록
식물과 녹조류에서, 빛은 빛 수확 단지 (LHCs), 엽록소와 카로티노이드 좌표 세포막 단백질의 가족에 의해 캡처됩니다. 생체가,이 단백질이 틸라코이드 막에 삽입 복합체를 형성하는 안료로 접혀 엽록체의. 이들이 쉽게 분리 중에 안료를 잃을 수 있다는 사실과 가족의 구성원의 화학적 및 물리적 특성에 높은 유사성은, 기본 상태에서의 정제 도전한다. LHCs의 균질 한 제제를 얻는 다른 방법은 (는) 고유의 것과 매우 유사한 성질을 갖는 복합체의 결과 정제 된 안료 및 펼친 apoproteins에서부터 시험 관내에서 이러한 복합체를 재구성 할 수있다였다 보여준 1987 1 Plumley과 슈미트에 의해 개발되었다 단지. 이것은 생체 외 박테리아 발현 용 재조합 단백질의 사용 방법을 연 (예를 들어, 색소 결합 부위) 또는 단백질 도메인 (예를 들어, 단백질 - 단백질 상호 작용, 접이식)의 역할. 이 방법은 여러 실험실에서 최적화 광 수확 복합체의 대부분에 적용되어왔다. 여기에 설명 된 프로토콜은, 현재 우리 실험실에서 사용되는 시험 관내 광 수확 복합체를 재구성하는 방법을 자세히 상기 방법의 적용을 설명하는 예가 제공된다.
서문
식물과 조류의 광합성 장치는 세포막 (CHL) 엽록소를 결합 단백질, B (CHL의 b) 및 카로티노이드 (자동차)를 포함한다. 이러한 안료 단백질 복합체 수확 빛 에너지가 2 전하 분리를 촉진하기 위해 사용되는 반응 중심에 그 여기 에너지를 전송하는 활성이다. 그들은 또한 높은 광 손상 3,4에서 광합성기구를 보호 규제 피드백 메커니즘에 참여하고 있습니다. 광 수확 복합체 (LHCs)는 식물과 조류 5에 관련된 단백질의 큰 가족으로 구성되어있다.
가족의 각 구성원의 균일 한 정제 단지의 매우 유사한 화학적 및 물리적 특성에 의해 복잡하게되었습니다. 또한, 정제 절차는 종종 그러한 지질 등의 안료 또는 기타 보조 인자의 잠재적 인 손실이 발생할. 관내 재구성을 represenTS 강력한 방법은 이러한 문제점을 극복한다. 광계 II (LHC-II)와 관련된 LHC는 첫째 연구진은 식물 엽록체 별도로 delipidated 단백질과 색소를 추출 하였다. 1,987 일에 Plumley 슈미트에 의해 시험관 내에서 재구성 한 후 리튬의 존재 안료 열 변성 단백질을 결합했다 동결 융해 하나의 3주기 다음 도데 실 황산염 (LDS). 그들은 재구성 된 LHC 단지의 분광 특성은 식물에서 정제 단지와 매우 유사한 것으로 나타났다. 미생물에서 정제 된 복합체를 분리의 어려움과 함께 (때문에) 고유의 자기 조립 (self-assembly) 기능에 LHC 색소 단백질 복합체 가능성을 재구성의 용이성, 다른 연구자에 의한 방법의 빠른 채택되었다. 대장균 (E. 콜라이)에서 과발현 광합성 단백질의 재구성은 1990 년 6 폴슨과 동료들에 의해 달성되었다. E. 투표대장균 과발현 막 단백질은 전형적으로, 봉입체에 포함되는 기능들이 정제. 재구성은 단백질 폴딩을 개시 안료 첨가하여 LDS의 존재하에 포함하는 재조합 단백질을 봉입체의 열 변성을 통해 달성된다. LHCII 착체 접이식 두 단계 프로세스이다 : 첫째, 엽록소가 1 분 미만에 바인딩; 둘째, 엽록소 B는 몇 분 동안 7 바운드 및 안정화된다.
폴딩의 동력학에 대한 통찰력을 제공 할뿐만 아니라, 부위 특이 적 변이와 결합 관내 재구성 특정 아미노산의 안정성에 중요한 아미노산 (예를 들면, 8,9) 또는 안료 조정의 식별을 허용하고있다 (예를 들어, 10). 이러한 안료 조성물 또는 세제 등의 파라미터를 조절함으로써 리 폴딩 조건의 조작도 비판적 요소를 식별 한같은 LHCII 컴플렉스의 크 산토 필의 요구 사항으로 적절한 폴딩에 대한 리터 (예를 들어, 1,11). 또한, 상기 복합체에 결합 된 개별 안료의 특성의 조사는 생체 내에서 재구성 된 복합체를 사용하는 것이 가능하고있다 (예를 들어, 10).
여기에 설명 된 방법은 안료의 분리 (엽록소와 카로티노이드) 시금치에서와 녹조류 인 Chlamydomonas reinhardtii를 시작합니다. E.에서 LHC 단백질의 발현 및 정제를 봉입체의 형태로 대장균이어서 니켈 친 화성 칼럼에 의해 LHC의 재구성 및 후속 정제 한 후, 상술된다. 최종 단계에서, 상기 재구성 된 착체는 자유 염료 및 펼친 아포 단백질을 제거 할 수 크로스 구배 원심 분리에 의해 정제된다. 이 프로토콜을 통해 서로 다른 실험실에서 도입 된 몇 가지 수정 사항을 통합 최적화 된 절차를 나타냅니다시간 1,6,10,12 -14.
프로토콜
시금치 잎에서 1 전체 안료 추출
- 저온 분쇄 완충액 100ml에 시금치 잎 (~ 20g) 중 하나 소수 20 초 동안 균질화 믹서를 사용하여 (표 1 참조).
- 4 ℃에서 10 분 동안 1,500 XG에 20 μm의 원심 여과 공경 나일론 헝겊이 층을 통해 용액을 필터.
- 소프트 아티스트 엽록체를 포함하는 펠릿을 냉 세척 완충액 1 ㎖에 재현 탁 페인트 브러시 (표 1 참조). 펠릿을 재현 탁되면, 4 ℃에서 10 분 동안 10,000 XG에 세척 버퍼와 원심 분리기 50 ㎖ 솔루션을 추가합니다.
- 세척 완충액 50 ㎖ 중의 펠릿 (틸라코이드)를 부드럽게 재현 탁 상등액을 제거하고 (표 1 참조).
- 4 ° C에서 10 분 동안 10,000 XG에 솔루션을 원심 분리기 완전히 뜨는을 제거합니다. 이 시점에서, 안료 산화를 피하기 위하여, 어둠 속에서 다음 단계를 수행한다.
- 나 2 CO 3와 버퍼링 80 % 아세톤 20 ㎖가 색소를 추출하는 (표 1 참조)에 추가 ~. 가끔 텍싱, 10 분 동안 얼음에 솔루션을 둡니다.
- 4 ° C에서 15 분 동안 12,000 XG에서 원심 분리하여 세포 성분 펠렛.
NOTE : 안료가 완전히 추출하지 않는 경우, 펠릿은 녹색 컬러가 1.6이 반복되어야 넘어 간다. - 분리 깔때기에 상층 액을 수집합니다. , 디 에틸 에테르의 0.4 볼륨을 추가 흔들어 및 가스를 배출하는 밸브를 엽니 다.
- 0.33 M의 NaCl 0.8 볼륨을 추가하고 적극적으로 섞는다. 층을 분리하기위한 ~ 10 분을 허용합니다. 상단에있는 에테르 단계는 추출 된 안료가 포함되어 있습니다. 맑은 낮은 단계를 제거합니다.
NOTE : 분리가 명확하지 않은 경우, 고정 및 상분리를 개선하기위한 해결책을 해동. - 적당한 유리 용기에 분리 깔때기의 위로부터 부어 에테르를 제거합니다. 할머니 한 숟가락을 추가하여 드라이신경근 무수 황산나트륨. 용액을 소용돌이 에테르로부터 수분을 흡수하는 건조제를 위해 ~ 5 분을 허용한다.
참고 : 황산 나트륨이 완전히 뭉쳐 나타나는 경우이 단계를 반복; 에테르가 충분히 건조 될 때 약간의 자유 부동의 결정이 있어야합니다. 수층을 형성하는 경우, 추가로 황산나트륨 무수물을 첨가하기 전에 파스퇴르 피펫으로이를 제거한다. - 뒤에 황산나트륨 고체 떠나 새로운 유리 용기에 에테르를 경사 분리한다.
- 로터리를 Speedvac 또는 N 2 기류하에 에테르를 증발시키고.
- 100 % 아세톤 10ml에 완전히 녹이고, 안료.
- 80 % 아세톤 1 ㎖ 중에 소량 (~ 3 μL)으로 희석하고 흡수 스펙트럼을 측정하고 으악 등에 의해 기재된 방법에 엽록소 a / b를 비와 엽록소 농도를 결정한다. (1989) 15.
- 아세톤 때까지 분취 액을 로터리를 Speedvac 또는 N 2 흐름하에 건조 안료완전히 증발. -80 ° C에서 건조 된 안료를 저장합니다.
시금치의 카로티노이드의 2 추출
- 단계 1.5로 1.1을 따르십시오. 이 시점에서, 안료 산화를 피하기 위하여, 어둠 속에서 다음 단계를 수행한다.
- 안료를 추출 나 2 CO 3 (표 1 참조)로 버퍼링 ~ 50 ㎖의 96 % 에탄올에서 틸라코이드 펠렛을 재현 탁. 5 분 동안 얼음에 솔루션을 둡니다.
- 4 ° C에서 15 분 동안 12,000 XG에서 원심 분리하여 세포 성분 펠렛.
NOTE : 안료가 완전히 추출하지 않는 경우, 펠릿은 녹색 컬러가 2.2이 반복되어야 넘어 간다. - 상층 액을 수집하고 (/ V w) 비누화을 시작하는 80 % KOH의 0.1 볼륨을 추가합니다.
- 4 ° CO / N에 솔루션을 남겨 단단히 뚜껑을 닫고 빛으로부터 보호.
- 분리 깔때기에 솔루션을 수집합니다. 디 에틸 에테르의 1 볼륨을 추가하고 부드럽게 섞는다.
- 0.8 권 추가0.33 M의 NaCl을 메와 부드럽게 섞는다. 층을 분리하기위한 ~ 10 분을 허용합니다. 상단에 오렌지 에테르 단계는 비누화 된 카로티노이드가 포함되어 있습니다. 깔때기의 콕을 통해 배출하여 녹색 낮은 단계를 제거합니다.
- 물 3 볼륨을 추가하고 수산화 칼륨을 제거하기 위해 부드럽게 섞는다. 층이 분리 할 수 있습니다. NOTE : 상부 위상 흐린 나타나면 NaCl을 소량의 추가 (예 3 용액 200 ㎖의 염화나트륨 g) 및 부드럽게 소용돌이 용해.
- 깔때기의 콕을 통해 배출하여 낮은 단계를 제거합니다.
- 팔로우은 1.13에 1.10 단계를 반복합니다.
- 80 % 아세톤 1 ㎖ 중에 소량 (~ 3 μL)을 희석하고 80 % 아세톤 440 nm에서 흡수 스펙트럼을 측정한다. 농도를 측정하기 위해, 카로티노이드의 평균 계수 멸종을 사용하여 다음과 같은 식 (16) (440 = 255 ε) : 승용차 [㎎ / ㎖] = (절대 440 나노 미터 / 225) X 11 (광로) = 1cm.
- 나누어지는 및 carotenoi 건조를 Speedvac 또는 일부 디 에틸 에테르 때까지 N이 스트림에서 DS는 증발되고있다. -80 ° C에서 건조 된 안료를 저장합니다.
클라 미도 모나스에서 3 전체 안료 및 카로 티 노이드 추출 reinhardtii를
- C. 성장 표면에 액체 배양의 작은 금액을 확산하여 배양 접시에 고체 TAP 매체 17 reinhardtii에서. 20 μmol의 사진 PSA의 m -2 초 연속 조명 속에서 성장 -1 세포의 녹색 층이 보일 때까지.
- 무균 접종 루프를 사용하면, C. 소량 수확 고체 TAP 매체로부터 reinhardtii를하고 1 L 플라스크에 TAP 매체 (17)의 500 ML에 세포를 넣어. 20 μmol의 사진 PSA의 m -2 sec의 연속 조명 속에서 170 rpm에서 교반과 함께 25 ° C에서 문화를 성장 -1.
- 5-6일 후, 배양은 대수 위상의 단부에 도달한다 (6 × 106 세포 / ㎖또는 750 nm에서 2-2.5 광학 밀도). 4 ° C에서 15 분 동안 4,000 XG에 문화를 원심 분리기.
- 총 색소 추출의 경우, 단계 1.15에 1.6을 따릅니다.
- C.의 전체 성장 배양 500ml의 전체 안료에서 시작 추출물의 수율 reinhardtii를는 + B / ㎖ 0.5 밀리그램 CHL의 농도와 용액의 약 5 ㎖이다.
- 카로티노이드 추출의 경우, 단계 2.12에 2.2을 따릅니다.
봉입체의 4 정제
- 표준 분자 생물학 방법을 사용하여 융합 된 C-말단 태그 그의 결과 발현 벡터에 관심 LHC 단백질의 코딩 서열을 복제. E.으로이 구조를 변환 같은 BL21 (DE3)와 같은 호스트 대장균 균주.
- 준비 용해 완충액 세제 버퍼 트리톤 버퍼, TE (표 1), 1 M 이소 프로필 β-D-1-티오 갈 락토 피 라노 시드 (IPTG)과 적절한 항생제 LB 배지 18.
- 자장 선택전자 E. 표준 절차 (6)를 사용하여 적절한 항생제 LB 배지 ~ 5 ㎖ 중에 갓 스트리킹 플레이트에서 발현 클론을 함유하는 대장균 콜로니. 적어도 16 시간 동안 220 rpm으로 교반과 함께 37 ° C에서 성장.
- O의 2.5 ML을 추가 / 적절한 항생제로 보충 LB 250 ㎖와 1 L 삼각 플라스크에 넣고 N 문화.
- 2 ~ 3 시간 동안 세포를 성장 220 rpm에서 37 ° C에서 (또는 OD 때까지 600 ~ 0.6)입니다.
- 최종 농도 1mM IPTG 추가. 220 rpm으로 3 ~ 4 시간에 37 ° C에서 세포 성장을 계속합니다.
- 미리 무게를 원심 분리 관에 4 ° C에서 5,000 XG에 10 분 동안 문화를 원심 분리기. 철저하게 뜨는을 취소하고 다시 무게와 원심 분리기 튜브의 무게를 뺀 무게에게 펠렛을 결정합니다.
- E.을 재현 탁 0.8 ㎖ / 격렬하게 볼 텍싱에 의한 용해 완충액 g에서 대장균 세포 펠렛.
NOTE : 대안 적으로, 세포 펠릿을 -80에서 냉동 될 수있다나중에 사용하기 위해 C. 동결 된 펠릿을 시작하는 경우, 용해 버퍼를 첨가하기 전에 완전 해동 할 수있다. - 세포의 g 당 라이소자임의 2 mg을 추가하고, 30 분 동안 가끔 소용돌이로 교반 젖은 얼음에 품어.
- 20 μg / ml의 DNase를, 10 mM의 MgCl2를, 1 ㎜의 NaCl, 20 μg / ml의 RNAse가를 추가합니다. 소용돌이와 30 분 동안 얼음에 넣어.
- 세포의 g 당 차가운 세제 버퍼의 두 ML을 추가합니다. 잘 혼합하고 5 분 동안 RT를 유지합니다.
- 2 ㎖의 원심 분리기 튜브에 전송 (필요한 경우이 튜브로 분할). 4 ° C에서 12,000 XG에 10 분 동안 원심 분리기는 봉입체 펠렛.
- 버퍼 차가운 트리톤의 1 mL를 넣고 완전히 음파에 의해 펠렛을 (20 초 간격으로 3 펄스 × 5 초 × 50 % 전력) 재현 탁. 참고 : 음파 동안 감기를 유지하기 위해 얼음 물에 둘러싸인 작은 비커에 튜브를하게한다. 다수의 튜브의 경우에는, 재 부유 한 후 튜브로 재현 탁 봉입체를 결합한다.
- 12,000에서 10 분 동안 원심 분리기4 ° C에서 XG는 봉입체 펠렛.
- 단계를 반복 4.13과 4.14 두 번.
- 트리톤 버퍼를 제거하기위한 최종 세척 음파 감기 TE 1 ㎖에서 봉입체를 재현 탁. 4 ° C에서 12,000 XG에 10 분 동안 원심 분리기는 봉입체 펠렛.
- 음파에 의한 냉간 TE 1 ㎖에 펠렛을 재현 탁.
- 이러한 브래드 포드 분석법 (19)과 같은 표준 방법에 의해 단백질 농도를 평가한다. -20 ° C에서 봉입체의 저장 분취.
(5)의 재구성
흡광도 QY 영역 (600-750 nm의)에서 측정 할 때이 프로토콜은 일반적으로 4 OD으로 재구성 단백질의 1-2 ML을 얻을 수 있습니다. 치료는 절차 중에 적절한 비율을 유지하기 위해 취해 져야한다하더라도 수량은 원하는대로 조정될 수있다.
- 배의 재구성 버퍼, 20 % OG, 2 M의 KCl, TE : 표 1에 설명 된대로 다음과 같은 솔루션을 준비합니다. 다음의를 수행희미한 빛 TEPS.
- 2 ml의 미세 원심 분리 튜브에 400 ㎕의 TE의 총 LHC 봉입체의 800 μg을 재현 탁. 배의 재구성 버퍼와 소용돌이 짧게의 400 μl를 추가합니다.
- 10 mm의 최종 농도를 가지고 β-메르 캅토 에탄올 (주 14.8 M)의 0.6 μl를 추가합니다. 98 ° C에서 1 분 동안 단백질을 가열. 3 분 동안 실온에서 소용돌이 짧게 장소.
- 적극적으로 1 ~ 2 분 동안 목욕 초음파 분쇄기에 1 분 또는 장소를 텍싱 30 ㎕의 100 % EtOH로 총 건조 엽록소 안료의 500 μg 플러스 80 μg 카로티노이드 색소를 재현 탁.
- 4 ° C에서 15,800 XG에서 ~ 30 초 안료 혼합 스핀 더 펠릿이 없음을 확인합니다. 펠릿이 있으면 텍싱 및 / 또는 초음파 처리를 반복한다. 중요 : 재 부유 스핀 후 즉시 단백질에 안료를 추가하거나 통합 할 수 있으며, 다시 재현 탁해야합니다.
- 텍싱하면서 천천히 냉각 단백질 안료 믹스를 추가합니다. 소용돌이 5-10의 계속젖은 얼음에 EC와 장소 튜브. 단백질이 튜브의 상단을 오버 플로우 수도 적극적으로 와동하지 않도록주의하십시오.
- 20 % 옥틸 β-D-글루 코피 라노 시드 (OG) (최종 농도 2 %), 소용돌이 짧게의 94 μl를 추가하고 얼음 10 분 계속.
- 잠깐의 KCl이 M (최종 농도 150 ~ 200 밀리미터), 소용돌이의 90 μl를 추가하고 얼음 20 분 계속. 참고 : 열 준비 (6 절)는이 시간에 시작할 수 있습니다.
- 4 ° C에서 15,800 XG에 10 분 동안 스핀. 10 ML 튜브에 (LDS 침전) 펠렛을 방해하지 않고 뜨는을 제거합니다. 추위와 빛으로부터 보호하십시오.
(6) 니켈 열 정화
- OG 버퍼, OG 린스 버퍼, 용출 버퍼 : 표 1에 설명 된대로 다음과 같은 솔루션을 준비합니다.
- 공기는이 단계와 다음 단계에서 열 내부로 들어갈 없다는 것을 보장 연동 펌프에 니켈 - 세파 로즈 컬럼 (1 ㎖) 또는 이와 동등한를 연결합니다.
- t의 속도를 설정그는 1 ml / 분으로 펌핑 및 저장 용액을 제거하기 위해 물 5-10 ml의 컬럼을 헹군다.
- OG 버퍼의 3 ~ 4 mL를 열 평형.
- 컬럼에 단백질 시료와 부하에 OG 버퍼의 3-4 ML을 추가합니다. 참고 : 단백질이 LDS 제거 후 이상 10 분 동안 얼음에 앉아 한 경우 1 분 추가 LDS 침전을 제거하기 위해, 4 ° C에서 15,800 XG에 다시 회전.
- OG 버퍼 5 ㎖로 컬럼을 씻어.
- OG 린스 버퍼의 두 ㎖로 컬럼을 씻어.
- 3 ㎖의 용출 완충액으로 단백질을 용출 바인딩. 재구성 된 단백질을 포함하는 녹색 용출를 수집합니다. 참고 :이 일반적으로 총 약 1 ML입니다.
7 자당 기울기 원심 분리
- 자당 용액, 0.06 %의 β-DM, 0.01 M HEPES, pH가 7.6 표 1에 설명 된대로 다음과 같은 솔루션을 준비합니다.
- -20 ° CO / N 오에서 자당 용액 및 동결로 초 원심 분리기 튜브 채우기R -80 ° C에 대해 적어도 1 시간.
- 냉장고에서 튜브를 제거하고 4 ° C에서 방해받지 않고 해동 할 수 있습니다. 참고 : 동결 / 해동 과정은 0.1 ~ 1 M 자당에 그라데이션을 만듭니다. 15 ML 튜브는 일반적으로 약 3 시간에 해동.
- 조심스럽게 상단에서 단계 6.8에서 니켈 세파 로즈 컬럼에서 용출 녹색 부분과 동일한 볼륨을 제거합니다. 그런 다음 그라데이션을 방해하지 않도록 천천히 위쪽에 재구성 된 샘플을로드합니다.
- 가속 및 브레이크없이 중지를 느리게 설정 18 시간 동안 SW-41 SW-60 스윙 버킷 로터를 사용하여 초 원심 분리기의 균형 튜브와 4 ° C에서 200,000 XG에 스핀.
- 조심스럽게 집게로 튜브 홀더에서 구배를 꺼내. 상단에서 분획을 수집하는 무딘 개구가 긴 바늘과 주사기를 사용한다. 참고 : 다른 방법으로, 바늘로 튜브를 관통하고 방울을 수집하여 바닥에서 분수를 수집합니다.
결과
이 프로토콜은 시험관 내에서의 chorophyll / B 결합 단백질을 재구성하는 방법을 자세히 설명. 이 기술은 식물 또는 해조류로부터 추출 이들 안료 단백질 이종 시스템의 과발현에 의해 얻을 수있다 아포 단백질로부터 시작하여 시험 관내 착체 및 안료의 폴딩을 허용한다. 재구성 한 후, 리 폴딩 된 안료 - 단백질 복합체는 안료의 과량이 단계 펼친 아포 단백질로부터 정제한다. 첫 번째 단계 (도 1 AB)가 결합되지 않은 안료의 큰 부분의 제거를 허용하는 단백질의 C-말단에 그의 태그의 존재에 기초한다. 두 번째 정제 단계는 단백질은 일반적으로 펼쳐진 재구성 단백질을 함유하는 녹색 대역보다 느린 마이그레이션 자당 밀도 구배 원심 분리, (도 2)를 이용한다. 시험 관내 재구성의 목표와 같은 적절한 착물을 획득하는 것네이티브 것과 관계. 이 결과를 설명하기 위해 생체 내 광 수확 복합체의 분광 특성은 체외 13,20,21에서 재구성 같은 LHC 단지와 비교된다. 가시 범위 (350 nm 내지 750 nm의)에서 LHCs의 흡수 스펙트럼은 안료의 환경에서뿐만 아니라, 복합체의 안료 조성물에 달려있다 (단백질을 포함 함)하고, 따라서 품질을 확인하기위한 중요한 도구이다 재구성의. 도 3, CP24의 흡수 스펙트럼에서, 클로로필 a / b를 시험 관내에서 재구성 된 애기 장대로부터 결합 단백질, 애기 틸라코이드 (21)로부터 같은 복잡한 정제의 스펙트럼과 비교된다. 스펙트럼에서는 QY 및 (피크 439분의 671 nm에서)의 엽록소 Soret 전이 및 엽록소의 B (466분의 649 nm에서 피크)을 인식 할 수있다. 네이티브 및 재구성 단지는 동일 abso을 보여사실상 동일한 안료 조성물 및 조직을 나타내는 rption 스펙트럼. 형광 분광기 재구성 복합체의 품질을 평가하는데 사용될 수있다. 형광 방출 스펙트럼은 우선적 다른 안료를 여기 상이한 파장, 여기에 따라 측정된다 : 엽록소의 440 nm의 엽록소의 475 nm에서의 b 및 500 nm에서의 크 산토 필. 제대로 접힌 단백질 안료 복잡한에서 엽록소 B와 크 산토 필은 몇 피코 초 내에서 주로 엽록소의 자신의 여기 에너지를 전송하고, 형광 같은 모양과 최대 값에서 세 여자와 함께 단일 피크의 결과로 열 평형 시스템에서 유래 파장 (도 4A-B). 단백질에 배위되지 b를 엽록소의 존재는 475 nm의 여기 (도 4C)에 따라 650 nm의 주위에 추가적인 피크 또는 어깨에 의해 인식 될 수있다. 무료 엽록소의 존재는 대신 리드440 nm의 여기시에 주로 존재하는 675 nm의 주위 추가 방출합니다. 475 재구성 모두의 나노 여기 및 기본 CP24 단지 (그림 4D)에 따라 형광 방출 스펙트럼은 재구성 된 복잡한 제대로 접혀 있음을 나타내는, 681 nm에서 단일 피크를 보여줍니다. 색소 단백질 복합체가 올바르게 재구성되는 추가 확인이 원형 이색 성 (CD) 측정에서 온다. 가시 광선 영역의 CD 신호는 안료의 엑시톤의 상호 작용에 의존하며, 따라서 발색단 (22)의 조직에 아주 작은 변화에 매우 민감하다. 일반적인 지문 산봉우리와, 재구성 및 기본 CP24의 CD 스펙트럼을 보여줍니다 그림 5 681 나노 미터, 650 나노 미터와 481 나노 미터. 결론적으로, 분광 고유의 특성 및 그 재구성 된 CP24 재구성 절차 수율 네이티브 같은 컴플렉스 이타를 확인 간의 유사도가 높은 빛 수확 단백질의 생체 외 연구 상상력.
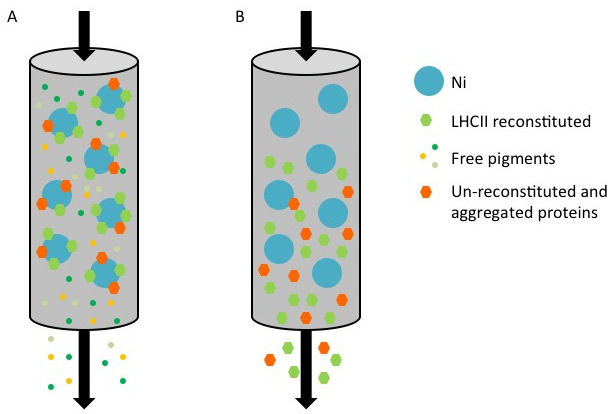
니켈 열을 사용하여 자신의 태그를 재조합 LHC 단백질의 정제의 그림 1 표현입니다. (A) 모두 재구성 단지 (녹색 육각) 및 취소 재구성 / 집계 단백질로 구성 정화, 그의 태그가 단백질, 중 (오렌지 언 바운드 안료 (작은 컬러 점)이 흐를 동안 육각은), 니켈 - 세파 로즈 (파란색 점)의 표면에 바인딩됩니다. (B) 칼럼 용출 버퍼가 이미 다졸을 함유로 세정하면, 재구성 및 해제 재구성 된 단백질을 통한 흐름에서 수집된다.
hres.jpg "폭 ="500 "/>
재구성 LHCII의 그림 2 자당 기울기 니켈 열을 기준으로 정제 한 후. 재구성 단지는 밀도 구배에 의한 무료 안료에서 분리된다. 짙은 녹색 밴드는 재구성 된 LHCII을 나타내고 옅은 녹색 배경 무료 안료로 구성되어있다.
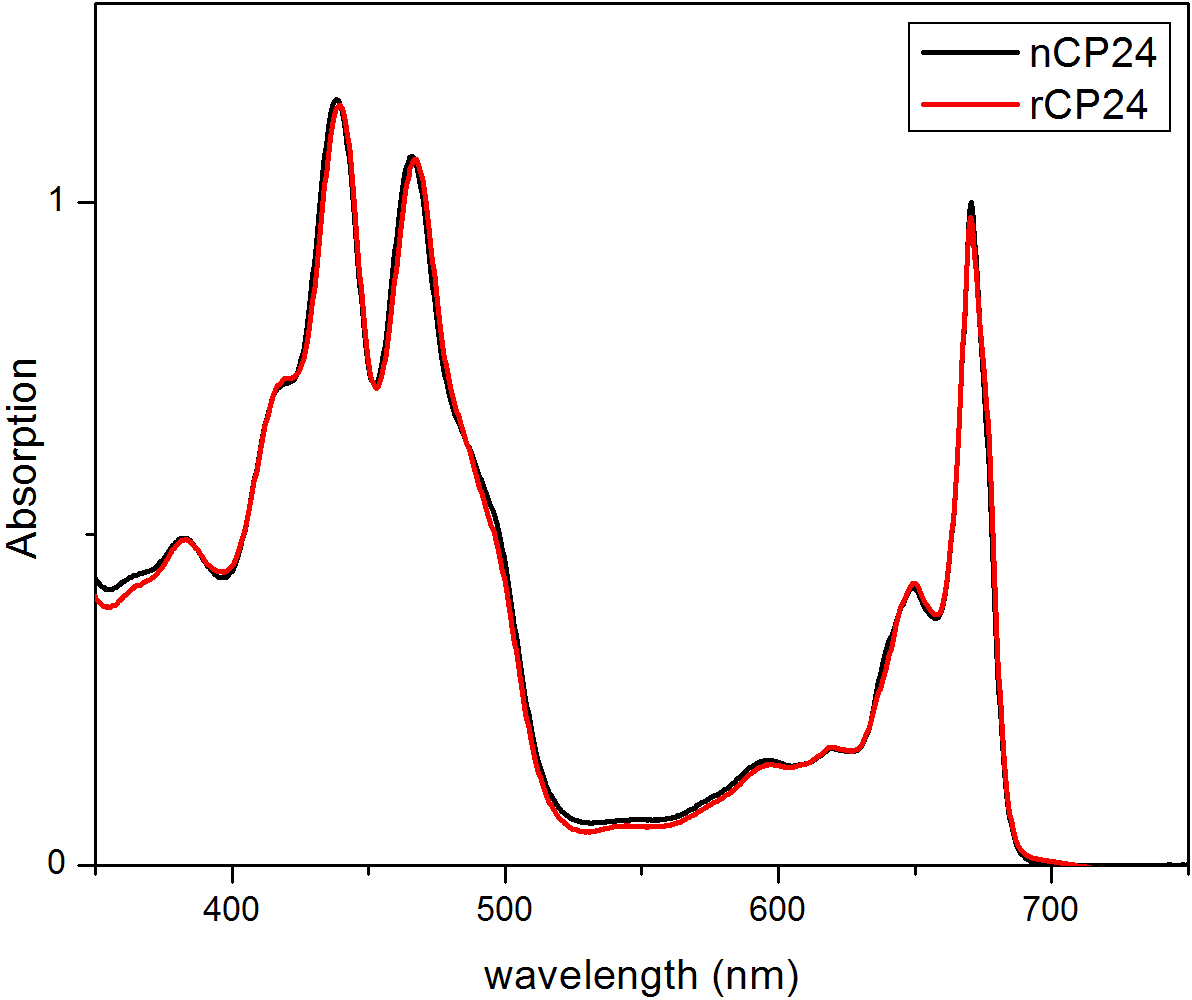
재구성 단백질 CP24 (rCP24, 빨간 선)와 애기 장대에서 분리 된 고유 한 (nCP24, 검은 선)의 그림 3 흡수 스펙트럼. 두 스펙트럼에서, 그것은 QY과 엽록소의 Soret 전이 (피크를 인식 할 수있다 439분의 671 nm의)과 엽록소의 B (466분의 649 nm에서 피크)에서. 이 수치는 Passarini 외에서 수정되었습니다. 2014 21.
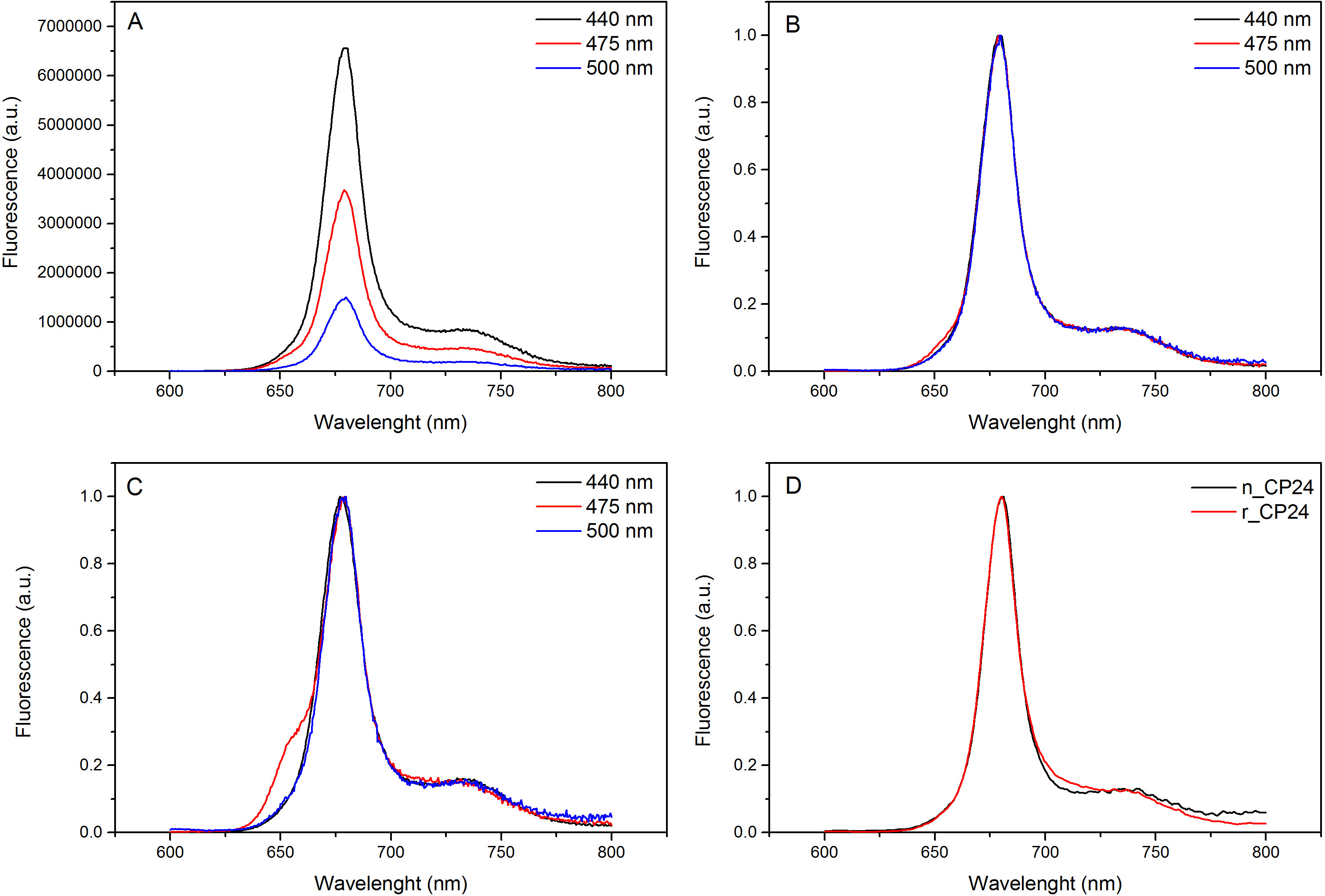
도 4 형광 발광 스펙트럼.을 CHL하는 엽록소 B와 Xanthophyls로부터 효율적인 에너지 전달을 나타내는 최대 (B)로 재구성 된 CP24의 야생형 복합체 (A) 및 정규화의 형광 발광 스펙트럼. 재구성 CP24 (rCP24)와 애기 장대에서 분리 된 (nCP24) 네이티브 단지의 (C) 형광 발광 스펙트럼. 스펙트럼 피크 (D)의 최대 정규화됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
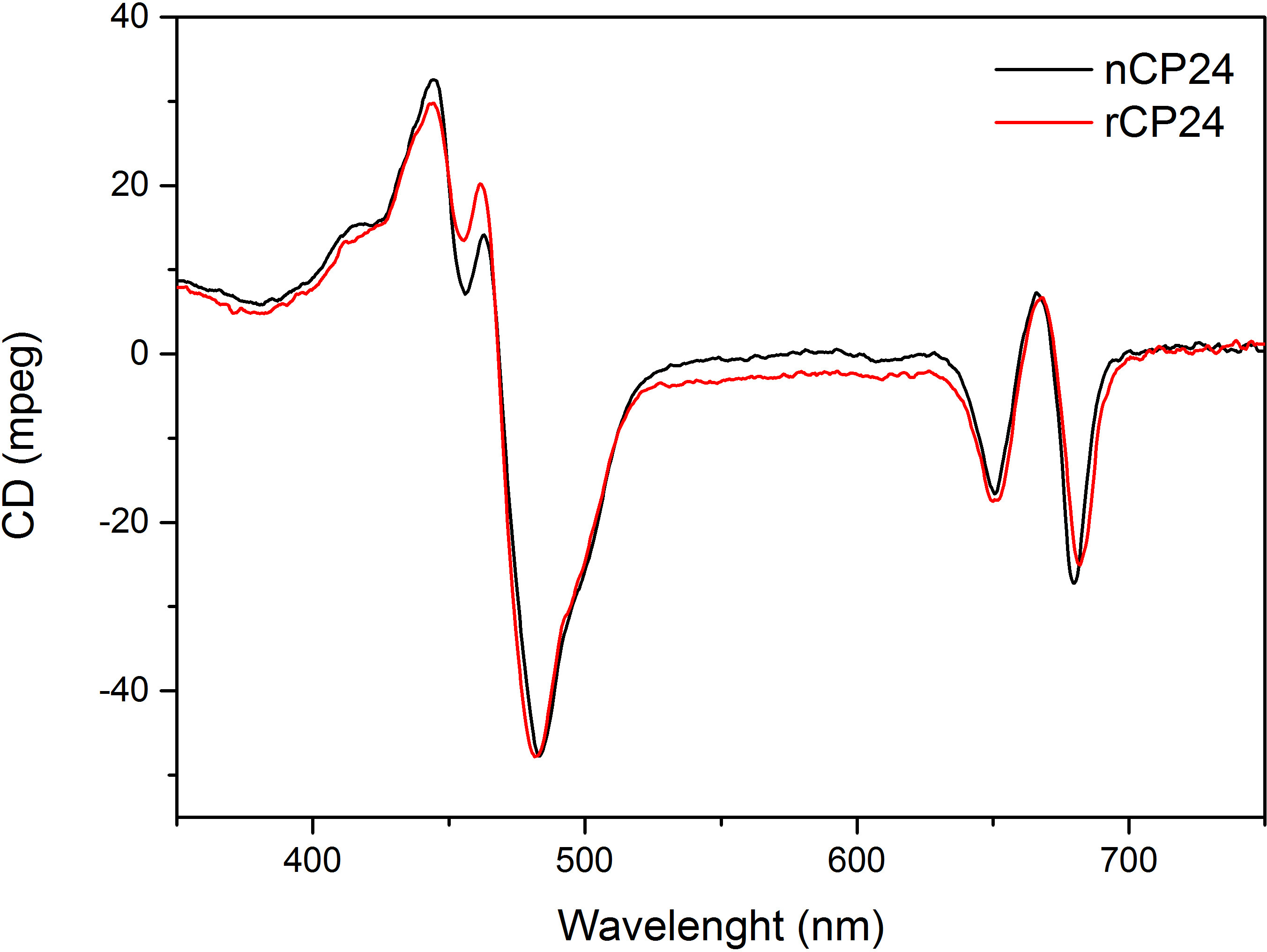
그림 5 원 편광 이색 스펙트럼. 재구성 CP24 (rCP24, 빨간 선)와 애기 장대에서 분리 된 고유의 복잡한 (nCP24, 검은 색 선은) 매우 유사한 스펙트럼을 보여줍니다.

CP29 야생형 (CP29_WT) 및 돌연변이 CP29 (CP29_A2)의 그림 6 흡수 스펙트럼. 녹색 선은 두 개의 플롯의 차이점을 보여줍니다.
| 모든 버퍼는 4 ° C에 저장할 수 있습니다. | |||
| 구성 요소 | 최종 농도 | 추가 참고 | |
| 연마 버퍼 | 소르비톨 | 0.4 M | |
| 트리 신 | 0.1 M | pH를 7.8 | |
| 염화나트륨 | 10 mM의 | ||
| MgCl2를 | 5 mM의 | ||
| 우유 분말 | 0.5 % / V w | ||
| 세척 버퍼 | 소르비톨 | 50 mM의 | |
| 트리 신 | 5 mM의 | pH를 7.8 | |
| EDTA | 10 mM의 | pH가 8 | |
| 용해 버퍼 | 트리스 | 50 mM의 | pH가 8 |
| 자당 | 2.5 % / V w | ||
| EDTA | 1 ㎜ | pH가 8 | |
| 세제 버퍼 | 염화나트륨 | 200 mM의 NaCl을 | |
| 데 옥시 콜린 산 | 1 % / V w | ||
| NONIDET의 P-40 | 1 % / V w | ||
| 트리스 | 20 mM의 | pH를 7.5 | |
| EDTA | 2 mM의 | pH가 8 | |
| 베타 - 머 캅토 에탄올 | 10 mM의 | ||
| 트리톤 버퍼 | 트리톤 X-100 | 0.5 % / V w | |
| 트리스 | 20 mM의 | pH를 7.5 | |
| 베타 - 머 캅토 에탄올 | 1 ㎜ | ||
| 버퍼 TE | 트리스 | 50 mM의 | pH가 8 |
| EDTA | 1 ㎜ | pH가 8 | |
| 재구성 버퍼 | HEPES | 200 밀리미터 | |
| 자당 | 5 % / V w | ||
| Lithiumdodecylsulfate (LDS) | 4 % / V w | ||
| 벤즈 아미 딘 | 2 mM의 | ||
| 아미노 카프로 산 | 10 mM의 | ||
| OG 버퍼 | 옥틸 글루코 시드 | 1 % / V w | |
| 12.5 % / V w | |||
| 염화나트륨 | 0.2 M | ||
| HEPES | 20 mM의 | ||
| 이미 다졸 | 10 mM의 | ||
| OG 린스 버퍼 | N-도데 실-베타-D-말토 (β-DM) | 0.06 % / V w | |
| HEPES | 40 mM의 | 산도 7.5-9 | |
| 염화나트륨 | 0.2 M | ||
| 용출 버퍼 | 이미 다졸 | 0.5 M | |
| N-도데 실-베타-D-말토 (β-DM) | 0.06 % / V w | ||
| HEPES | 40 mM의 | pH가 8 | |
| 염화나트륨 | 0.2 M | ||
| 자당 솔루션 | 자당 | 20 % / V w | |
| N-도데 실-베타-D-말토 (β-DM) | 0.06 % / V w | ||
| HEPES | 0.01 M | pH를 7.6 | |
| 아세톤은 80 % 탄산 나트륨으로 완충 | 아세톤 | 80 %의 v / V | |
| 차아 염소산 나트륨 | 한 M | ||
| 탄산 나트륨으로 완충 에탄올 96 % | 에탄올 | 96 %의 v / V | |
| 차아 염소산 나트륨 | 한 M | ||
이 프로토콜에 사용되는 버퍼 및 솔루션의 표 1에서입니다.
rCP26| Chla a / b를 믹스 | Chla A / B | 엽록소의 | 엽록소의 B | 네오 | 비올라 | 류트 | 엽록소 어린 아이 | 엽록소 / 자동차 | |
| nCP26 | - | 2.2 ± 0.05 | 6.2 | 2.8 | 0.61 | 0.38 | 1.02 | 9 | 4.5 ± 0.1 |
| rCP26 | 8 | 2.71 ± 0.05 | 6.57 | 2.43 | 0.72 | 0.32 | 0.97 | 3.9 ± 0.04 | |
| rCP26 | 5.5 | 2.25 ± 0.05 | 6.23 | 2.77 | 0.77 | 0.3 | 0.96 | 9 | 4.0 ± 0.1 |
| rCP26 | 3 | 2.08 ± 0.04 | 6.08 | 2.92 | 0.76 | 0.3 | 1.04 | 9 | 4.1 ± 0.1 |
| rCP26 | 1 | 1.7 ± 0.05 | 5.7 | 3.3 | 0.7 | 0.3 | 0.9 | 9 | 4.3 ± 0.05 |
| rCP26 | 0.3 | 1.11 ± 0.04 | 4.7 | 4.28 | 0.7 | 0.3 | 0.9 | 9 | 4.2 ± 0.2 |
| 0.05 | 0.23 ± 0.01 | 1.4 | 5.6 | 0.58 | 0.24 | 1.11 | 7 | 3.1 ± 0.06 | |
| rCP26 | <0.01 | 0.11 ± 0.01 | 0.7 | 6.3 | 0.64 | 0.3 | 1.08 | 7 | 3.06 ± 0.06 |
CP26 네이티브 표 2의 안료 함량 복잡한 다른 엽록소 A / B의 비율 (39)과 재구성 된 단백질 복합체 안료에 비해.
토론
막 단백질은 공부를 너무 쉽게하지 않습니다. 기본 막 단백질의 분리는 단백질에 손상을 필수 보조 인자를 제거 할 수있는 세제와 지질 이중층을 가용화 할 필요성에 의해 복잡해진다. 이 단백질은 또한 생물학적 막에서 낮은 수준으로 존재할 수있는, 또는 하나의 어려운 착물 정제를 만든다 광 수확 복합체의 경우에서와 같이, 밀접하게 관련된 단백질과 혼합 될 수있다. E.에서 이종 단백질 발현 대장균 및 체외 재구성에 이러한 문제를 회피 할 수있는 가능성을 제공한다. 체외 균질성 (24)에 정제 할 수없는 복합체를 연구하기 위해 사용될 수있다 네이티브 착체 20,21,23 따라서의 것과 매우 유사한 특성을 가지고 착체의 재구성 및 접힌 단백질 결과 정화용 - 27.
이 방법은 attainab 쉽게이다 시금치를 사용총 안료 및 카로티노이드 준비를위한 소스로 제작 : 일년 내내. 조류 네이티브 단백질의 일부 reconstitutions 들어, 해조류로부터 정제 안료의 사용으로 인해 상이한 안료 조성물에 바람직하다. 엽록소 a / b를 비와 엽록소 / 차 안료 비율에 관계없이 소스 동일하게 남아있다.
그것은 재구성의 효율은 일반적으로 약 35 % 28 것을 깨닫는 것이 중요하다. 그러므로 그것은 재구성 후의 용액으로부터 비 바운드 안료 펼친 아포 단백질을 제거 할 필요가있다. 두 단계의 정제 프로토콜 (또한 결과 참조)이 프로토콜에 제시되어있다. 그러나 자당 구배 단계 apo- 및 홀로 - 단백질의 완전한 분리를 허용하지 않는다는 것을 주목해야한다. 아포 단백질을 측정 기능을 방해하지 않는, 따라서 안료를 함유하지 않으며, 대부분의 경우 이러한 분석은 문제가되지 않는다. 그러나, 케이스에 완전히 FR에서 아포 단백질을 제거 할 필요가있다재구성 된 복합체를 (예를 들어, 단백질의 화학 양론에 안료를 계산하기 위해) 함유 액션, 음이온 교환 칼럼 (참고 Passarini 외. 자세한 2009 29)이 사용될 수있다.
용량은 시험 관내에서 격리 안료 재조합 광 수확 단백질 접힘하기 때문에 생성 된 복합체의 특성을 변경하는 다양한 방법으로 재구성 "환경"을 변경하여 복합체를 "조작"할 기회를 제공한다. 예를 들어, 재구성시 안료 조성물을 변경하면 변경된 안료 조성물과 복합 될 수있다. 이 기능은 다양한 안료 복합체의 구조 및 안정성에 미치는 영향을 연구하기 위해 이용 될 수있다. 1과 2.9의 엽록소 / 차 비율 : 보통 시금치에서 얻어진 안료 (3)의 준비는 엽록소 A / B의 비율이 1. 이 비율은 일반적으로 N과 동일한 특성을 갖는 재구성 된 단백질을 생산하나를 극상. 33 - 그러나 정제하여 엽록소의 A 또는 B의 첨가에 의해 엽록소 A / B 비의 조정은 결합 부위 (30)의 선택도를 변화로 인해 다른 안료의 결합에 영향을 미칠 수있다. 안료 결합 부위의 대부분은 엽록소의 엽록소 또는 B에 대한 선택적 완전히 아니지만, 모두를 수용 할 수 있기 때문에, 가능하지만 서로 다른 친 화성으로 10,30,34. 38 - 유사한 방식으로, 카로티노이드 결합 부위는 하나 이상의 종 8,35 크 산토 필을 수용 할 수 있도록 도시 하였다. CP26, 각종 안료 조성물을 사용 고등 식물, 다른 안료 - 단백질 복합체의 다른 reconstitutions 39은 표 2에 나타낸다. reconstitutions 선택된 특정 안료 (39)에 대한 결합 부위의 친화도를 평가하기 위해 사용되었다. 그것은 동일한 안료와 C 복합체를 얻기 위해 그 흥미 롭다1 : 기본 하나 omposition는 안료 혼합의 엽록소 a / b를 비는 3이어야합니다. 이 고등 식물 20,40 모든 LHC 착물에 대한 경우 일 것 같다.
재구성 기술과 분자 생물학의 조합은 엽록소 결합 복합체의 특성을 더 자세히 연구 할 수 있습니다. 44 - 착물, 또는 단백질 - 단백질 상호 작용에 관여 그들의 안정성 및 접힘에 다른 단백질 도메인의 중요성은, 아포 단백질을 절단 또는 랜덤 돌연변이 유발 8,41보기를 수행하여 결정 하였다. 52 - 다른 안료의 코디에 중요한 단일 아미노산 잔기 개별 안료의 특성을 분석하거나 복잡한 10,28,29,45의 기능과 안정성에 대한 그들의 기여를 평가하기 위해 부위 특이 적 변이를 통해 변경 될 수있다. 그림 6은 함께 Lhcb4 (CP29)를 재구성위치 (216) (53)에서 히스티딘의 돌연변이. 야생형과 돌연변이 착체의 안료 조성물의 비교 돌연변이 표적 사이트 WT 복잡 엽록소의 수용을 나타내는, 분자 하나 엽록소의 손실을 유도하는 것을 나타낸다. WT 및 돌연변이의 흡수 스펙트럼의 차이는, 안료 함량에 따라 정규화, 또한 분실 된 안료의 흡수 특성을 나타낸다. 이 경우, 차이는 엽록소 His216에 의해 조정이 파장에서 흡수 (이 돌연변이에 대한 자세한 내용 및 분광 특성이 Mozzo 등. 2,008 53 참조)을 나타내는, 680 nm에서 주 피크에서 볼 수 있습니다. 돌연변이 분석은 또한 안료 (54)의 광학적 특성에 대한 환경의 영향을 결정하기 위해 사용될 수있다.
결론적으로, 광 수확 단백질 용이 안료 PROTEI 결과 시험 관내에서 재구성 될 수있다네이티브 단지와 매우 유사한 특성을 갖는 n 개의 단지. 또한 추가 연구에 대한 높은 수율 및 순도 단백질 준비를 제공하면서 이러한 방법으로, 기본 단백질을 분리하는 어려움이 제거된다. (3)의 중요성 : 정통 복합체의 제조 1 엽록소 A / B 비를 강조하고, 재구성 된 야생형 및 돌연변이 LHCs의 예는 기술의 애플리케이션을 예시하기 위해 제공된다.
공개
The authors declare no conflict of interest
감사의 말
This work was supported by the European research council by a ERC starting/consolidator grant to RC and by the Dutch Foundation for research on matter (FOM) via a FOM program (10TM01).
자료
| Name | Company | Catalog Number | Comments |
| HisTrap HP | GE Healthcare | 17-5247-01 | |
| Nylon cloth | 20 μm pores | ||
| Soft artists paint brush | |||
| NONIDET P-40 | Sigma | 74385 | |
| Beta-DM | Sigma | D4641 | |
| DNAase | ThermoScientific | EN0525 | |
| Milk Powders | |||
| RNAase | ThermoScientific | EN0531 | |
| Sonicator | |||
| Octyl β-D-glucopyranoside | Sigma | O8001 | |
| Ultracentrifuge XL | Beckman-Coulter | ||
| TAP medium | see reference 17 | ||
| LB medium | see reference 19 |
참고문헌
- Plumley, F. G., Schmidt, G. W. Reconstitution of chlorophyll a/b light-harvesting complexes: Xanthophyll-dependent assembly and energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 84, 146-150 (1987).
- Croce, R., van Amerongen, H. Light-harvesting and structural organization of Photosystem II from individual complexes to thylakoid membrane. Journal of photochemistry and photobiology B Biology. 104 (1-2), 142-153 (2011).
- Li, Z., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and responding to excess light. Annual review of plant biology. 60, 239-260 (2009).
- De Bianchi, S., Ballottari, M., Dall’osto, L., Bassi, R. Regulation of plant light harvesting by thermal dissipation of excess energy. Biochemical Society transactions. 38 (2), 651-660 (2010).
- Neilson, J. A. D., Durnford, D. G. Structural and functional diversification of the light-harvesting complexes in photosynthetic eukaryotes. Photosynthesis research. 106 (1-2), 57-71 (2010).
- Paulsen, H., Rümler, U., Rüdiger, W. Reconstitution of pigment-containing complexes from light-harvesting chlorophyll a/b-binding protein overexpressed in Escherichia coli. Planta. 181 (2), 204-211 (1990).
- Horn, R., Grundmann, G., Paulsen, H. Consecutive binding of chlorophylls a and b during the assembly in vitro of light-harvesting chlorophyll-a/b protein (LHCIIb). Journal of molecular biology. 366 (3), 1045-1054 (2007).
- Cammarata, K. V., Schmidt, G. W. In vitro reconstitution of a light-harvesting gene product: deletion mutagenesis and analyses of pigment binding. Biochemistry. 31 (10), 2779-2789 (1992).
- Paulsen, H., Hobe, S. Pigment-binding properties of mutant light-harvesting chlorophyll-a/b-binding protein. European journal of biochemistry / FEBS. 205 (1), 71-76 (1992).
- Bassi, R., Croce, R., Cugini, D., Sandonà, D. Mutational analysis of a higher plant antenna protein provides identification of chromophores bound into multiple sites. Proceedings of the National Academy of Sciences of the United States of America. 96 (18), 10056-10061 (1999).
- Paulsen, H., Finkenzeller, B., Kühlein, N. Pigments induce folding of light-harvesting chlorophyll a/b-binding protein. European journal of biochemistry / FEBS. 215 (3), 809-816 (1993).
- Caffarri, S., Croce, R., Cattivelli, L., Bassi, R. A look within LHCII differential analysis of the Lhcb1-3 complexes building the major trimeric antenna complex of higher-plant photosynthesis. Biochemistry. 43 (29), 9467-9476 (2004).
- Giuffra, E., Cugini, D., Croce, R., Bassi, R. Reconstitution and pigment-binding properties of recombinant CP29. European journal of biochemistry / FEBS. 238 (1), 112-120 (1996).
- Rogl, H., Kosemund, K., Kühlbrandt, W., Collinson, I. Refolding of Escherichia coli produced membrane protein inclusion bodies immobilised by nickel chelating chromatography. FEBS letters. (1-2), 21-26 (1998).
- Porra, R. J., Thompson, W. A., Kriedemann, P. E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 975 (3), 384-394 (1989).
- Davies, B. H. Identification of carotenoids by their absorption characteristics. Biochem J. 103 (2), (1967).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. Journal of bacteriology. 62 (3), 293-300 (1951).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical biochemistry. 72, 248-254 (1976).
- Wientjes, E., Croce, R. The light-harvesting complexes of higher-plant Photosystem I Lhca1/4 and Lhca2/3 form two red-emitting heterodimers. The Biochemical journal. 433 (3), 477-485 (2011).
- Passarini, F., Xu, P., Caffarri, S., Hille, J., Croce, R. Towards in vivo mutation analysis knock-out of specific chlorophylls bound to the light-harvesting complexes of Arabidopsis thaliana - the case of CP24 (Lhcb6). Biochimica et biophysica acta. , (2014).
- Georgakopoulou, S., van der Zwan, G., Bassi, R., van Grondelle, R., van Amerongen, H., Croce, R. Understanding the changes in the circular dichroism of light harvesting complex II upon varying its pigment composition and organization. Biochemistry. 46 (16), 4745-4754 (2007).
- Croce, R., Müller, M. G., Caffarri, S., Bassi, R., Holzwarth, A. R. Energy transfer pathways in the minor antenna complex CP29 of photosystem II a femtosecond study of carotenoid to chlorophyll transfer on mutant and WT complexes. Biophysical journal. 84 (4), 2517-2532 (2003).
- Schmid, V. H., Cammarata, K. V., Bruns, B. U., Schmidt, G. W. In vitro reconstitution of the photosystem I light-harvesting complex LHCI-730 heterodimerization is required for antenna pigment organization. Proceedings of the National Academy of Sciences of the United States of America. 94 (14), 7667-7672 (1997).
- Castelletti, S., Morosinotto, T., Robert, B., Caffarri, S., Bassi, R., Croce, R. Recombinant Lhca2 and Lhca3 subunits of the photosystem I antenna system. Biochemistry. 42 (14), 4226-4234 (2003).
- Storf, S., Jansson, S., Schmid, V. H. R. Pigment binding, fluorescence properties, and oligomerization behavior of Lhca5, a novel light-harvesting protein. The Journal of biological chemistry. 280 (7), 5163-5168 (2005).
- Mozzo, M., Mantelli, M., Passarini, F., Caffarri, S., Croce, R., Bassi, R. Functional analysis of photosystem I light-harvesting complexes (Lhca) gene products of Chlamydomonas reinhardtii. Biochimica et biophysica acta. 1797 (2), 212-221 (2010).
- Remelli, R., Varotto, C., Sandonà, D., Croce, R., Bassi, R. Chlorophyll binding to monomeric light-harvesting complex. A mutation analysis of chromophore-binding residues. The Journal of biological chemistry. 274 (47), 33510-33521 (1999).
- Passarini, F., Wientjes, E., Hienerwadel, R., Croce, R. Molecular basis of light harvesting and photoprotection in CP24 unique features of the most recent antenna complex. The Journal of biological chemistry. 284 (43), 29536-29546 (2009).
- Giuffra, E., et al. Analysis of some optical properties of a native and reconstituted photosystem II antenna complex, CP29 pigment binding sites can be occupied by chlorophyll a or chlorophyll b and determine spectral forms. Biochemistry. 36 (42), 12984-12993 (1997).
- Pagano, A., Cinque, G., Bassi, R. In vitro reconstitution of the recombinant photosystem II light-harvesting complex CP24 and its spectroscopic characterization. The Journal of biological chemistry. 273 (27), 17154-17165 (1998).
- Kleima, F. J., et al. Decreasing the chlorophyll a/b ratio in reconstituted LHCII structural and functional consequences. Biochemistry. 38 (20), 6587-6596 (1999).
- Croce, R., Morosinotto, T., Castelletti, S., Breton, J., Bassi, R. The Lhca antenna complexes of higher plants photosystem I. Biochimica et biophysica acta. 1556 (1), 29-40 (2002).
- Hobe, S., Trostmann, I., Raunser, S., Paulsen, H. Assembly of the major light-harvesting chlorophyll-a/b complex Thermodynamics and kinetics of neoxanthin binding. The Journal of biological chemistry. 281 (35), 25156-25166 (2006).
- Croce, R., Weiss, S., Bassi, R. Carotenoid-binding sites of the major light-harvesting complex II of higher plants. The Journal of biological chemistry. 274 (42), 29613-29623 (1999).
- Hobe, S., Niemeier, H., Bender, A., Paulsen, H. Carotenoid binding sites in LHCIIb. Relative affinities towards major xanthophylls of higher plants. European journal of biochemistry / FEBS. 267 (2), 616-624 (2000).
- Jahns, P., Depka, B., Trebst, A. Xanthophyll cycle mutants from Chlamydomonas reinhardtii indicate a role for zeaxanthin in the D1 protein turnover. Plant Physiology and Biochemistry. 38 (5), 371-376 (2000).
- Wehner, A., Grasses, T., Jahns, P. De-epoxidation of violaxanthin in the minor antenna proteins of photosystemII, LHCB4, LHCB5, and LHCB6. The Journal of biological chemistry. 281 (31), 21924-21933 (2006).
- Croce, R., Canino, G., Ros, F., Bassi, R. Chromophore organization in the higher-plant photosystem II antenna protein CP26. Biochemistry. 41 (23), 7334-7343 (2002).
- Caffarri, S., Passarini, F., Bassi, R., Croce, R. A specific binding site for neoxanthin in the monomeric antenna proteins CP26 and CP29 of Photosystem II. FEBS letters. 581 (24), 4704-4710 (2007).
- Hobe, S., Förster, R., Klingler, J., Paulsen, H. N-proximal sequence motif in light-harvesting chlorophyll a/b-binding protein is essential for the trimerization of light-harvesting chlorophyll a/b complex. Biochemistry. 34 (32), 10224-10228 (1995).
- Kuttkat, A., Hartmann, A., Hobe, S., Paulsen, H. The C-terminal domain of light-harvesting chlorophyll-a/b-binding protein is involved in the stabilisation of trimeric light-harvesting complex. European journal of biochemistry / FEBS. 242 (2), 288-292 (1996).
- Rupprecht, J., Paulsen, H., Schmid, V. H. Protein domains required for formation of stable monomeric Lhca1- and Lhca4-complexes. Photosynthesis research. 63 (3), 217-224 (2000).
- Yang, C., et al. The negatively charged amino acids in the lumenal loop influence the pigment binding and conformation of the major light-harvesting chlorophyll a/b complex of photosystem II. Biochimica et biophysica acta. 1777 (11), 1463-1470 (2008).
- Rogl, H., Kühlbrandt, W. Mutant trimers of light-harvesting complex II exhibit altered pigment content and spectroscopic features. Biochemistry. 38 (49), 16214-16222 (1999).
- Yang, C., Kosemund, K., Cornet, C., Paulsen, H. Exchange of pigment-binding amino acids in light-harvesting chlorophyll a/b protein. Biochemistry. 38 (49), 16205-16213 (1999).
- Morosinotto, T., Castelletti, S., Breton, J., Bassi, R., Croce, R. Mutation analysis of Lhca1 antenna complex. Low energy absorption forms originate from pigment-pigment interactions. The Journal of biological chemistry. 277 (39), 36253-36261 (2002).
- Morosinotto, T., Breton, J., Bassi, R., Croce, R. The nature of a chlorophyll ligand in Lhca proteins determines the far red fluorescence emission typical of photosystem I. The Journal of biological chemistry. 278 (49), 49223-49229 (2003).
- Ballottari, M., Mozzo, M., Croce, R., Morosinotto, T., Bassi, R. Occupancy and functional architecture of the pigment binding sites of photosystem II antenna complex Lhcb5. The Journal of biological chemistry. 284 (12), 8103-8113 (2009).
- Croce, R., et al. Origin of the 701-nm fluorescence emission of the Lhca2 subunit of higher plant photosystem I. The Journal of biological chemistry. 279 (47), 48543-48549 (2004).
- Morosinotto, T., Mozzo, M., Bassi, R., Croce, R. Pigment-pigment interactions in Lhca4 antenna complex of higher plants photosystem I. The Journal of biological chemistry. 280 (21), 20612-20619 (2005).
- Mozzo, M., Morosinotto, T., Bassi, R., Croce, R. Probing the structure of Lhca3 by mutation analysis. Biochimica et biophysica acta. 1757 (12), 1607-1613 (2006).
- Mozzo, M., Passarini, F., Bassi, R., van Amerongen, H., Croce, R. Photoprotection in higher plants the putative quenching site is conserved in all outer light-harvesting complexes of photosystem II. Biochimica et biophysica acta. 1777 (10), 1263-1267 (2008).
- Wientjes, E., Roest, G., Croce, R. From red to blue to far-red in Lhca4 how does the protein modulate the spectral properties of the pigments. Biochimica et biophysica acta. 1817 (5), 711-717 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유