Method Article
Bitkiler ve Yeşil Alg Işık hasat Kompleksleri İn Vitro Sulandırma içinde
Bu Makalede
Özet
This protocol details the reconstitution of light-harvesting complexes in vitro. These integral membrane proteins coordinate chlorophylls and carotenoids and are responsible for harvesting light in higher plants and green algae.
Özet
Bitkiler ve yeşil algler, ışık, ışık hasat kompleksleri (LHCs), klorofiller ve karotenoidler koordinat bütün zar proteinlerinin, bir ailesi tarafından yakalanır. In vivo olarak, bu proteinler Tilakoid zarının eklenir kompleksler oluşturmak üzere pigmentler içeren katlanır kloroplastın. Birlikte kolayca izolasyonu sırasında pigmentler kaybedebilir gerçeği ile ailenin üyeleri, kimyasal ve fiziksel özellikleri, yüksek benzerlik, bir doğal halde saflaştırılması zor hale getirir. LHCs arasında homojen terkiplerinin elde edilmesi için alternatif bir yaklaşım, bu natif çok benzer özelliklere sahip kompleksler sonuçlanan saflaştırılmış pigmentler ve katlanmamış, apolar başlayarak bu in vitro kompleksleri tekrar oluşturmak için mümkün olduğunu gösterdi, 1987 1 Plumley ve Schmidt geliştirilmiştir kompleksleri. Bu in vitro bakteriyel eksprese edilen rekombinant proteinlerin kullanımına yol açtı (örneğin, pigment bağlama bölgeleri) veya protein domaini (örneğin protein-protein etkileşimi, katlama) rolü. Bu yöntem, çeşitli laboratuvarlarda optimize edilmiş ve ışık hasat kompleksi en uygulanmıştır. Burada açıklanan protokol, şu anda laboratuvarda kullanılan in vitro ışık hasat kompleksleri yeniden yapılandırma yöntemi ayrıntıları ve yöntem uygulamaları açıklayan örnekler verilmektedir.
Giriş
Bitki ve alglerin fotosentez cihazı integral membran (chl a) klorofil a bağlayan proteinleri b (chl b) ve karotenoidler (araba) bulunmaktadır. Bu pigment-protein kompleksleri hasat ışık enerjisi ve şarj ayırma 2 teşvik etmek için kullanılan reaksiyon merkezleri, bu uyarım enerji aktarmak aktiftir. Bunlar ayrıca, yüksek ışık hasarına 3,4 'den fotosentetik düzenek korumak düzenleyici geri besleme mekanizmalarının katılmaktadırlar. Işık hasat kompleksi (LHCs) bitkiler ve yosun 5 ilişkili proteinlerin büyük bir ailenin oluşmaktadır.
Ailenin her bir üyesinin öznel homojen saflaştırma komplekslerinin çok benzer kimyasal ve fiziksel özellikleri daha karmaşık hale gelmiştir. Buna ek olarak, saflaştırma işlemleri çoğu zaman, lipidler, pigment ya da başka yardımcı faktörler potansiyel kaybı ile sonuçlanabilir. In vitro yeniden oluşum Represents güçlü bir yöntem bu sorunların üstesinden gelmek için. Fotositem II'nin (BHÇ-II) ile bağlantılı LHC ilk araştırmacılar bitki kloroplast ayrı delipide protein ve pigment ekstre edilmiştir. 1987 1 Plumley ve Schmidt in vitro yeniden ve daha sonra lityum mevcudiyetinde pigmentler ile ısıyla denatüre proteini birleştirildi dondurma ve eritme 1 üç döngü izledi dodesil sülfat (LDS). Bunlar, yeniden oluşturulmuş LHC komplekslerinin spektral özellikleri bitkilerden arıtıldı kompleksleri çok benzer olduğunu gösterdi. Organizmalardan saflaştırılmış komplekslerini izole edilmesindeki güçlük, birlikte, bağlı bazı içsel kendi kendine bağlanma özelliği BHÇ pigment protein kompleksleri, muhtemelen yeniden yapılandırma kolaylığı, başka araştırmacılar tarafından, yöntemin pratik kabul edilmesine yol açmıştır. Escherichia coli (E. coli) aşın fotosentetik proteinlerin yeniden oluşturma 6 Paulsen 1990 ve meslektaşları tarafından elde edilmiştir. E'deE. coli, aşın zar proteinleri, genellikle, inklüzyon cisimcikleri içinde yer alır tesisleri için saflaştırma. Sulandırma, protein katlanmasını başlatır pigmentlerin ilave edildi LDS varlığında yeniden birleştirici protein içeren inklüzyon gövdelerinin yalıtılması, ısıl denatürasyonu ile elde edilir. LHCII kompleksinin katlanması, iki aşamalı bir işlemdir: ilk olarak, klorofil a 1 dakikadan daha az olarak bağlanmıştır; ikinci, klorofil b birkaç dakika 7 üzerine bağlanmış ve stabilize edilir.
Katlama dinamikleri ilişkin bilgi temin edilmesine ilave olarak, yer yönelimli mutagenez ile kombine tüpte yeniden spesifik amino asitlerin stabilitesi için önemlidir (örneğin, 8,9) ya da pigment koordinasyon tanımlanmasını sağladı (örneğin, 10). Böyle pigment kompozisyon ya da deterjan gibi parametreleri ayarlayarak tekrar katlama koşulları Manipülasyon da unsurları Critica belirledikBöyle LHCII kompleksi için Ksantofiller gereği olarak doğru katlanması, l (örneğin, 1,11). Buna ek olarak, komplekslerine bağlanmış bireysel pigmentlerin özelliklerinin incelenmesi, in vivo olarak yeniden kompleksleri kullanılarak mümkün olmuştur (örneğin, 10).
Burada açıklanan yöntem pigmentler izolasyonu (klorofil ve karotenoid) ıspanaktan ve yeşil deniz yosunu Chlamydomonas reinhardtii ile başlar. E. LHC proteinin ifadesi ve saflaştırılması inklüzyon cisimcikleri formunda Coli sonra Ni afinite kolonu ile LHC'in yeniden oluşturulması ve daha sonra, ardından arıtma için, ayrıntılı olarak verilmiştir. Son aşamada, yeniden oluşturulmuş kompleksleri ayrıca serbest pigmentler ve katlanmamış apoprotein kaldırmak için sukroz gradyanlı santrifüjleme vasıtasıyla saflandırılır. Bu protokol üzerinde farklı laboratuvarlar tarafından tanıtıldı çeşitli değişiklikler içeren bir optimize prosedürünü temsilzaman 1,6,10,12 -14.
Protokol
Ispanak Yapraklarından 1. Toplam Pigment Ekstraksiyon
- Öğütme soğuk tampon 100 ml ıspanak yaprağı (~ 20 g), homojen bir avuç 20 saniye boyunca bir karıştırıcı kullanılarak (Tablo 1 e bakınız).
- 4 ° C'de 10 dakika boyunca 1500 x g'de 20 um ve santrifüj filtre ürünü bir gözenek çapına sahip naylon kumaş iki katmanı boyunca solüsyonu filtre.
- Yumuşak bir sanatçı ile kloroplast içeren topak soğutulmuş Yıkama Tamponu, 1 ml boya fırçası süspanse (Tablo 1 e bakınız). Topak tekrar askıda bırakılmıştır sonra, 4 ° C'de 10 dakika boyunca 10,000 x g'de santrifüj Yıkama Tamponu ve 50 ml solüsyon ilave edin.
- Yıkama Tamponu 50 ml pelet (tilakoidler) tekrar süspansiyon yavaşça Süpernatantı ve (Tablo 1 e bakınız).
- 4 ° C'de 10 dakika boyunca 10,000 x g'de santrifüj ve çözelti tamamen supernatant çıkarın. Bu noktada, boya oksidasyonu önlemek için karanlıkta aşağıdaki adımları gerçekleştirmek.
- Na 2 CO 3 ile tamponlanmış% 80 aseton, 20 ml pigmentleri elde etmek için (Tablo 1 e bakınız) ~ ekleyin. Bazen vorteks, 10 dakika boyunca buz üzerinde çözeltisi bırakın.
- 4 ° C'de 15 dakika boyunca 12,000 x g'de santrifüj ile hücresel bileşenlerini Pelet.
Not: pigmentler tamamen ekstre değil ise, topak yeşil bir renge sahip olabilir ve 1,6 tekrar edilmelidir adım olacaktır. - Bir ayırma hunisi içine supernatant toplamak. Dietiletere 0.4 birimler eklemek şiddetle sarsmak ve gazın boşaltılması vanasını açın.
- 0.33 M NaCl 0.8 hacimlerini ekleyin ve kuvvetlice karıştırın. Fazların ayrılması için ~ 10 dakika bekleyin. Üst Eter fazı ekstre pigmentler içerir. Berrak bir alt faz çıkarın.
Not: Ayırma açık değilse, dondurma ve faz ayrışmasını geliştirmek için bir çözüm eritin. - Uygun bir cam kap içine, ayırıcı bir huniye üstten dökülerek eter çıkarın. Gran bir kaşık ekleyerek Kurunitlerin susuz sodyum sülfat. Çözeltisi girdap ve eterden su absorbe kurutucu için ~ 5 dakika izin verir.
NOT: sodyum sülfat tamamen kümeleştiler görünüyorsa bu adımı tekrarlayın; Eter yeterince kurutulur, bazı serbest yüzen kristaller olmalıdır. Bir su tabakası oluşması durumunda, ilave susuz sodyum sülfat ilave edilmeden önce bir yeniden süspanse ile çıkarın. - Arkasından, sodyum sülfat katı bırakarak yeni bir cam kaba eter süzün.
- Döner bir speedvac ya da N2 akışı altında eter buharlaştırın.
- % 100 aseton, 10 ml tamamen pigmentler çözülür.
- % 80 aseton, 1 ml içine az miktarda (~ 3 ul) seyreltin ve soğurma spektrumunu ölçmek ve Porra ve arkadaşları tarafından tarif edilen yöntem ile Chl a / b oranı ve Chl konsantrasyonunu belirler. (1989) 15.
- Aseton kadar kısım ve döner bir speedvac ya da N2 akışı altında kuru pigmentlertamamen buharlaştırıldı. -80 ° C de kurutuldu pigmentler saklayın.
Ispanak gelen Karotenoidler 2. Ekstraksiyon
- Adımları 1,1-1,5 izleyin. Bu noktada, boya oksidasyonu önlemek için karanlıkta aşağıdaki adımları gerçekleştirmek.
- Pigmentleri elde etmek için, Na 2 CO 3 (Tablo 1 e bakınız) ile tamponlanmış ~ 50 ml% 96 etanol içinde Tilakoid pelletini. 5 dakika boyunca buz üzerinde çözeltisi bırakın.
- 4 ° C'de 15 dakika boyunca 12,000 x g'de santrifüj ile hücresel bileşenlerini Pelet.
Not: pigmentler tamamen ekstre değil ise, topak yeşil bir renge sahip olabilir ve 2,2 tekrar edilmelidir adım olacaktır. - Supernatant toplamak ve (w / v) sabunlaştırılmasını başlatmak için% 80 KOH ve 0.1 hacim ekleyin.
- 4 ° CO / N de çözümü bırakın, sıkıca kapatılmış ve ışıktan korunmalıdır.
- Bir ayırma hunisi içine çözeltisi toplayın. Dietil eter 1 hacim ekleyin ve hafifçe karıştırın.
- 0.8 vol Ekle0.33 M NaCl Umes ve hafifçe karıştırın. Fazların ayrılması için ~ 10 dakika bekleyin. Üstünde turuncu eter fazı sabunlaştırılmış karotenoidler içerir. Huninin vana içinden boşaltılmasını tarafından yeşil alt faz çıkarın.
- 3 hacim su ilave edin ve potasyum hidroksit çıkarmak için yavaşça karıştırın. Katmanlar ayrılmaya bırakılır. Not: üst faz bulutlu görünürse, NaCI, az miktarda ilave (örneğin, 3 çözeltisi 200 ml NaCI g) ve yavaşça girdap eritin.
- Huninin vana ile süzülmesiyle alt faz çıkarın.
- Takip 1,10-1,13 adımları.
- % 80 aseton, 1 ml içine az miktarda (~ 3 ul) seyreltin ve% 80 aseton içinde 440 nm'deki absorpsiyon spektrumları ölçer. Konsantrasyonunu belirlemek için, karotenoidler için ortalama yok olma katsayısı kullanılan aşağıdaki formül 16 (440 ε = 255): Araba [mg / ml] = (Abs, 440 nm / 225) x 11 (optik yol) = 1 cm.
- Kısım ve kuru carotenoibir speedvac veya tüm dietileter kadar N2 akışı altında buharlaştırılmıştır DS edilmiştir. -80 ° C de kurutuldu pigmentler saklayın.
Chlamydomonas 3. Toplam Pigment ve Karotenoit Ekstraksiyon reinhardtiinin
- C büyütün yüzey üzerine sıvı kültür az miktarda yayılması ile bir petri çanağı içinde katı ortam TAP 17 reinhardtii. 20 ľmol fotoğraflar PSA m -2 sn sürekli aydınlatma akı altında büyümeye -1 hücre yeşil tabaka görünür oluncaya kadar.
- Steril bir aşılama döngü kullanılarak C arasında bir miktar hasat Katı TAP ortamından reinhardtii bir 1 L şişe TAP ortamı 17 500 ml hücreleri koydu. 20 umol m-2 resimleri, PSA sn'lik bir sürekli aydınlatma akışı altında 170 rpm'de çalkalanarak 25 ° C'de kültür büyütün -1.
- 5-6 gün sonra, kültür logaritmik fazın sonuna ulaşmalıdır (6 x 10 6 hücre / mLya da 750 nm'de optik yoğunluk 2-2.5). 4 ° C'de 15 dakika boyunca 4000 x g'de santrifüje kültürü.
- Toplam pigment çıkarımı için, adımları 1,6-1,15 izleyin.
- C. tam büyüme kültürü 500 ml başlayarak toplam pigment ekstresinin verim reinhardtii + b / mL, 0.5 mg a CHL bir konsantrasyon ile çözelti yaklaşık 5 ml'dir.
- Karotenoidler çıkarımı için, adımları 2,2-2,12 izleyin.
İçerme Kuruluşlarının 4. saflaştırılması
- Standart moleküler biyoloji prosedürleri kullanılarak bir kaynaşmış bir C-terminal His etiketi ile sonuçlanan bir ekspresyon vektörü içine ilgi LHC'in proteininin kodlama dizisi klonu. E. içine bu yapı Dönüşümü örneğin, BL21 (DE3) gibi E.coli host suşu.
- Hazırlama Liziz tamponu, deterjan tamponu, Triton tamponu TE (Tablo 1), 1 M izopropil β-D-1-tiogalaktopiranosid (IPTG) ile, uygun antibiyotik ile LB ortamı 18.
- Bir SINGL seçinE E. Standart prosedürler kullanılarak, uygun 6 antibiyotiklerle LB ortamının ~ 5 ml yeni boyanmış bir plakaya ekspresyon klonu içeren E. coli kolonisi. En az 16 saat boyunca 220 rpm'de çalkalanarak 37 ° C'de büyütülmüştür.
- O 2.5 ml /, uygun antibiyotik ile takviye edilmiş LB 250 ml bir 1 L'lik Erlenmeyen şişesi içine K kültürü.
- 2-3 saat boyunca hücrelerin büyümesine 220 rpm'de 37 ° C'de (ya da O.D. oluşana kadar 600 ~ 0.6).
- 1 mM'lik nihai bir konsantrasyona kadar IPTG ilave edin. 220 rpm'de 3-4 saat 37 ° C'de hücreler büyümeye devam etmektedir.
- Önceden tartılmış bir santrifüj tüpüne 4 ° C'de 5000 x g'de 10 dakika boyunca santrifüj kültür. Iyice Süpernatantı atın ve yeniden tartma ve santrifüj tüpü ağırlığı çıkarılarak ağırlık pelet belirler.
- E. süspanse 0.8 ml / güçlü döndürülerek liziz tamponu g E. coli hücre topağı.
Not: Alternatif olarak, hücre topağı -80 ° C'de dondurulabilirDaha sonra kullanılmak üzere ° C. Dondurulmuş bir pelet ile başlanırsa, liziz tamponu ilave edilmeden önce tam olarak çözünmesine izin. - Hücrelerin gramı başına 2 mg lisozim ekleyin ve 30 dakika boyunca arada sırada burgaç gibi ıslak buz üzerinde inkübe edilir.
- 20 ug / ml DNAz, 10 mM MgCl2, 1 mM NaCI, 20 ug / ml RNAse ekleyin. Karıştırın ve 30 dakika için buz üzerine yerleştirilmiştir.
- Hücre gramı başına soğuk Deterjan tampon maddesinin 2 ml ilave edilir. İyice karıştırın ve 5 dakika boyunca oda tutun.
- 2 ml santrifüj tüplerine transfer (gerekirse iki tüp içine bölünmüş). 4 ° C'de 12,000 x g'de 10 dakika boyunca santrifüje cisimciği: pelet.
- Tampon soğuk Triton 1 ml ekleyin ve tamamen sonification tarafından pelet (20 sn aralıklarla 3 bakliyat x 5 sn x% 50 güç) tekrar süspansiyon. NOT: sonification sırasında soğuk tutmak için buzlu su ile çevrili küçük bir beher tüp var. Birden fazla tüp durumunda, yeniden süspansiyon haline getirilmesi sonra bir tüp içine yeniden süspansiyon haline getirilmiş cisimciği birleştirir.
- 12,000 10 dakika boyunca santrifüj4 ° C'de xg cisimciği: pelet.
- Adımı tekrarlayın 4.13 ve 4.14 iki kez.
- Triton tampon kaldırmak için bir yıkama için sonifikasyon soğuk TE 1 ml cisimciği yeniden süspanse edin. 4 ° C'de 12,000 x g'de 10 dakika boyunca santrifüje cisimciği: pelet.
- Sonifikasyon soğuk TE 1 ml pelletini.
- Bu Bradford tahlili 19 gibi standart yöntemler ile protein konsantrasyonu değerlendirin. -20 ° C'de saklayın inklüzyon cisimleri alikotları.
5. Sulandırma
Absorbans Qy bölgesine (600-750 nm) olarak ölçülür, bu protokol, genellikle 4 OD'ye ile yeniden protein 1-2 ml verir. Bakım işlemi sırasında uygun oranlarının muhafaza edilmesi için gereken miktarı, ancak, istendiği gibi ayarlanabilir.
- 2x Sulandırma Tamponu,% 20 RG, 2M KCI, TE, Tablo 1 'de tarif edildiği gibi aşağıdaki çözümleri hazırlayın. Aşağıdaki s gerçekleştirinloş ışıkta Teps'in.
- 2 ml mikrofuge'de tüp 400 ul TE toplam LHC Eklenmesi Organları 800 mikrogram süspanse. 2x Sulandırma Tampon ve vorteks kısaca 400 ul ekleyin.
- 10 mM'lik bir son konsantrasyon için β-merkaptoetanol (14.8 M stok), 0.6 ul ekleyin. 98 ° C'de 1 dakika boyunca proteini ısıtın. 3 dakika boyunca oda sıcaklığında Vortex kısa ve yer.
- 1-2 dakika boyunca kuvvetli bir şekilde bir banyo sonikatörü içinde 1 dakika ya da bir yer girdaplanarak 30 ul% 100 EtOH toplam kurutulmuş klorofil pigmentlerin 500 ug ve 80 ug karotenoid pigmentler yeniden süspanse edin.
- 4 ° C'de 15,800 xg ~ 30 sn pigment karışımı Spin ve hiçbir pelet olduğunu onaylayın. Pelet varsa, vorteksleme ve / veya sonifikasyon tekrarlayın. ÖNEMLİ: yeniden süspansiyon ve spin sonra, hemen proteine pigment eklemek veya toparlayıp tekrar yeniden süspanse gerekecektir.
- Vorteks edilirken yavaşça soğutuldu proteine pigment karışımı ekleyin. Girdabına 5-10 s DevamIslak buz üzerinde ec ve yer tüpü. Protein tüpün üst taşabilir de dinç bir şekilde vorteks için dikkatli olun.
- % 20 Octyl β-D-glukopiranozide (OG) (son konsantrasyon% 2), vorteks kısaca 94 ul ekleyin ve buz 10 dakika devam.
- Kısaca M KCI 2 (nihai konsantrasyon 150-200 mM) girdap 90 ul ilave edin ve 20 dakika buz üzerinde tutun. NOT: kolon hazırlama (Bölüm 6) şu anda başlatılabilir.
- 4 ° C'de 15,800 x g'de 10 dakika boyunca spin. 10 ml tüp (LDS çöktürülmüş) pelet bozmadan süpernatantı. Soğuk ve ışıktan korumalı tutun.
6. Nikel Kolonu Saflaştırması
- RG tamponu, RG durulama tamponu Ayrıştırma Tamponu: Tablo 1 de tarif edildiği gibi aşağıdaki çözümleri hazırlayın.
- Bu aşama hava ve aşağıdaki aşamaları esnasında, kolonun iç alır sağlayan bir peristaltik pompa, bir Ni-Sefaroz sütunu (1 mi) ya da eşdeğer bağlayın.
- T hızını ayarlamaO, 1 ml / dak pompa ve depolama çözeltinin çıkarılması için su ile 5-10 ml sütunu yıkayın.
- OG tamponu 3-4 ml sütun dengelenmesi.
- Kolona protein örnek ve yük OG tampon 3-4 ml ilave edilir. Not: protein LDS çıkarılmasından sonra daha uzun bir süre 10 dakika boyunca buz üzerinde kuluçka süresi edilmiş ise 1 dakika ilave LDS çökelmesini kaldırmak için, 4 ° C'de 15,800 x g hızında tekrar dönerler.
- OG tamponu, 5 ml ile sütun durulayın.
- RG durulama tamponu 2 ml ile sütun durulayın.
- 3 mi tampon maddesi ile bağlanmış proteininin elüt edilmesi. Yeniden oluşturulmuş protein içeren yeşil eluteye toplayın. NOT: Bu genellikle toplam olarak yaklaşık 1 ml olmuştur.
7. Sükroz Gradyan Santrifüjü Geri
- Sakroz çözeltisi,% 0.06 β-DM 0.01 M HEPES, pH 7.6: Tablo 1 de tarif edildiği gibi aşağıdaki çözümleri hazırlayın.
- -20 ° CO / N o da sukroz çözeltisi ve dondurulması ile ultrasantrifüjdeki tüpleri doldurmakR, -80 ° C'de en az 1 saat.
- Dondurucudan tüp çıkarın ve 4 ° C'de dokunulmadan çözülme sağlar. Not: donma / çözülme işlemi 0.1 ila 1 M sukroz ile bir gradyan oluşturur. Bir 15 ml tüp, tipik olarak yaklaşık 3 saat içinde çözülür.
- Dikkatli bir şekilde üst aşama 6.8 'de nikel Sefaroz sütunundan elüt yeşil fraksiyon olarak aynı hacimde çıkarın. Daha sonra gradyanı rahatsız etmemek için yavaş yavaş üstüne yeniden örnek yüklemek.
- Hızlanma ve fren olmayan durdurma yavaşlaması, 18 saat boyunca, SW-41 ya da SW-60 sallanan kepçeli rotor kullanılarak bir ultrasantrifüjdeki Tüpleri dengeleyin, ve 4 ° C sıcaklıkta 200,000 x g'de santrifüj.
- Dikkatlice forseps ile tüp sahibinden degrade çıkar. Üst kısmını toplamak için bir kör deliğe sahiptir uzun bir iğne ile bir şırınga kullanın. Not: Alternatif olarak, bir iğne ile delme ve tüp damla toplayarak alttan fraksiyonlarım toplamak.
Sonuçlar
Bu protokol, in vitro chorophyll a / b bağlayıcı protein tekrar oluşturmak için bir yöntem göstermektedir. Bu teknik, bitki ya da yosun ekstre bu pigment protein, bir heterolog sistemde aşırı ekspresyonu ile elde edilebilir apoprotein başlayarak in vitro kompleksleri ve pigmentlerin katlanmasına izin verir. Sulandırıldıktan sonra tekrar katlanmış protein kompleksi pigment pigmentler fazla iki adımda katlanmamış apoprotein saflaştırılır. İlk adım, (Şekil 1 AB) bağlanmamış pigmentlerin büyük bir kısmının bertaraf edilmesine imkan sağladığı proteinin C-terminalinde His-etiketinin varlığına dayanmaktadır. Ikinci bir saflaştırma aşaması olarak, katlanmamış protein çoğunlukla yeniden proteini içeren yeşil bir bant daha yavaş göç sükroz yoğunluklu santrifüjleme (Şekil 2) kullanılmaktadır. In vitro yeniden kurulması amacı, aynı uygun kompleksler elde etmektiryerli olanlar gibi kravatlar. Bu sonucu göstermek için, bir in vivo ışık hasat kompleksi spektroskopik özellikleri in vitro 13,20,21 içinde yeniden aynı LHC kompleksi ile karşılaştırılır. Görünür aralık (350 nm ve 750 nm) 'de LHCs absorbsiyon spektrumu, pigment ortamına yanı sıra kompleks pigment bileşimine bağlı (protein içeren) ve bu nedenle de kalite kontrol etmek için hassas bir araçtır Yeniden oluşturma. Şekil 3, CP24 emilim spektrumunda bir klorofil a / b, in vitro yeniden Arabidopsis thaliana, ikinci protein bağlama Arabidopsis tilakoidler 21 aynı kompleks saflaştırılmış spektrumu ile karşılaştırılır. Spektrumları olarak, kı ve (tepe 671/439 nm'de) Chl arasında Soret geçiş ve Chl b (649/466 nm tepe değeri) görmek mümkündür. Yerli ve yeniden kompleksleri aynı abso göstermekbir hemen hemen aynı bir pigment bileşimi ve organizasyonunu gösteren rption spektrumu. Floresans spektroskopisi yeniden kompleksinin kalitesini değerlendirmek için kullanılabilir. Floresans emisyon spektrumları tercihen farklı pigmentlerin heyecanlandırmak farklı dalga boylarında uyarım üzerine ölçülür: Chl bir 440 nm, Chl 475 nm b ve 500 nm'de Ksantofiller de. Doğru bir şekilde katlanmış bir protein kompleksi içinde pigment, Chl B ve ksantofiller birkaç piko içinde esas Chl a kendi uyarım enerji transferi ve floresan, aynı şekilde ve azami her üç uyarım ile tek bir tepe noktası ile sonuçlanan, termal dengeye sistemden kaynaklanır dalga boyu (Şekil 4A-B). Proteine koordine olmayan B Chl mevcudiyeti, 475 nm eksitasyon (Şekil 4C) üzerine 650 nm civarında ilave bir tepe ya da omuz tarafından kabul edilebilir. Serbest Chl varlığı yerine açar440 nm uyarım üzerine, esasen 675 nm, emisyon etrafında ek. 475 yeniden hem nm'de uyarma ve doğal CP24 kompleksleri (Şekil 4D) üzerine floresans emisyon spektrumu yeniden oluşturulmuş bir kompleksi doğru katlanmış gösteren 681 nm, tek bir pik gösterir. Pigment-protein kompleksi doğru yeniden bir ek onay dairesel dikroizm (CD) ölçümleri geliyor. Görülebilir bölgedeki CD sinyali pigmentleri arasında Eksitonik etkileşimlerine bağlıdır ve bu nedenle de 22 kromoforların organizasyonunda hatta küçük değişikliklere karşı çok hassastır. Tipik parmak izi zirvelerde ile yeniden kurulmuş ve doğal CP24 CD spektrumunu göstermektedir Şekil 5 681 nm, 650 nm ve 481 nm olarak ölçülmüştür. Sonuç olarak, doğal spektroskopik özellikleri ile yeniden CP24 bu yeniden oluşturma işlemi verimler doğal benzeri kompleksleri Suita teyit arasındaki yüksek benzerlik ışık hasat proteinlerin in vitro çalışma için ble.
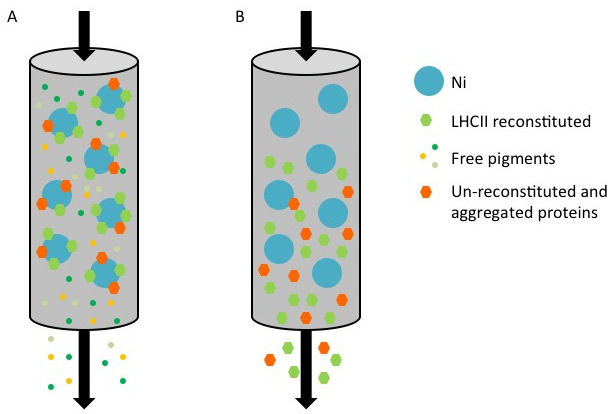
, Bir nikel kolonu kullanılarak bir His etiketi rekombinant proteinlerin BHÇ saflaştırma gösterimi Şekil 1. (A). Her ikisi de yeniden kompleksleri (yeşil altıgen) ve BM-yeniden / toplu proteini, saflaştırılması, His-etiketli protein sırasında, (turuncu Bağlanmamış pigmentler (küçük renkli noktalar) akmaya devam altıgen), Ni-Sefaroz (lekesi) yüzeyine bağlanmıştır. (B) sütunu elüsyon tamponu imidazol ihtiva ile yıkandığında, tekrar oluşturulmuş ve BM-yeniden proteinler akış içinde toplanır.
hres.jpg "width =" 500 "/>
Yeniden LHCII Şekil 2. sukroz gradyanlı nikel kolonu ile konsantre edildi. Yeniden kompleksler yoğunluk gradyanı ile serbest pigment ayrılır. Koyu yeşil bant yeniden oluşturulmuş LHCII temsil eder ve soluk yeşil arka serbest pigmentlerden meydana gelmiştir.
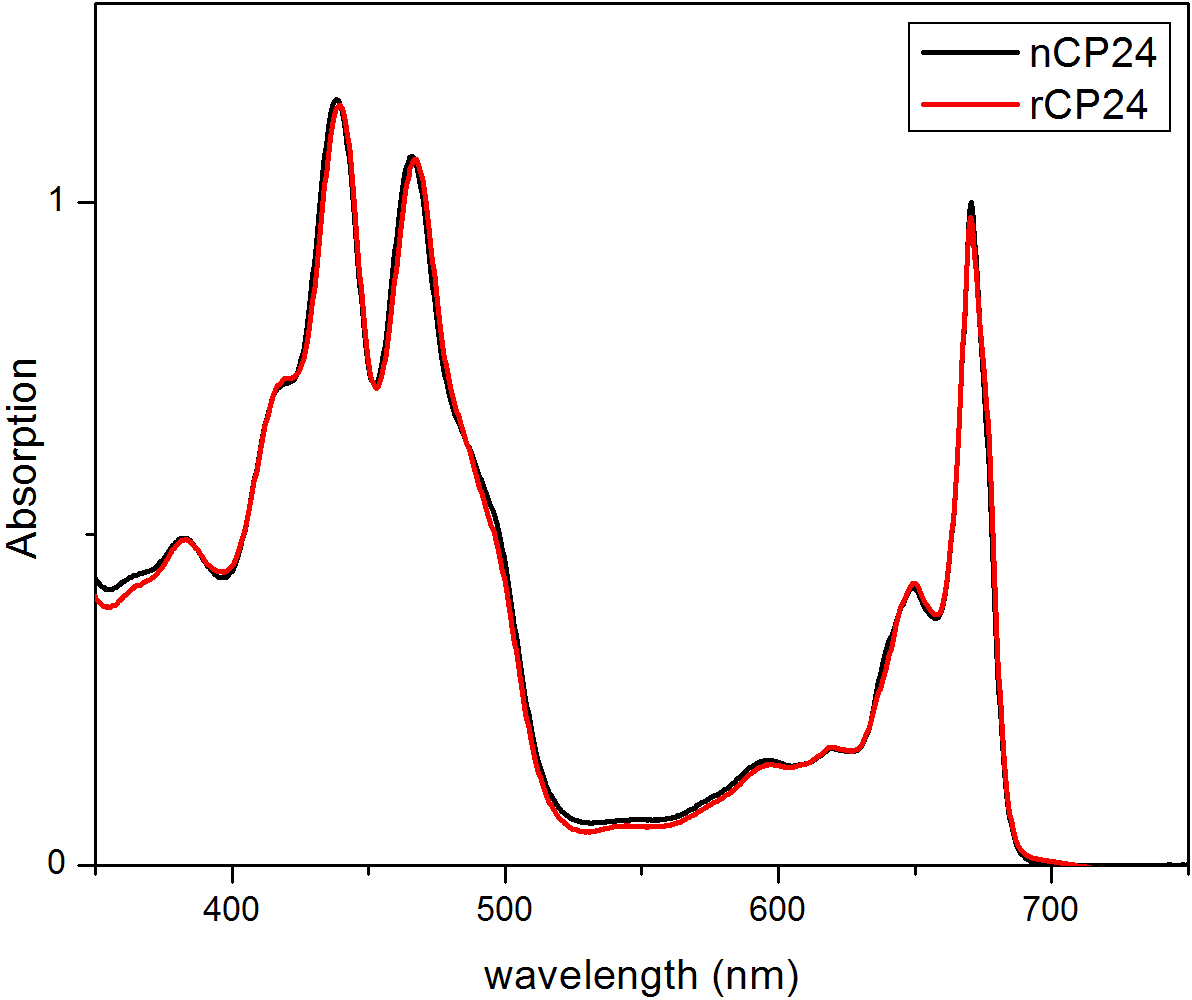
Yeniden proteini CP24 (rCP24, kırmızı çizgi) ve Arabidopsis thaliana'dan izole edilen doğal bir (nCP24, siyah çizgi) Şekil 3. absorpsiyon spektrumları. Her iki grafik olarak, kı ve Chl a Soret geçiş yönü (tepe noktalar kabul etmek mümkündür 671/439 nm) ve b Chl (649/466 nm tepe değeri) uygulanır. Bu rakam Passarini et al modifiye edilmiştir. 2014 21.
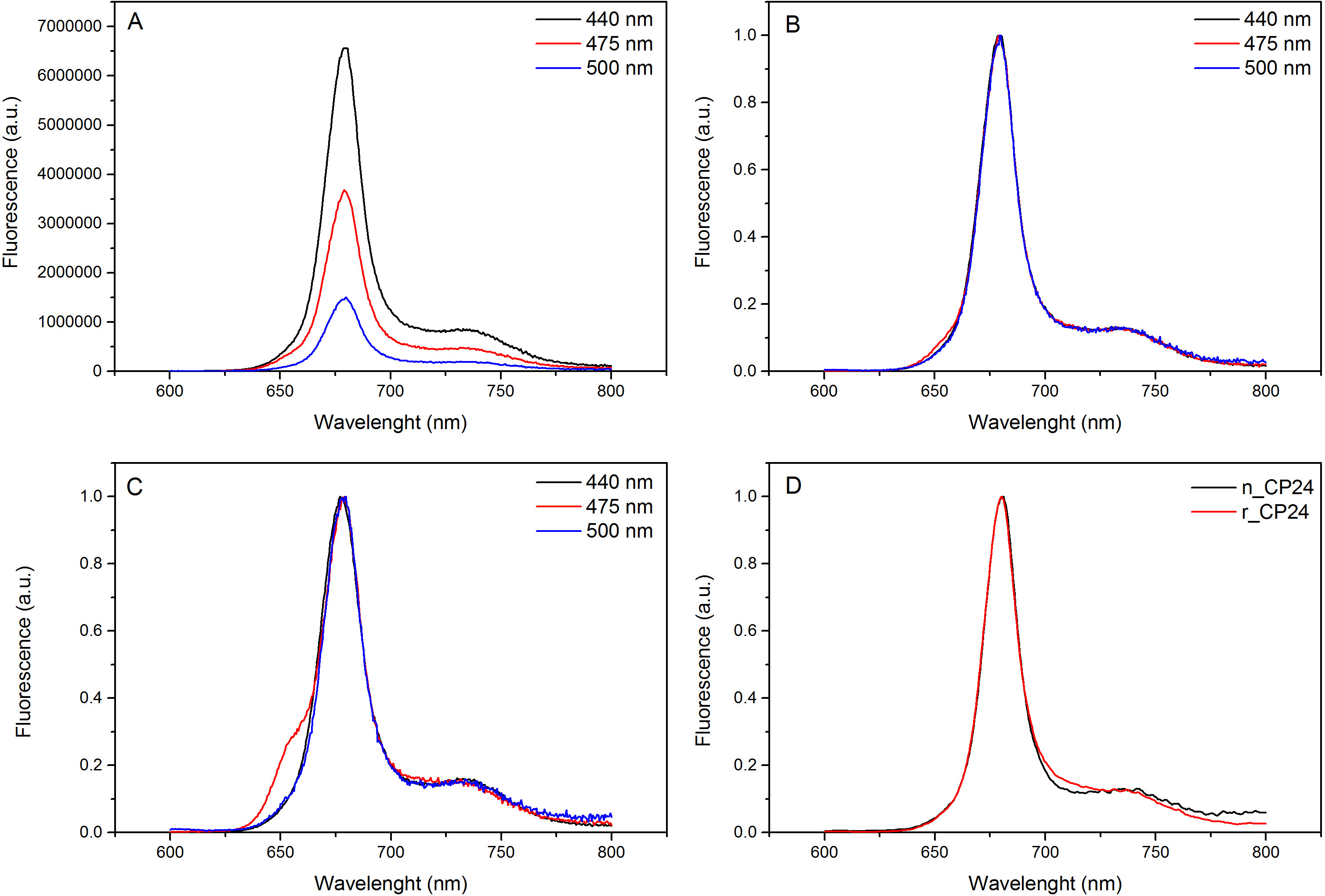
Şekil 4. floresans emisyon. Bir CHL için Chl b ve Xanthophyls verimli enerji transferi gösterilen maksimum (B) yeniden CP24 vahşi tipli kompleksi (A) ve normalize floresans emisyon spektrumu. Yeniden CP24 (rCP24) ve Arabidopsis thaliana'dan izole (nCP24) yerli kompleksi (C) Floresan emisyon spektrumları. Spektrumları tepe (D) maksimum normalleştirilmiş. , bu rakamın büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
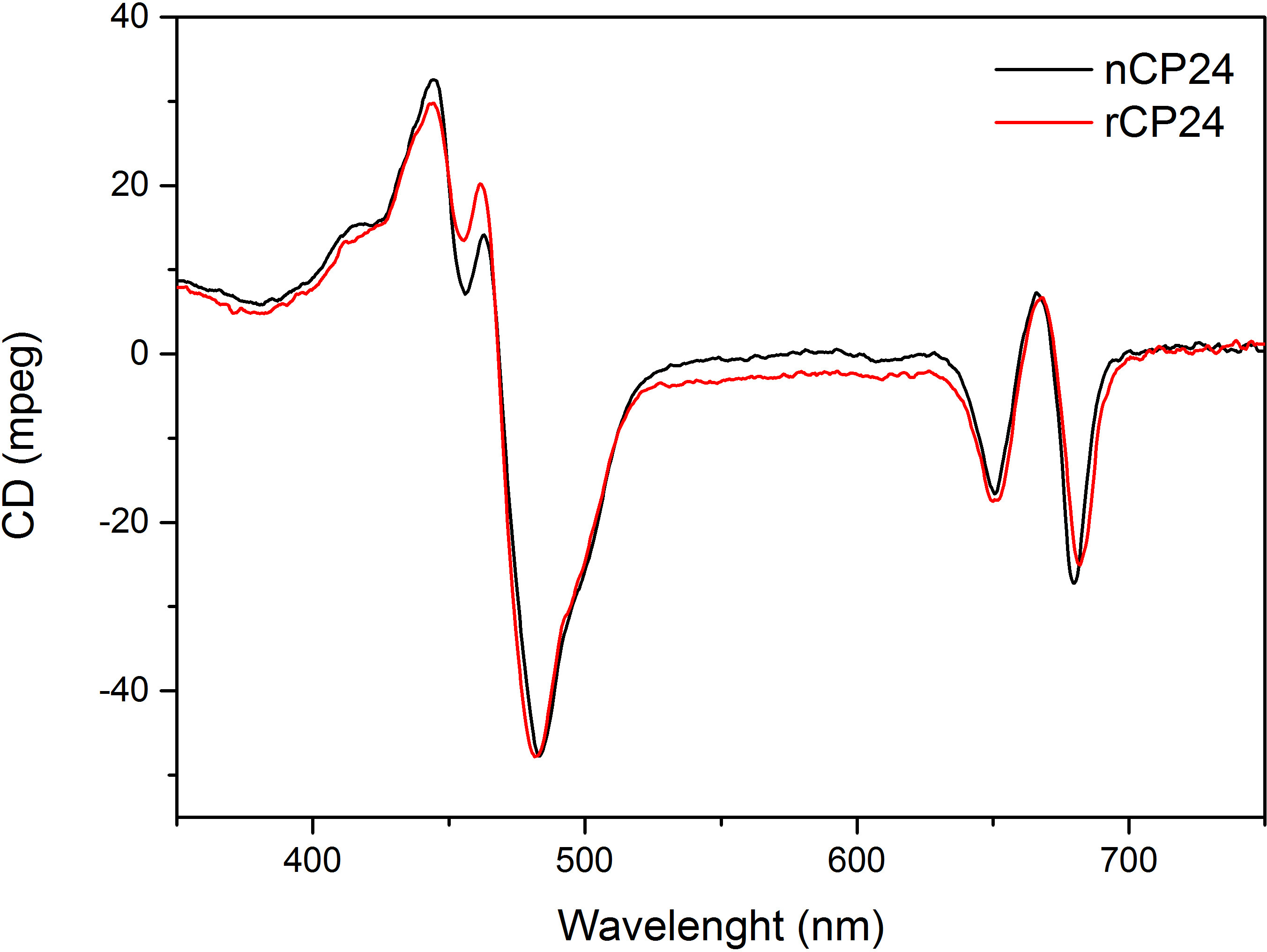
Şekil 5. Dairesel Dikroizm Spektrumu. Sulandırılmış CP24 (rCP24, kırmızı çizgi) ve Arabidopsis thaliana'dan izole edilen doğal kompleksi (nCP24, siyah çizgi) çok benzer spektrumlarını göstermektedir.

CP29 vahşi tip (CP29_WT) ve mutasyona uğramış CP29 (CP29_A2) Şekil 6. absorpsiyon spektrumları. Yeşil hat iki parsel arasındaki farkları gösterir.
| Bütün tamponlar, 4 ° C'de saklanabilir. | |||
| Bileşenleri | Final Konsantrasyon | Ek notlar | |
| Taşlama Tampon | Sorbitol | 0.4 M | |
| Trişin | 0.1M | pH 7.8 | |
| NaCl | 10 mM | ||
| MgCI2 | 5mM | ||
| Süt Tozu | % 0.5 a / h | ||
| Yıkama Tampon | Sorbitol | 50 mM | |
| Trişin | 5mM | pH 7.8 | |
| EDTA | 10 mM | pH değeri 8 | |
| Liziz Tamponu | Tris | 50 mM | pH değeri 8 |
| Sukroz | % 2.5 a / h | ||
| EDTA | 1mM | pH değeri 8 | |
| Deterjan tampon | NaCl | 200 mM NaCI | |
| Deoksikolik asit | % 1 w / v | ||
| Nonidet P-40 | % 1 w / v | ||
| Tris | 20 mM | pH 7.5 | |
| EDTA | 2mM | pH değeri 8 | |
| beta-Merkaptoetanol | 10 mM | ||
| Triton tampon | Triton X-100 | % 0.5 a / h | |
| Tris | 20 mM | pH 7.5 | |
| beta-Merkaptoetanol | 1mM | ||
| Tampon TE | Tris | 50 mM | pH değeri 8 |
| EDTA | 1mM | pH değeri 8 | |
| Sulandırma Tampon | Hepes | 200 mM | |
| Sukroz | % 5 w / v | ||
| Lithiumdodecylsulfate (LDS) | % 4 a / h | ||
| Benzamidin | 2mM | ||
| Aminokaproik Asit | 10 mM | ||
| OG Tampon | Oktilglükosid | % 1 w / v | |
| % 12.5 w / v | |||
| NaCl | 0.2 M | ||
| Hepes | 20 mM | ||
| Imidazol | 10 mM | ||
| OG durulayın Tampon | n-dodesil-p-D-maltozit (β-DM) | % 0.06 w / v | |
| Hepes | 40 mM | pH değeri 7,5-9 | |
| NaCl | 0.2 M | ||
| Elüsyon Tamponu | Imidazol | 0.5M | |
| n-dodesil-p-D-maltozit (β-DM) | % 0.06 w / v | ||
| Hepes | 40 mM | pH değeri 8 | |
| NaCl | 0.2 M | ||
| Sukroz çözeltisi | Sukroz | % 20 w / v | |
| n-dodesil-p-D-maltozit (β-DM) | % 0.06 w / v | ||
| Hepes | 0.01 M | pH 7.6 | |
| Aseton% 80 sodyum karbonat ile tamponlanmış | Aseton | % 80 h / h | |
| Sodyum Karbonat | 1 M | ||
| Sodyum Karbonat ile tamponlanmış% 96 Etanol | Etanol | % 96 h / h | |
| Sodyum Karbonat | 1 M | ||
Bu protokolde kullanılan tamponlar ve çözümleri Tablo 1. listesi.
rCP26| ChlA a / b karışımı | ChlA a / b | Chl a | Chl b | Neo | Viola | Lute | Chl tot | Chl / Araç | |
| nCP26 | - | 2.2 ± 0.05 | 6.2 | 2.8 | 0.61 | 0.38 | 1.02 | 9 | 4.5 ± 0.1 |
| rCP26 | 8 | 2.71 ± 0.05 | 6.57 | 2.43 | 0.72 | 0.32 | 0.97 | 3.9 ± 0.04 | |
| rCP26 | 5.5 | 2.25 ± 0.05 | 6.23 | 2.77 | 0.77 | 0.3 | 0.96 | 9 | 4.0 ± 0.1 |
| rCP26 | 3 | 2.08 ± 0.04 | 6.08 | 2.92 | 0.76 | 0.3 | 1.04 | 9 | 4.1 ± 0.1 |
| rCP26 | 1 | 1.7 ± 0.05 | 5.7 | 3.3 | 0.7 | 0.3 | 0.9 | 9 | 4.3 ± 0.05 |
| rCP26 | 0.3 | 1.11 ± 0.04 | 4.7 | 4.28 | 0.7 | 0.3 | 0.9 | 9 | 4.2 ± 0.2 |
| 0.05 | 0.23 ± 0.01 | 1.4 | 5.6 | 0.58 | 0.24 | 1.11 | 7 | 3.1 ± 0.06 | |
| rCP26 | <0.01 | 0.11 ± 0.01 | 0.7 | 6,3 | 0.64 | 0.3 | 1.08 | 7 | 3.06 ± 0.06 |
CP26 yerli Tablo 2. Pigment içeriği karmaşık farklı Chl a / b Oranlarının 39 ile yeniden protein pigment kompleksleri ile karşılaştırıldığında.
Tartışmalar
Membran proteinleri çalışmak çok kolay değil. Doğal zar proteinlerinin izolasyonu protein zarar verebilir ve temel kofaktör kaldırmak deterjanlarla lipid çift katmanından çözündürülmesi için ihtiyacı karmaşık hale gelir. Bu proteinler ayrıca biyolojik zarların düşük seviyelerde mevcut olabilir, ya da zor tek komplekslerinin saflaştırılması kılan hafif hasat kompleks durumunda olduğu gibi, yakın ilişkili proteinler ile karıştırılabilir. E. coli 'de heterolog protein ekspresyonu E. coli ve in vitro yeniden yapımında Bu sorunları önlemek için imkanı sunar. in vitro homojenliğe 24 saflaştırılarak edilemez kompleksleri incelemek için kullanılabilir doğal kompleksleri 20,21,23 ve dolayısıyla çok benzer özelliklere sahip kompleksleri sulandırılması ve katlanmış proteinler, sonuç saflaştırılması - 27.
Bu yöntem attainab kolaylıkla, ıspanak, kullanırtoplam pigment ve karotenoid hazırlıkları için bir kaynak olarak le yıl boyunca,. Yosunlar için nativ proteinlerin bazı reconstitutions, yosunlar saflaştırılmış pigmentlerin kullanılması nedeniyle farklı pigment bileşimler tercih edilir. Chl a / b oranı ve Chl / otomobil oranı ne olursa olsun, pigment kaynağı aynı kalır.
Bu sulandırma verimliliği genellikle% 35 civarındadır 28 olduğunu fark etmek önemlidir. Bu nedenle, yeniden oluşumun ardından çözeltiden Bağlı olmayan pigmentler ve katlanmamış apoprotein kaldırmak için gereklidir. Iki aşamalı bir saflaştırma protokolü (ayrıca sonuçları bakınız), bu protokolde sunulmuştur. Bununla birlikte, sukroz gradyanlı adım APO ve sanal-proteinin tam olarak ayrılmasına izin vermez unutulmamalıdır. Apoprotein fonksiyonel ölçülerde müdahale etmeyen, böylece pigmentler ihtiva etmez ve en gibi analizler için bu bir sorun değildir. Bununla birlikte, bu durumda, tamamen fr apoprotein kaldırmak için gereklidiryeniden kompleksi (örneğin protein stoikiometriye pigment hesaplamak için) ihtiva eden işlem, bir anyonik değiştirme sütunu (bakınız Passarini ve ark. detayları için 29, 2009) kullanılabilir.
Kapasite in vitro izole edilmiş yeniden birleştirici pigmentler ile ışık toplayıcı proteinlerin yeniden kapatmak için, böylece elde edilen kompleksin özelliklerini değiştirmeden, çeşitli şekillerde yeniden oluşturma "çevre" değiştirerek kompleksleri "ayarlamak" için bir fırsat sağlar. Örneğin, sulandırma sırasında pigment bileşimi değişen değiştirilmiş bir pigment bileşimi ile bir kompleks neden olabilir. Bu özellik, çeşitli pigmentler kompleksinin yapısı ve kararlılığı üzerindeki etkisini incelemek için kullanılabilir. 1 ve 2.9 arasında bir Chl / araç oranı l: süresi ıspanak elde edilen pigment preparasyonu 3 bir Chl a / b oranı 1. Bu oran, tipik olarak n ile aynı özelliklere sahip olan bir sulandırma proteini üretirbirini Ative. 33 - Bununla birlikte, arıtılmış, Chl a veya b eklenmesiyle Chl a / b oranı ayarlanması bağlanma yerleri 30 seçiciliği değişken bağlı olarak farklı pigmentlerin bağlayıcı etkileyebilir. Pigment bağlama sitelerinin çoğu Chl a ya da b Chl tamamen selektif değildir, ama her ikisi için uygun olabilir, çünkü bu, mümkün olmasına rağmen, farklı afinite ile 10,30,34. 38 - Benzer şekilde, karotenoid bağlanma yerleri, ayrıca birden Ksantofil tür 8,35 karşılamak mümkün olduğu gösterilmiştir. CP26, çeşitli pigment bileşimleri kullanılarak yüksek bitkiler, diğer pigment-protein kompleksinin farklı reconstitutions Tablo 2'de 39 olarak gösterilmiştir. Bu reconstitutions, özellikle pigmentler 39 için bağlanma afinitesini belirlemek için kullanıldı. Bu aynı pigment c ile bir kompleks elde etmek için dikkat çekicidir1: doğal olarak omposition pigment karışımı Chl a / b oranı 3 olmalıdır. Bu, daha yüksek bitki 20,40 her BHÇ kompleksleri için geçerli görünmektedir.
Yeniden oluşturma tekniği ile, moleküler biyoloji kombinasyonu, Chl bağlayıcı kompleksinin özellikleri daha ayrıntılı olarak incelenecektir sağlar. 44 - kompleksleri, ya da protein-protein etkileşimleri katılımları kararlılığı ve katlanma farklı bir protein alanlarının önemi, apoprotein kesilmesi ya da rastgele mutagenez 8,41 yapılarak belirlenmiştir. 52 - Farklı pigmentlerin koordinasyonu için önemli bir tek amino asit kalıntıları tek tek pigmentlerin özelliklerini analiz ya da kompleks 10,28,29,45 bir fonksiyon ve stabilite etkilerinin değerlendirilmesi için, yer yönlendirmeli mutagenez ile değiştirilebilir. Şekil 6 ile Lhcb4 (CP29) yeniden53, 216 konumunda bir mutasyonu histidin. vahşi tip ve mutant komplekslerinin pigment bileşimin bir karşılaştırması mutasyon hedef sitesi WT kompleksi içinde Chl a barındırır gösteren bir molekül, bir Chl kaybını uyardığını göstermektedir. WT ve mutant absorpsiyon spektrumları arasındaki farklar, pigment içeriğine normalleşmeyi üzerine de kayıp pigmentin emme özelliklerini gösterir. Bu durumda, fark Chl His216 tarafından koordine edilen bu dalga boyunda absorbe eder (bu, mutant ile ilgili daha fazla bilgi için ve spektroskopik özellikleri Mozzo ve ark. 2008 53) gösteren, 680 nm 'de, ana zirve görülebilir. Mutasyon analizi, aynı zamanda pigmentlerin 54 spektroskopik özellikleri üzerindeki çevre etkisini belirlemek için de kullanılabilir.
Sonuç olarak, ışık hasat proteinlerini pigment Protei sonuçlanan in vitro yeniden oluşturulabiliryerli kompleksleri çok benzer özelliklere sahip n kompleksleri. Ayrıca, ileri çalışmalar için yüksek verim ve saflıkta olan bir protein preparasyonunu elde ederlerken, bu şekilde, doğal proteinlerin izole zorlukları ortadan kaldırılır. 3 önemi: otantik bir kompleks oluşturan 1 Chl a / b oranı vurgulanmıştır ve yeniden vahşi tip ve mutant LHCs örnekleri tekniğin kullanımlarını daha fazla açıklamak için verilmiştir.
Açıklamalar
The authors declare no conflict of interest
Teşekkürler
This work was supported by the European research council by a ERC starting/consolidator grant to RC and by the Dutch Foundation for research on matter (FOM) via a FOM program (10TM01).
Malzemeler
| Name | Company | Catalog Number | Comments |
| HisTrap HP | GE Healthcare | 17-5247-01 | |
| Nylon cloth | 20 μm pores | ||
| Soft artists paint brush | |||
| NONIDET P-40 | Sigma | 74385 | |
| Beta-DM | Sigma | D4641 | |
| DNAase | ThermoScientific | EN0525 | |
| Milk Powders | |||
| RNAase | ThermoScientific | EN0531 | |
| Sonicator | |||
| Octyl β-D-glucopyranoside | Sigma | O8001 | |
| Ultracentrifuge XL | Beckman-Coulter | ||
| TAP medium | see reference 17 | ||
| LB medium | see reference 19 |
Referanslar
- Plumley, F. G., Schmidt, G. W. Reconstitution of chlorophyll a/b light-harvesting complexes: Xanthophyll-dependent assembly and energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 84, 146-150 (1987).
- Croce, R., van Amerongen, H. Light-harvesting and structural organization of Photosystem II from individual complexes to thylakoid membrane. Journal of photochemistry and photobiology B Biology. 104 (1-2), 142-153 (2011).
- Li, Z., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and responding to excess light. Annual review of plant biology. 60, 239-260 (2009).
- De Bianchi, S., Ballottari, M., Dall’osto, L., Bassi, R. Regulation of plant light harvesting by thermal dissipation of excess energy. Biochemical Society transactions. 38 (2), 651-660 (2010).
- Neilson, J. A. D., Durnford, D. G. Structural and functional diversification of the light-harvesting complexes in photosynthetic eukaryotes. Photosynthesis research. 106 (1-2), 57-71 (2010).
- Paulsen, H., Rümler, U., Rüdiger, W. Reconstitution of pigment-containing complexes from light-harvesting chlorophyll a/b-binding protein overexpressed in Escherichia coli. Planta. 181 (2), 204-211 (1990).
- Horn, R., Grundmann, G., Paulsen, H. Consecutive binding of chlorophylls a and b during the assembly in vitro of light-harvesting chlorophyll-a/b protein (LHCIIb). Journal of molecular biology. 366 (3), 1045-1054 (2007).
- Cammarata, K. V., Schmidt, G. W. In vitro reconstitution of a light-harvesting gene product: deletion mutagenesis and analyses of pigment binding. Biochemistry. 31 (10), 2779-2789 (1992).
- Paulsen, H., Hobe, S. Pigment-binding properties of mutant light-harvesting chlorophyll-a/b-binding protein. European journal of biochemistry / FEBS. 205 (1), 71-76 (1992).
- Bassi, R., Croce, R., Cugini, D., Sandonà, D. Mutational analysis of a higher plant antenna protein provides identification of chromophores bound into multiple sites. Proceedings of the National Academy of Sciences of the United States of America. 96 (18), 10056-10061 (1999).
- Paulsen, H., Finkenzeller, B., Kühlein, N. Pigments induce folding of light-harvesting chlorophyll a/b-binding protein. European journal of biochemistry / FEBS. 215 (3), 809-816 (1993).
- Caffarri, S., Croce, R., Cattivelli, L., Bassi, R. A look within LHCII differential analysis of the Lhcb1-3 complexes building the major trimeric antenna complex of higher-plant photosynthesis. Biochemistry. 43 (29), 9467-9476 (2004).
- Giuffra, E., Cugini, D., Croce, R., Bassi, R. Reconstitution and pigment-binding properties of recombinant CP29. European journal of biochemistry / FEBS. 238 (1), 112-120 (1996).
- Rogl, H., Kosemund, K., Kühlbrandt, W., Collinson, I. Refolding of Escherichia coli produced membrane protein inclusion bodies immobilised by nickel chelating chromatography. FEBS letters. (1-2), 21-26 (1998).
- Porra, R. J., Thompson, W. A., Kriedemann, P. E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 975 (3), 384-394 (1989).
- Davies, B. H. Identification of carotenoids by their absorption characteristics. Biochem J. 103 (2), (1967).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. Journal of bacteriology. 62 (3), 293-300 (1951).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical biochemistry. 72, 248-254 (1976).
- Wientjes, E., Croce, R. The light-harvesting complexes of higher-plant Photosystem I Lhca1/4 and Lhca2/3 form two red-emitting heterodimers. The Biochemical journal. 433 (3), 477-485 (2011).
- Passarini, F., Xu, P., Caffarri, S., Hille, J., Croce, R. Towards in vivo mutation analysis knock-out of specific chlorophylls bound to the light-harvesting complexes of Arabidopsis thaliana - the case of CP24 (Lhcb6). Biochimica et biophysica acta. , (2014).
- Georgakopoulou, S., van der Zwan, G., Bassi, R., van Grondelle, R., van Amerongen, H., Croce, R. Understanding the changes in the circular dichroism of light harvesting complex II upon varying its pigment composition and organization. Biochemistry. 46 (16), 4745-4754 (2007).
- Croce, R., Müller, M. G., Caffarri, S., Bassi, R., Holzwarth, A. R. Energy transfer pathways in the minor antenna complex CP29 of photosystem II a femtosecond study of carotenoid to chlorophyll transfer on mutant and WT complexes. Biophysical journal. 84 (4), 2517-2532 (2003).
- Schmid, V. H., Cammarata, K. V., Bruns, B. U., Schmidt, G. W. In vitro reconstitution of the photosystem I light-harvesting complex LHCI-730 heterodimerization is required for antenna pigment organization. Proceedings of the National Academy of Sciences of the United States of America. 94 (14), 7667-7672 (1997).
- Castelletti, S., Morosinotto, T., Robert, B., Caffarri, S., Bassi, R., Croce, R. Recombinant Lhca2 and Lhca3 subunits of the photosystem I antenna system. Biochemistry. 42 (14), 4226-4234 (2003).
- Storf, S., Jansson, S., Schmid, V. H. R. Pigment binding, fluorescence properties, and oligomerization behavior of Lhca5, a novel light-harvesting protein. The Journal of biological chemistry. 280 (7), 5163-5168 (2005).
- Mozzo, M., Mantelli, M., Passarini, F., Caffarri, S., Croce, R., Bassi, R. Functional analysis of photosystem I light-harvesting complexes (Lhca) gene products of Chlamydomonas reinhardtii. Biochimica et biophysica acta. 1797 (2), 212-221 (2010).
- Remelli, R., Varotto, C., Sandonà, D., Croce, R., Bassi, R. Chlorophyll binding to monomeric light-harvesting complex. A mutation analysis of chromophore-binding residues. The Journal of biological chemistry. 274 (47), 33510-33521 (1999).
- Passarini, F., Wientjes, E., Hienerwadel, R., Croce, R. Molecular basis of light harvesting and photoprotection in CP24 unique features of the most recent antenna complex. The Journal of biological chemistry. 284 (43), 29536-29546 (2009).
- Giuffra, E., et al. Analysis of some optical properties of a native and reconstituted photosystem II antenna complex, CP29 pigment binding sites can be occupied by chlorophyll a or chlorophyll b and determine spectral forms. Biochemistry. 36 (42), 12984-12993 (1997).
- Pagano, A., Cinque, G., Bassi, R. In vitro reconstitution of the recombinant photosystem II light-harvesting complex CP24 and its spectroscopic characterization. The Journal of biological chemistry. 273 (27), 17154-17165 (1998).
- Kleima, F. J., et al. Decreasing the chlorophyll a/b ratio in reconstituted LHCII structural and functional consequences. Biochemistry. 38 (20), 6587-6596 (1999).
- Croce, R., Morosinotto, T., Castelletti, S., Breton, J., Bassi, R. The Lhca antenna complexes of higher plants photosystem I. Biochimica et biophysica acta. 1556 (1), 29-40 (2002).
- Hobe, S., Trostmann, I., Raunser, S., Paulsen, H. Assembly of the major light-harvesting chlorophyll-a/b complex Thermodynamics and kinetics of neoxanthin binding. The Journal of biological chemistry. 281 (35), 25156-25166 (2006).
- Croce, R., Weiss, S., Bassi, R. Carotenoid-binding sites of the major light-harvesting complex II of higher plants. The Journal of biological chemistry. 274 (42), 29613-29623 (1999).
- Hobe, S., Niemeier, H., Bender, A., Paulsen, H. Carotenoid binding sites in LHCIIb. Relative affinities towards major xanthophylls of higher plants. European journal of biochemistry / FEBS. 267 (2), 616-624 (2000).
- Jahns, P., Depka, B., Trebst, A. Xanthophyll cycle mutants from Chlamydomonas reinhardtii indicate a role for zeaxanthin in the D1 protein turnover. Plant Physiology and Biochemistry. 38 (5), 371-376 (2000).
- Wehner, A., Grasses, T., Jahns, P. De-epoxidation of violaxanthin in the minor antenna proteins of photosystemII, LHCB4, LHCB5, and LHCB6. The Journal of biological chemistry. 281 (31), 21924-21933 (2006).
- Croce, R., Canino, G., Ros, F., Bassi, R. Chromophore organization in the higher-plant photosystem II antenna protein CP26. Biochemistry. 41 (23), 7334-7343 (2002).
- Caffarri, S., Passarini, F., Bassi, R., Croce, R. A specific binding site for neoxanthin in the monomeric antenna proteins CP26 and CP29 of Photosystem II. FEBS letters. 581 (24), 4704-4710 (2007).
- Hobe, S., Förster, R., Klingler, J., Paulsen, H. N-proximal sequence motif in light-harvesting chlorophyll a/b-binding protein is essential for the trimerization of light-harvesting chlorophyll a/b complex. Biochemistry. 34 (32), 10224-10228 (1995).
- Kuttkat, A., Hartmann, A., Hobe, S., Paulsen, H. The C-terminal domain of light-harvesting chlorophyll-a/b-binding protein is involved in the stabilisation of trimeric light-harvesting complex. European journal of biochemistry / FEBS. 242 (2), 288-292 (1996).
- Rupprecht, J., Paulsen, H., Schmid, V. H. Protein domains required for formation of stable monomeric Lhca1- and Lhca4-complexes. Photosynthesis research. 63 (3), 217-224 (2000).
- Yang, C., et al. The negatively charged amino acids in the lumenal loop influence the pigment binding and conformation of the major light-harvesting chlorophyll a/b complex of photosystem II. Biochimica et biophysica acta. 1777 (11), 1463-1470 (2008).
- Rogl, H., Kühlbrandt, W. Mutant trimers of light-harvesting complex II exhibit altered pigment content and spectroscopic features. Biochemistry. 38 (49), 16214-16222 (1999).
- Yang, C., Kosemund, K., Cornet, C., Paulsen, H. Exchange of pigment-binding amino acids in light-harvesting chlorophyll a/b protein. Biochemistry. 38 (49), 16205-16213 (1999).
- Morosinotto, T., Castelletti, S., Breton, J., Bassi, R., Croce, R. Mutation analysis of Lhca1 antenna complex. Low energy absorption forms originate from pigment-pigment interactions. The Journal of biological chemistry. 277 (39), 36253-36261 (2002).
- Morosinotto, T., Breton, J., Bassi, R., Croce, R. The nature of a chlorophyll ligand in Lhca proteins determines the far red fluorescence emission typical of photosystem I. The Journal of biological chemistry. 278 (49), 49223-49229 (2003).
- Ballottari, M., Mozzo, M., Croce, R., Morosinotto, T., Bassi, R. Occupancy and functional architecture of the pigment binding sites of photosystem II antenna complex Lhcb5. The Journal of biological chemistry. 284 (12), 8103-8113 (2009).
- Croce, R., et al. Origin of the 701-nm fluorescence emission of the Lhca2 subunit of higher plant photosystem I. The Journal of biological chemistry. 279 (47), 48543-48549 (2004).
- Morosinotto, T., Mozzo, M., Bassi, R., Croce, R. Pigment-pigment interactions in Lhca4 antenna complex of higher plants photosystem I. The Journal of biological chemistry. 280 (21), 20612-20619 (2005).
- Mozzo, M., Morosinotto, T., Bassi, R., Croce, R. Probing the structure of Lhca3 by mutation analysis. Biochimica et biophysica acta. 1757 (12), 1607-1613 (2006).
- Mozzo, M., Passarini, F., Bassi, R., van Amerongen, H., Croce, R. Photoprotection in higher plants the putative quenching site is conserved in all outer light-harvesting complexes of photosystem II. Biochimica et biophysica acta. 1777 (10), 1263-1267 (2008).
- Wientjes, E., Roest, G., Croce, R. From red to blue to far-red in Lhca4 how does the protein modulate the spectral properties of the pigments. Biochimica et biophysica acta. 1817 (5), 711-717 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır