Method Article
In-vitro-Rekonstitution der Lichtsammelkomplexe der Pflanzen und Grünalgen
In diesem Artikel
Zusammenfassung
This protocol details the reconstitution of light-harvesting complexes in vitro. These integral membrane proteins coordinate chlorophylls and carotenoids and are responsible for harvesting light in higher plants and green algae.
Zusammenfassung
In Pflanzen und Grünalgen, wird von den Lichtsammelkomplexe (LHCs), eine Familie von integralen Membranproteinen, die Chlorophylle und Carotinoide koordinieren gefangen genommen. In vivo werden diese Proteine mit Pigmenten gefaltet, um Komplexe, die in der Thylakoidmembran eingefügt sind, bilden des Chloroplasten. Die hohe Ähnlichkeit in der chemischen und physikalischen Eigenschaften der Mitglieder der Familie, zusammen mit der Tatsache, dass sie leicht Pigmente während der Isolierung zu verlieren, macht die Reinigung in einem nativen Zustand schwierig. Ein alternativer Ansatz zur homogenen Zubereitungen von LHCs erhalten wurde durch Plumley und Schmidt 1987 1 entwickelt, die zeigten, dass es möglich war, diese Komplexe in vitro ausgehend von gereinigten Pigmente und ungefalteten Apoproteine wiederherzustellen, was zu Komplexen mit Eigenschaften sehr ähnlich zu der von nativem Komplexe. Dies eröffnet den Weg zur Verwendung von bakteriell exprimierten rekombinanten Proteinen in vitro (beispielsweise Pigment-Bindungsstellen) oder Proteindomäne (zB Protein-Protein-Wechselwirkung, Falten). Dieses Verfahren wurde in verschiedenen Laboratorien optimiert und die meisten der Lichtsammelkomplexe angewendet. Das hier beschriebene Protokoll beschreibt die Verfahren zur Wiederlichtsammelkomplexe in vitro noch in unserem Labor verwendet wird, und Beispiele beschreiben Anwendungen des Verfahrens sind vorgesehen.
Einleitung
Die Photosyntheseapparat von Pflanzen und Algen umfassen integrale Membranproteine, binden Chlorophyll (Chl a), b (Chl b) und Carotinoide (Auto). Diese Pigment-Protein-Komplexe sind in der Erntelichtenergie und übertragen diese Anregungsenergie zu den Reaktionszentren, in denen es verwendet wird, um die Ladungstrennung 2 fördern aktiv. Sie sind auch in regulatorischen Rückkopplungsmechanismen, die den Photosyntheseapparat von hoher Lichtschäden schützen 3,4 beteiligt. Die Lichtsammelkomplexe (LHCs) aus einer großen Familie von verwandten Proteinen in Pflanzen und Algen 5 besteht.
Die homogene Reinigung jedes Mitglied der Familie von den hoch ähnlichen chemischen und physikalischen Eigenschaften der Komplexe erschwert. Darüber hinaus führen Reinigungsverfahren oft zu einem Verlust der Pigmente oder andere potenzielle Kofaktoren wie Lipide. In-vitro-Rekonstitution Vertrets eine leistungsfähige Methode, um diese Probleme zu überwinden. Der LHC mit Photosystem II (LHC-II) zugeordnet wurde in vitro durch Plumley und Schmidt 1987 1 rekonstituiert. Die Forscher extrahiert entfetteten Protein und Pigmente getrennt von Chloroplasten, und dann kombiniert, die Hitze denaturierten Proteins mit Pigmenten in Gegenwart von Lithium Natriumdodecylsulfat (LDS), gefolgt von drei Zyklen von Einfrieren und Auftauen 1. Sie zeigten, dass die spektralen Eigenschaften des rekonstituierten LHC-Komplexe sehr ähnlich waren, um Komplexe aus Pflanzen gereinigt. Die Leichtigkeit der Rekonstitution LHC Pigment-Protein-Komplexe, wahrscheinlich aufgrund eines inhärenten Selbstorganisation kennzeichnen, zusammen mit der Schwierigkeit bei der Isolierung von gereinigten Komplexe aus Organismen, führte zur schnellen Einführung des Verfahrens von anderen Forschern. Die Rekonstitution der photo Proteine in Escherichia coli (E. coli) überexprimiert wurde von Paulsen et al 1990 6 erreicht. In E.coli, überexprimiert Membranproteine sind in der Regel in Einschlusskörpern enthalten sind, die Einrichtungen ihre Reinigung. Rekonstitution durch Hitzedenaturierung der Einschlusskörper, die rekombinantes Protein in Gegenwart von LDS, gefolgt von der Zugabe von Pigmenten, die die Proteinfaltung initiiert erreicht. Faltung des LHCII-Komplex ist ein zweistufiges Verfahren: Zunächst wird Chlorophyll a in weniger als 1 min gebunden; zweite, Chlorophyll b gebunden und über mehrere Minuten 7 stabilisiert.
Zusätzlich zur Bereitstellung Einblick in die Faltungsdynamik in vitro Rekonstitution in Verbindung mit ortsgerichteter Mutagenese wurde die Identifizierung von spezifischen Aminosäuren wichtig für die Stabilität (zB 8,9) oder Pigmenten Abstimmung erlaubt (zB 10). Manipulation der Rückfaltungsbedingungen durch Anpassung der Parameter wie Pigmentzusammensetzung oder Reinigungsmittel haben auch Elemente Critica identifiziertl für die richtige Faltung, wie die Forderung der Xanthophylle für die LHCII-Komplex (zB 1,11). Zusätzlich Untersuchung der Eigenschaften des in den Komplexen gebundenen einzelnen Pigmente ist möglich unter Verwendung von Komplexen in vivo rekonstituiert (zB 10).
Das hier beschriebene Verfahren beginnt mit der Isolierung der Pigmente (Chlorophylle und Carotinoid) aus Spinat und der Grünalge Chlamydomonas reinhardtii. Die Expression und Reinigung eines LHC-Protein aus E. coli in Form von Einschlusskörpern wird dann beschrieben, gefolgt von der Wiederherstellung des LHC und anschließender Reinigung durch Ni-Affinitätssäule. Im letzten Schritt werden die rekonstituierten Komplexen durch Saccharose-Gradienten-Zentrifugation gereinigt, um freien Pigmente und ungefalteten Apoprotein entfernen. Dieses Protokoll stellt eine optimierte Verfahren, das mehrere Änderungen, die von verschiedenen Labors über eingeführt wurdenZeit 1,6,10,12 -14.
Protokoll
1. Gesamtpigmentextraktion aus Spinatblättern
- Homogenisieren eine Handvoll Blattspinat (~ 20 g) in 100 ml kaltem Grinding-Puffer (siehe Tabelle 1) mit einem Mixer für 20 Sekunden.
- Filtern der Lösung durch ein zwei Schichten aus Nylongewebe mit einem Porendurchmesser von 20 um und Zentrifuge das Filtrat bei 1500 g für 10 min bei 4 ° C ist.
- Das Pellet, das die Chloroplasten mit einem weichen Pinsel Künstler malen in 1 ml kaltem Waschpuffer (siehe Tabelle 1). Sobald das Pellet resuspendiert, mit 50 ml Waschpuffer und Zentrifuge die Lösung bei 10.000 × g für 10 min bei 4 ° C ist.
- Entfernen Sie den Überstand und das Pellet vorsichtig (Thylakoide) in 50 ml Waschpuffer (siehe Tabelle 1).
- Zentrifugieren der Lösung bei 10.000 × g für 10 min bei 4 ° C vollständig zu entfernen, den Überstand. An dieser Stelle führen Sie die folgenden Schritte in der Dunkelheit, um Pigment Oxidation zu vermeiden.
- Fügen ~ 20 ml 80% Aceton mit Na 2 CO 3 gepuffert (siehe Tabelle 1), um die Pigmente zu extrahieren. Verlassen Sie die Lösung auf Eis für 10 min, gelegentlich Vortexen.
- Pellet die zellulären Bestandteile durch Zentrifugation bei 12.000 × g für 15 min bei 4 ° C ist.
HINWEIS: Wenn die Pigmente nicht völlig extrahiert, wird der Pellet eine grüne Farbe haben und Schritt 1.6 sollte wiederholt werden. - Die überstehende Flüssigkeit in einen Scheidetrichter. Fügen 0,4 Volumina Diethylether, kräftig schütteln und öffnen Sie das Ventil, um das Gas zu entlüften.
- Fügen 0,8 Volumen von 0,33 M NaCl und kräftig mischen. ~ 10 min ermöglichen die Schichten zu trennen. Die Ether-Phase auf die extrahierten Pigmente enthält. Entfernen Sie die untere Phase.
HINWEIS: Wenn die Trennung nicht klar ist, einfrieren und auftauen die Lösung, um die Phasentrennung zu verbessern. - Entfernen Sie den Äther durch Eingießen von der Oberseite der Scheidetrichter in einen geeigneten Glasbehälter. Trocken, indem Sie einen Löffel grandere wasserfreiem Natriumsulfat. Schwenken Sie die Lösung und lassen ~ 5 min für das Trockenmittel, um Wasser aus dem Äther zu absorbieren.
HINWEIS: Wiederholen Sie diesen Schritt, wenn die Natriumsulfat erscheint völlig verklumpten; Es sollte auch frei schwebend sein, wenn die Kristalle Ether ausreichend getrocknet. Wenn eine Wasserschicht bildet, entfernen Sie diese mit einer Pasteur-Pipette, bevor zusätzliche wasserfreiem Natriumsulfat. - Dekantieren den Äther zu einem neuen Glas-Container, so dass das Natriumsulfat solide hinter sich.
- Verdampft den Ether im Rotations Speedvac oder unter einem Strom von N 2.
- Man löst die Pigmente vollständig in 10 ml 100% igem Aceton gewaschen.
- Verdünnte eine kleine Menge (~ 3 ul) in 1 ml 80% Aceton und Messen der Absorptionsspektren und bestimmen den Chl a / b-Verhältnis und die Chl-Konzentration mit der durch Porra et al. (1989) 15.
- Aliquoten und trocknen die Pigmente in einem Dreh Speedvac oder unter N 2-Strom, bis das Aceton istvollständig verdampft ist. Bewahren Sie die getrockneten Pigmente bei -80 ° C.
2. Extraktion der Carotinoide aus Spinat
- Führen Sie die Schritte 1.1 bis 1.5. An dieser Stelle führen Sie die folgenden Schritte in der Dunkelheit, um Pigment Oxidation zu vermeiden.
- Resuspendieren thylakoid Pellet in ~ 50 ml 96% Ethanol mit Na 2 CO 3 (siehe Tabelle 1) zwischengespeichert, um die Pigmente zu extrahieren. Verlassen Sie die Lösung auf Eis für 5 min.
- Pellet die zellulären Bestandteile durch Zentrifugation bei 12.000 × g für 15 min bei 4 ° C ist.
HINWEIS: Wenn die Pigmente nicht völlig extrahiert, wird der Pellet eine grüne Farbe haben und Schritt 2.2 sollte wiederholt werden. - Sammeln des Überstandes und mit 0,1 Volumen von 80% KOH (w / v) einer Verseifung initiieren.
- Verlassen Sie die Lösung bei 4 ° CO / N, fest verschlossen und vor Licht geschützt.
- Sammeln Sie die Lösung in einen Scheidetrichter. 1 Volumen Diethylether und vorsichtig mischen.
- 0,8 vol hinzufügenmengen von 0,33 M NaCl und vorsichtig mischen. ~ 10 min ermöglichen die Schichten zu trennen. Die orange Ether-Phase auf verseiften enthält die Carotinoide. Entfernen Sie die grüne untere Phase durch Ablassen durch den Hahn des Trichters.
- Hinzufügen 3 Volumen Wasser und vorsichtig mischen, um das Kaliumhydroxid zu entfernen. Lassen Sie die Schichten zu trennen. HINWEIS: Wenn die obere Phase trübe erscheint, fügen Sie eine kleine Menge von NaCl (zB 3 g NaCl in 200 ml Lösung) und vorsichtig schwenken, sich aufzulösen.
- Entfernen Sie die untere Phase durch Ablassen durch den Hahn des Trichters.
- Folgen Sie den Schritten von 1,10 bis 1,13.
- Verdünnte eine kleine Menge (~ 3 ul) in 1 ml 80% Aceton und Messen der Absorptionsspektren bei 440 nm in 80% Aceton. Um die Konzentration zu bestimmen, verwenden Sie die Durchschnittskoeffizient Aussterben der Carotinoide (ε 440 = 255) 16 in der folgenden Formel: Auto [mg / ml] = (Abs 440 nm / 225) x 11 (Strahlengang) = 1 cm.
- Aliquoten und trocknen Sie die carotenoids in einem Speedvac oder unter N 2-Strom, bis alle Diethylether wurde verdampft. Bewahren Sie die getrockneten Pigmente bei -80 ° C.
3. Gesamt Pigment und Carotinoid-Extraktion aus Chlamydomonas reinhardtii
- Wachsen C. reinhardtii auf festen TAP Medium 17 in einer Petrischale durch die Verbreitung eine kleine Menge Flüssigkultur auf die Oberfläche. Wachsen unter ständiger Beleuchtung Strom von 20 mmol Fotos PSA m -2 s -1 bis eine grüne Schicht von Zellen sichtbar ist.
- Verwendung einer sterilen Impföse ernten eine kleine Menge von C reinhardtii vom festen TAP Medium und setzen Sie die Zellen in 500 ml Leitungsmedium 17 in einem 1 l-Kolben. Die Kultur bei 25 ° C mit 170 Upm unter Rühren unter kontinuierlicher Beleuchtung Fluß von 20 umol Fotos PSA m -2 s -1.
- Nach 5-6 Tagen ist die Kultur am Ende der logarithmischen Phase erreicht (6 x 10 6 Zellen / mloder 2-2,5 optische Dichte bei 750 nm). Zentrifugieren der Kultur bei 4000 × g für 15 min bei 4 ° C ist.
- Für Gesamtpigment-Extraktion, befolgen Sie die Schritte 1,6 bis 1,15.
- Die Ausbeute an Gesamtpigmentextrakt ab 500 ml Vollwachstumskultur von C. reinhardtii ist etwa 5 ml Lösung mit einer Konzentration von 0,5 mg Chl a + b / ml.
- Carotinoide für Extraktion, befolgen Sie die Schritte 2,2 bis 2,12.
4. Reinigung von Inclusion Bodies
- Klonierung der kodierenden Sequenz des LHC Protein von Interesse in einen Expressionsvektor, der in einem kondensierten C-terminalen His-Tag unter Verwendung von molekularbiologischen Standardverfahren ergibt. Verwandeln, die dieses Konstrukt in E. coli-Wirtsstamm wie BL21 (DE3).
- Vorbereitung Lysepuffer, Wasch-Puffer, Triton-Puffer TE (Tabelle 1), 1 M Isopropyl β-D-1-thiogalactopyranosid (IPTG) und LB-Medium 18 mit den entsprechenden Antibiotika.
- Wählen Sie eine einzE E. coli-Kolonie, enthaltend den Expressions Klon aus einer frisch ausgestrichenen Platte in ~ 5 ml LB-Medium mit den entsprechenden Antibiotika unter Verwendung von Standardverfahren 6. Wachsen bei 37 ° C mit 220 Upm Rühren für mindestens 16 Stunden.
- Hinzufügen von 2,5 ml des O / N-Kultur in einen 1 l-Erlenmeyerkolben mit 250 ml LB mit dem entsprechenden Antibiotikum ergänzt.
- Wachsen die Zellen für 2-3 Stunden (oder bis die OD 600 ~ 0,6) bei 37 ° C bei 220 UpM.
- Hinzufügen IPTG bis zu einer Endkonzentration von 1 mM. Weiterhin die Zellen bei 37 ° C mit 220 Upm 3-4 h wachsen.
- Zentrifugieren der Kultur für 10 min bei 5.000 × g bei 4 ° C in einem vorgewogenen Zentrifugenglas. Überstand verwerfen und gründlich Bestimmen Sie das Gewicht des Pellets durch Wiegen wieder und Subtraktion der Zentrifugenröhrchen Gewicht.
- Resuspendieren E. coli-Zellpellet in 0,8 ml / g Lysepuffer durch kräftiges Vortexen.
HINWEIS: Alternativ kann das Zellpellet bei -80 eingefrorenC für die spätere Verwendung. Wenn die mit einem gefrorenen Pellets, lassen Sie sie vollständig vor der Zugabe des Lyse-Puffer auftauen. - Add 2 mg Lysozym pro Gramm Zellen und Inkubation auf nassem Eis mit gelegentlichem Vortexen für 30 min.
- Mit 20 ug / ml DNAse, 10 mM MgCl 2, 1 mM NaCl, 20 ug / ml RNAse. Wirbel und auf Eis für 30 Minuten setzen.
- 2 ml kaltem Detergenspuffer pro Gramm Zellen. Gut mischen und halten RT für 5 min.
- Übertragung auf 2 ml Zentrifugenröhrchen (aufgeteilt in zwei Röhren, wenn nötig). Zentrifuge für 10 min bei 12.000 × g bei 4 ° C, um die Einschlusskörper zu pelletieren.
- 1 ml kaltem Triton-Puffer und die Pellets durch Sonifikation (3 x 5 sec Impulse x 50% Leistung mit 20 Sekunden-Intervallen) vollständig zu suspendieren. HINWEIS: Haben Sie den Schlauch in einem kleinen Becherglas mit Eis Wasser umgeben, um sie während der Sonifikation kalt zu halten. Im Falle von Mehrfachrohren, verbinden die resuspendiert Einschlußkörper in eine Röhre nach Resuspendierung.
- Zentrifugieren für 10 min bei 12.000× g bei 4 ° C, um die Einschlusskörper zu pelletieren.
- Wiederholen Sie Schritt 4.13 und 4.14 zwei Mal.
- Resuspendieren der Einschlusskörper in 1 ml kaltem TE mit Sonifikation für einen letzten Wasch die Triton-Puffer zu entfernen. Zentrifuge für 10 min bei 12.000 × g bei 4 ° C, um die Einschlusskörper zu pelletieren.
- Das Pellet in 1 ml kaltem TE durch Beschallung.
- Beurteilung der Proteinkonzentration durch Standardverfahren, wie dem Bradford-Assay 19. Speicher Aliquots der Einschlusskörper bei -20 ° C.
5. Rekonstitution
Dieses Protokoll liefert typischerweise 1-2 ml der rekonstituierten Protein mit einem Außendurchmesser von 4, wenn die Absorption in der Region Qy (600-750 nm) gemessen. Menge kann nach Wunsch eingestellt werden, wobei darauf zu achten ist, um die richtigen Verhältnisse während des Verfahrens aufrecht zu erhalten.
- Bereiten Sie die folgenden Lösungen, wie in Tabelle 1 beschrieben: 2x Rekonstitutionspuffer, 20% OG, 2 M KCl, TE. Führen Sie das folgende sTEPs bei schwachem Licht.
- Resuspendieren 800 ug LHC Inclusion Bodies in insgesamt 400 ul TE in einem 2 ml Mikrozentrifugenröhrchen. Geben Sie 400 ul der 2x Rekonstitutionspuffer und kurz vortexen.
- Fügen 0,6 ul β-Mercaptoethanol (14,8 M stock), um eine Endkonzentration von 10 mM zu erhalten. Wärme, die das Protein für 1 min bei 98 ° C aufweist. Wirbel kurz und Ort bei RT für 3 min.
- Resuspendieren 500 g Gesamt-Chlorophyll-Pigmente getrocknet plus 80 ug Carotinoidpigmente in 30 ul 100% EtOH durch kräftiges Vortexen für 1 min oder in einem Ultraschallbad für 1-2 min.
- Drehen Sie das Pigment-Mix ~ 30 sec bei 15.800 xg bei 4 ° C und bestätigen, dass es keine Pellets. Wenn es ein Pellet, wiederholen Verwirbelung und / oder Ultraschallbehandlung. WICHTIG: Nach der Aufwirbelung und Spin, sofort Pigment in den das Protein, oder es kann zu aggregieren und müssen wieder suspendiert werden.
- Langsam das Pigment-Mix zu dem gekühlten Protein unter Vortexen. Weiterhin Wirbel 5-10 sec und das Röhrchen auf nassem Eis. Seien Sie vorsichtig, nicht zu kräftig vortexen, wie das Protein die Spitze des Rohres überlaufen.
- Fügen Sie 94 ul 20% Octyl β-D-glucopyranosid (OG) (Endkonzentration 2%), kurz vortexen und auf Eis 10 min halten.
- Fügen Sie 90 ul von KCl 2 M (Endkonzentration 150-200 mM), kurz vortexen und auf Eis 20 min halten. HINWEIS: Säulenvorbereitung (Abschnitt 6) kann zu diesem Zeitpunkt eingeleitet werden.
- Spin für 10 min bei 15.800 × g bei 4 ° C ist. Überstand entfernen, ohne das Pellet (gefälltes LDS) in einen 10-ml-Röhrchen stören. Halten Kälte und vor Licht geschützt.
6. Nickel Säulenreinigung
- Bereiten Sie die folgenden Lösungen, wie in Tabelle 1 beschrieben: OG-Puffer, OG Spülpuffer, Elution Puffer.
- Verbinden einer Ni-Sepharose-Säule (1 ml) oder äquivalent zu einer Schlauchpumpe gewährleistet, dass keine Luft in der Säule wird bei diesem Schritt und die nachfolgenden Schritte.
- Stellen Sie die Geschwindigkeit von ter zu pumpen, um 1 ml / min und spülen Sie die Säule mit 5-10 ml Wasser, um die Storage-Lösung zu entfernen.
- Ins Gleichgewicht der Säule mit 3-4 ml OG-Puffer.
- Zusatz von 3-4 ml OG-Puffer zu der Proteinprobe und der Last auf die Säule. Hinweis: Wenn das Protein wurde auf Eis nach der Entfernung des LDS sitzen länger als 10 min, wieder drehen sich mit 15.800 g bei 4 ° C für 1 min, um zusätzliche LDS Niederschlag zu entfernen.
- Spülen der Säule mit 5 ml OG-Puffer.
- Mit 2 ml OG Spülpuffer Spülen der Säule.
- Elution des gebundenen Proteins mit 3 ml Elutionspuffer. Sammeln Sie die grüne Eluat, das die wiederhergestellten Protein enthält. Hinweis: Dies ist in der Regel etwa 1 ml insgesamt.
7. Saccharosegradientenzentrifugation
- Bereiten Sie die folgenden Lösungen, wie in Tabelle 1 beschrieben: Saccharose-Lösung, 0,06% β-DM, 0,01 M HEPES, pH 7,6.
- Füllen Ultrazentrifuge Rohre mit der Saccharose-Lösung und bei -20 ° CO / N or -80 ° C für mindestens 1 Stunde.
- Entfernen Sie den Schlauch aus dem Gefrierschrank und lassen Sie bei 4 ° C auftauen ungestört. HINWEIS: Die Frost / Tau-Verfahren erzeugt einen Gradienten von 0,1 bis 1 M Saccharose. Eine 15-ml-Tube taut in der Regel in etwa 3 Stunden.
- Sorgfältig von oben zu entfernen das gleiche Volumen wie die grüne Fraktion aus der Nickel-Sepharose-Säule in Schritt 6.8 eluiert. Dann laden Sie die rekonstituierte Probe langsam auf, um zu vermeiden das Gefälle zu stören.
- Balance Rohren und Spin bei 200.000 × g bei 4 ° C in einer Ultrazentrifuge mit einem SW-41 oder SW-60 Ausschwingrotor für 18 Stunden, eingestellt, um die Beschleunigung und Stoppen ohne Bremsen verlangsamen.
- Sie vorsichtig die Gradienten von der Rohrhalter mit einer Pinzette. Verwenden Sie eine Spritze mit langer Nadel, die eine stumpfe Öffnung, um den Anteil von der Spitze zu sammeln hat. HINWEIS: Alternativ sammeln Fraktionen von unten durch Anstechen des Röhrchens mit einer Nadel und Sammeln Tropfen.
Ergebnisse
Diese Protokollinformationen ein Verfahren zum chorophyll a / b bindenden Proteinen in vitro zu rekonstituieren. Diese Technik ermöglicht die Faltung dieser Pigment-Protein-Komplexe in vitro ausgehend von dem Apoprotein, die durch Überexpression in einem heterologen System erhalten werden kann, und Pigmenten, die aus Pflanzen oder Algen extrahiert. Nach dem Auflösen wird die rückgefaltete Pigment-Protein-Komplex vom überschüssigen Pigmente und ungefalteten Apoprotein in zwei Schritten gereinigt. Der erste Schritt (1 AB) auf die Anwesenheit von His-Tag am C-Terminus des Proteins, das die Beseitigung des Großteils der nicht gebundenen Pigmenten ermöglicht basiert. Die zweite Reinigungsstufe verwendet Saccharosedichtegradientenzentrifugation, (Abbildung 2), wo das entfaltete Protein wandert in der Regel langsamer als die grüne Band der rekonstituierten Protein enthält. Das Ziel der Rekonstitution in vitro ist, Komplexe mit der gleichen korrekten erhaltenBeziehungen wie die Einheimischen. Um dieses Ergebnis zu veranschaulichen, wird die spektroskopischen Eigenschaften eines in vivo Lichtsammelkomplex mit dem gleichen LHC-Komplex in vitro rekonstituiert 13,20,21 verglichen. Das Absorptionsspektrum des LHCs im sichtbaren Bereich (350 nm und 750 nm) hängt von der Pigmentzusammensetzung des Komplexes sowie auf das Pigment der Umgebung (die das Protein enthält), und es ist somit ein empfindliches Werkzeug, um die Qualität zu überprüfen der Rekonstitution. In 3 ist das Absorptionsspektrum des CP24, ein Chlorophyll a / b-Bindungsprotein aus Arabidopsis thaliana, in vitro rekonstituiert, mit dem Spektrum des gleichen Komplexes gereinigt aus Arabidopsis Thylakoide 21 verglichen. In den Spektren ist es möglich, die Qy und die Soret Übergang von Chl a (Peaks bei 671/439 nm) und Chl b (Peaks bei 649/466 nm) zu erkennen. Die nativen und rekonstituierten Komplexe zeigen identische absorption Spektren, was auf eine nahezu identische Pigmentzusammensetzung und Organisation. Fluoreszenz-Spektroskopie kann verwendet werden, um die Qualität des wieder Komplex zu bewerten. Die Fluoreszenzemissionsspektren bei einer Anregung bei verschiedenen Wellenlängen, die bevorzugt unterschiedliche Pigmente erregt gemessen: Chl a bei 440 nm, Chl b bei 475 nm und bei 500 nm Xanthophylle. In einem korrekt gefalteten Protein-Pigment-Komplexes Chl b und Xanthophylle übertragen ihre Anregungsenergie in erster Linie auf Chl a innerhalb weniger Picosekunden, und die Fluoreszenz stammt von einem thermischen Gleichgewicht Systems, durch einen einzigen Peak mit der gleichen Form und Maxima bei allen drei Anregungs Wellenlängen (4A-B). Die Anwesenheit von Chl b nicht an das Protein koordiniert durch einen zusätzlichen Peak oder eine Schulter um 650 nm bei 475 nm Anregung (4C) erfasst werden. Das Vorhandensein von freien Chl a statt führtzusätzliche Emission um 675 nm, die vor allem auf 440 nm Anregung vorhanden ist. Die Fluoreszenzemissionsspektren bei 475 nm Anregung sowohl wiederhergestellt und der einheimischen CP24-Komplexe (4D) einen einzelnen Peak zeigen bei 681 nm, was darauf hinweist, dass rekonstituierten Komplexes korrekt gefaltet ist. Eine zusätzliche Bestätigung, dass das Pigment-Protein-Komplex wird vollständig wiederhergestellt kommt aus Zirkulardichroismus (CD)-Messungen. Das CD-Signal im sichtbaren Bereich hängt von der exzitonischen Wechselwirkungen zwischen Pigmenten und es ist somit sehr empfindlich auf kleine Änderungen in der Organisation der Chromophore 22. 5 zeigt die CD-Spektren der nativen rekonstituiert und CP24 mit den typischen Fingerabdruck Peaks bei 681 nm, 650 nm und 481 nm auf. Abschließend die hohe Ähnlichkeit zwischen den spektroskopischen Eigenschaften des nativen und die rekonstituierte CP24 bestätigt, dass die Rekonstitution Verfahren ergibt nativ-ähnlichen Komplexen suita BLE für in-vitro-Studie von Lichtsammelproteine.
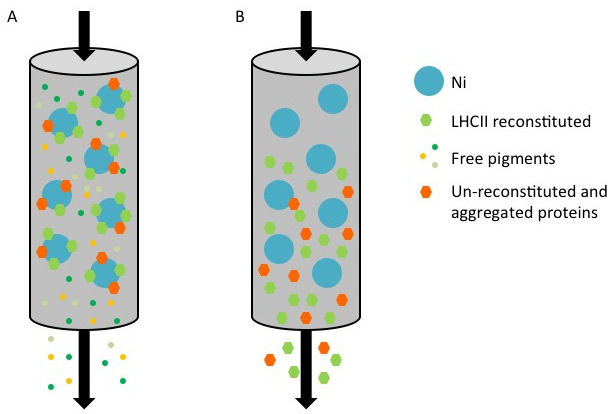
Abbildung 1. Darstellung der Aufreinigung von rekombinanten Proteinen LHC mit einem His-Tag mit einem Nickelsäule. (A) während der Reinigung, His-tag-Protein, von den beiden wiederhergestellten Komplexe (grün Sechseck) und un-Rekonstitution / aggregierten Proteins besteht (orange Sechskant) an der Oberfläche der Ni-Sepharose (blauer Fleck) gebunden, während ungebundene Pigmente (kleine farbige Punkte) durchfließen. (B) Wenn die Säule mit dem Elutionspuffer Imidazol enthält, gewaschen, werden die wiederhergestellten und un-rekonstituierten Proteine im Durchfluß gesammelt.
hres.jpg "width =" 500 "/>
Figur 2 Sucrose-Gradienten von rekonstituiertem LHCII nach Reinigung durch Nickel-Säule. Die rekonstituierten Komplexe aus den freien Pigment durch die Dichte-Gradienten getrennt. Die dunkelgrüne Band stellt rekonstituierten LHCII und die hellgrünen Hintergrund wird von freien Pigmenten.
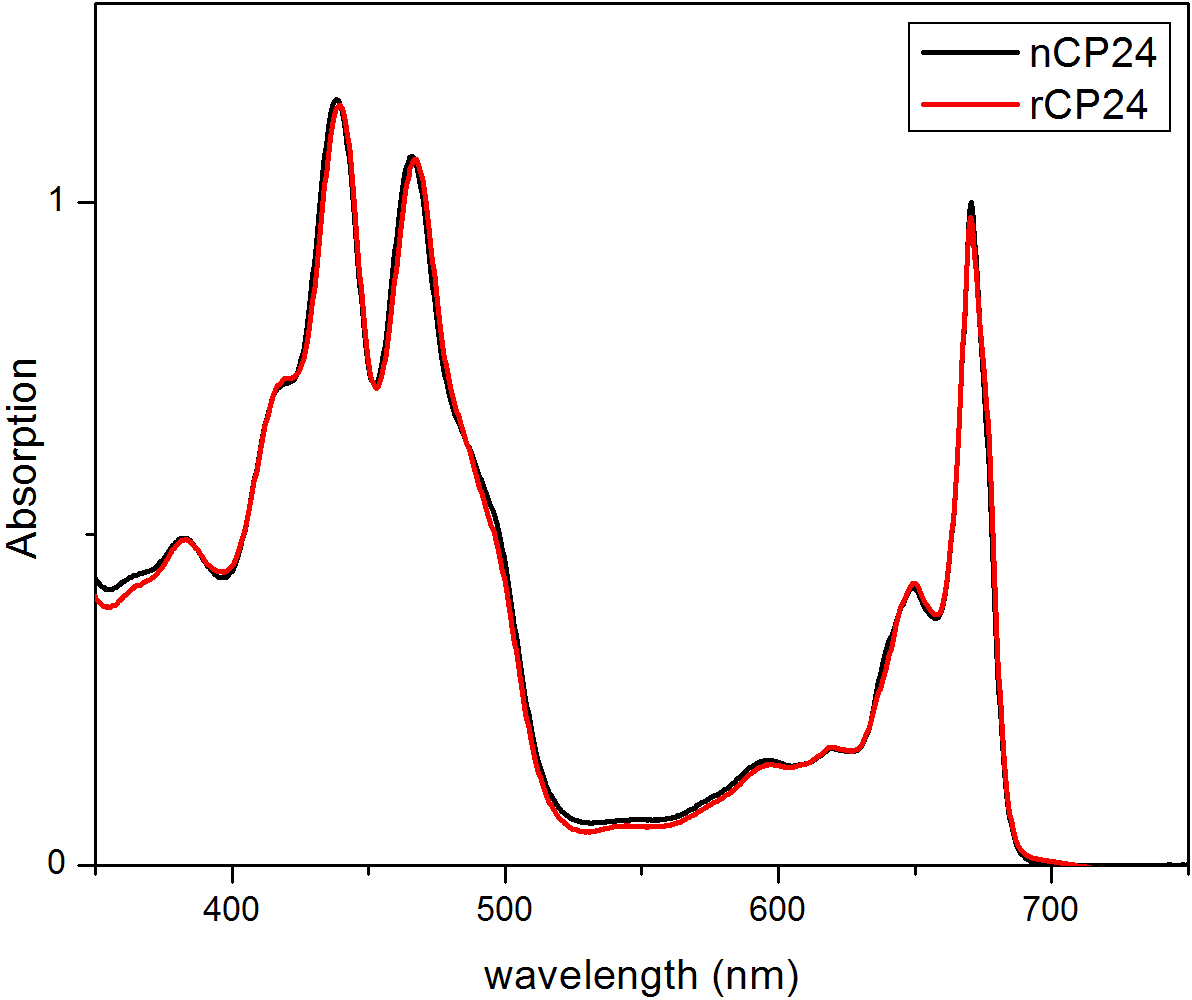
Abbildung 3. Absorptionsspektren von rekonstituiertem Protein CP24 (rCP24, rote Linie) und einer nativen (nCP24, schwarze Linie) aus Arabidopsis thaliana isoliert. In beiden Spektren ist es möglich, die Qy und die Soret Übergang von einem Chl (Peaks erkennen bei 671/439 nm) und Chl b (Peaks bei 649/466 nm). Diese Zahl hat sich von Passarini et al modifiziert. 2014 21.
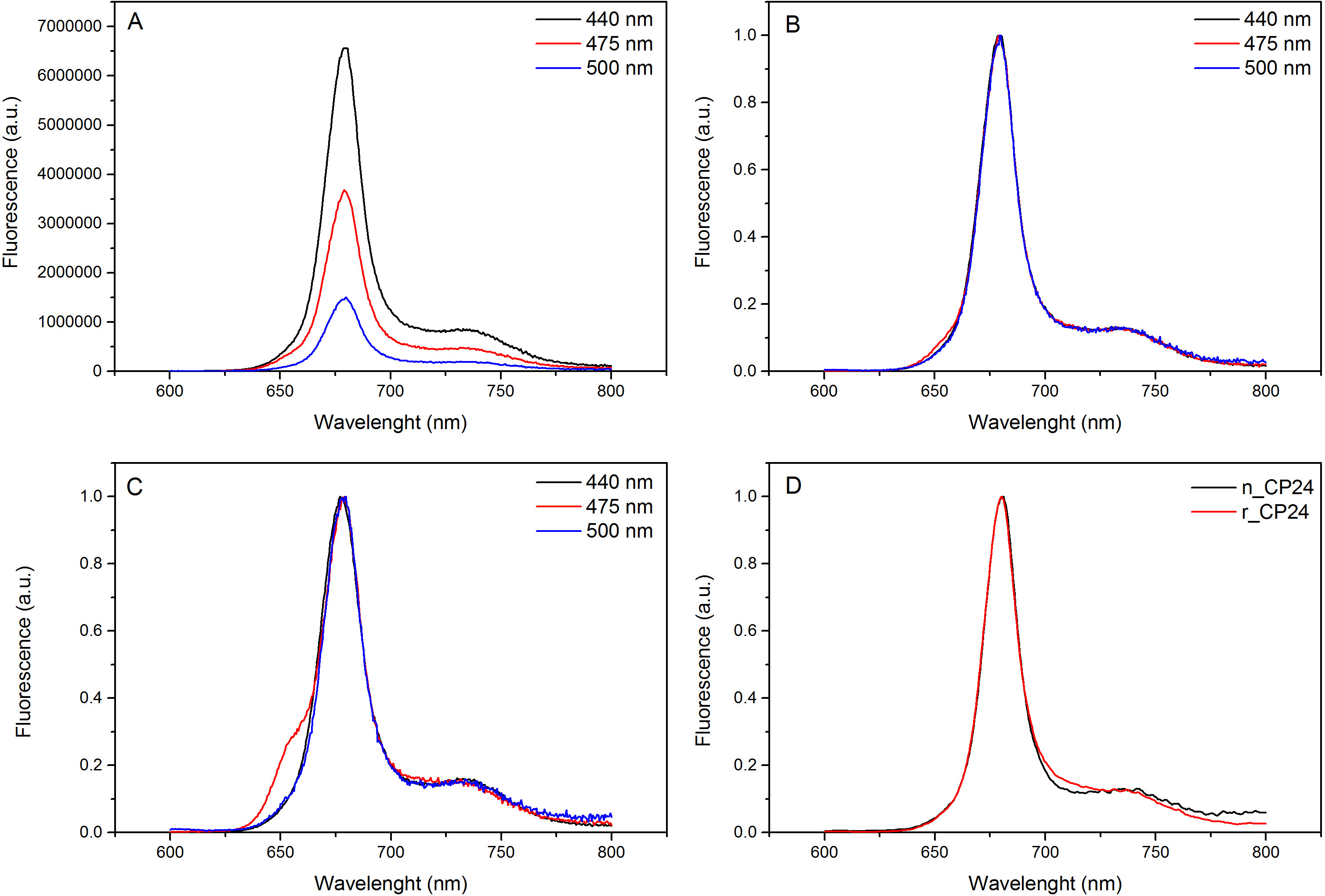
Abbildung 4. Fluoreszenzemissionsspektren. Die Fluoreszenzemissionsspektren von Wildtyp-CP24 rekonstituierte Komplex (A) und normiert auf den Maximalwert (B) zeigen eine effiziente Energieübertragung von Chl b und Xanthophyls ein Chl. (C) Fluoreszenzemissionsspektren der rekonstituierten CP24 (rCP24) und dem nativen Komplex (nCP24) aus Arabidopsis thaliana isoliert. Die Spektren sind normiert auf das Maximum der Spitze (D). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
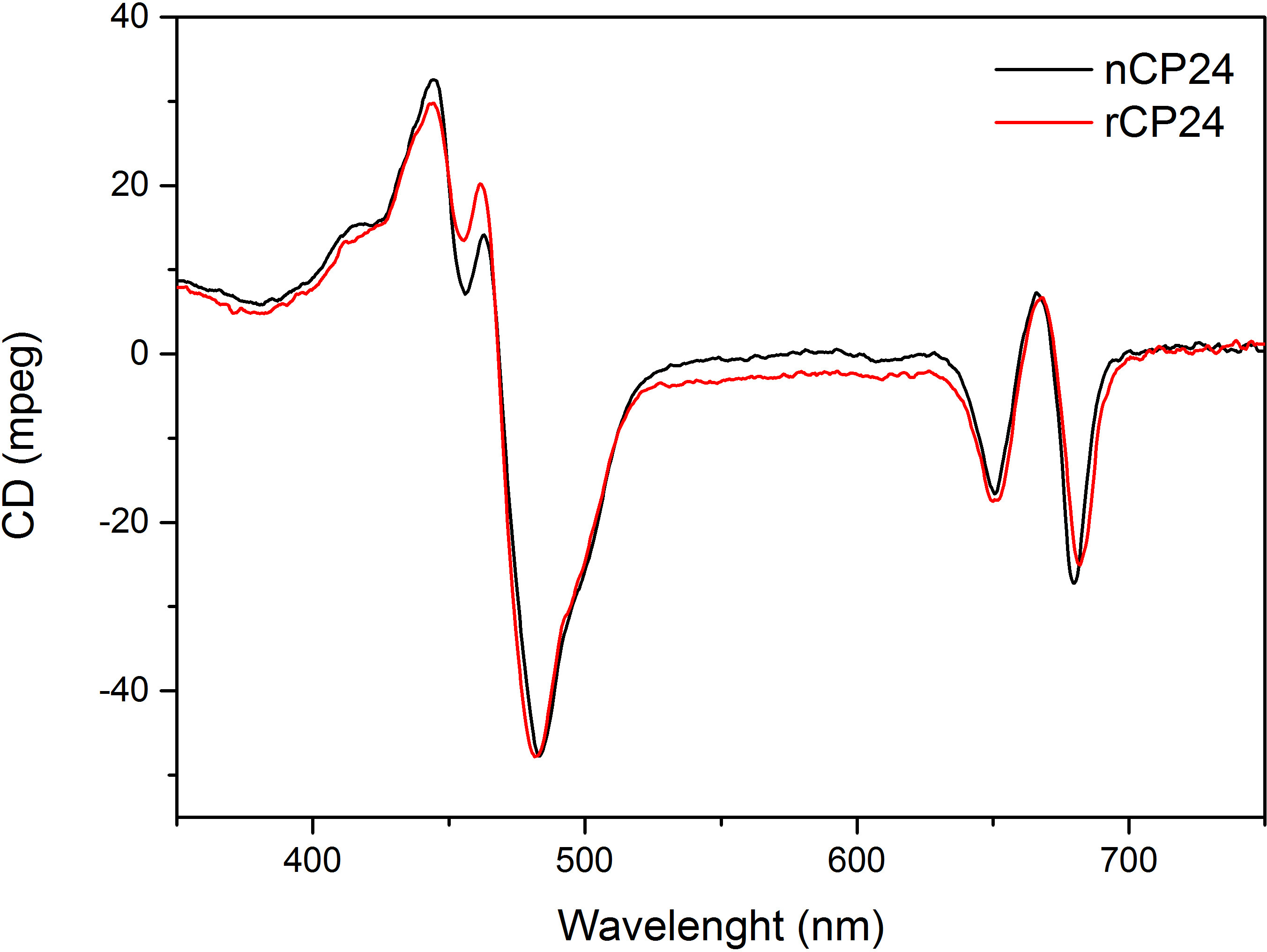
Abbildung 5. Circulardichroismus. Rekonstituierten CP24 (rCP24, rote Linie) und der Mutterkomplex (nCP24, schwarze Linie) aus Arabidopsis thaliana isoliert zeigt sehr ähnliche Spektren.

Abbildung 6. Absorptionsspektren von CP29 Wildtyp (CP29_WT) und mutiert CP29 (CP29_A2). Die grüne Linie zeigt die Unterschiede zwischen den beiden Grundstücken.
| Alle Puffer bei 4 ° C gelagert werden. | |||
| Komponenten | Endkonzentration | Zusätzliche Hinweise | |
| Schleif Buffer | Sorbit | 0,4 M | |
| Tricin | 0,1 M | pH 7,8 | |
| NaCl | 10 mM | ||
| MgCl 2 | 5 mM | ||
| Milchpulver | 0,5% w / v | ||
| Waschpuffer | Sorbit | 50 mM | |
| Tricine | 5 mM | pH 7,8 | |
| EDTA | 10 mM | pH 8 | |
| Lysepuffer | Tris | 50 mM | pH 8 |
| Saccharose | 2,5% w / v | ||
| EDTA | 1 mM | pH 8 | |
| Detergenspuffer | NaCl | 200 mM NaCl | |
| Desoxycholsäure | 1% w / v | ||
| NONIDET P-40 | 1% w / v | ||
| Tris | 20 mM | pH-Wert 7,5 | |
| EDTA | 2 mM | pH 8 | |
| beta-Mercaptoethanol | 10 mM | ||
| Triton-Puffer | Triton X-100 | 0,5% w / v | |
| Tris | 20 mM | pH-Wert 7,5 | |
| beta-Mercaptoethanol | 1 mM | ||
| Puffer TE | Tris | 50 mM | pH 8 |
| EDTA | 1 mM | pH 8 | |
| Rekonstitutionspuffer | HEPES | 200 mM | |
| Saccharose | 5% w / v | ||
| Lithiumdodecylsulfate (LDS) | 4% w / v | ||
| Benzamidin | 2 mM | ||
| Aminocapronsäure | 10 mM | ||
| OG-Puffer | Octylglucosids | 1% w / v | |
| 12,5% w / v | |||
| NaCl | 0,2 M | ||
| HEPES | 20 mM | ||
| Imidazol | 10 mM | ||
| OG Pufferspülgang | n-Dodecyl-beta-D-Maltosid (β-DM) | 0,06% w / v | |
| HEPES | 40 mM | pH 7,5-9 | |
| NaCl | 0,2 M | ||
| Elution Buffer | Imidazol | 0,5 M | |
| n-Dodecyl-beta-D-Maltosid (β-DM) | 0,06% w / v | ||
| HEPES | 40 mM | pH 8 | |
| NaCl | 0,2 M | ||
| Saccharose-Lösung | Saccharose | 20% w / v | |
| n-Dodecyl-beta-D-Maltosid (β-DM) | 0,06% w / v | ||
| HEPES | 0,01 M | pH-Wert 7,6 | |
| Aceton 80% mit Natriumcarbonat gepuffert | Aceton | 80% v / v | |
| Natriumcarbonat | 1 M | ||
| Ethanol 96% mit Natriumcarbonat gepuffert | Ethanol | 96% v / v | |
| Natriumcarbonat | 1 M | ||
Tabelle 1. Liste der Puffer und Lösungen in diesem Protokoll verwendet.
rCP26| Chla a / b-Mix | Chla a / b | Chl a | Chl b | Neo | Viola | Laute | Chl tot | Chl / Auto | |
| nCP26 | - | 2,2 ± 0,05 | 6.2 | 2.8 | 0,61 | 0,38 | 1,02 | 9 | 4,5 ± 0,1 |
| rCP26 | 8 | 2,71 ± 0,05 | 6,57 | 2,43 | 0,72 | 0,32 | 0,97 | 3,9 ± 0,04 | |
| rCP26 | 5.5 | 2,25 ± 0,05 | 6,23 | 2,77 | 0,77 | 0,3 | 0,96 | 9 | 4,0 ± 0,1 |
| rCP26 | 3 | 2,08 ± 0,04 | 6,08 | 2,92 | 0,76 | 0,3 | 1,04 | 9 | 4,1 ± 0,1 |
| rCP26 | 1 | 1,7 ± 0,05 | 5.7 | 3.3 | 0,7 | 0,3 | 0,9 | 9 | 4,3 ± 0,05 |
| rCP26 | 0,3 | 1,11 ± 0,04 | 4.7 | 4,28 | 0,7 | 0,3 | 0,9 | 9 | 4,2 ± 0,2 |
| 0,05 | 0,23 ± 0,01 | 1.4 | 5.6 | 0,58 | 0,24 | 1.11 | 7 | 3,1 ± 0,06 | |
| rCP26 | <0,01 | 0,11 ± 0,01 | 0,7 | 6.3 | 0,64 | 0,3 | 1,08 | 7 | 3,06 ± 0,06 |
Tabelle 2. Pigmentgehalt von CP26-Komplex im Vergleich zu nativen rekonstituierte Protein-Pigment-Komplexe mit unterschiedlichen Chl a / b-Verhältnisse 39.
Diskussion
Membranproteine sind nicht so leicht zu untersuchen. Isolierung von nativen Membranproteine wird durch die Notwendigkeit, die Lipid-Doppelschicht mit Detergenzien solubilisieren, die das Protein beschädigen und zu entfernen wesentlichen Kofaktoren kompliziert. Diese Proteine können auch in geringen Mengen vorhanden sein, die in biologischen Membranen oder mit eng verwandten Proteinen gemischt werden, wie im Fall der Lichtsammelkomplexe, die die Reinigung der einzelnen Komplexe erschwert. Heterologe Proteinexpression in E. coli und in vitro Rekonstitution bietet die Möglichkeit, diese Probleme zu vermeiden. In vitro Rekonstitution und Reinigung von gefalteten Proteinen führt zu Komplexen, die Eigenschaften sehr ähnlich denen des nativen Komplexe 20,21,23 und besitzen somit verwendet werden, um Komplexe, die nicht bis zur Homogenität gereinigt werden können, 24 zu untersuchen - 27.
Dieses Verfahren verwendet Spinat, die leicht ist attainable ganze Jahr über, als Quelle für den Gesamtpigment und Carotinoid-Zubereitungen. Für einige Rekonstruktionen von Proteinen stammt aus Algen ist die Verwendung von Pigmenten aus Algen gereinigt aufgrund unterschiedlicher Pigmentzusammensetzungen bevorzugt. Das Chl a / b-Verhältnis und Chl / Auto Verhältnis gleich bleibt, unabhängig von Pigmentquelle.
Es ist wichtig zu erkennen, dass der Wirkungsgrad der Rekonstitution ist in der Regel rund 35% 28. Somit ist es erforderlich, die nicht-gebundene Pigmente und das entfaltete Apoprotein aus der Lösung nach dem Auflösen zu entfernen. Ein Zwei-Schritt-Reinigungsprotokoll wird in diesem Protokoll vorgestellt (siehe Ergebnisse). Es sollte jedoch beachtet werden, dass die Saccharose-Gradienten Schritt nicht die vollständige Trennung der Apo-und Holo-Protein zu ermöglichen. Bei den meisten Analysen ist dies kein Problem, da das Apoprotein keine Pigmente enthalten und somit nicht mit den funktionellen Messungen stören. In dem Fall ist es jedoch notwendig, die Apoprotein vollständig entfernen aus der FRAktion mit dem rekonstituierten Komplexes (zum Beispiel, um das Pigment zu Protein-Stöchiometrie berechnen), kann eine anionische Austauschsäule verwendet werden (siehe Passarini et al. 2009 29 für Details).
Die Fähigkeit zur rekombinanten Lichtsammelproteine mit isolierten Pigmente in vitro Rückfaltung bietet die Möglichkeit, "manipulieren" die Komplexe durch Änderung der Rekonstitution "Umwelt" in verschiedener Weise, wodurch sich die Eigenschaften des resultierenden Komplexes. Zum Beispiel kann die Änderung der Pigmentzusammensetzung bei der Rekonstitution in einem Komplex mit veränderten Pigmentzusammensetzung führen. Diese Funktion kann verwendet werden, um den Einfluss verschiedener Pigmente auf der Struktur und Stabilität des Komplexes zu untersuchen. Regel die Pigmentzubereitung aus Spinat erhalten wird, eine Chl a / b-Verhältnis von 3: 1 und einen Chl / Auto-Verhältnis von 2,9: 1 liegt. Dieses Verhältnis typischerweise eine rekonstituierte Protein mit den gleichen Eigenschaften wie der nAtive einem. 33 - jedoch kann die Einstellung der Chl a / b-Verhältnis durch Zugabe von gereinigtem Chl a oder b die Bindung von verschiedenen Pigmenten aufgrund der unterschiedlichen Selektivität der Bindungsstellen 30 zu beeinflussen. Dies ist möglich, weil die meisten der Pigmentbindungsstellen sind nicht vollständig selektiv für Chl a und Chl b, kann aber auch unterzubringen, wenn auch mit unterschiedlicher Affinität 10,30,34. In ähnlicher Weise wurden die Carotinoid-Bindungsstellen auch gezeigt in der Lage, mehr als eine Art Xanthophyll 8,35 aufzunehmen - 38. Verschiedene Rekonstruktionen von CP26, ein anderes Pigment-Protein-Komplex höherer Pflanzen mit verschiedenen Pigmentzusammensetzungen werden in Tabelle 2 gezeigt, 39. Diese Rekonstruktionen wurden verwendet, um die Affinität der Bindungsstellen für bestimmte Pigmente 39 zu beurteilen. Es ist interessant zu bemerken, dass, um einen Komplex mit dem gleichen Pigment c erhalten1: usammensetzung wie das native einen muss der Chl a / b-Verhältnis von Pigmentmischung 3 sein. Dies scheint der Fall für alle LHC-Komplexe der höheren Pflanzen 20,40 sein.
Die Kombination der Molekularbiologie mit der Rekonstitution Technik können die Eigenschaften eines Chl-bindenden Komplexes näher zu untersuchen. 44 - die Bedeutung der verschiedenen Proteindomänen auf die Stabilität und Faltung der Komplexe oder deren Einbindung in die Protein-Protein-Wechselwirkungen wurden durch Abschneiden des Apoprotein oder Führen Zufallsmutagenese 8,41 bestimmt. 52 - einzelne Aminosäurereste die für die Koordinierung der verschiedenen Pigmente können durch ortsgerichtete Mutagenese, um die Eigenschaften der einzelnen Pigmente zu analysieren oder zu beurteilen, deren Beitrag zu der Funktion und Stabilität des Komplexes 10,28,29,45 verändert werden. Figur 6 zeigt rekonstituiert Lhcb4 (CP29) miteine Mutation von Histidin an Position 216, 53. Ein Vergleich der Pigmentzusammensetzung von Wildtyp-und Mutanten-Komplexen zeigt, dass die Mutation induziert den Verlust eines Chl ein Molekül, das anzeigt, dass die Zielstelle nimmt eine Chl a im WT-Komplex. Die Unterschiede der Absorptionsspektren von WT und Mutanten, bei Normierung auf den Pigmentgehalt, zeigt auch die Absorptionseigenschaften des verlorenen Pigment. In diesem Fall kann der Unterschied in der Hauptpeak bei 680 nm zu erkennen, was darauf hinweist, dass der Chl a von His216 koordiniert bei dieser Wellenlänge absorbiert (für weitere Details zu diesem Mutante und die spektroskopischen Eigenschaften sehen Mozzo et al., 2008 53). Mutationsanalyse kann auch verwendet werden, um die Wirkung der Umgebung auf die spektroskopischen Eigenschaften der Pigmente 54 zu bestimmen.
Abschließend kann Lichtsammelproteine leicht in vitro rekonstituiert werden, was zu Pigment-protein-Komplexe mit sehr ähnlichen Eigenschaften wie Mutterkomplexen. Auf diese Weise werden die Schwierigkeiten bei der Isolierung von nativen Proteinen eliminiert, während auch die Bereitstellung Proteinpräparat mit hoher Ausbeute und Reinheit zur weiteren Untersuchung. Die Bedeutung einer 3: 1 Chl a / b-Verhältnis bei der Herstellung eines authentischen Komplex wird hervorgehoben, und Beispiele von rekonstituierten Wildtyp und Mutante LHCs sind vorgesehen, um Anwendungen der Technik veranschaulichen.
Offenlegungen
The authors declare no conflict of interest
Danksagungen
This work was supported by the European research council by a ERC starting/consolidator grant to RC and by the Dutch Foundation for research on matter (FOM) via a FOM program (10TM01).
Materialien
| Name | Company | Catalog Number | Comments |
| HisTrap HP | GE Healthcare | 17-5247-01 | |
| Nylon cloth | 20 μm pores | ||
| Soft artists paint brush | |||
| NONIDET P-40 | Sigma | 74385 | |
| Beta-DM | Sigma | D4641 | |
| DNAase | ThermoScientific | EN0525 | |
| Milk Powders | |||
| RNAase | ThermoScientific | EN0531 | |
| Sonicator | |||
| Octyl β-D-glucopyranoside | Sigma | O8001 | |
| Ultracentrifuge XL | Beckman-Coulter | ||
| TAP medium | see reference 17 | ||
| LB medium | see reference 19 |
Referenzen
- Plumley, F. G., Schmidt, G. W. Reconstitution of chlorophyll a/b light-harvesting complexes: Xanthophyll-dependent assembly and energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 84, 146-150 (1987).
- Croce, R., van Amerongen, H. Light-harvesting and structural organization of Photosystem II from individual complexes to thylakoid membrane. Journal of photochemistry and photobiology B Biology. 104 (1-2), 142-153 (2011).
- Li, Z., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and responding to excess light. Annual review of plant biology. 60, 239-260 (2009).
- De Bianchi, S., Ballottari, M., Dall’osto, L., Bassi, R. Regulation of plant light harvesting by thermal dissipation of excess energy. Biochemical Society transactions. 38 (2), 651-660 (2010).
- Neilson, J. A. D., Durnford, D. G. Structural and functional diversification of the light-harvesting complexes in photosynthetic eukaryotes. Photosynthesis research. 106 (1-2), 57-71 (2010).
- Paulsen, H., Rümler, U., Rüdiger, W. Reconstitution of pigment-containing complexes from light-harvesting chlorophyll a/b-binding protein overexpressed in Escherichia coli. Planta. 181 (2), 204-211 (1990).
- Horn, R., Grundmann, G., Paulsen, H. Consecutive binding of chlorophylls a and b during the assembly in vitro of light-harvesting chlorophyll-a/b protein (LHCIIb). Journal of molecular biology. 366 (3), 1045-1054 (2007).
- Cammarata, K. V., Schmidt, G. W. In vitro reconstitution of a light-harvesting gene product: deletion mutagenesis and analyses of pigment binding. Biochemistry. 31 (10), 2779-2789 (1992).
- Paulsen, H., Hobe, S. Pigment-binding properties of mutant light-harvesting chlorophyll-a/b-binding protein. European journal of biochemistry / FEBS. 205 (1), 71-76 (1992).
- Bassi, R., Croce, R., Cugini, D., Sandonà, D. Mutational analysis of a higher plant antenna protein provides identification of chromophores bound into multiple sites. Proceedings of the National Academy of Sciences of the United States of America. 96 (18), 10056-10061 (1999).
- Paulsen, H., Finkenzeller, B., Kühlein, N. Pigments induce folding of light-harvesting chlorophyll a/b-binding protein. European journal of biochemistry / FEBS. 215 (3), 809-816 (1993).
- Caffarri, S., Croce, R., Cattivelli, L., Bassi, R. A look within LHCII differential analysis of the Lhcb1-3 complexes building the major trimeric antenna complex of higher-plant photosynthesis. Biochemistry. 43 (29), 9467-9476 (2004).
- Giuffra, E., Cugini, D., Croce, R., Bassi, R. Reconstitution and pigment-binding properties of recombinant CP29. European journal of biochemistry / FEBS. 238 (1), 112-120 (1996).
- Rogl, H., Kosemund, K., Kühlbrandt, W., Collinson, I. Refolding of Escherichia coli produced membrane protein inclusion bodies immobilised by nickel chelating chromatography. FEBS letters. (1-2), 21-26 (1998).
- Porra, R. J., Thompson, W. A., Kriedemann, P. E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 975 (3), 384-394 (1989).
- Davies, B. H. Identification of carotenoids by their absorption characteristics. Biochem J. 103 (2), (1967).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. Journal of bacteriology. 62 (3), 293-300 (1951).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical biochemistry. 72, 248-254 (1976).
- Wientjes, E., Croce, R. The light-harvesting complexes of higher-plant Photosystem I Lhca1/4 and Lhca2/3 form two red-emitting heterodimers. The Biochemical journal. 433 (3), 477-485 (2011).
- Passarini, F., Xu, P., Caffarri, S., Hille, J., Croce, R. Towards in vivo mutation analysis knock-out of specific chlorophylls bound to the light-harvesting complexes of Arabidopsis thaliana - the case of CP24 (Lhcb6). Biochimica et biophysica acta. , (2014).
- Georgakopoulou, S., van der Zwan, G., Bassi, R., van Grondelle, R., van Amerongen, H., Croce, R. Understanding the changes in the circular dichroism of light harvesting complex II upon varying its pigment composition and organization. Biochemistry. 46 (16), 4745-4754 (2007).
- Croce, R., Müller, M. G., Caffarri, S., Bassi, R., Holzwarth, A. R. Energy transfer pathways in the minor antenna complex CP29 of photosystem II a femtosecond study of carotenoid to chlorophyll transfer on mutant and WT complexes. Biophysical journal. 84 (4), 2517-2532 (2003).
- Schmid, V. H., Cammarata, K. V., Bruns, B. U., Schmidt, G. W. In vitro reconstitution of the photosystem I light-harvesting complex LHCI-730 heterodimerization is required for antenna pigment organization. Proceedings of the National Academy of Sciences of the United States of America. 94 (14), 7667-7672 (1997).
- Castelletti, S., Morosinotto, T., Robert, B., Caffarri, S., Bassi, R., Croce, R. Recombinant Lhca2 and Lhca3 subunits of the photosystem I antenna system. Biochemistry. 42 (14), 4226-4234 (2003).
- Storf, S., Jansson, S., Schmid, V. H. R. Pigment binding, fluorescence properties, and oligomerization behavior of Lhca5, a novel light-harvesting protein. The Journal of biological chemistry. 280 (7), 5163-5168 (2005).
- Mozzo, M., Mantelli, M., Passarini, F., Caffarri, S., Croce, R., Bassi, R. Functional analysis of photosystem I light-harvesting complexes (Lhca) gene products of Chlamydomonas reinhardtii. Biochimica et biophysica acta. 1797 (2), 212-221 (2010).
- Remelli, R., Varotto, C., Sandonà, D., Croce, R., Bassi, R. Chlorophyll binding to monomeric light-harvesting complex. A mutation analysis of chromophore-binding residues. The Journal of biological chemistry. 274 (47), 33510-33521 (1999).
- Passarini, F., Wientjes, E., Hienerwadel, R., Croce, R. Molecular basis of light harvesting and photoprotection in CP24 unique features of the most recent antenna complex. The Journal of biological chemistry. 284 (43), 29536-29546 (2009).
- Giuffra, E., et al. Analysis of some optical properties of a native and reconstituted photosystem II antenna complex, CP29 pigment binding sites can be occupied by chlorophyll a or chlorophyll b and determine spectral forms. Biochemistry. 36 (42), 12984-12993 (1997).
- Pagano, A., Cinque, G., Bassi, R. In vitro reconstitution of the recombinant photosystem II light-harvesting complex CP24 and its spectroscopic characterization. The Journal of biological chemistry. 273 (27), 17154-17165 (1998).
- Kleima, F. J., et al. Decreasing the chlorophyll a/b ratio in reconstituted LHCII structural and functional consequences. Biochemistry. 38 (20), 6587-6596 (1999).
- Croce, R., Morosinotto, T., Castelletti, S., Breton, J., Bassi, R. The Lhca antenna complexes of higher plants photosystem I. Biochimica et biophysica acta. 1556 (1), 29-40 (2002).
- Hobe, S., Trostmann, I., Raunser, S., Paulsen, H. Assembly of the major light-harvesting chlorophyll-a/b complex Thermodynamics and kinetics of neoxanthin binding. The Journal of biological chemistry. 281 (35), 25156-25166 (2006).
- Croce, R., Weiss, S., Bassi, R. Carotenoid-binding sites of the major light-harvesting complex II of higher plants. The Journal of biological chemistry. 274 (42), 29613-29623 (1999).
- Hobe, S., Niemeier, H., Bender, A., Paulsen, H. Carotenoid binding sites in LHCIIb. Relative affinities towards major xanthophylls of higher plants. European journal of biochemistry / FEBS. 267 (2), 616-624 (2000).
- Jahns, P., Depka, B., Trebst, A. Xanthophyll cycle mutants from Chlamydomonas reinhardtii indicate a role for zeaxanthin in the D1 protein turnover. Plant Physiology and Biochemistry. 38 (5), 371-376 (2000).
- Wehner, A., Grasses, T., Jahns, P. De-epoxidation of violaxanthin in the minor antenna proteins of photosystemII, LHCB4, LHCB5, and LHCB6. The Journal of biological chemistry. 281 (31), 21924-21933 (2006).
- Croce, R., Canino, G., Ros, F., Bassi, R. Chromophore organization in the higher-plant photosystem II antenna protein CP26. Biochemistry. 41 (23), 7334-7343 (2002).
- Caffarri, S., Passarini, F., Bassi, R., Croce, R. A specific binding site for neoxanthin in the monomeric antenna proteins CP26 and CP29 of Photosystem II. FEBS letters. 581 (24), 4704-4710 (2007).
- Hobe, S., Förster, R., Klingler, J., Paulsen, H. N-proximal sequence motif in light-harvesting chlorophyll a/b-binding protein is essential for the trimerization of light-harvesting chlorophyll a/b complex. Biochemistry. 34 (32), 10224-10228 (1995).
- Kuttkat, A., Hartmann, A., Hobe, S., Paulsen, H. The C-terminal domain of light-harvesting chlorophyll-a/b-binding protein is involved in the stabilisation of trimeric light-harvesting complex. European journal of biochemistry / FEBS. 242 (2), 288-292 (1996).
- Rupprecht, J., Paulsen, H., Schmid, V. H. Protein domains required for formation of stable monomeric Lhca1- and Lhca4-complexes. Photosynthesis research. 63 (3), 217-224 (2000).
- Yang, C., et al. The negatively charged amino acids in the lumenal loop influence the pigment binding and conformation of the major light-harvesting chlorophyll a/b complex of photosystem II. Biochimica et biophysica acta. 1777 (11), 1463-1470 (2008).
- Rogl, H., Kühlbrandt, W. Mutant trimers of light-harvesting complex II exhibit altered pigment content and spectroscopic features. Biochemistry. 38 (49), 16214-16222 (1999).
- Yang, C., Kosemund, K., Cornet, C., Paulsen, H. Exchange of pigment-binding amino acids in light-harvesting chlorophyll a/b protein. Biochemistry. 38 (49), 16205-16213 (1999).
- Morosinotto, T., Castelletti, S., Breton, J., Bassi, R., Croce, R. Mutation analysis of Lhca1 antenna complex. Low energy absorption forms originate from pigment-pigment interactions. The Journal of biological chemistry. 277 (39), 36253-36261 (2002).
- Morosinotto, T., Breton, J., Bassi, R., Croce, R. The nature of a chlorophyll ligand in Lhca proteins determines the far red fluorescence emission typical of photosystem I. The Journal of biological chemistry. 278 (49), 49223-49229 (2003).
- Ballottari, M., Mozzo, M., Croce, R., Morosinotto, T., Bassi, R. Occupancy and functional architecture of the pigment binding sites of photosystem II antenna complex Lhcb5. The Journal of biological chemistry. 284 (12), 8103-8113 (2009).
- Croce, R., et al. Origin of the 701-nm fluorescence emission of the Lhca2 subunit of higher plant photosystem I. The Journal of biological chemistry. 279 (47), 48543-48549 (2004).
- Morosinotto, T., Mozzo, M., Bassi, R., Croce, R. Pigment-pigment interactions in Lhca4 antenna complex of higher plants photosystem I. The Journal of biological chemistry. 280 (21), 20612-20619 (2005).
- Mozzo, M., Morosinotto, T., Bassi, R., Croce, R. Probing the structure of Lhca3 by mutation analysis. Biochimica et biophysica acta. 1757 (12), 1607-1613 (2006).
- Mozzo, M., Passarini, F., Bassi, R., van Amerongen, H., Croce, R. Photoprotection in higher plants the putative quenching site is conserved in all outer light-harvesting complexes of photosystem II. Biochimica et biophysica acta. 1777 (10), 1263-1267 (2008).
- Wientjes, E., Roest, G., Croce, R. From red to blue to far-red in Lhca4 how does the protein modulate the spectral properties of the pigments. Biochimica et biophysica acta. 1817 (5), 711-717 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten