Method Article
植物や緑藻の光捕集複合体のin vitro再構成では、
要約
This protocol details the reconstitution of light-harvesting complexes in vitro. These integral membrane proteins coordinate chlorophylls and carotenoids and are responsible for harvesting light in higher plants and green algae.
要約
植物および緑藻類では、光は光捕集複合体(LHCs)、クロロフィルおよびカロテノイド座標内在性膜タンパク質のファミリーによって捕捉される。 インビボでは 、これらのタンパク質はチラコイド膜に挿入されている複合体を形成する顔料を用いて折り畳まれる葉緑体の。ファミリーのメンバーの化学的および物理的特性の高い類似性は、一緒に彼らは簡単に単離中の顔料を失う可能性があるという事実と、天然の状態での精製が困難なことができます。 LHCsの均質な調製物を得るための別のアプローチは、それが天然のものと非常に類似した特性を有する複合体が得られる、精製された顔料および折り畳まれていないアポタンパク質から出発して、インビトロでこれらの複合体を再構成することが可能であったことを示した1987年1 Plumleyシュミットによって開発された複合体。これは、in vitro細菌発現された組換えタンパク質の使用への道を開い例えば、顔料結合部位)、またはタンパク質ドメイン( 例えば、タンパク質-タンパク質相互作用、フォールディング)の役割。この方法は、いくつかの研究室で最適と光捕集複合体の大部分に適用されている。ここに記載されているプロトコルは、現在、私たちの研究室で使用されるin vitroでの集光性複合体を再構成する方法を詳述 および方法の用途を説明する実施例を提供する。
概要
植物や藻類の光合成装置は、膜内在性(CHL a)のクロロフィル a を結合するタンパク質、B(クロロフィルb)およびカロテノイド(車)が挙げられる。これらの色素-タンパク質複合体は、収穫光エネルギーで活性であり、それが電荷分離2を促進するために使用される反応中心にその励起エネルギーを伝達する。それらはまた、高い光損傷3,4から光合成装置を保護調節フィードバック機構に関与している。集光複 合体(LHCs)は植物や藻類5の関連タンパク質の大きなファミリーで構成されている。
ファミリーの各メンバーの均質な精製は、複合体の高度に類似の化学的及び物理的性質によって複雑化されている。また、精製手順は、しばしば、顔料または脂質などの他の潜在的な補因子の損失をもたらす。 インビトロ再構成representsは強力な方法は、これらの問題を克服する。光化学系II(LHC-II)に関連付けられているLHCは、最初1987年1 Plumleyとシュミットによってin vitroで再構成された。研究者は、植物の葉緑体とは別に脱脂タンパク質及び顔料を抽出した後、リチウムの存在下での顔料と熱変性タンパク質を組み合わせた凍結融解1の3つのサイクルが続くドデシル硫酸(LDS)、。これらは、再構成されたLHC複合体のスペクトル特性は、植物から精製された複合体と非常に類似していたことを示した。何らかの固有の自己組織化機能への可能性が高いLHC顔料 - タンパク質複合体を再構成の容易さは、生物から精製された複合体を単離することが困難であるとともに、他の研究者による方法の迅速な採択につながった。 大腸菌(E. coli)で過剰発現光合成タンパク質の再構成1990年6ポールセンらによって達成された。E.で大腸菌は、過剰発現した膜タンパク質は、典型的には、その設備のそれらの精製、封入体に含まれている。再構成は、タンパク質の折り畳みを開始する顔料を添加したLDSの存在下で組換えタンパク質を含有する封入体の熱変性によって達成される。 LHCII複合体の折り畳みは、2段階のプロセスである:まず、 クロロフィル a が 1分以内に結合している;第二、 クロロフィル b は、数分7かけ結合し、安定化される。
フォールディング動力学への洞察を提供することに加えて、部位特異的突然変異誘発と組み合わせたインビトロでの再構成において安定性( 例えば、8,9)または顔料の調整( 例えば、10)に特異的なアミノ酸の同定が重要で可能にした。そのような顔料組成物または洗剤のようなパラメータを調整することによってリフォールディング条件の操作はまた、要素criticaを同定したそのようなLHCIIコンプレックスのキサントフィルの要件として適切な折り畳みのためのL( 例えば、1,11)。さらに、複合体に結合された個別の顔料の特性の調査は生体内で再構成された複合体を使用可能であった( 例えば、10)。
ここで説明する方法は、ほうれん草と緑藻クラミドモナスから色素(クロロフィルやカロテノイド)を単離することから始まる。EからLHCのタンパク質の発現および精製封入体の形で大腸菌を LHCとNiアフィニティーカラムによるその後の精製の 再構成に続いて、次に詳細に説明する。最後のステップでは、再構成された複合体はさらに自由顔料および折り畳まれていないアポタンパク質を除去するために、スクロース勾配遠心分離により精製される。このプロトコルは、以上の異なる研究所によって導入されたいくつかの変更を組み込んだ最適化された手順を示して時間1,6,10,12 -14。
プロトコル
ホウレンソウの葉から1全顔料の抽出
- 20秒間、ブレンダーを使用します( 表1を参照)、コールド研削バッファー100mlにホウレンソウの葉(〜20グラム)の一方の握りをホモジナイズする。
- 4℃で10分間1500×gで20ミクロン遠心濾液の孔径を有するナイロン布の二つの層を通して溶液を濾過する。
- ソフトアーティストは冷たい洗浄バッファー( 表1参照)1ml中にブラシをペイントして葉緑体を含むペレットを再懸濁します。ペレットを再懸濁した後、4℃で10分間、10,000×gで遠心洗浄緩衝液50mlの溶液を加える。
- 上清を除去し、穏やかに( 表1参照)の洗浄緩衝液50ml中にペレット(チラコイド)を懸濁します。
- 遠心分離し、4℃で10分間、10,000×gで解決し、完全に上清を除去。この時点で、顔料の酸化を避けるために、暗闇の中で、以下のステップを実行する。
- 色素を抽出する( 表1参照)〜のNa 2 CO 3で緩衝し、80%アセトン20mlを加える。時折ボルテックス、10分間氷上で解決策をしておきます。
- 4℃で15分間12,000×gでの遠心分離により細胞成分のペレット。
NOTE:顔料が完全に抽出されない場合は、ペレットが緑色を有しており、1.6を繰り返すべきであるステップう。 - 分液ロートに上清を収集します。ジエチルエーテルの0.4ボリュームを追加し、激しく振り、ガスを排出するためのバルブを開きます。
- 0.33 M NaClを0.8ボリュームを追加し、激しく混ぜる。層を分離するための〜10分を許可します。上部のエーテル相を抽出顔料が含まれています。明確な下相を除去します。
注:分離が明確でない場合、相分離を改善するための解決策を凍結し、解凍。 - 適切なガラス容器に分液ロートの上から注ぐことによって、エーテルを除去します。グランのスプーンを追加することでドライウラル無水硫酸ナトリウム。溶液を旋回し、エーテルから水分を吸収する乾燥剤のために約5分を可能にする。
注:硫酸ナトリウムが完全に一緒に凝集しているような場合は、この手順を繰り返します。エーテルを十分に乾燥したとき、いくつかのフリーフローティングの結晶があるはずです。水層を形成した場合、追加の無水硫酸ナトリウムを添加する前に、パスツールピペットでこれを削除してください。 - 背後に固体硫酸ナトリウムを残し、新しいガラス容器にエーテルをデカント。
- ロータリースピードバックでまたはN 2気流下でエーテルを蒸発。
- 100%のアセトン10mlに完全に色素を溶解する。
- 80%アセトン1ml中に少量(〜3μl)を希釈し、吸収スペクトルを測定し、クロロフィルa / bの比とPorra らによって記載された方法とクロロフィル濃度を決定する。 (1989)15。
- アセトンになるまで一定分量を、ロータリースピードバック中またはN 2気流下で顔料を乾燥完全に蒸発。 -80℃で乾燥した顔料を格納します。
ホウレンソウからカロテノイドの2の抽出
- 、手順1.1〜1.5に従ってください。この時点で、顔料の酸化を避けるために、暗闇の中で、以下のステップを実行する。
- 色素を抽出する( 表1参照)のNa 2 CO 3で緩衝〜50ミリリットルの96%エタノール中にチラコイドペレットを再懸濁する。 5分間氷上で解決策をしておきます。
- 4℃で15分間12,000×gでの遠心分離により細胞成分のペレット。
NOTE:顔料が完全に抽出されない場合は、ペレットが緑色を有しており、2.2を繰り返すべきであるステップう。 - 上清を収集し、(w / v)のケン化を開始するために80%のKOH 0.1ボリュームを追加。
- 4℃のCO / Nで溶液のままにし、しっかりと蓋をし、光から保護。
- 分液ロートに溶液を収集します。ジエチルエーテルの1ボリュームを追加し、穏やかに混合。
- 0.8巻を追加0.33 M NaClをリューム、穏やかに混合。層を分離するための〜10分を許可します。上部のオレンジ色のエーテル相をケン化カロテノイドが含まれています。漏斗のストップコックを介して排出することによって、グリーン下相を除去します。
- 水3容量を追加し、水酸化カリウムを除去するために穏やかに混合。層を分離することを許可する。注:上相が濁って表示された場合は、塩化ナトリウム(溶液200ml中のNaClの例、3グラム)を少量添加し、溶解するために穏やかに旋回。
- 漏斗のストップコックを介して排出することによって下相を除去します。
- 、手順1.13に1.10に従ってください。
- 80%アセトン1ml中に少量(〜3μl)を希釈し、80%アセトン中で440 nmでの吸収スペクトルを測定する。濃度を決定するために、カロテノイドの平均係数絶滅を使用し、以下の式16(440 = 255ε):カー[mg / mlの] =(ABS 440nmで / 225)×11(光路)= 1センチメートル。
- carotenoiを分注し、乾燥スピードバック中またはN 2気流下dsはすべてジエチルエーテルが蒸発されるまで。 -80℃で乾燥した顔料を格納します。
クラミドモナスから3全顔料とカロテノイドの抽出
- C.を育てる表面に液体培養の少量を広げることにより、シャーレ中の固体TAP培地17上のクラミドモナス 。細胞の緑色の層が表示されるまで20マイクロモルの写真の連続照明フラックスのPSAメートル-2秒-1の下で成長する。
- 無菌接種ループを用いて、C.少量の収穫固体TAP培地からクラミドモナスとを1Lフラスコ中でTAP培地17 500ml中に細胞を置く。 20マイクロモルの写真の連続照明フラックスのPSAメートル-2秒-1の下で170rpmで攪拌しながら25℃で文化を育てる。
- 5-6日後、培養液を対数期(6×10 6細胞/ mlでの最後に到達する必要がありまたは750 nmで2〜2.5の光学密度)。遠心し、4℃で15分間、4,000×gで文化。
- 全顔料抽出には、ステップ1.15に1.6に従ってください。
- 全顔料抽出物の収率は、Cの完全な増殖培養の500ミリリットルから始まるクラミドモナスは、0.5mgのCHL a + b の / mlの濃度で遊ん5ミリリットルの溶液である。
- カロテノイドの抽出のために、ステップ2.12に2.2に従ってください。
封入体の精製4。
- 標準的な分子生物学的手順を用いて融合したC末端Hisタグをもたらす発現ベクターに目的のLHCタンパク質のコード配列をクローニングする。 E.に、この構築物を変換するそのようなBL21(DE3)などの大腸菌宿主株。
- 準備溶解緩衝液、洗剤緩衝液、トリトン緩衝液、TE( 表1)、1 Mイソプロピルβ-D-1-チオガラクトピラノシド(IPTG)および適切な抗生物質を含むLB培地18。
- SINGLピック電子E.標準的な手順6を用いて、適切な抗生物質を含むLB培地約5中へ新たに画線し、プレートからの発現クローンを含む大腸菌コロニー 。少なくとも16時間、220rpmで攪拌しながら37℃で成長させる。
- LBの250ミリリットルと1リットルの三角フラスコに、O / N培養の2.5ミリリットルを追加し、適切な抗生物質を補充した。
- (OD 600が 〜0.6になるまで、または)、220rpmで、37℃で2〜3時間細胞を成長させる。
- 1 mMの最終濃度までIPTGを追加します。 220rpmで3〜4時間、37℃で細胞を増殖し続ける。
- 予め秤量した遠心管中、4℃で5000×gで10分間の文化を遠心します。徹底的に上澄みを捨て、再び計量し、遠心管の重量を差し引くことにより、重量のペレットを決定。
- E.を再懸濁0.8ミリリットル/激しいボルテックスによる溶解バッファーのg中の大腸菌細胞ペレット。
注:あるいは、細胞ペレットを-80℃で凍結することができ後で使用するためのC。凍結したペレットで始まる場合は、溶解バッファーを追加する前に、完全に解凍することができます。 - 細胞1グラム当たりのリゾチーム2mgを追加し、30分間、時折ボルテックスで濡れた氷上でインキュベートする。
- 20μg/ mlのDNA分解酵素、10mMのMgCl 2、1のNaCl、20μg/ mlのRNA分解酵素を追加します。ボルテックスし、30分間氷上に置く。
- 細胞1グラムあたりの冷洗剤緩衝液2mlを加える。よく混合し、5分間、室温を保つ。
- 2ミリリットルの遠心管への転送は、(必要に応じて2のチューブに分割)。 4℃で12,000×gで10分間遠心分離し、封入体をペレット化する。
- 冷たいトリトン緩衝液1mlを加え、完全に超音波処理することによりペレットを再懸濁し(20秒間隔で3パルス×5秒×50%出力)。注:超音波処理の間、寒さを保つために氷水に囲まれた小さなビーカーにチューブを持っている。複数のチューブの場合には、再懸濁した後に1チューブに再懸濁し、封入体を兼ね備えています。
- 12,000で10分間遠心分離4℃での遠心は、封入体をペレット化する。
- 繰り返し手順4.13と4.14の2倍。
- Tritonバッファーを除去するための最終洗浄のために超音波処理を使用してコールドTE 1ml中封入体を再懸濁します。 4℃で12,000×gで10分間遠心分離し、封入体をペレット化する。
- 超音波処理による風邪のTE 1ml中にペレットを再懸濁。
- そのようなブラッドフォードアッセイ19などの標準的な方法によってタンパク質濃度を評価する。 -20℃で封入体のストア分量。
5。再構成
吸光度はQyは地域(600〜750ナノメートル)で測定されている場合、このプロトコルは、典型的には4のODで再構成したタンパク質1〜2mlのが得られます。注意を手術中に適切な比率を維持するように注意すべきである量は、所望のように調節することができる。
- 2X再構成緩衝液、20%OG、2 MのKCl、TE: 表1に記載したように、以下の溶液を調製する。以下のを実行します薄暗い光の中でTEPS。
- 2ミリリットルの微量遠心管中で400μlのTEの合計LHC封入体の800μgの再懸濁する。 2倍の再構成バッファと渦簡単に400μlのを追加します。
- 10 mMの最終濃度が、β-メルカプトエタノール(株式14.8 M)0.6を添加する。 98℃で1分間、タンパク質を加熱する。 3分間室温でボルテックス簡潔にと場所。
- 精力的に1-2分間入浴ソニケーターで1分間、または場所をボルテックスすることによって30μlの100%エタノールの総乾燥したクロロフィル色素の500μgのプラス80μgのカロテノイド色素を懸濁します。
- 4℃で15,800×gで〜30秒顔料ミックスをスピンしてないペレットがないことを確認してください。ペレットがある場合は、ボルテックスおよび/または超音波処理を繰り返します。重要:再懸濁し、スピンした後、すぐにタンパク質に顔料を追加したり、それを集約することができますし、再び再懸濁する必要があります。
- ボルテックスしながらゆっくりと冷却してタンパク質に顔料ミックスを追加します。ボルテックス5-10 sに進みますECおよび湿った氷上にチューブを配置すること。タンパク質がチューブの上部をオーバーフローすることができますようにあまりにも積極的にボルテックスしないように注意してください。
- 、20%のオクチルβ-D-グルコピラノシド(OG)(最終濃度2%)の94μl加え簡単にボルテックスし、氷上で10分間保つ。
- 、塩化カリウム2 M(最終濃度150〜200 mM)を90μl加え手短にボルテックスし、氷上で20分間続ける。注:カラム調製(第6節)は、この時点で開始することができます。
- 4℃で15,800×gで10分間スピン。 10ミリリットルチューブに(LDS沈殿した)ペレットを乱すことなく、上清を取り除きます。寒さと、光から保護してください。
6。ニッケルカラム精製
- OG緩衝液、OGリンス緩衝液、溶出バッファー: 表1に記載したように、以下の溶液を調製する。
- 空気が、このステップと次のステップの間に、列の中に入っていないことを確実にする蠕動ポンプにニッケルセファロースカラム(1ミリリットル)または同等を接続します。
- Tの速度を設定します彼は1ミリリットル/分にポンプおよびストレージ·ソリューションを除去するために水5〜10mlのカラムをすすいでください。
- OGバッファ3-4 mlのカラムを平衡化する。
- カラムにタンパク質試料負荷にOGバッファ3-4 mlを加え。注記:タンパク質はLDSの除去後10分よりも長い間、氷上で座っている場合には、追加のLDS沈殿を除去するために1分間、4℃で15,800×gで再度スピン。
- OG緩衝液5mlでカラムを洗浄します。
- OGリンス緩衝液2mlでカラムを洗浄します。
- 3ミリリットルの溶出バッファーで結合したタンパク質を溶出。再構成されたタンパク質が含まれている緑色の溶出を収集します。注:これは通常、合計で約1ミリリットルである。
7。スクロース勾配遠心
- ショ糖溶液、0.06%のβ-DM、0.01MのHEPES、pH7.6の表1に記載したように、以下の溶液を調製する。
- ショ糖溶液を用いて超遠心管を記入し、CO / N O -20℃で凍結rは-80°Cのために少なくとも1時間。
- 冷凍庫からチューブを外し、4℃で邪魔されずに解凍することができます。注:凍結/解凍工程は、0.1〜1Mのスクロース勾配を作成します。 15mlチューブは、典型的には約3時間で解凍。
- 慎重にステップ6.8のニッケルセファロースカラムから溶出された緑色の画分として、上から同じボリュームを削除します。その後、勾配を乱さないようにゆっくりと上に再構成されたサンプルをロードします。
- 加速とブレーキなしで停止を遅らせるように設定18時間SW-41またはSW-60スウィングローターを使用して、超遠心分離機内のバランス管4℃200,000×gでスピン。
- 慎重にピンセットでチューブホルダの勾配を取り出します。トップからの画分を収集する鈍い開口部を有する長い針と注射器を使用してください。注:別の方法として、針でチューブを穿刺し、滴を収集することにより、下からの画分を収集します。
結果
このプロトコルは、in vitroで chorophyll a / b結合タンパク質を再構成する方法について詳しく説明します。この技術は、異種系で過剰発現したものであり、顔料は、植物又は藻類から抽出することができるアポタンパク質から出発して、インビトロでこれらの色素-タンパク質複合体の折り畳みを可能にする。再構成後、リフォールディングされた色素 - タンパク質複合体は、顔料を超えると2段階で折り畳まれていないアポタンパク質から精製される。最初のステップ( 図1 AB)は 、結合していない色素の大部分を除去することを可能にするタンパク質のC末端にHis-タグの存在に基づいている。第二の精製工程は、変性タンパク質は、通常、再構成されたタンパク質を含有する緑色の帯域よりもゆっくりと移動ショ糖密度勾配遠心分離( 図2)を利用する。 in vitroでの再構成の目標は、同じ適切と複合体を得ることであるネイティブのものとネクタイ。この結果を説明するために、in vivoでの集光性複合体の分光学的特性は、in vitroで再構成13,20,21同じLHC複合体と比較されます。可視領域(350 nmおよび750 nm)の中LHCsの吸収スペクトルは、複合体の顔料組成物に、同様に(タンパク質を含む)、顔料の環境に依存し、それは、このように品質を確認するための感度の高いツールである再構成の。 図3では、in vitroで再構成されたシロイヌナズナからの結合タンパク質CP24、 クロロフィル a / bの吸収スペクトルは、シロイヌナズナチラコイド21から精製された同じ複合体のスペクトルと比較される。スペクトルでは、Qyとし、クロロフィルのソーレー遷移(439分の671 nmでのピーク)およびクロロフィルb の (466分の649 nmでのピーク)を認識することが可能である。ネイティブと再構成された複合体は、同一のABSOを表示実質的に同一の顔料組成と組織を示すrptionスペクトル、。蛍光分光法は、再構成された複合体の品質を評価するために使用することができる。 500 nmで440 nmでクロロフィルa を 、475nmでのクロロフィルb、およびキサントフィル:蛍光発光スペクトルは、優先的に異なる顔料を励起し、異なる波長での励起の際に測定される。正しく折り畳まれたタンパク質-色素複合体では、クロロフィルbおよびキサントフィルは数ピコ秒以内に主にクロロフィルaに 、その励起エネルギーを転送し、蛍光は同じ形状値と最大値ですべての3つの励起で単一のピークが得られる熱的に平衡化したシステムに由来する波長( 図4A-B)。タンパク質に配位していないBのクロロフィルの存在は、475nmの励起( 図4C)上に追加のピークまたは肩650nm付近で認識できる。無料のクロロフィルの存在の代わりにリード線440 nmの励起で主に存在している675ナノメートル、周りの追加の発光に。両方の475nmの励起で蛍光発光スペクトルを再構成し、ネイティブCP24複合体( 図4D)は、再構成された複合体が正しく折り畳まれていることを示す、681 nmでの単一のピークを示している。色素 - タンパク質複合体が正しく再構成される追加の確認は、円偏光二色性(CD)測定から来る。可視領域におけるCD信号は、顔料間の励起子相互作用に依存し、それは、このように発色団22の組織内の小さな変化に非常に敏感である。典型的な指紋ピーク時で、再構成し、ネイティブCP24のCDスペクトルを示す図5を参照 681ナノメートル、650ナノメートルと481ナノメートル。結論として、ネイティブの分光学的特性との間に高い類似性と再構成されたCP24は、再構成手順利回りは天然様複合体の吹田ことを確認する光捕集タンパク質のin vitro研究のためにBLE。
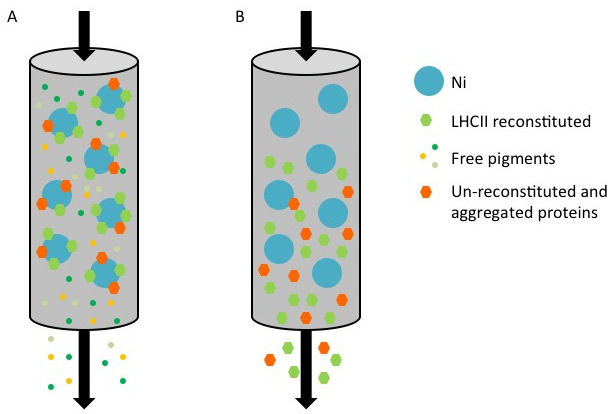
ニッケルカラムを用いてHisタグを有する組換えLHCタンパク質の精製の 図1の表現。(A)の両方で再構成複合体(緑色六角形)、未再構成された/凝集したタンパク質から成る精製、His標識タンパク質の間、(橙未結合の顔料(色の小さな点)が貫流しながら、六角形)は、ニッケルセファロース(青色スポット)の表面に結合されている。カラムをイミダゾールを含む溶出緩衝液で洗浄した場合(B)、再構成され、非再構成されたタンパク質は、フロースルー中に回収される。
hres.jpg "幅=" 500 "/>
再構成されたLHCIIの図2。スクロース勾配は、ニッケルカラムによる精製後。再構成された複合体は、密度勾配によるフリー顔料から分離される。濃い緑色のバンドが再構成されたLHCIIを表し、淡い緑色の背景には、無料の顔料で構成されている。
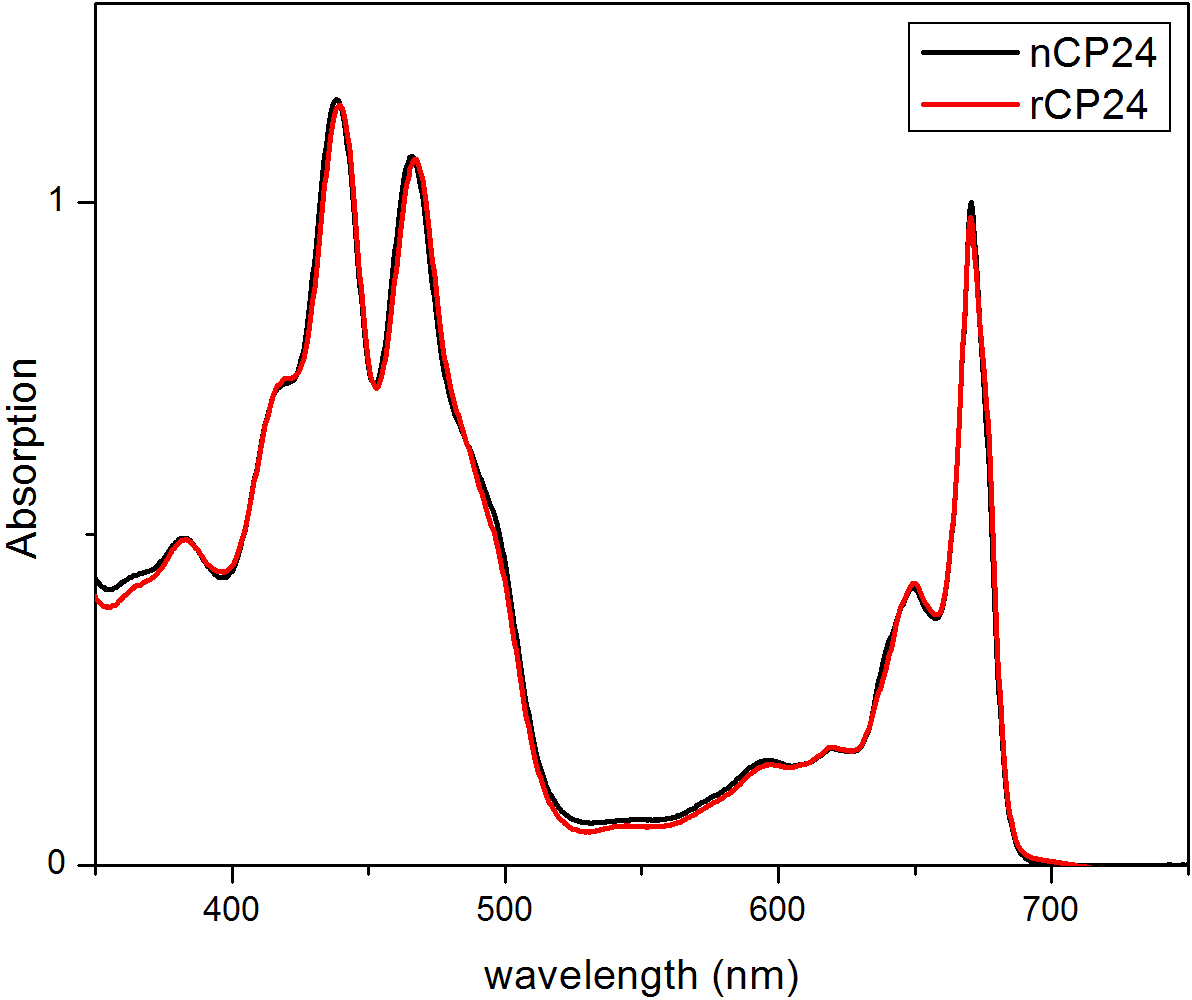
再構成タンパク質CP24(rCP24、赤線)、およびシロイヌナズナから単離された天然の一方(nCP24、黒線)の、図3の吸収スペクトル。両スペクトルにおいて、Qyとし、クロロフィルのソーレー遷移(ピークを認識することができる439分の671 nmで)と、466分の649 nmにおけるクロロフィルb の (ピーク)。この図は、Passarini らから変更されている。 2014 21。
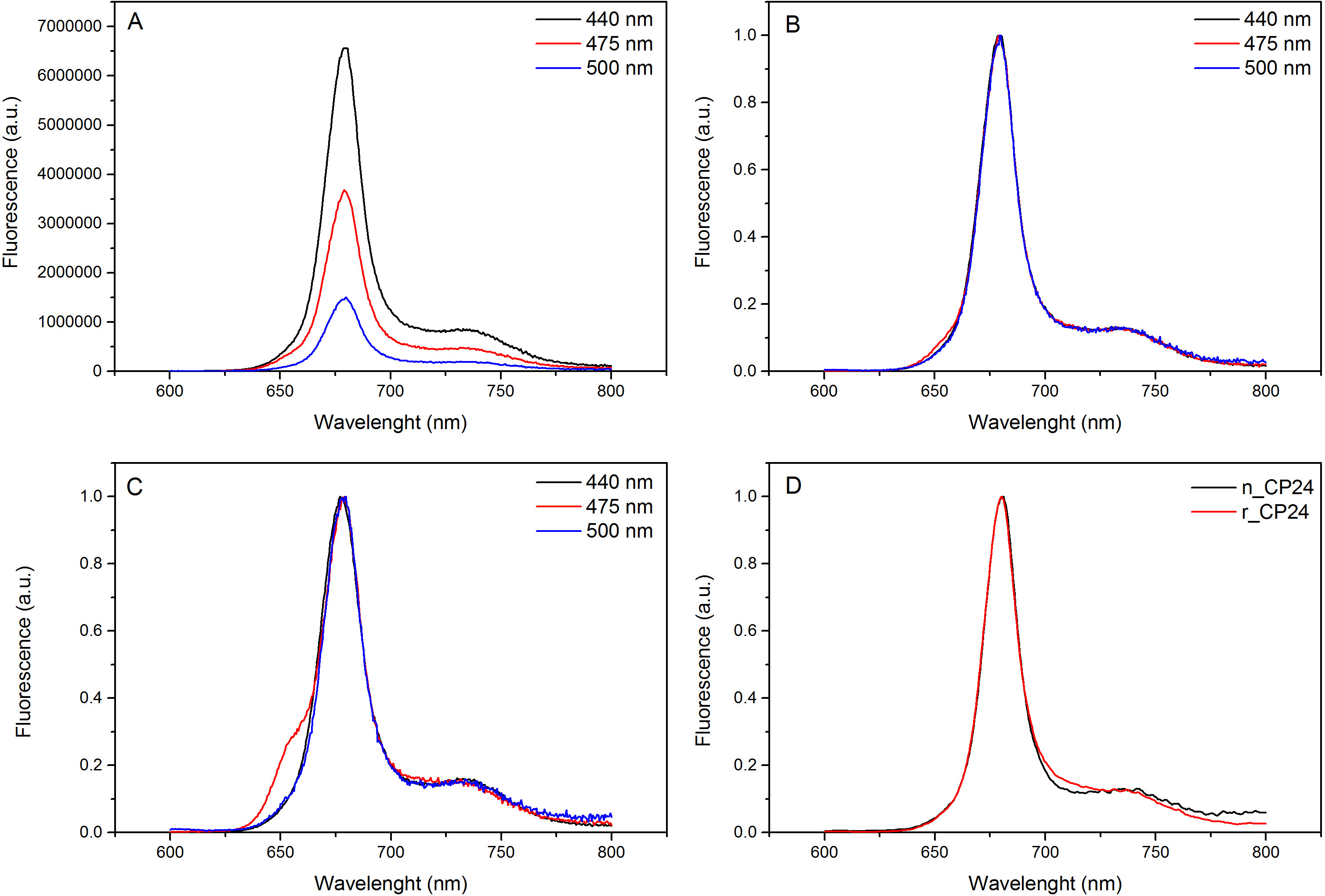
図4蛍光発光スペクトル。CHLするクロロフィルbおよびXanthophylsからの効率的なエネルギー伝達を示す最大値(B)に再構成されたCP24野生型複合体(A)との正規化蛍光発光スペクトル。再構成されたCP24(rCP24)とシロイヌナズナから単離された(nCP24)ネイティブの複合体(C)蛍光発光スペクトル。スペクトルは、ピーク(D)の最大に正規化されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
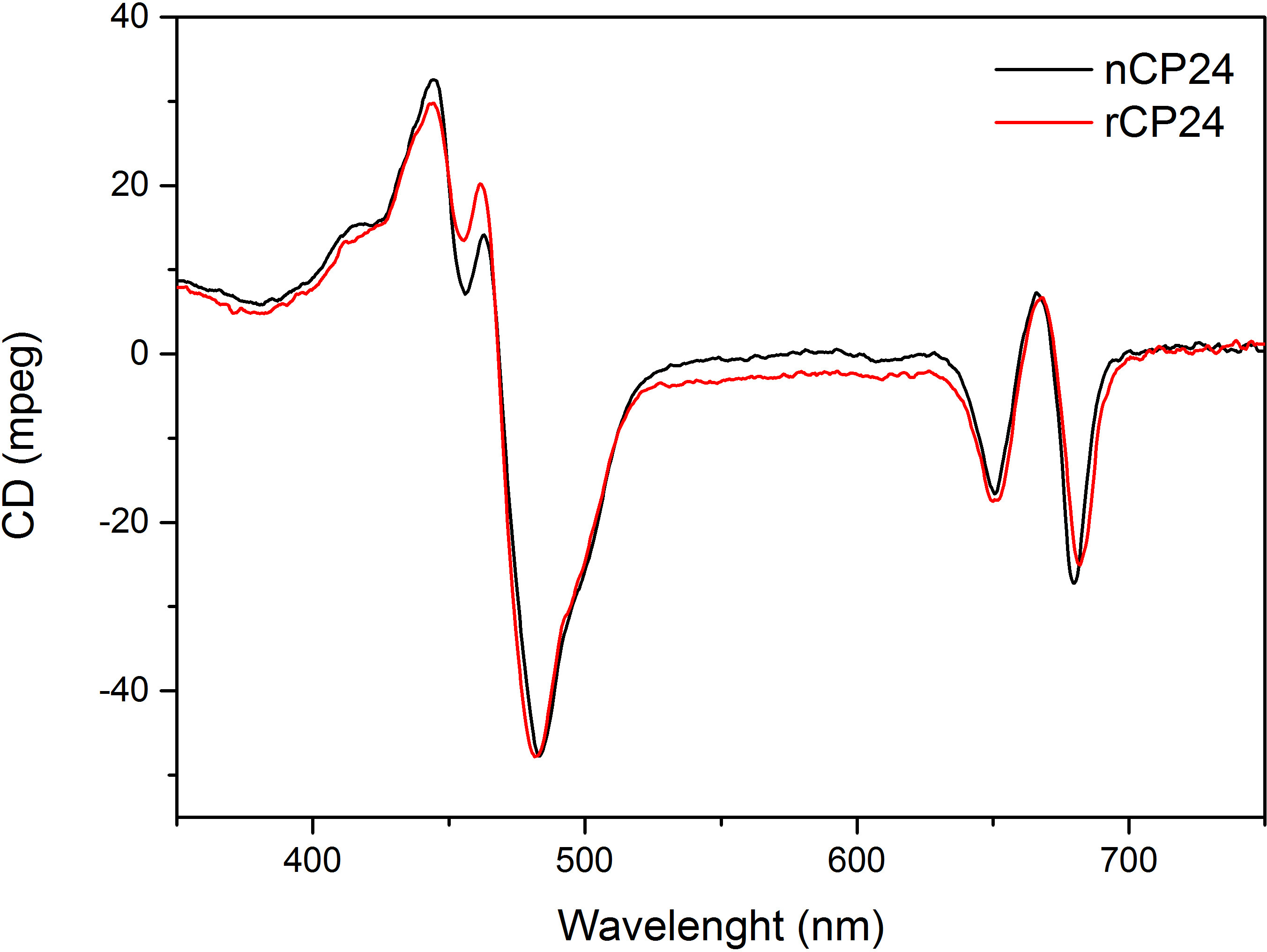
図5。円偏光二色性スペクトル。再構成CP24(rCP24、赤線)とシロイヌナズナから単離された天然複合体(nCP24、黒い線)は非常によく似たスペクトルを示す。

CP29野生型(CP29_WT)および変異CP29(CP29_A2)の図6の吸収スペクトル。緑の線は、2つのグラフの違いを示します。
| すべてのバッファーを4℃で保存することができる。 | |||
| コンポーネント | 最終濃度 | 補注 | |
| 研削·バッファ | ソルビトール | 0.4Mの | |
| トリシン | 0.1Mの | pHは7.8 | |
| NaClを | 10 mMの | ||
| のMgCl 2 | 5 mMの | ||
| 粉ミルク | w / vの0.5% | ||
| 洗浄バッファー | ソルビトール | 50 mMの | |
| トリシン | 5 mMの | pHは7.8 | |
| EDTA | 10 mMの | pHは8 | |
| 溶解バッファー | トリス | 50 mMの | pHは8 |
| スクロース | w / vの2.5% | ||
| EDTA | 1 mMの | pHは8 | |
| 界面活性剤緩衝液 | NaClを | 200mMのNaCl | |
| デオキシコール酸 | w / vの1% | ||
| NONIDET P-40 | w / vの1% | ||
| トリス | 20 mMの | pHは7.5 | |
| EDTA | 2 mMの | pHは8 | |
| ベータ - メルカプトエタノール | 10 mMの | ||
| トリトンバッファー | トリトンX-100 | w / vの0.5% | |
| トリス | 20 mMの | pHは7.5 | |
| ベータ - メルカプトエタノール | 1 mMの | ||
| バッファーTE | トリス | 50 mMの | pHは8 |
| EDTA | 1 mMの | pHは8 | |
| 再構成バッファ | HEPES | 200 mMの | |
| スクロース | w / vの5% | ||
| Lithiumdodecylsulfate(LDS) | 4%w / vで | ||
| ベンザミジン | 2 mMの | ||
| アミノカプロン酸 | 10 mMの | ||
| OGバッファー | オクチルグルコシド | w / vの1% | |
| w / vの12.5% | |||
| NaClを | 0.2 M | ||
| HEPES | 20 mMの | ||
| イミダゾール | 10 mMの | ||
| OGリンスバッファー | のn-ドデシル-β-D-マルトシド(β-DM) | w / vの0.06% | |
| HEPES | 40 mMの | pHは7.5から9 | |
| NaClを | 0.2 M | ||
| 溶出バッファー | イミダゾール | 0.5Mの | |
| のn-ドデシル-β-D-マルトシド(β-DM) | w / vの0.06% | ||
| HEPES | 40 mMの | pHは8 | |
| NaClを | 0.2 M | ||
| 蔗糖液 | スクロース | w / vの20% | |
| のn-ドデシル-β-D-マルトシド(β-DM) | w / vの0.06% | ||
| HEPES | 0.01 M | pHは7.6 | |
| アセトンを80%炭酸ナトリウムで緩衝化 | アセトン | 80%v / vの | |
| 炭酸ナトリウム | 1 M | ||
| 炭酸ナトリウムで緩衝化エタノール96% | エタノール | 96%v / vの | |
| 炭酸ナトリウム | 1 M | ||
このプロトコルで使用される緩衝液および溶液の表1のリスト。
rCP26| のChla A / B ミックス | のChla A / B | クロロフィルa の | クロロフィルb を | ネオ | ビオラ | リュート | クロロフィルTOT | クロロフィル/カー | |
| nCP26 | - | 2.2±0.05 | 6.2 | 2.8 | 0.61 | 0.38 | 1.02 | 9 | 4.5±0.1 |
| rCP26 | 8 | 2.71±0.05 | 6.57 | 2.43 | 0.72 | 0.32 | 0.97 | 3.9±0.04 | |
| rCP26 | 5.5 | 2.25±0.05 | 6.23 | 2.77 | 0.77 | 0.3 | 0.96 | 9 | 4.0±0.1 |
| rCP26 | 3 | 2.08±0.04 | 6.08 | 2.92 | 0.76 | 0.3 | 1.04 | 9 | 4.1±0.1 |
| rCP26 | 1 | 1.7±0.05 | 5.7 | 3.3 | 0.7 | 0.3 | 0.9 | 9 | 4.3±0.05 |
| rCP26 | 0.3 | 1.11±0.04 | 4.7 | 4.28 | 0.7 | 0.3 | 0.9 | 9 | 4.2±0.2 |
| 0.05 | 0.23±0.01 | 1.4 | 5.6 | 0.58 | 0.24 | 1.11 | 7 | 3.1±0.06 | |
| rCP26 | <0.01 | 0.11±0.01 | 0.7 | 6.3 | 0.64 | 0.3 | 1.08 | 7 | 3.06±0.06 |
別のクロロフィルa / bの比率 39 で再構成タンパク質色素複合体に比べて複雑なネイティブCP26の表2の顔料の含有量。
ディスカッション
膜タンパク質は勉強するのは簡単ではありません。天然の膜タンパク質の単離は、タンパク質を損傷し、必須の補因子を除去することができる界面活性剤と脂質二重層を可溶化する必要性によって複雑になる。これらのタンパク質は、集光性複合体の場合のように、それは、単一の複合体の精製が困難になる、また、生体膜において低レベルで存在するかもしれない、または密接に関連するタンパク質と混合する。 E.における異種タンパク質の発現大腸菌およびインビトロでの再構成中 これらの問題を回避する可能性を提供する。従ってネイティブ複合体20,21,23とのものと非常に類似した特性を有する複合体におけるインビトロ再構成および折り畳まれたタンパク質の精製の 結果が均質24にまで精製することができない複合体を研究するために使用することができ- 27。
この方法は簡単にattainabさほうれん草を使用しています全顔料及びカロテノイド調製物のためのソースとしてル一年中、。藻類に対する天然のタンパク質のいくつかの再構成のために、藻類から精製された顔料の使用は、異なる顔料組成物に好適である。クロロフィルa / bの比およびクロロフィル/車比に関係なく、顔料ソースの同じままである。
これは、再構成の効率は通常約35%で28であることを認識することが重要です。したがって、再構成後の溶液から非結合顔料および折り畳まれていないアポタンパク質を除去することが必要である。二段階精製プロトコルは、(また結果を参照)、このプロトコルで提示される。しかし、ショ糖勾配ステップはアポとホロタンパク質の完全な分離を可能にしないことに留意すべきである。アポタンパク質は、機能的測定を妨害しない、したがって顔料を含有しない限り、ほとんどの分析のため、これは問題ではない。しかし、ケースでは、完全に、FRからアポタンパク質を除去することが必要である再構成された複合体(例えば、タンパク質の化学量論に顔料を計算する)を含有するアクションは、陰イオン交換カラムは、(参照Passarini ら詳細については2009年)を使用することができる。
試験管内で孤立した顔料を用いて、組換え集光タンパク質をリフォールディングする能力は、それによって得られた複合体の特性を変化させる、さまざまな方法で再構成「環境」を変更することにより、複合体を「操る」する機会を提供する。例えば、再構成中の顔料組成物を変更すると、変更された顔料組成物との複合体をもたらすことができる。この機能は、各種顔料を複合体の構造および安定性に及ぼす影響を調べるために利用することができる。 1と2.9のクロロフィル/車比:1通常ホウレンソウから得られた顔料調製物は、3のクロロフィルa / bの比を有する。この比率は、一般的にn個と同じ性質を用いて再構成タンパク質を産生する1をative。 33 -しかし、精製されたクロロフィルAまたはBの添加によりクロロフィルa / bの比の調整は、結合部位30の選択性を変化させることに起因する異なる顔料の結合に影響を与えることができる。顔料の結合部位の大部分はクロロフィルa またはクロロフィルbのための完全に選択的ではないが、異なる親和性10,30,34であるが、両方を収容することができるので可能である。 38 -同様に、カロテノイド結合部位はまた、複数のキサントフィル種8,35に対応できることが示された。 CP26、各種の顔料組成物を用いて、高等植物、他の色素-タンパク質複合体の別の再構成は、 表2 39に示されている。これらの再構成は、特定の顔料39の結合部位の親和性を評価した。これは、同じ顔料cを有する複合体を得るために、ことに留意することが興味深い。1:ネイティブ一つとしてompositionは、顔料ミックスのクロロフィルa / bの比は3でなければなりません。これは高等植物20,40のすべてのLHC複合体のためのケースであると思われる。
再構成技術を用いて、分子生物学の組み合わせがクロロフィル結合複合体の性質をより詳細に研究することができます。 44 -異なるタンパク質複合体の安定性及び折り畳みドメイン、またはタンパク質-タンパク質相互作用への関与の重要性は、アポタンパク質を切り捨てる又はランダム突然変異誘発8,41を実行することによって決定されている。 52 -異なる顔料の調整のための重要な単一のアミノ酸残基は、個別の顔料の特性を分析したり、複雑な10,28,29,45の機能および安定性への寄与を評価するために、部位特異的変異誘発によって変更することができる。 図6ははとLhcb4(CP29)を再構成した位置216 53位のヒスチジンの変異。野生型および突然変異体複合体の顔料組成物の比較は、変異が標的部位は、WT複合体中のクロロフィルa を収容することを示す、分子1クロロフィルの喪失を誘導することを示す。 WTおよび変異体の吸収スペクトルの違いは、顔料の含有量に対して正規化の際に、また、失われた顔料の吸収特性を示している。この場合、差はクロロフィルHis216によってコーディネートこの波長で吸収する(この変異体についての詳細は、分光特性がモッツォら 、2008年53参照 )ことを示し、680nmでの主ピークに見ることができる。変異分析はまた、顔料54の分光特性に及ぼす環境の影響を決定するために用いることができる。
結論として、集光性タンパク質は、容易に顔料proteiその結果、in vitroで再構成することができる天然の複合体と非常に類似した特性を有するn複合体。また、さらなる研究のために高い収率および純度でタンパク質調製物を提供しながらこのように、天然のタンパク質を単離することの困難さは、排除される。 3の重要性:本物の複合体の製造における1クロロフィルa / bの比が強調され、再構成された野生型および変異LHCsの実施例は、技術の応用を説明するために提供される。
開示事項
The authors declare no conflict of interest
謝辞
This work was supported by the European research council by a ERC starting/consolidator grant to RC and by the Dutch Foundation for research on matter (FOM) via a FOM program (10TM01).
資料
| Name | Company | Catalog Number | Comments |
| HisTrap HP | GE Healthcare | 17-5247-01 | |
| Nylon cloth | 20 μm pores | ||
| Soft artists paint brush | |||
| NONIDET P-40 | Sigma | 74385 | |
| Beta-DM | Sigma | D4641 | |
| DNAase | ThermoScientific | EN0525 | |
| Milk Powders | |||
| RNAase | ThermoScientific | EN0531 | |
| Sonicator | |||
| Octyl β-D-glucopyranoside | Sigma | O8001 | |
| Ultracentrifuge XL | Beckman-Coulter | ||
| TAP medium | see reference 17 | ||
| LB medium | see reference 19 |
参考文献
- Plumley, F. G., Schmidt, G. W. Reconstitution of chlorophyll a/b light-harvesting complexes: Xanthophyll-dependent assembly and energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 84, 146-150 (1987).
- Croce, R., van Amerongen, H. Light-harvesting and structural organization of Photosystem II from individual complexes to thylakoid membrane. Journal of photochemistry and photobiology B Biology. 104 (1-2), 142-153 (2011).
- Li, Z., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and responding to excess light. Annual review of plant biology. 60, 239-260 (2009).
- De Bianchi, S., Ballottari, M., Dall’osto, L., Bassi, R. Regulation of plant light harvesting by thermal dissipation of excess energy. Biochemical Society transactions. 38 (2), 651-660 (2010).
- Neilson, J. A. D., Durnford, D. G. Structural and functional diversification of the light-harvesting complexes in photosynthetic eukaryotes. Photosynthesis research. 106 (1-2), 57-71 (2010).
- Paulsen, H., Rümler, U., Rüdiger, W. Reconstitution of pigment-containing complexes from light-harvesting chlorophyll a/b-binding protein overexpressed in Escherichia coli. Planta. 181 (2), 204-211 (1990).
- Horn, R., Grundmann, G., Paulsen, H. Consecutive binding of chlorophylls a and b during the assembly in vitro of light-harvesting chlorophyll-a/b protein (LHCIIb). Journal of molecular biology. 366 (3), 1045-1054 (2007).
- Cammarata, K. V., Schmidt, G. W. In vitro reconstitution of a light-harvesting gene product: deletion mutagenesis and analyses of pigment binding. Biochemistry. 31 (10), 2779-2789 (1992).
- Paulsen, H., Hobe, S. Pigment-binding properties of mutant light-harvesting chlorophyll-a/b-binding protein. European journal of biochemistry / FEBS. 205 (1), 71-76 (1992).
- Bassi, R., Croce, R., Cugini, D., Sandonà, D. Mutational analysis of a higher plant antenna protein provides identification of chromophores bound into multiple sites. Proceedings of the National Academy of Sciences of the United States of America. 96 (18), 10056-10061 (1999).
- Paulsen, H., Finkenzeller, B., Kühlein, N. Pigments induce folding of light-harvesting chlorophyll a/b-binding protein. European journal of biochemistry / FEBS. 215 (3), 809-816 (1993).
- Caffarri, S., Croce, R., Cattivelli, L., Bassi, R. A look within LHCII differential analysis of the Lhcb1-3 complexes building the major trimeric antenna complex of higher-plant photosynthesis. Biochemistry. 43 (29), 9467-9476 (2004).
- Giuffra, E., Cugini, D., Croce, R., Bassi, R. Reconstitution and pigment-binding properties of recombinant CP29. European journal of biochemistry / FEBS. 238 (1), 112-120 (1996).
- Rogl, H., Kosemund, K., Kühlbrandt, W., Collinson, I. Refolding of Escherichia coli produced membrane protein inclusion bodies immobilised by nickel chelating chromatography. FEBS letters. (1-2), 21-26 (1998).
- Porra, R. J., Thompson, W. A., Kriedemann, P. E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 975 (3), 384-394 (1989).
- Davies, B. H. Identification of carotenoids by their absorption characteristics. Biochem J. 103 (2), (1967).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Bertani, G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. Journal of bacteriology. 62 (3), 293-300 (1951).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical biochemistry. 72, 248-254 (1976).
- Wientjes, E., Croce, R. The light-harvesting complexes of higher-plant Photosystem I Lhca1/4 and Lhca2/3 form two red-emitting heterodimers. The Biochemical journal. 433 (3), 477-485 (2011).
- Passarini, F., Xu, P., Caffarri, S., Hille, J., Croce, R. Towards in vivo mutation analysis knock-out of specific chlorophylls bound to the light-harvesting complexes of Arabidopsis thaliana - the case of CP24 (Lhcb6). Biochimica et biophysica acta. , (2014).
- Georgakopoulou, S., van der Zwan, G., Bassi, R., van Grondelle, R., van Amerongen, H., Croce, R. Understanding the changes in the circular dichroism of light harvesting complex II upon varying its pigment composition and organization. Biochemistry. 46 (16), 4745-4754 (2007).
- Croce, R., Müller, M. G., Caffarri, S., Bassi, R., Holzwarth, A. R. Energy transfer pathways in the minor antenna complex CP29 of photosystem II a femtosecond study of carotenoid to chlorophyll transfer on mutant and WT complexes. Biophysical journal. 84 (4), 2517-2532 (2003).
- Schmid, V. H., Cammarata, K. V., Bruns, B. U., Schmidt, G. W. In vitro reconstitution of the photosystem I light-harvesting complex LHCI-730 heterodimerization is required for antenna pigment organization. Proceedings of the National Academy of Sciences of the United States of America. 94 (14), 7667-7672 (1997).
- Castelletti, S., Morosinotto, T., Robert, B., Caffarri, S., Bassi, R., Croce, R. Recombinant Lhca2 and Lhca3 subunits of the photosystem I antenna system. Biochemistry. 42 (14), 4226-4234 (2003).
- Storf, S., Jansson, S., Schmid, V. H. R. Pigment binding, fluorescence properties, and oligomerization behavior of Lhca5, a novel light-harvesting protein. The Journal of biological chemistry. 280 (7), 5163-5168 (2005).
- Mozzo, M., Mantelli, M., Passarini, F., Caffarri, S., Croce, R., Bassi, R. Functional analysis of photosystem I light-harvesting complexes (Lhca) gene products of Chlamydomonas reinhardtii. Biochimica et biophysica acta. 1797 (2), 212-221 (2010).
- Remelli, R., Varotto, C., Sandonà, D., Croce, R., Bassi, R. Chlorophyll binding to monomeric light-harvesting complex. A mutation analysis of chromophore-binding residues. The Journal of biological chemistry. 274 (47), 33510-33521 (1999).
- Passarini, F., Wientjes, E., Hienerwadel, R., Croce, R. Molecular basis of light harvesting and photoprotection in CP24 unique features of the most recent antenna complex. The Journal of biological chemistry. 284 (43), 29536-29546 (2009).
- Giuffra, E., et al. Analysis of some optical properties of a native and reconstituted photosystem II antenna complex, CP29 pigment binding sites can be occupied by chlorophyll a or chlorophyll b and determine spectral forms. Biochemistry. 36 (42), 12984-12993 (1997).
- Pagano, A., Cinque, G., Bassi, R. In vitro reconstitution of the recombinant photosystem II light-harvesting complex CP24 and its spectroscopic characterization. The Journal of biological chemistry. 273 (27), 17154-17165 (1998).
- Kleima, F. J., et al. Decreasing the chlorophyll a/b ratio in reconstituted LHCII structural and functional consequences. Biochemistry. 38 (20), 6587-6596 (1999).
- Croce, R., Morosinotto, T., Castelletti, S., Breton, J., Bassi, R. The Lhca antenna complexes of higher plants photosystem I. Biochimica et biophysica acta. 1556 (1), 29-40 (2002).
- Hobe, S., Trostmann, I., Raunser, S., Paulsen, H. Assembly of the major light-harvesting chlorophyll-a/b complex Thermodynamics and kinetics of neoxanthin binding. The Journal of biological chemistry. 281 (35), 25156-25166 (2006).
- Croce, R., Weiss, S., Bassi, R. Carotenoid-binding sites of the major light-harvesting complex II of higher plants. The Journal of biological chemistry. 274 (42), 29613-29623 (1999).
- Hobe, S., Niemeier, H., Bender, A., Paulsen, H. Carotenoid binding sites in LHCIIb. Relative affinities towards major xanthophylls of higher plants. European journal of biochemistry / FEBS. 267 (2), 616-624 (2000).
- Jahns, P., Depka, B., Trebst, A. Xanthophyll cycle mutants from Chlamydomonas reinhardtii indicate a role for zeaxanthin in the D1 protein turnover. Plant Physiology and Biochemistry. 38 (5), 371-376 (2000).
- Wehner, A., Grasses, T., Jahns, P. De-epoxidation of violaxanthin in the minor antenna proteins of photosystemII, LHCB4, LHCB5, and LHCB6. The Journal of biological chemistry. 281 (31), 21924-21933 (2006).
- Croce, R., Canino, G., Ros, F., Bassi, R. Chromophore organization in the higher-plant photosystem II antenna protein CP26. Biochemistry. 41 (23), 7334-7343 (2002).
- Caffarri, S., Passarini, F., Bassi, R., Croce, R. A specific binding site for neoxanthin in the monomeric antenna proteins CP26 and CP29 of Photosystem II. FEBS letters. 581 (24), 4704-4710 (2007).
- Hobe, S., Förster, R., Klingler, J., Paulsen, H. N-proximal sequence motif in light-harvesting chlorophyll a/b-binding protein is essential for the trimerization of light-harvesting chlorophyll a/b complex. Biochemistry. 34 (32), 10224-10228 (1995).
- Kuttkat, A., Hartmann, A., Hobe, S., Paulsen, H. The C-terminal domain of light-harvesting chlorophyll-a/b-binding protein is involved in the stabilisation of trimeric light-harvesting complex. European journal of biochemistry / FEBS. 242 (2), 288-292 (1996).
- Rupprecht, J., Paulsen, H., Schmid, V. H. Protein domains required for formation of stable monomeric Lhca1- and Lhca4-complexes. Photosynthesis research. 63 (3), 217-224 (2000).
- Yang, C., et al. The negatively charged amino acids in the lumenal loop influence the pigment binding and conformation of the major light-harvesting chlorophyll a/b complex of photosystem II. Biochimica et biophysica acta. 1777 (11), 1463-1470 (2008).
- Rogl, H., Kühlbrandt, W. Mutant trimers of light-harvesting complex II exhibit altered pigment content and spectroscopic features. Biochemistry. 38 (49), 16214-16222 (1999).
- Yang, C., Kosemund, K., Cornet, C., Paulsen, H. Exchange of pigment-binding amino acids in light-harvesting chlorophyll a/b protein. Biochemistry. 38 (49), 16205-16213 (1999).
- Morosinotto, T., Castelletti, S., Breton, J., Bassi, R., Croce, R. Mutation analysis of Lhca1 antenna complex. Low energy absorption forms originate from pigment-pigment interactions. The Journal of biological chemistry. 277 (39), 36253-36261 (2002).
- Morosinotto, T., Breton, J., Bassi, R., Croce, R. The nature of a chlorophyll ligand in Lhca proteins determines the far red fluorescence emission typical of photosystem I. The Journal of biological chemistry. 278 (49), 49223-49229 (2003).
- Ballottari, M., Mozzo, M., Croce, R., Morosinotto, T., Bassi, R. Occupancy and functional architecture of the pigment binding sites of photosystem II antenna complex Lhcb5. The Journal of biological chemistry. 284 (12), 8103-8113 (2009).
- Croce, R., et al. Origin of the 701-nm fluorescence emission of the Lhca2 subunit of higher plant photosystem I. The Journal of biological chemistry. 279 (47), 48543-48549 (2004).
- Morosinotto, T., Mozzo, M., Bassi, R., Croce, R. Pigment-pigment interactions in Lhca4 antenna complex of higher plants photosystem I. The Journal of biological chemistry. 280 (21), 20612-20619 (2005).
- Mozzo, M., Morosinotto, T., Bassi, R., Croce, R. Probing the structure of Lhca3 by mutation analysis. Biochimica et biophysica acta. 1757 (12), 1607-1613 (2006).
- Mozzo, M., Passarini, F., Bassi, R., van Amerongen, H., Croce, R. Photoprotection in higher plants the putative quenching site is conserved in all outer light-harvesting complexes of photosystem II. Biochimica et biophysica acta. 1777 (10), 1263-1267 (2008).
- Wientjes, E., Roest, G., Croce, R. From red to blue to far-red in Lhca4 how does the protein modulate the spectral properties of the pigments. Biochimica et biophysica acta. 1817 (5), 711-717 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved